8.2海水“晒盐“同步练习(含答案)—2022-2023学年九年级化学鲁教版下册
文档属性
| 名称 | 8.2海水“晒盐“同步练习(含答案)—2022-2023学年九年级化学鲁教版下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 131.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 17:04:13 | ||
图片预览

文档简介
8.2海水“晒盐”
同步练习
一、单选题
1.下列操作能达到目的是( )
A.稀释浓硫酸时,将水沿容器壁慢慢注入浓硫酸中,并不断搅拌
B.溶解食盐时用玻璃棒搅拌以增大氯化钠的溶解度
C.用湿润的pH试纸测量酸雨的酸碱度
D.蒸发操作中,当蒸发中出现较多固体时,停止加热
2.下图是A、B、C三种物质的溶解度曲线。下列叙述正确的是
A.t1℃时,三种物质溶解度大小顺序为A>B>C
B.t1℃时,A的饱和溶液中溶质的质量分数为10%
C.t2℃时,A、B、C的溶液的溶质质量分数一定相等
D.t3℃时,等质量的A、B、C的饱和溶液降温到t2℃时,所得溶液溶质质量分数由大到小顺序是A=B>C
3.下列实验方案不能达到实验目的的是
选项 实验目的 实验方案
A 鉴别木炭粉和铁粉 在氧气中灼烧
B 除去KCl固体中的KClO3 加热加入适量MnO2
C 提纯含有少量NaCl的KNO3 加水溶解,加热浓缩,冷却结晶后过滤
D 证明甲烷中含有氢元素 点燃甲烷,在火焰上方罩一个干冷的烧杯
A.A B.B C.C D.D
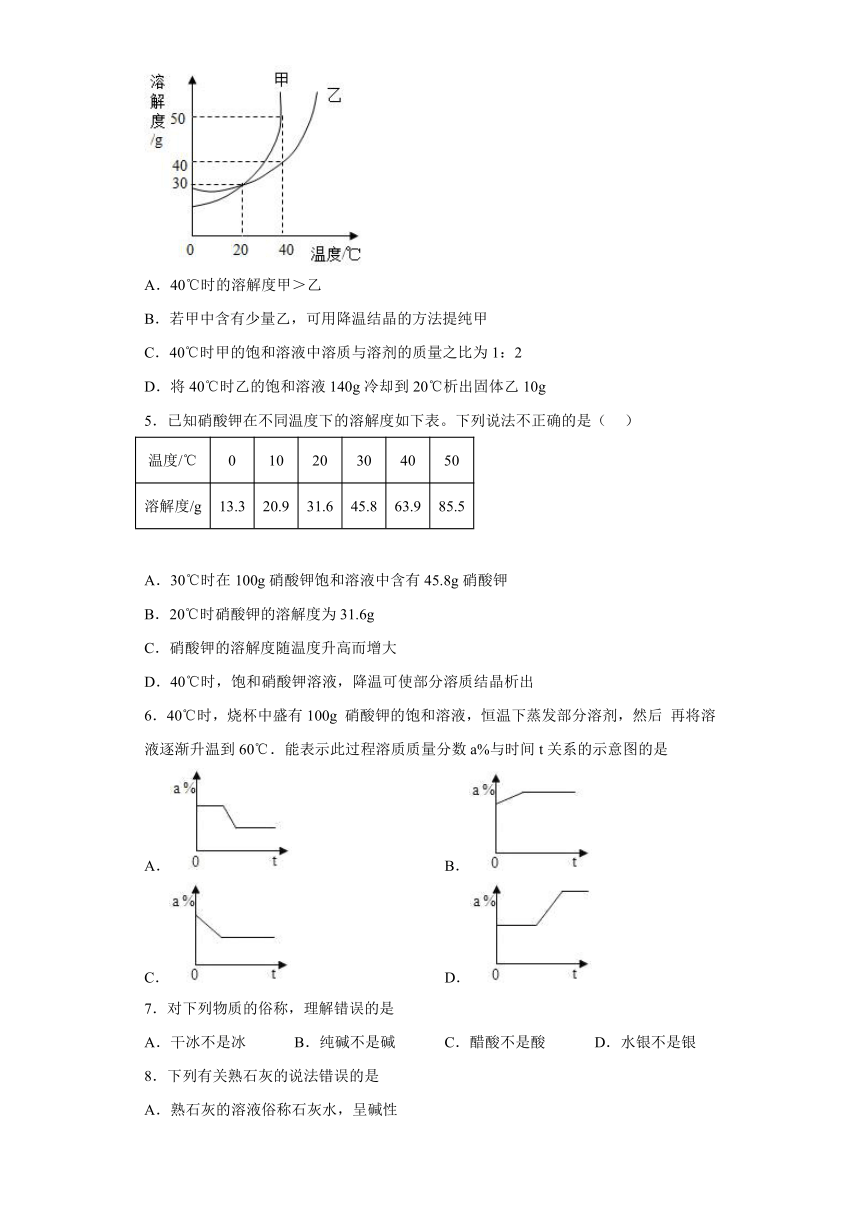
4.甲、乙两种固体的溶解度曲线如图所示,下列说法不正确的是
A.40℃时的溶解度甲>乙
B.若甲中含有少量乙,可用降温结晶的方法提纯甲
C.40℃时甲的饱和溶液中溶质与溶剂的质量之比为1:2
D.将40℃时乙的饱和溶液140g冷却到20℃析出固体乙10g
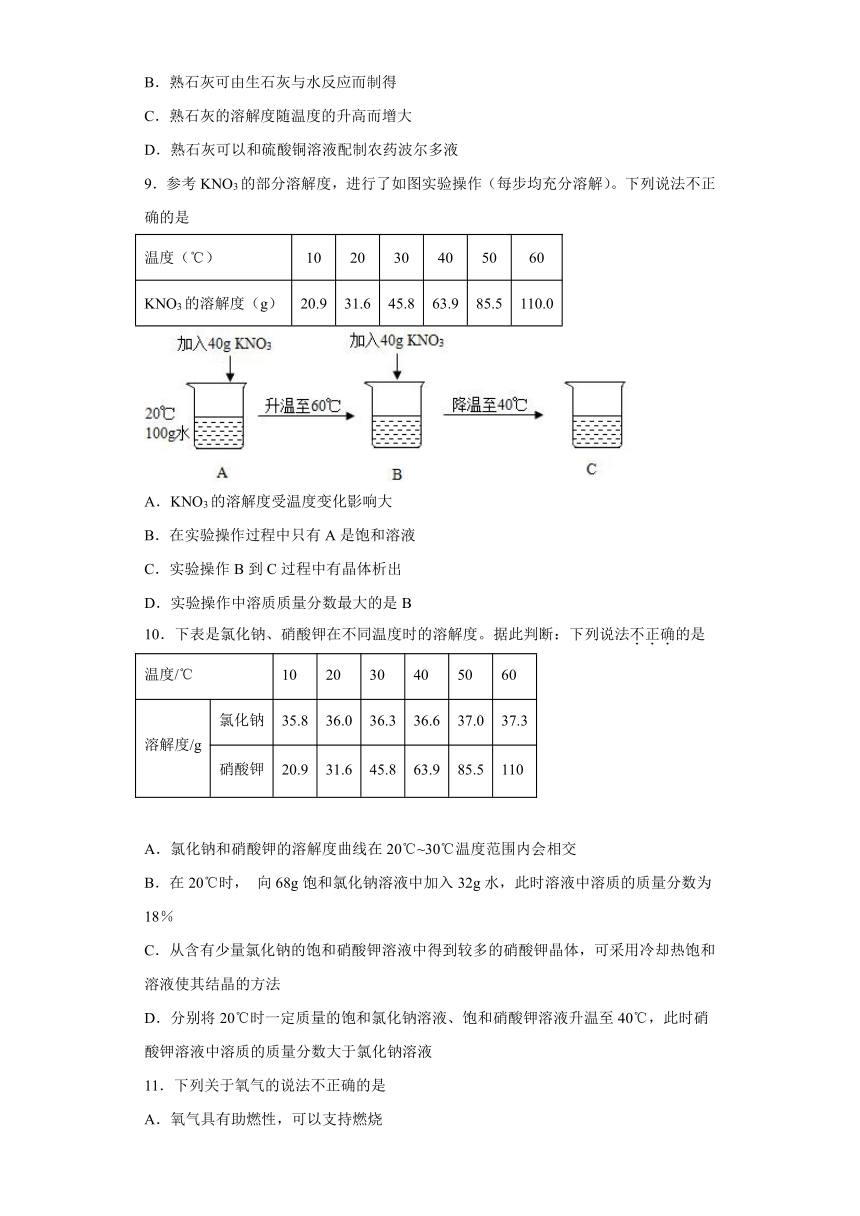
5.已知硝酸钾在不同温度下的溶解度如下表。下列说法不正确的是( )
温度/℃ 0 10 20 30 40 50
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5
A.30℃时在100g硝酸钾饱和溶液中含有45.8g硝酸钾
B.20℃时硝酸钾的溶解度为31.6g
C.硝酸钾的溶解度随温度升高而增大
D.40℃时,饱和硝酸钾溶液,降温可使部分溶质结晶析出
6.40℃时,烧杯中盛有100g 硝酸钾的饱和溶液,恒温下蒸发部分溶剂,然后 再将溶液逐渐升温到60℃.能表示此过程溶质质量分数a%与时间t关系的示意图的是
A. B.
C. D.
7.对下列物质的俗称,理解错误的是
A.干冰不是冰 B.纯碱不是碱 C.醋酸不是酸 D.水银不是银
8.下列有关熟石灰的说法错误的是
A.熟石灰的溶液俗称石灰水,呈碱性
B.熟石灰可由生石灰与水反应而制得
C.熟石灰的溶解度随温度的升高而增大
D.熟石灰可以和硫酸铜溶液配制农药波尔多液
9.参考KNO3的部分溶解度,进行了如图实验操作(每步均充分溶解)。下列说法不正确的是
温度(℃) 10 20 30 40 50 60
KNO3的溶解度(g) 20.9 31.6 45.8 63.9 85.5 110.0
A.KNO3的溶解度受温度变化影响大
B.在实验操作过程中只有A是饱和溶液
C.实验操作B到C过程中有晶体析出
D.实验操作中溶质质量分数最大的是B
10.下表是氯化钠、硝酸钾在不同温度时的溶解度。据此判断:下列说法不正确的是
温度/℃ 10 20 30 40 50 60
溶解度/g 氯化钠 35.8 36.0 36.3 36.6 37.0 37.3
硝酸钾 20.9 31.6 45.8 63.9 85.5 110
A.氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交
B.在20℃时, 向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18%
C.从含有少量氯化钠的饱和硝酸钾溶液中得到较多的硝酸钾晶体,可采用冷却热饱和溶液使其结晶的方法
D.分别将20℃时一定质量的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中溶质的质量分数大于氯化钠溶液
11.下列关于氧气的说法不正确的是
A.氧气具有助燃性,可以支持燃烧
B.工业上常采用分离液态空气法制取氧气
C.登山时携带氧气瓶,是因为高山上氧气体积分数小于21%
D.夏天鱼池内用增氧泵,是因为温度升高,氧气在水中的溶解能力降低
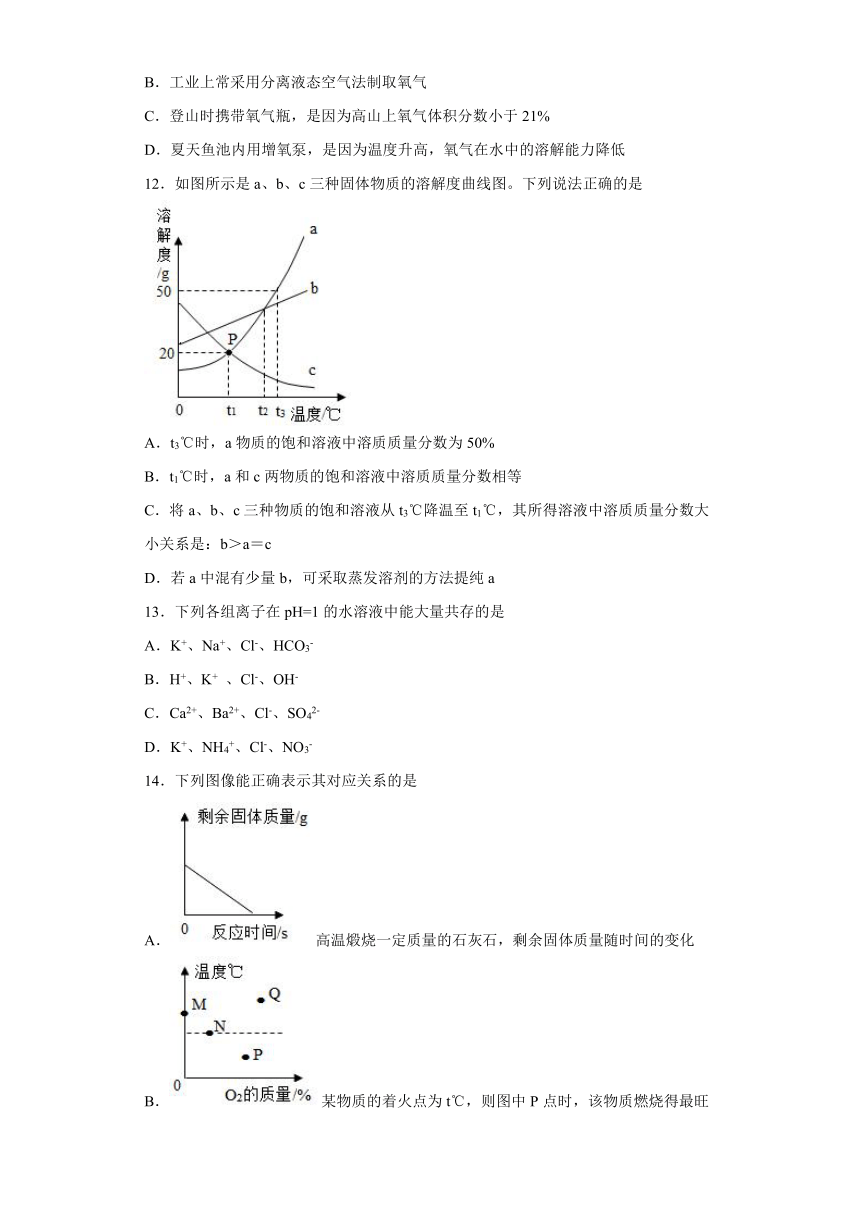
12.如图所示是a、b、c三种固体物质的溶解度曲线图。下列说法正确的是
A.t3℃时,a物质的饱和溶液中溶质质量分数为50%
B.t1℃时,a和c两物质的饱和溶液中溶质质量分数相等
C.将a、b、c三种物质的饱和溶液从t3℃降温至t1℃,其所得溶液中溶质质量分数大小关系是:b>a=c
D.若a中混有少量b,可采取蒸发溶剂的方法提纯a
13.下列各组离子在pH=1的水溶液中能大量共存的是
A.K+、Na+、Cl-、HCO3-
B.H+、K+ 、Cl-、OH-
C.Ca2+、Ba2+、Cl-、SO42-
D.K+、NH4+、Cl-、NO3-
14.下列图像能正确表示其对应关系的是
A.高温煅烧一定质量的石灰石,剩余固体质量随时间的变化
B.某物质的着火点为t℃,则图中P点时,该物质燃烧得最旺
C.20℃时,向一定量接近饱和的KNO3溶液中加入KNO3固体
D.向一定量 溶液中逐滴加入稀盐酸至过量,溶液pH的变化
15.如图表示的是KNO3和NaNO3的溶解度曲线。下列说法正确的
A.T2℃时,KNO3溶液的浓度一定等于NaNO3溶液的浓度
B.T1℃时,在50 g水里加入15 g KNO3固体,充分溶解,可得到65 g溶液
C.常温下,NaNO3属于易溶物
D.若KNO3中混有少量NaNO3,可用蒸发溶剂的方法提纯
二、填空题
16.下图是A、B、C三种物质的溶解度曲线,根据此图回答下列问题:
(1)__________℃时,物质A和C的溶解度相等。
(2)t2℃时,A物质的溶解度是_______g。
(3)等质量的A、B、C三种物质的饱和溶液同时从t2℃降温到t1℃,其中溶质质量分数没有发生改变的是_________
(4)t2℃时,小红向100g的水中加入45.8gA物质,她发现A物质全部溶解,一段时间后,她意外地发现又有部分A物质的晶体析出。我认为A物质“全部溶解”的原因是因为A物质溶解时_________(填“吸热”或“放热”)引起;析出晶体的原因是_________
17.现有9种物质:铁、铜、CuO、CaCO3、H2SO4、Ba(OH)2、NaOH、NaCl和AgCl。小王和小方根据不同的标准对它们进行如下分类,请你在他们分类的基础上再提出新的分类方法(每一类中不少于三种物质),并填写下表:
分类标准 类别
小王的分类标准:单质、化合物 类别一:铁、铜类别二:CuO、CaCO3、H2SO4、Ba(OH)2、NaOH、NaCl、AgCl
小方的分类标准:_______ 类别一:铁、铜、CuO、CaCO3、AgCl类别二:H2SO4、Ba(OH)2、NaOH、NaCl
新的分类标准:_______ 类别一:_______类别二:_______
18.根据实验回答以下问题。
(1)实验一的试管中发生反应的化学方程式为________ 。
(2)对实验一分析正确的是_______(填序号)。
①A处将稀盐酸换为稀硫酸,B、C处也一定能观察到同样的实验现象
②B处紫色石蕊变为红色,是因为CO2能与水反应生成碳酸
③C处蜡烛从低到高依次熄灭,说明CO2密度大于空气
(3)由实验二得出影响物质溶解性的因素是_______(填序号)。
A.溶质的种类 B.溶质的质量 C.溶剂的种类 D.温度
若省略实验二中试管a_______(填“能”或“不能”)得到相同结论。
(4)使用实验三装置进行验证质量守恒定律的实验,选择的试剂是碳酸钠和稀盐酸,反应结束后指针向右偏转,你认为该反应是否遵循质量守恒定律?______(填“是”成“否”)。
19.下图是A、B两种固体物质的溶解度曲线。据图回答:
(1)P点表示的意义是 _____ 。
(2)把t2℃时等质量A、B两物质的饱和溶液降低到t1℃,析出晶体较多的是 _____ 。
(3)当A中含有少量B物质时,可采用 _____ 的方法提纯A物质。
(4)t2℃时,将90gA物质投入到100g水中,得到A物质的 _____ (填“饱和”或“不饱和”)溶液,此时溶液的质量是 _____ g。
(5)t2℃时,将30gA物质投入到100g水中,可再采取哪些具体措施,使之变为饱和溶液? _____ 。
20.右图A、B、C三种固体物质的溶解度曲线。
(1)t1℃时,A物质的饱和溶液中溶质的质量分数是__________________。
(2)使t1℃时C物质的不饱和溶液都变成饱和溶液,采用的方法是________________(写一条)。
(3)t2℃时,B物质的溶解度______________ C物质的溶解度(填“大于”、“小于”或“等于”)。
三、实验题
21.实验室常用Y形管进行某些对比性实验。请你将图中的实验方案填写完整。
仪器 目的 操作 现象 结论
探究高锰酸钾和碘在水中的溶解能力 ____ 甲中固体溶解形成紫色溶液,乙中固体几乎不溶,水呈现淡淡黄色 __
参考答案:
1.D2.D3.B4.B5.A6.D7.C8.C9.B10.D11.C12.B13.D14.C15.C
16.(1)t1
(2)45
(3)C
(4) 放热 温度降低,A物质的溶解度变小
17. 物质的溶解性 是否含氧元素 CuO、CaCO3、H2SO4、Ba(OH)2、NaOH 铁、铜、碳、NaCl、AgCl
18.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)①②③
(3) AC/CA 能
(4)是
19. 在t1℃时,A、B两物质的溶解度相等 A物质/A 降温结晶/冷却热饱和溶液 饱和 150 再加入20gA物质,降温到t1℃及以下,恒温蒸发40g水等。
20. 28.6% 升温或减少溶剂或增加溶质 大于
21. 甲中放入一小粒高锰酸钾,乙中放入体积相同的一小粒碘,再分别向甲乙中加入等量水 常温下,高锰酸钾的溶解性比碘好。(高锰酸钾易溶,碘微溶于水)
同步练习
一、单选题
1.下列操作能达到目的是( )
A.稀释浓硫酸时,将水沿容器壁慢慢注入浓硫酸中,并不断搅拌
B.溶解食盐时用玻璃棒搅拌以增大氯化钠的溶解度
C.用湿润的pH试纸测量酸雨的酸碱度
D.蒸发操作中,当蒸发中出现较多固体时,停止加热
2.下图是A、B、C三种物质的溶解度曲线。下列叙述正确的是
A.t1℃时,三种物质溶解度大小顺序为A>B>C
B.t1℃时,A的饱和溶液中溶质的质量分数为10%
C.t2℃时,A、B、C的溶液的溶质质量分数一定相等
D.t3℃时,等质量的A、B、C的饱和溶液降温到t2℃时,所得溶液溶质质量分数由大到小顺序是A=B>C
3.下列实验方案不能达到实验目的的是
选项 实验目的 实验方案
A 鉴别木炭粉和铁粉 在氧气中灼烧
B 除去KCl固体中的KClO3 加热加入适量MnO2
C 提纯含有少量NaCl的KNO3 加水溶解,加热浓缩,冷却结晶后过滤
D 证明甲烷中含有氢元素 点燃甲烷,在火焰上方罩一个干冷的烧杯
A.A B.B C.C D.D
4.甲、乙两种固体的溶解度曲线如图所示,下列说法不正确的是
A.40℃时的溶解度甲>乙
B.若甲中含有少量乙,可用降温结晶的方法提纯甲
C.40℃时甲的饱和溶液中溶质与溶剂的质量之比为1:2
D.将40℃时乙的饱和溶液140g冷却到20℃析出固体乙10g
5.已知硝酸钾在不同温度下的溶解度如下表。下列说法不正确的是( )
温度/℃ 0 10 20 30 40 50
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5
A.30℃时在100g硝酸钾饱和溶液中含有45.8g硝酸钾
B.20℃时硝酸钾的溶解度为31.6g
C.硝酸钾的溶解度随温度升高而增大
D.40℃时,饱和硝酸钾溶液,降温可使部分溶质结晶析出
6.40℃时,烧杯中盛有100g 硝酸钾的饱和溶液,恒温下蒸发部分溶剂,然后 再将溶液逐渐升温到60℃.能表示此过程溶质质量分数a%与时间t关系的示意图的是
A. B.
C. D.
7.对下列物质的俗称,理解错误的是
A.干冰不是冰 B.纯碱不是碱 C.醋酸不是酸 D.水银不是银
8.下列有关熟石灰的说法错误的是
A.熟石灰的溶液俗称石灰水,呈碱性
B.熟石灰可由生石灰与水反应而制得
C.熟石灰的溶解度随温度的升高而增大
D.熟石灰可以和硫酸铜溶液配制农药波尔多液
9.参考KNO3的部分溶解度,进行了如图实验操作(每步均充分溶解)。下列说法不正确的是
温度(℃) 10 20 30 40 50 60
KNO3的溶解度(g) 20.9 31.6 45.8 63.9 85.5 110.0
A.KNO3的溶解度受温度变化影响大
B.在实验操作过程中只有A是饱和溶液
C.实验操作B到C过程中有晶体析出
D.实验操作中溶质质量分数最大的是B
10.下表是氯化钠、硝酸钾在不同温度时的溶解度。据此判断:下列说法不正确的是
温度/℃ 10 20 30 40 50 60
溶解度/g 氯化钠 35.8 36.0 36.3 36.6 37.0 37.3
硝酸钾 20.9 31.6 45.8 63.9 85.5 110
A.氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交
B.在20℃时, 向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18%
C.从含有少量氯化钠的饱和硝酸钾溶液中得到较多的硝酸钾晶体,可采用冷却热饱和溶液使其结晶的方法
D.分别将20℃时一定质量的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中溶质的质量分数大于氯化钠溶液
11.下列关于氧气的说法不正确的是
A.氧气具有助燃性,可以支持燃烧
B.工业上常采用分离液态空气法制取氧气
C.登山时携带氧气瓶,是因为高山上氧气体积分数小于21%
D.夏天鱼池内用增氧泵,是因为温度升高,氧气在水中的溶解能力降低
12.如图所示是a、b、c三种固体物质的溶解度曲线图。下列说法正确的是
A.t3℃时,a物质的饱和溶液中溶质质量分数为50%
B.t1℃时,a和c两物质的饱和溶液中溶质质量分数相等
C.将a、b、c三种物质的饱和溶液从t3℃降温至t1℃,其所得溶液中溶质质量分数大小关系是:b>a=c
D.若a中混有少量b,可采取蒸发溶剂的方法提纯a
13.下列各组离子在pH=1的水溶液中能大量共存的是
A.K+、Na+、Cl-、HCO3-
B.H+、K+ 、Cl-、OH-
C.Ca2+、Ba2+、Cl-、SO42-
D.K+、NH4+、Cl-、NO3-
14.下列图像能正确表示其对应关系的是
A.高温煅烧一定质量的石灰石,剩余固体质量随时间的变化
B.某物质的着火点为t℃,则图中P点时,该物质燃烧得最旺
C.20℃时,向一定量接近饱和的KNO3溶液中加入KNO3固体
D.向一定量 溶液中逐滴加入稀盐酸至过量,溶液pH的变化
15.如图表示的是KNO3和NaNO3的溶解度曲线。下列说法正确的
A.T2℃时,KNO3溶液的浓度一定等于NaNO3溶液的浓度
B.T1℃时,在50 g水里加入15 g KNO3固体,充分溶解,可得到65 g溶液
C.常温下,NaNO3属于易溶物
D.若KNO3中混有少量NaNO3,可用蒸发溶剂的方法提纯
二、填空题
16.下图是A、B、C三种物质的溶解度曲线,根据此图回答下列问题:
(1)__________℃时,物质A和C的溶解度相等。
(2)t2℃时,A物质的溶解度是_______g。
(3)等质量的A、B、C三种物质的饱和溶液同时从t2℃降温到t1℃,其中溶质质量分数没有发生改变的是_________
(4)t2℃时,小红向100g的水中加入45.8gA物质,她发现A物质全部溶解,一段时间后,她意外地发现又有部分A物质的晶体析出。我认为A物质“全部溶解”的原因是因为A物质溶解时_________(填“吸热”或“放热”)引起;析出晶体的原因是_________
17.现有9种物质:铁、铜、CuO、CaCO3、H2SO4、Ba(OH)2、NaOH、NaCl和AgCl。小王和小方根据不同的标准对它们进行如下分类,请你在他们分类的基础上再提出新的分类方法(每一类中不少于三种物质),并填写下表:
分类标准 类别
小王的分类标准:单质、化合物 类别一:铁、铜类别二:CuO、CaCO3、H2SO4、Ba(OH)2、NaOH、NaCl、AgCl
小方的分类标准:_______ 类别一:铁、铜、CuO、CaCO3、AgCl类别二:H2SO4、Ba(OH)2、NaOH、NaCl
新的分类标准:_______ 类别一:_______类别二:_______
18.根据实验回答以下问题。
(1)实验一的试管中发生反应的化学方程式为________ 。
(2)对实验一分析正确的是_______(填序号)。
①A处将稀盐酸换为稀硫酸,B、C处也一定能观察到同样的实验现象
②B处紫色石蕊变为红色,是因为CO2能与水反应生成碳酸
③C处蜡烛从低到高依次熄灭,说明CO2密度大于空气
(3)由实验二得出影响物质溶解性的因素是_______(填序号)。
A.溶质的种类 B.溶质的质量 C.溶剂的种类 D.温度
若省略实验二中试管a_______(填“能”或“不能”)得到相同结论。
(4)使用实验三装置进行验证质量守恒定律的实验,选择的试剂是碳酸钠和稀盐酸,反应结束后指针向右偏转,你认为该反应是否遵循质量守恒定律?______(填“是”成“否”)。
19.下图是A、B两种固体物质的溶解度曲线。据图回答:
(1)P点表示的意义是 _____ 。
(2)把t2℃时等质量A、B两物质的饱和溶液降低到t1℃,析出晶体较多的是 _____ 。
(3)当A中含有少量B物质时,可采用 _____ 的方法提纯A物质。
(4)t2℃时,将90gA物质投入到100g水中,得到A物质的 _____ (填“饱和”或“不饱和”)溶液,此时溶液的质量是 _____ g。
(5)t2℃时,将30gA物质投入到100g水中,可再采取哪些具体措施,使之变为饱和溶液? _____ 。
20.右图A、B、C三种固体物质的溶解度曲线。
(1)t1℃时,A物质的饱和溶液中溶质的质量分数是__________________。
(2)使t1℃时C物质的不饱和溶液都变成饱和溶液,采用的方法是________________(写一条)。
(3)t2℃时,B物质的溶解度______________ C物质的溶解度(填“大于”、“小于”或“等于”)。
三、实验题
21.实验室常用Y形管进行某些对比性实验。请你将图中的实验方案填写完整。
仪器 目的 操作 现象 结论
探究高锰酸钾和碘在水中的溶解能力 ____ 甲中固体溶解形成紫色溶液,乙中固体几乎不溶,水呈现淡淡黄色 __
参考答案:
1.D2.D3.B4.B5.A6.D7.C8.C9.B10.D11.C12.B13.D14.C15.C
16.(1)t1
(2)45
(3)C
(4) 放热 温度降低,A物质的溶解度变小
17. 物质的溶解性 是否含氧元素 CuO、CaCO3、H2SO4、Ba(OH)2、NaOH 铁、铜、碳、NaCl、AgCl
18.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)①②③
(3) AC/CA 能
(4)是
19. 在t1℃时,A、B两物质的溶解度相等 A物质/A 降温结晶/冷却热饱和溶液 饱和 150 再加入20gA物质,降温到t1℃及以下,恒温蒸发40g水等。
20. 28.6% 升温或减少溶剂或增加溶质 大于
21. 甲中放入一小粒高锰酸钾,乙中放入体积相同的一小粒碘,再分别向甲乙中加入等量水 常温下,高锰酸钾的溶解性比碘好。(高锰酸钾易溶,碘微溶于水)
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
