7.3溶液浓稀的表示同步练习(含答案)-2022-2023学年九年级化学科粤版下册
文档属性
| 名称 | 7.3溶液浓稀的表示同步练习(含答案)-2022-2023学年九年级化学科粤版下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 174.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 17:31:51 | ||
图片预览



文档简介
7.3 溶液浓稀的表示
同步练习
一、单选题
1.盛有饱和食盐水的烧杯在空气中放置较长时间后(外界条件不变),该溶液中的
A.氯化钠的质量减小 B.氯化钠的质量保持不变
C.氯化钠的质量分数不变 D.氯化钠的质量分数增大
2.溶解度曲线如图所示。下列说法不正确的是
A.0℃时,KCl的饱和溶液中溶质和溶剂的质量之为37:100
B.t℃时,KCl和KNO3两种饱和溶液中溶质的质量分数相等
C.30℃时,将接近饱和的KNO3溶液变成饱和溶液,可采用降温或添加溶质的方法
D.将恒温下的饱和KCl溶液敞口放置几天,有晶体析出,说明KCl的溶解度降低
3.农业上常用饱和食盐水进行选种.饱和食盐水露置在空气中一段时间后,有少量固体析出(设温度保持不变).下列推测正确的是( )
A.氯化钠溶解度变小
B.食盐水在空气中变质而不能继续使用
C.溶液依然饱和,溶质的质量分数不变
D.水分蒸发,溶质的质量分数变大
4. 下列叙述不正确的是
A.在水净化的单一操作中,蒸馏的净化程度最高
B.水通过三态变化实现天然循环
C.用密度约为1.04g/cm3的6%的氯化钠溶液配制3%的氯化钠溶液一定要使用托盘天平
D.用5%的过氧化氢溶液制氧气,为加快该反应的速率常加少量二氧化锰作催化剂
5.KCl和KNO3的溶解度及溶解度曲线如下。下列说法正确的是
温度/℃ 0 10 20 30 40 50 60
溶解度/g KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5
A.KCl的溶解度比KNO3的溶解度小
B.表示硝酸钾的溶解度曲线是甲
C.t2℃时,等质量的甲、乙溶液中,溶剂质量:甲<乙
D.将t1℃时甲、乙的饱和溶液升温至t2℃,溶质质量分数:甲>乙
6.配制溶质质量分数为10%的下列溶液,能达到目的是( )
A.称取10.0g氯化钠,放入90mL水中,充分搅拌
B.称取10.0g生石灰,放入90mL水中,充分搅拌
C.量取10.0ml浓盐酸,放入90mL水中,充分搅拌
D.称取10.0g硫酸钡,放入90mL水中,充分搅拌
7.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是
A.A点表示20℃时甲、乙溶解度相等
B.将30℃时甲、乙、丙三种物质的饱和溶液分别降温到10℃,它们的溶质质量分数都发生改变
C.甲中混有少量丙,可用冷却热饱和溶液的的方法提纯甲
D.30℃时,30g甲物质中加入50g水,充分溶解后得到72.5g溶液
8.如图是A、B两种固体物质的溶解度曲线。下列分析正确的是
A.物质A的溶解度大于物质B的溶解度
B.t1℃时,把15gA放入50g水中充分溶解可得到65g溶液
C.将A、B两物质的饱和溶液从t2℃升温至t3℃时,溶质质量分数A=B
D.物质A中混有少量的B,可采用蒸发结晶的方法提纯A
9.小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠。量取水的操作规程进行操作(图示为小芳操作时的读数,其它操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为1g/cm3)约为
A.12.4% B.17.2% C.16.9% D.12.5%
10.如图所示,A、B、C为三种物质的溶解度曲线,下列说法正确的是
A.A、B、C三种物质中溶解度最小的是C
B.t2℃时,将A、B、C的饱和溶液分别降温到t1℃,所得溶液中溶质质量分数的大小关系是B>A>C
C.t1℃时,将25gB物质投入100g水中,充分溶解,温度不变,所得溶液为饱和溶液
D.t2℃时,将A和C的混合溶液(两者均已达到饱和),降温到t1℃,析出的晶体含有A和C
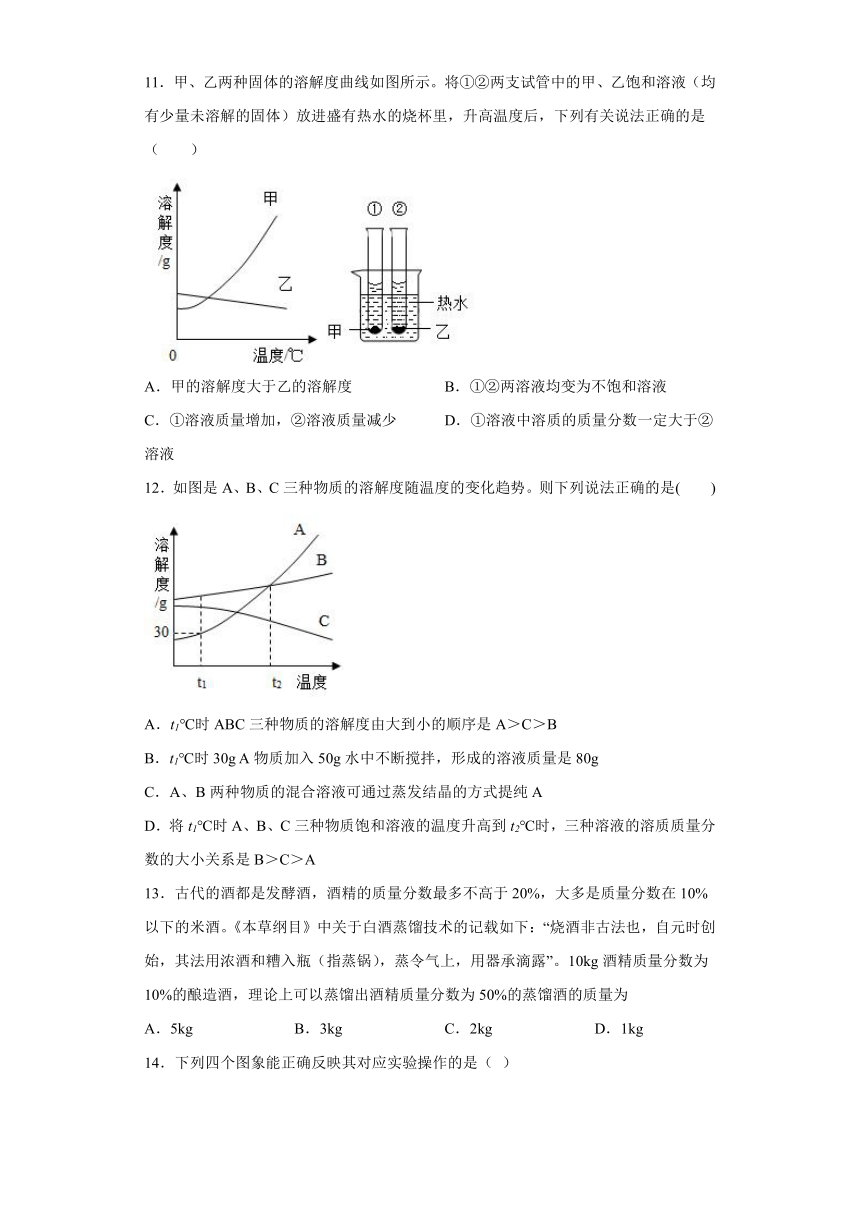
11.甲、乙两种固体的溶解度曲线如图所示。将①②两支试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里,升高温度后,下列有关说法正确的是( )
A.甲的溶解度大于乙的溶解度 B.①②两溶液均变为不饱和溶液
C.①溶液质量增加,②溶液质量减少 D.①溶液中溶质的质量分数一定大于②溶液
12.如图是A、B、C三种物质的溶解度随温度的变化趋势。则下列说法正确的是( )
A.t1℃时ABC三种物质的溶解度由大到小的顺序是A>C>B
B.t1℃时30g A物质加入50g水中不断搅拌,形成的溶液质量是80g
C.A、B两种物质的混合溶液可通过蒸发结晶的方式提纯A
D.将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数的大小关系是B>C>A
13.古代的酒都是发酵酒,酒精的质量分数最多不高于20%,大多是质量分数在10%以下的米酒。《本草纲目》中关于白酒蒸馏技术的记载如下:“烧酒非古法也,自元时创始,其法用浓酒和糟入瓶(指蒸锅),蒸令气上,用器承滴露”。10kg酒精质量分数为10%的酿造酒,理论上可以蒸馏出酒精质量分数为50%的蒸馏酒的质量为
A.5kg B.3kg C.2kg D.1kg
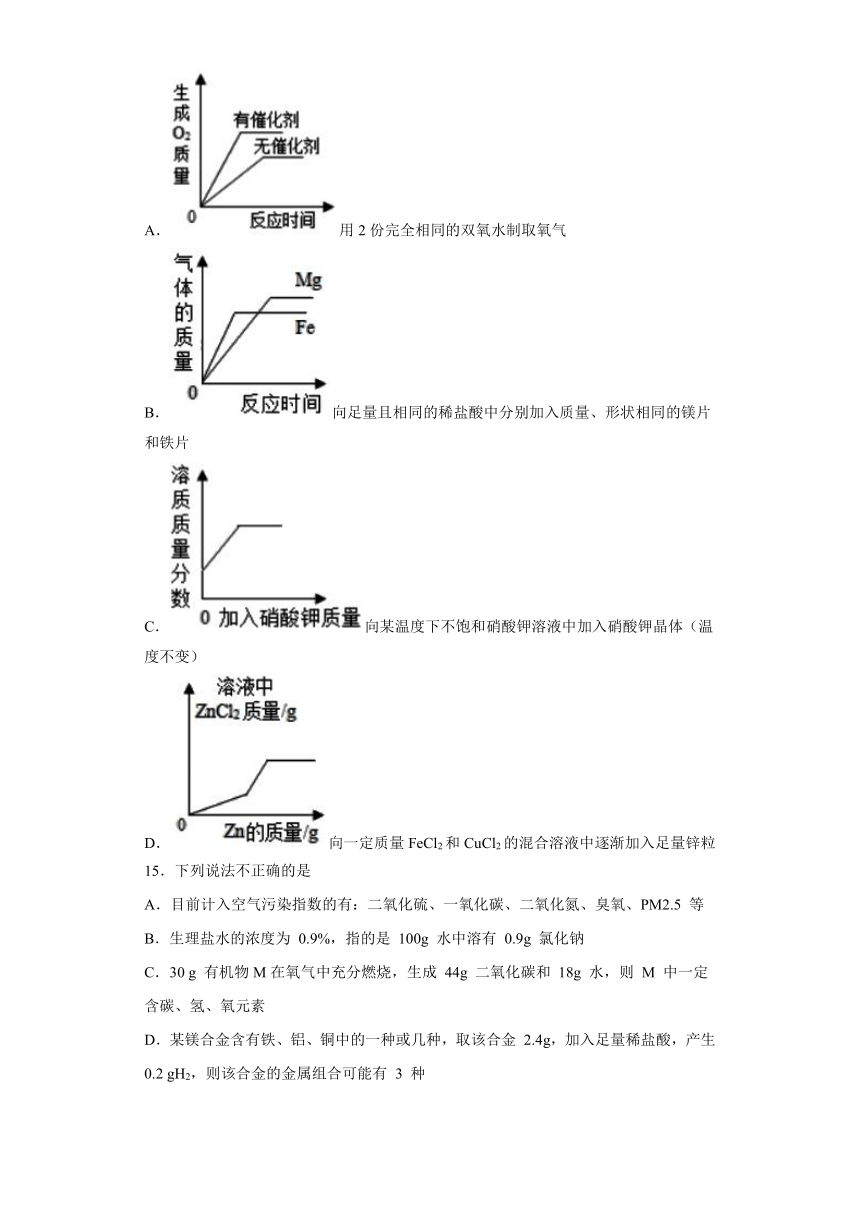
14.下列四个图象能正确反映其对应实验操作的是( )
A.用2份完全相同的双氧水制取氧气
B.向足量且相同的稀盐酸中分别加入质量、形状相同的镁片和铁片
C.向某温度下不饱和硝酸钾溶液中加入硝酸钾晶体(温度不变)
D.向一定质量FeCl2和CuCl2的混合溶液中逐渐加入足量锌粒
15.下列说法不正确的是
A.目前计入空气污染指数的有:二氧化硫、一氧化碳、二氧化氮、臭氧、PM2.5 等
B.生理盐水的浓度为 0.9%,指的是 100g 水中溶有 0.9g 氯化钠
C.30 g 有机物M在氧气中充分燃烧,生成 44g 二氧化碳和 18g 水,则 M 中一定含碳、氢、氧元素
D.某镁合金含有铁、铝、铜中的一种或几种,取该合金 2.4g,加入足量稀盐酸,产生 0.2 gH2,则该合金的金属组合可能有 3 种
二、填空题
16.甲、乙、丙三种固体物质的溶解度曲线如下图所示。
(1)20℃时,甲、乙、丙三种物质的溶解度由大到小的顺序为_____。
(2)20℃时,将50g乙物质放入100g水中充分溶解,所得溶液是_____溶液填“饱和”或“不饱和”。将此溶液升温至50℃,此时该溶液的溶质质量分数为_____。(结果精确到0.1%)
(2)50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃,所得溶液中溶质质量分数最小的是_____(填“甲”、“乙”或“丙”)。
17.如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
(1)P点的含义是______。
(2)t2℃时30ga物质加入到50g水中不断搅拌,形成溶液质量______g,该溶液的溶质质量分数为______(结果保留至0.1%)。
(3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是______(填写物质序号)。
(4)图中______物质的溶解度曲线与气体物质溶解度曲线受温度影响变化相似。
(5)若从混有少量b的a饱和溶液中提取a,应采取的方法是______。(填“降温结晶”或“蒸发结晶”)进行。
(6)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是______(填写物质序号)。
(7)据题图,下列有关说法正确的是______。
A、a的不饱和溶液只能采用蒸发溶剂的方法才可变成饱和溶液
B、t2℃时,a溶液的溶质质量分数一定比b溶液的大
C、将t2℃时a和b两种溶液分别降温至t1℃,析出晶体较多的是a溶液
D、t2℃时,从a和b两种饱和溶液中获得等质量晶体,蒸发水较多的是b溶液
18.A和B两物质的溶解度曲线如图。
(1) t1℃时分别配制A和B的饱和溶液各100克,则加入水的质量A _______ B (填“>”、“=”或“<”)。
(2)t℃时A和B的饱和溶液中溶质的质量分数A _______ B (填“>”、“=”或“<”)。
(3)有t2℃时含有A和B的混合溶液,要得到A的晶体,应采用的方法是 ____________ 。
19.如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答
温度/℃ 10 20 30 40
溶解度/g 氯化钠 35.8 36.0 36.3 36.6
碳酸钠 12.2 21.8 39.7 53.2
(1)40℃时,氯化钠的溶解度为_____g.
(2)在20℃时,将30g碳酸钠加入100g水中,充分搅拌后得到溶液的溶质质量分数为_____(计算结果精确到0.1%)
(3)10℃时,分别取等质量的氯化钠和碳酸钠配制饱和溶液,需要水的质量氯化钠_____(填“>”、“=”或“<”)碳酸钠.
20.我国化学家侯德榜创立的侯氏制碱法为纯碱工业技术发展做出杰出贡献。在制备纯碱过程中涉及Na2CO3、NaCl、NH4Cl、NaHCO3等物质。请结合下表数据回答:
温度/°C 0 10 20 30 40 50 60
溶解度/g Na2CO3 7 12.2 21.8 39.7 48.8 47.3 46.4
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.2
NaHCO3 6.9 8.2 9.6 11.1 12.7 14.5 16.4
(1)在50°C时,向100g水中加入48gNa2CO3充分搅拌所得溶液质量为____,保持烧杯中各物质质量不变,降温至40°C时,所得溶液溶质的质量分数会____(填“变小”、“不变”或“变大”)。
(2)请根据表格中数据在如图中绘制Na2CO3溶解度曲线____。
(3)根据图中四种物质的溶解度曲线,回答下列问题:
①60°C时,分别向等质量的四种固体物质中加水配成饱和溶液,所得溶液质量最大的是_____。
②侯氏制碱法的原理是:NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3,在生成物碳酸氢钠和氯化铵中,先析出的是____,理由是____。
三、实验题
21.实验是进行科学探究的重要方式,请据图回答问题:
(1)A实验玻璃管②中产生的气体是_________________。
(2)B实验如果实验数据小于 21%,可能原因是_________________(答出一条即可)。
(3)C实验中加植物油的目的是_________________。
(4)图D中喷水的紫色纸花放到二氧化碳气体中,纸花变红,说明_________________。
(5)图E膜法淡化海水时,右侧海水的溶质质量分数_________________ (填“变大”“变小”或“不变”)。
(6)图F玻璃棒的作用是_________________。
参考答案:1.C2.D3.C4.C5.B6.A7.B8.C9.A10.B11.C12.D13.C14.C15.B
16. 乙、甲、丙 饱和 28.6% 丙
17. t1℃时,a、c两种物质的溶解度相等为20g 75g 33.3% c、b、a c 降温结晶 b>a>c D
18.(1)>
(2)=
(3)降温结晶
19. 36.6 17.9% <
20. 147.3g 变大 NaHCO3溶液 碳酸氢钠(或NaHCO3) NaHCO3的溶解度远小于NH4Cl的溶解度(或NaHCO3的溶解度较小;或反应生成的碳酸氢钠的质量大于氯化铵,且相同温度下NaHCO3的溶解度远小于NH4Cl的溶解度)
21. 氢气 装置漏气(答案合理即可) 隔绝氧气 二氧化碳与水反应生成酸性物质 变大 搅拌,防止局部温度过高造成液体飞溅
同步练习
一、单选题
1.盛有饱和食盐水的烧杯在空气中放置较长时间后(外界条件不变),该溶液中的
A.氯化钠的质量减小 B.氯化钠的质量保持不变
C.氯化钠的质量分数不变 D.氯化钠的质量分数增大
2.溶解度曲线如图所示。下列说法不正确的是
A.0℃时,KCl的饱和溶液中溶质和溶剂的质量之为37:100
B.t℃时,KCl和KNO3两种饱和溶液中溶质的质量分数相等
C.30℃时,将接近饱和的KNO3溶液变成饱和溶液,可采用降温或添加溶质的方法
D.将恒温下的饱和KCl溶液敞口放置几天,有晶体析出,说明KCl的溶解度降低
3.农业上常用饱和食盐水进行选种.饱和食盐水露置在空气中一段时间后,有少量固体析出(设温度保持不变).下列推测正确的是( )
A.氯化钠溶解度变小
B.食盐水在空气中变质而不能继续使用
C.溶液依然饱和,溶质的质量分数不变
D.水分蒸发,溶质的质量分数变大
4. 下列叙述不正确的是
A.在水净化的单一操作中,蒸馏的净化程度最高
B.水通过三态变化实现天然循环
C.用密度约为1.04g/cm3的6%的氯化钠溶液配制3%的氯化钠溶液一定要使用托盘天平
D.用5%的过氧化氢溶液制氧气,为加快该反应的速率常加少量二氧化锰作催化剂
5.KCl和KNO3的溶解度及溶解度曲线如下。下列说法正确的是
温度/℃ 0 10 20 30 40 50 60
溶解度/g KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5
A.KCl的溶解度比KNO3的溶解度小
B.表示硝酸钾的溶解度曲线是甲
C.t2℃时,等质量的甲、乙溶液中,溶剂质量:甲<乙
D.将t1℃时甲、乙的饱和溶液升温至t2℃,溶质质量分数:甲>乙
6.配制溶质质量分数为10%的下列溶液,能达到目的是( )
A.称取10.0g氯化钠,放入90mL水中,充分搅拌
B.称取10.0g生石灰,放入90mL水中,充分搅拌
C.量取10.0ml浓盐酸,放入90mL水中,充分搅拌
D.称取10.0g硫酸钡,放入90mL水中,充分搅拌
7.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是
A.A点表示20℃时甲、乙溶解度相等
B.将30℃时甲、乙、丙三种物质的饱和溶液分别降温到10℃,它们的溶质质量分数都发生改变
C.甲中混有少量丙,可用冷却热饱和溶液的的方法提纯甲
D.30℃时,30g甲物质中加入50g水,充分溶解后得到72.5g溶液
8.如图是A、B两种固体物质的溶解度曲线。下列分析正确的是
A.物质A的溶解度大于物质B的溶解度
B.t1℃时,把15gA放入50g水中充分溶解可得到65g溶液
C.将A、B两物质的饱和溶液从t2℃升温至t3℃时,溶质质量分数A=B
D.物质A中混有少量的B,可采用蒸发结晶的方法提纯A
9.小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠。量取水的操作规程进行操作(图示为小芳操作时的读数,其它操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为1g/cm3)约为
A.12.4% B.17.2% C.16.9% D.12.5%
10.如图所示,A、B、C为三种物质的溶解度曲线,下列说法正确的是
A.A、B、C三种物质中溶解度最小的是C
B.t2℃时,将A、B、C的饱和溶液分别降温到t1℃,所得溶液中溶质质量分数的大小关系是B>A>C
C.t1℃时,将25gB物质投入100g水中,充分溶解,温度不变,所得溶液为饱和溶液
D.t2℃时,将A和C的混合溶液(两者均已达到饱和),降温到t1℃,析出的晶体含有A和C
11.甲、乙两种固体的溶解度曲线如图所示。将①②两支试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里,升高温度后,下列有关说法正确的是( )
A.甲的溶解度大于乙的溶解度 B.①②两溶液均变为不饱和溶液
C.①溶液质量增加,②溶液质量减少 D.①溶液中溶质的质量分数一定大于②溶液
12.如图是A、B、C三种物质的溶解度随温度的变化趋势。则下列说法正确的是( )
A.t1℃时ABC三种物质的溶解度由大到小的顺序是A>C>B
B.t1℃时30g A物质加入50g水中不断搅拌,形成的溶液质量是80g
C.A、B两种物质的混合溶液可通过蒸发结晶的方式提纯A
D.将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数的大小关系是B>C>A
13.古代的酒都是发酵酒,酒精的质量分数最多不高于20%,大多是质量分数在10%以下的米酒。《本草纲目》中关于白酒蒸馏技术的记载如下:“烧酒非古法也,自元时创始,其法用浓酒和糟入瓶(指蒸锅),蒸令气上,用器承滴露”。10kg酒精质量分数为10%的酿造酒,理论上可以蒸馏出酒精质量分数为50%的蒸馏酒的质量为
A.5kg B.3kg C.2kg D.1kg
14.下列四个图象能正确反映其对应实验操作的是( )
A.用2份完全相同的双氧水制取氧气
B.向足量且相同的稀盐酸中分别加入质量、形状相同的镁片和铁片
C.向某温度下不饱和硝酸钾溶液中加入硝酸钾晶体(温度不变)
D.向一定质量FeCl2和CuCl2的混合溶液中逐渐加入足量锌粒
15.下列说法不正确的是
A.目前计入空气污染指数的有:二氧化硫、一氧化碳、二氧化氮、臭氧、PM2.5 等
B.生理盐水的浓度为 0.9%,指的是 100g 水中溶有 0.9g 氯化钠
C.30 g 有机物M在氧气中充分燃烧,生成 44g 二氧化碳和 18g 水,则 M 中一定含碳、氢、氧元素
D.某镁合金含有铁、铝、铜中的一种或几种,取该合金 2.4g,加入足量稀盐酸,产生 0.2 gH2,则该合金的金属组合可能有 3 种
二、填空题
16.甲、乙、丙三种固体物质的溶解度曲线如下图所示。
(1)20℃时,甲、乙、丙三种物质的溶解度由大到小的顺序为_____。
(2)20℃时,将50g乙物质放入100g水中充分溶解,所得溶液是_____溶液填“饱和”或“不饱和”。将此溶液升温至50℃,此时该溶液的溶质质量分数为_____。(结果精确到0.1%)
(2)50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃,所得溶液中溶质质量分数最小的是_____(填“甲”、“乙”或“丙”)。
17.如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
(1)P点的含义是______。
(2)t2℃时30ga物质加入到50g水中不断搅拌,形成溶液质量______g,该溶液的溶质质量分数为______(结果保留至0.1%)。
(3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是______(填写物质序号)。
(4)图中______物质的溶解度曲线与气体物质溶解度曲线受温度影响变化相似。
(5)若从混有少量b的a饱和溶液中提取a,应采取的方法是______。(填“降温结晶”或“蒸发结晶”)进行。
(6)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是______(填写物质序号)。
(7)据题图,下列有关说法正确的是______。
A、a的不饱和溶液只能采用蒸发溶剂的方法才可变成饱和溶液
B、t2℃时,a溶液的溶质质量分数一定比b溶液的大
C、将t2℃时a和b两种溶液分别降温至t1℃,析出晶体较多的是a溶液
D、t2℃时,从a和b两种饱和溶液中获得等质量晶体,蒸发水较多的是b溶液
18.A和B两物质的溶解度曲线如图。
(1) t1℃时分别配制A和B的饱和溶液各100克,则加入水的质量A _______ B (填“>”、“=”或“<”)。
(2)t℃时A和B的饱和溶液中溶质的质量分数A _______ B (填“>”、“=”或“<”)。
(3)有t2℃时含有A和B的混合溶液,要得到A的晶体,应采用的方法是 ____________ 。
19.如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答
温度/℃ 10 20 30 40
溶解度/g 氯化钠 35.8 36.0 36.3 36.6
碳酸钠 12.2 21.8 39.7 53.2
(1)40℃时,氯化钠的溶解度为_____g.
(2)在20℃时,将30g碳酸钠加入100g水中,充分搅拌后得到溶液的溶质质量分数为_____(计算结果精确到0.1%)
(3)10℃时,分别取等质量的氯化钠和碳酸钠配制饱和溶液,需要水的质量氯化钠_____(填“>”、“=”或“<”)碳酸钠.
20.我国化学家侯德榜创立的侯氏制碱法为纯碱工业技术发展做出杰出贡献。在制备纯碱过程中涉及Na2CO3、NaCl、NH4Cl、NaHCO3等物质。请结合下表数据回答:
温度/°C 0 10 20 30 40 50 60
溶解度/g Na2CO3 7 12.2 21.8 39.7 48.8 47.3 46.4
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.2
NaHCO3 6.9 8.2 9.6 11.1 12.7 14.5 16.4
(1)在50°C时,向100g水中加入48gNa2CO3充分搅拌所得溶液质量为____,保持烧杯中各物质质量不变,降温至40°C时,所得溶液溶质的质量分数会____(填“变小”、“不变”或“变大”)。
(2)请根据表格中数据在如图中绘制Na2CO3溶解度曲线____。
(3)根据图中四种物质的溶解度曲线,回答下列问题:
①60°C时,分别向等质量的四种固体物质中加水配成饱和溶液,所得溶液质量最大的是_____。
②侯氏制碱法的原理是:NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3,在生成物碳酸氢钠和氯化铵中,先析出的是____,理由是____。
三、实验题
21.实验是进行科学探究的重要方式,请据图回答问题:
(1)A实验玻璃管②中产生的气体是_________________。
(2)B实验如果实验数据小于 21%,可能原因是_________________(答出一条即可)。
(3)C实验中加植物油的目的是_________________。
(4)图D中喷水的紫色纸花放到二氧化碳气体中,纸花变红,说明_________________。
(5)图E膜法淡化海水时,右侧海水的溶质质量分数_________________ (填“变大”“变小”或“不变”)。
(6)图F玻璃棒的作用是_________________。
参考答案:1.C2.D3.C4.C5.B6.A7.B8.C9.A10.B11.C12.D13.C14.C15.B
16. 乙、甲、丙 饱和 28.6% 丙
17. t1℃时,a、c两种物质的溶解度相等为20g 75g 33.3% c、b、a c 降温结晶 b>a>c D
18.(1)>
(2)=
(3)降温结晶
19. 36.6 17.9% <
20. 147.3g 变大 NaHCO3溶液 碳酸氢钠(或NaHCO3) NaHCO3的溶解度远小于NH4Cl的溶解度(或NaHCO3的溶解度较小;或反应生成的碳酸氢钠的质量大于氯化铵,且相同温度下NaHCO3的溶解度远小于NH4Cl的溶解度)
21. 氢气 装置漏气(答案合理即可) 隔绝氧气 二氧化碳与水反应生成酸性物质 变大 搅拌,防止局部温度过高造成液体飞溅
