7.2物质溶解的量同步练习(含答案)—2022-2023学年九年级化学科粤版下册
文档属性
| 名称 | 7.2物质溶解的量同步练习(含答案)—2022-2023学年九年级化学科粤版下册 |
|
|
| 格式 | docx | ||
| 文件大小 | 106.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-24 17:33:48 | ||
图片预览


文档简介
7.2 物质溶解的量
同步练习
一、单选题
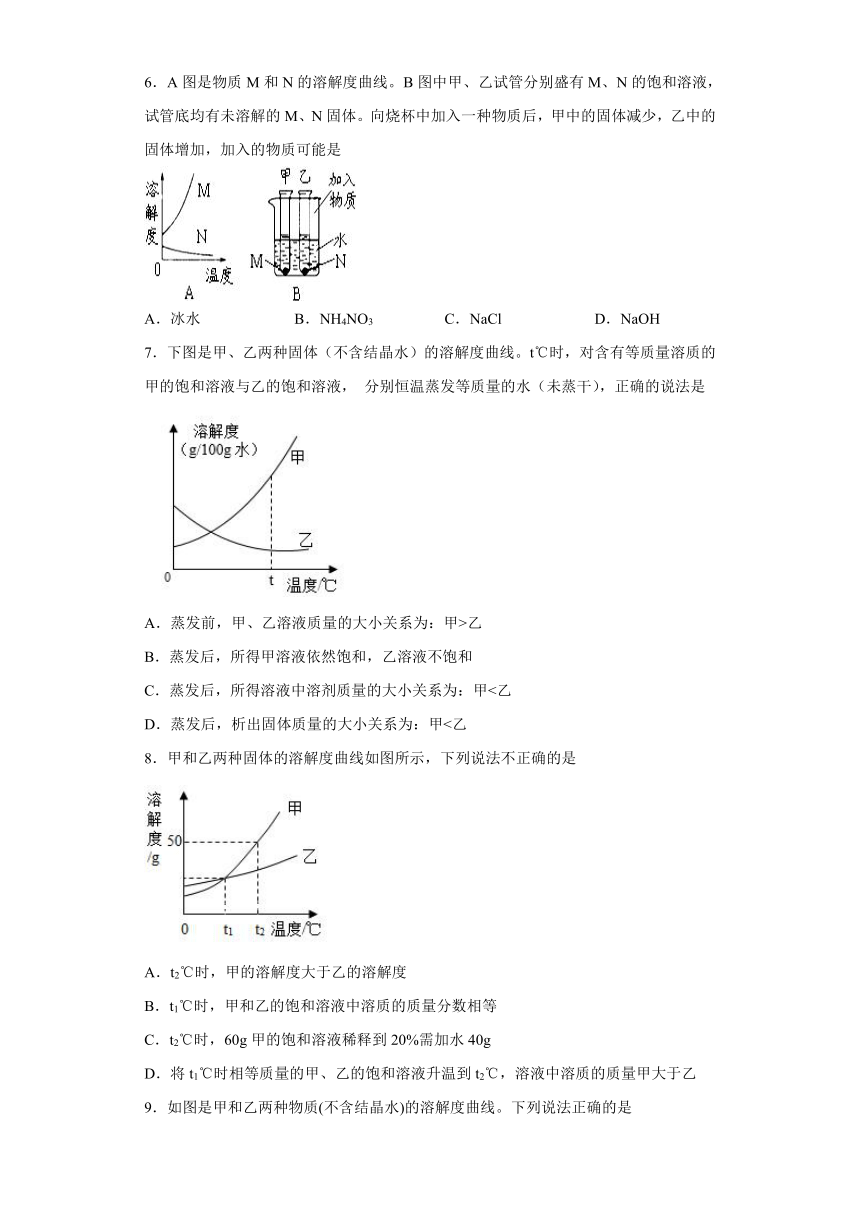
1.20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水不与水反应),充分溶解后,结果如图。下列说法正确的是
A.所得溶液可能都是饱和溶液
B.20℃时,乙溶液的溶质质量最小
C.20℃时,三种物质的溶解度:甲>丙>乙
D.升高温度,溶液溶质的质量分数一定变大
2.取70g某温度下的氯化钾饱和溶液,将其恒温蒸发10g水,析出4g氯化钾固体,则剩余溶液中所含溶质质量为
A.16g B.20g C.40g D.56g
3.你认为下列溶液肯定是该温度下的饱和溶液的是( )
A.氯化钾溶液 B.浓度较大的氯化铵溶液
C.黄色的氯化铁溶液 D.颜色很深的硫酸铜溶液
4.下列关于溶液的说法错误的是
A.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
B.溶液是具有均一性 稳定性的混合物
C.将20%的NaOH溶液均分成两份,每份溶液的溶质质量分数都为20%
D.食盐溶液中溶质是以离子形式分散到溶剂中
5.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.水能溶解很多物质,是一种最常用的溶剂
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体,得到的溶液是t℃时的不饱和溶液
6.A图是物质M和N的溶解度曲线。B图中甲、乙试管分别盛有M、N的饱和溶液,试管底均有未溶解的M、N固体。向烧杯中加入一种物质后,甲中的固体减少,乙中的固体增加,加入的物质可能是
A.冰水 B.NH4NO3 C.NaCl D.NaOH
7.下图是甲、乙两种固体(不含结晶水)的溶解度曲线。t℃时,对含有等质量溶质的甲的饱和溶液与乙的饱和溶液, 分别恒温蒸发等质量的水(未蒸干),正确的说法是
A.蒸发前,甲、乙溶液质量的大小关系为:甲>乙
B.蒸发后,所得甲溶液依然饱和,乙溶液不饱和
C.蒸发后,所得溶液中溶剂质量的大小关系为:甲<乙
D.蒸发后,析出固体质量的大小关系为:甲<乙
8.甲和乙两种固体的溶解度曲线如图所示,下列说法不正确的是
A.t2℃时,甲的溶解度大于乙的溶解度
B.t1℃时,甲和乙的饱和溶液中溶质的质量分数相等
C.t2℃时,60g甲的饱和溶液稀释到20%需加水40g
D.将t1℃时相等质量的甲、乙的饱和溶液升温到t2℃,溶液中溶质的质量甲大于乙
9.如图是甲和乙两种物质(不含结晶水)的溶解度曲线。下列说法正确的是
A.图中阴影部分表示的甲和乙两溶液都是饱和溶液
B.t1℃时,等质量甲和乙的饱和溶液中溶质质量相等
C.t2℃时,将60g甲物质加入50g水中充分溶解,所得溶液质量为110g
D.将t2℃时乙的不饱和溶液降温至t1℃,一定变为饱和溶液
10.根据如图所示的溶解度曲线判断,下列说法正确的是( )
A.℃时,甲溶液的溶质的质量分数一定比乙小
B.℃时,甲、乙两饱和溶液溶质的质量分数都为40%
C.℃时,甲饱和溶液中溶质的质量一定比乙饱和溶液中溶质的质量大
D.将相同质量℃时的甲、乙饱和溶液降温至℃时,甲饱和溶液中析出的晶体更多
11.以下几种物质中:①KNO3 ②Ca(OH)2 ③O2 ④NaCl,溶解度随温度的升高而明显增大的是( )
A.①④ B.③④ C.①③④ D.只有①
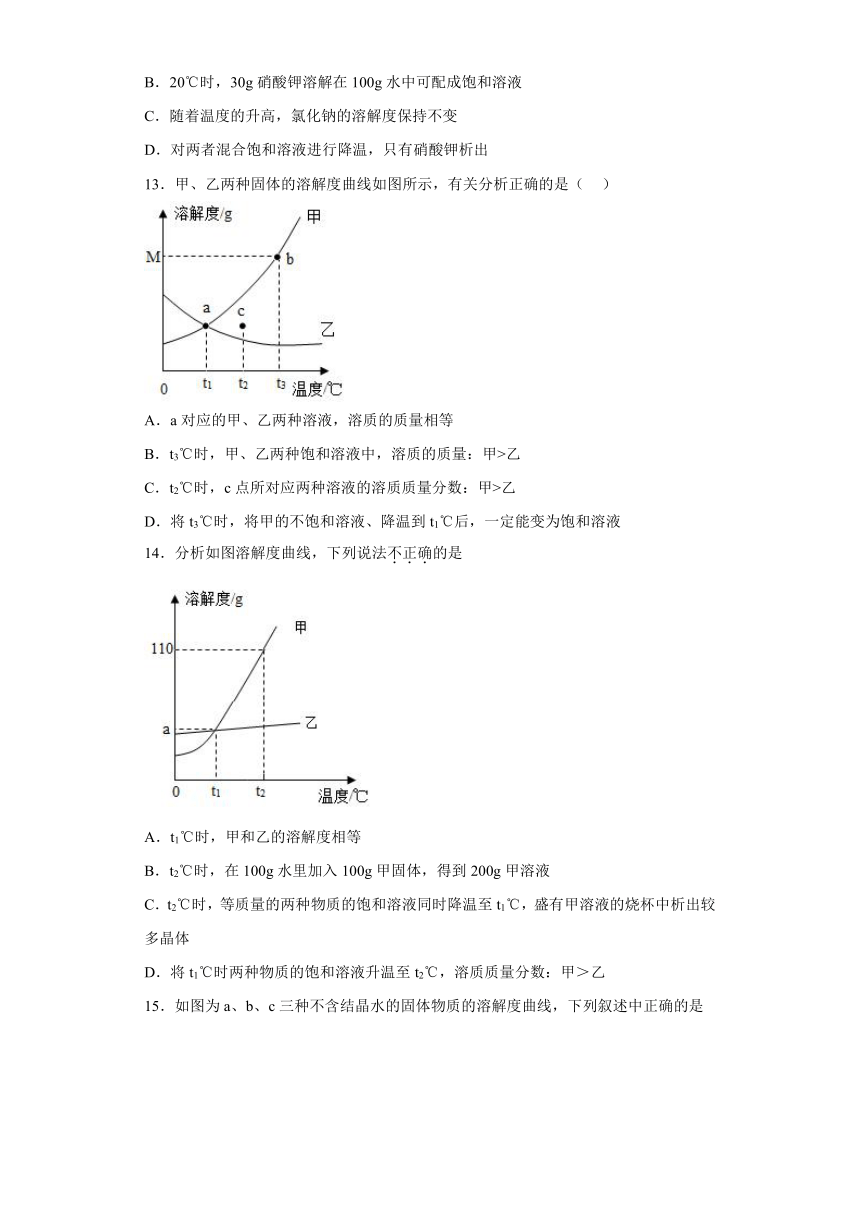
12.硝酸钾和氯化钠的溶解度曲线如下图所示,下列说法正确的是
A.硝酸钾的溶解度大于氯化钠
B.20℃时,30g硝酸钾溶解在100g水中可配成饱和溶液
C.随着温度的升高,氯化钠的溶解度保持不变
D.对两者混合饱和溶液进行降温,只有硝酸钾析出
13.甲、乙两种固体的溶解度曲线如图所示,有关分析正确的是( )
A.a对应的甲、乙两种溶液,溶质的质量相等
B.t3℃时,甲、乙两种饱和溶液中,溶质的质量:甲>乙
C.t2℃时,c点所对应两种溶液的溶质质量分数:甲>乙
D.将t3℃时,将甲的不饱和溶液、降温到t1℃后,一定能变为饱和溶液
14.分析如图溶解度曲线,下列说法不正确的是
A.t1℃时,甲和乙的溶解度相等
B.t2℃时,在100g水里加入100g甲固体,得到200g甲溶液
C.t2℃时,等质量的两种物质的饱和溶液同时降温至t1℃,盛有甲溶液的烧杯中析出较多晶体
D.将t1℃时两种物质的饱和溶液升温至t2℃,溶质质量分数:甲>乙
15.如图为a、b、c三种不含结晶水的固体物质的溶解度曲线,下列叙述中正确的是
A.t1℃时,a、b、c饱和溶液的溶质质量分数约为21%
B.P点表示t2℃时,a、b的溶液是饱和状态,c的溶液是不饱和状态
C.t2℃时,a、b、c三种物质溶液的溶质质量分数a>b>c
D.100ga溶液从t2℃降温到t1℃时,析出晶体14g
二、填空题
16.请回答下列有关溶液的问题。
(1)把面粉与酒精分别加入蒸馏水中,能形成悬浊液的是___________。
(2)如图是a、b两种固体物质的溶解度曲线。
①当温度高于20℃,溶解度:a___________b(填“>”“<”或“=”)。
②20℃,相同质量的a、b饱和溶液中,a的饱和溶液中所含水的质量______(填“>”“<”或“=”)b的饱和溶液中所含水的质量。
③t℃时,将等质量的a、b两种饱和溶液分别升温到30℃,还能继续溶解溶质的质量:a____b(填“>”“<”或“=”)。
17.“二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。”这是中国应对全球气候问题作出的庄严承诺。请回答下列问题:
(1)控制CO2的排放,目的是为减缓______。加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度______。
(2)利用天然气代替含硫煤做家庭燃料的优点是可以减少______的排放。
18.按要求回答:
(1)下列是与水有关的几个描述,请根据所学知识回答:
①水是由大量______直接构成的;
②自来水厂净化水的过程中有静置、沉淀、过滤、吸附,这些变化属于______变化;
③水电解过程与电源正极连接的一端产生______。
(2)t1℃时,将等质量的硝酸钾和氯化钾分配加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
①烧杯②中的上层清液是否达到饱和状态?______(填“是”“否”或“无法判断”);
②烧杯①中溶解的溶质是______(写名称或化学式);
③关于图1中烧杯内的物质,下列说法正确的是______。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
19.酸、碱、盐是重要的化合物,研究它们的性质有重要意义。NaCl、KNO3、NH4CI三种固体在水中的溶解度曲线如图所示。请仔细观察如图曲线,回答下列问题:
①三种固体物质的溶解度受温度影响最小的是______。
②40°C时三种固体物质饱和水溶液中溶质的质量分数由大到小的顺序是______。
③图中A、B点的坐标为A (10, 21),B(40, 64) 。若将40°C时164g的硝酸钾饱和水溶液降温到10°C,析出KNO3固体的质量为_____g。
20.KNO3和KCl在不同温度时的溶解度如下表所示:
温度/℃ 0 10 20 30 40 50 60 70
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3
回答下列问题:
(1)30℃时,KC1的溶解度为_______g。
(2)依据表中数据,绘制KNO3和KC1的溶解度曲线,如图中能表示KNO3溶解度曲线的是_______(选填“a”或“b”)。
(3)40℃时,现有质量均为100g的硝酸钾和氯化钾两种饱和溶液,若将它们同时降温至10℃。下列说法不正确的是_______。
A.40℃时,硝酸钾饱和溶液水的质量大于氯化钾饱溶液中水的质量
B.降温至10℃时,析出的KNO3晶体质量比析的KC1晶体质量大
C.降温至10℃时,硝酸钾饱和溶液的质量分数大于氯化钾饱和溶液的质量分数
D.当温度降至20℃和30℃之间的某一温度,两种溶液的质量分数可能相等
三、实验题
21.小明在家做蔗糖溶于水的实验时,观察到如图所示的现象。请填空:
(1)能说明糖水是溶液的现象是 __________ ;
(2)溶解后,液面低于原水平线的微观解释是 ________ ;
(3)再加入足量蔗糖,充分搅拌后,发现仍有蔗糖固体留在杯底,其原因是 ______ 。
参考答案:
1.A2.A3.A4.A5.A6.D7.C8.D9.B10.D11.D12.B13.C14.D15.A
16. 面粉 > < >
17.(1) 温室效应 增大
(2)二氧化硫/SO2
18.(1) 水分子 物理 氧气/O2
(2) 是 氯化钾/KCl AD
19. NaCl(或氯化钠) KNO3>NH4Cl>NaCl 43
20.(1)37.0
(2)a
(3)AC
21.(1)杯中的糖块消失了
(2)分子之间存在间隔
(3)蔗糖溶液达到饱和后就不能再溶解蔗糖
同步练习
一、单选题
1.20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水不与水反应),充分溶解后,结果如图。下列说法正确的是
A.所得溶液可能都是饱和溶液
B.20℃时,乙溶液的溶质质量最小
C.20℃时,三种物质的溶解度:甲>丙>乙
D.升高温度,溶液溶质的质量分数一定变大
2.取70g某温度下的氯化钾饱和溶液,将其恒温蒸发10g水,析出4g氯化钾固体,则剩余溶液中所含溶质质量为
A.16g B.20g C.40g D.56g
3.你认为下列溶液肯定是该温度下的饱和溶液的是( )
A.氯化钾溶液 B.浓度较大的氯化铵溶液
C.黄色的氯化铁溶液 D.颜色很深的硫酸铜溶液
4.下列关于溶液的说法错误的是
A.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
B.溶液是具有均一性 稳定性的混合物
C.将20%的NaOH溶液均分成两份,每份溶液的溶质质量分数都为20%
D.食盐溶液中溶质是以离子形式分散到溶剂中
5.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.水能溶解很多物质,是一种最常用的溶剂
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体,得到的溶液是t℃时的不饱和溶液
6.A图是物质M和N的溶解度曲线。B图中甲、乙试管分别盛有M、N的饱和溶液,试管底均有未溶解的M、N固体。向烧杯中加入一种物质后,甲中的固体减少,乙中的固体增加,加入的物质可能是
A.冰水 B.NH4NO3 C.NaCl D.NaOH
7.下图是甲、乙两种固体(不含结晶水)的溶解度曲线。t℃时,对含有等质量溶质的甲的饱和溶液与乙的饱和溶液, 分别恒温蒸发等质量的水(未蒸干),正确的说法是
A.蒸发前,甲、乙溶液质量的大小关系为:甲>乙
B.蒸发后,所得甲溶液依然饱和,乙溶液不饱和
C.蒸发后,所得溶液中溶剂质量的大小关系为:甲<乙
D.蒸发后,析出固体质量的大小关系为:甲<乙
8.甲和乙两种固体的溶解度曲线如图所示,下列说法不正确的是
A.t2℃时,甲的溶解度大于乙的溶解度
B.t1℃时,甲和乙的饱和溶液中溶质的质量分数相等
C.t2℃时,60g甲的饱和溶液稀释到20%需加水40g
D.将t1℃时相等质量的甲、乙的饱和溶液升温到t2℃,溶液中溶质的质量甲大于乙
9.如图是甲和乙两种物质(不含结晶水)的溶解度曲线。下列说法正确的是
A.图中阴影部分表示的甲和乙两溶液都是饱和溶液
B.t1℃时,等质量甲和乙的饱和溶液中溶质质量相等
C.t2℃时,将60g甲物质加入50g水中充分溶解,所得溶液质量为110g
D.将t2℃时乙的不饱和溶液降温至t1℃,一定变为饱和溶液
10.根据如图所示的溶解度曲线判断,下列说法正确的是( )
A.℃时,甲溶液的溶质的质量分数一定比乙小
B.℃时,甲、乙两饱和溶液溶质的质量分数都为40%
C.℃时,甲饱和溶液中溶质的质量一定比乙饱和溶液中溶质的质量大
D.将相同质量℃时的甲、乙饱和溶液降温至℃时,甲饱和溶液中析出的晶体更多
11.以下几种物质中:①KNO3 ②Ca(OH)2 ③O2 ④NaCl,溶解度随温度的升高而明显增大的是( )
A.①④ B.③④ C.①③④ D.只有①
12.硝酸钾和氯化钠的溶解度曲线如下图所示,下列说法正确的是
A.硝酸钾的溶解度大于氯化钠
B.20℃时,30g硝酸钾溶解在100g水中可配成饱和溶液
C.随着温度的升高,氯化钠的溶解度保持不变
D.对两者混合饱和溶液进行降温,只有硝酸钾析出
13.甲、乙两种固体的溶解度曲线如图所示,有关分析正确的是( )
A.a对应的甲、乙两种溶液,溶质的质量相等
B.t3℃时,甲、乙两种饱和溶液中,溶质的质量:甲>乙
C.t2℃时,c点所对应两种溶液的溶质质量分数:甲>乙
D.将t3℃时,将甲的不饱和溶液、降温到t1℃后,一定能变为饱和溶液
14.分析如图溶解度曲线,下列说法不正确的是
A.t1℃时,甲和乙的溶解度相等
B.t2℃时,在100g水里加入100g甲固体,得到200g甲溶液
C.t2℃时,等质量的两种物质的饱和溶液同时降温至t1℃,盛有甲溶液的烧杯中析出较多晶体
D.将t1℃时两种物质的饱和溶液升温至t2℃,溶质质量分数:甲>乙
15.如图为a、b、c三种不含结晶水的固体物质的溶解度曲线,下列叙述中正确的是
A.t1℃时,a、b、c饱和溶液的溶质质量分数约为21%
B.P点表示t2℃时,a、b的溶液是饱和状态,c的溶液是不饱和状态
C.t2℃时,a、b、c三种物质溶液的溶质质量分数a>b>c
D.100ga溶液从t2℃降温到t1℃时,析出晶体14g
二、填空题
16.请回答下列有关溶液的问题。
(1)把面粉与酒精分别加入蒸馏水中,能形成悬浊液的是___________。
(2)如图是a、b两种固体物质的溶解度曲线。
①当温度高于20℃,溶解度:a___________b(填“>”“<”或“=”)。
②20℃,相同质量的a、b饱和溶液中,a的饱和溶液中所含水的质量______(填“>”“<”或“=”)b的饱和溶液中所含水的质量。
③t℃时,将等质量的a、b两种饱和溶液分别升温到30℃,还能继续溶解溶质的质量:a____b(填“>”“<”或“=”)。
17.“二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。”这是中国应对全球气候问题作出的庄严承诺。请回答下列问题:
(1)控制CO2的排放,目的是为减缓______。加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度______。
(2)利用天然气代替含硫煤做家庭燃料的优点是可以减少______的排放。
18.按要求回答:
(1)下列是与水有关的几个描述,请根据所学知识回答:
①水是由大量______直接构成的;
②自来水厂净化水的过程中有静置、沉淀、过滤、吸附,这些变化属于______变化;
③水电解过程与电源正极连接的一端产生______。
(2)t1℃时,将等质量的硝酸钾和氯化钾分配加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
①烧杯②中的上层清液是否达到饱和状态?______(填“是”“否”或“无法判断”);
②烧杯①中溶解的溶质是______(写名称或化学式);
③关于图1中烧杯内的物质,下列说法正确的是______。
A.烧杯①内溶液中溶质的质量分数>烧杯②内上层清液中溶质的质量分数
B.蒸发一定量的水,两烧杯中都一定有固体析出
C.将两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余固体
D.将温度升高到t2℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
19.酸、碱、盐是重要的化合物,研究它们的性质有重要意义。NaCl、KNO3、NH4CI三种固体在水中的溶解度曲线如图所示。请仔细观察如图曲线,回答下列问题:
①三种固体物质的溶解度受温度影响最小的是______。
②40°C时三种固体物质饱和水溶液中溶质的质量分数由大到小的顺序是______。
③图中A、B点的坐标为A (10, 21),B(40, 64) 。若将40°C时164g的硝酸钾饱和水溶液降温到10°C,析出KNO3固体的质量为_____g。
20.KNO3和KCl在不同温度时的溶解度如下表所示:
温度/℃ 0 10 20 30 40 50 60 70
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3
回答下列问题:
(1)30℃时,KC1的溶解度为_______g。
(2)依据表中数据,绘制KNO3和KC1的溶解度曲线,如图中能表示KNO3溶解度曲线的是_______(选填“a”或“b”)。
(3)40℃时,现有质量均为100g的硝酸钾和氯化钾两种饱和溶液,若将它们同时降温至10℃。下列说法不正确的是_______。
A.40℃时,硝酸钾饱和溶液水的质量大于氯化钾饱溶液中水的质量
B.降温至10℃时,析出的KNO3晶体质量比析的KC1晶体质量大
C.降温至10℃时,硝酸钾饱和溶液的质量分数大于氯化钾饱和溶液的质量分数
D.当温度降至20℃和30℃之间的某一温度,两种溶液的质量分数可能相等
三、实验题
21.小明在家做蔗糖溶于水的实验时,观察到如图所示的现象。请填空:
(1)能说明糖水是溶液的现象是 __________ ;
(2)溶解后,液面低于原水平线的微观解释是 ________ ;
(3)再加入足量蔗糖,充分搅拌后,发现仍有蔗糖固体留在杯底,其原因是 ______ 。
参考答案:
1.A2.A3.A4.A5.A6.D7.C8.D9.B10.D11.D12.B13.C14.D15.A
16. 面粉 > < >
17.(1) 温室效应 增大
(2)二氧化硫/SO2
18.(1) 水分子 物理 氧气/O2
(2) 是 氯化钾/KCl AD
19. NaCl(或氯化钠) KNO3>NH4Cl>NaCl 43
20.(1)37.0
(2)a
(3)AC
21.(1)杯中的糖块消失了
(2)分子之间存在间隔
(3)蔗糖溶液达到饱和后就不能再溶解蔗糖
