2023年高三化学二轮专题复习 工艺流程为主流的无机综合题 课件(共101张PPT)
文档属性
| 名称 | 2023年高三化学二轮专题复习 工艺流程为主流的无机综合题 课件(共101张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 09:52:49 | ||
图片预览






文档简介
(共101张PPT)
工艺流程为主流的无机综合题
题型特训1 以工业废料及矿物为原料制备物质类工艺流程题
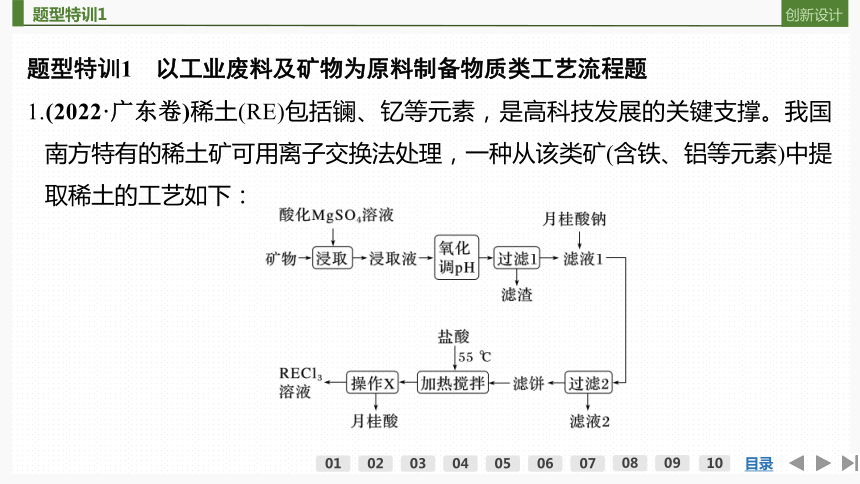
1.(2022·广东卷)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
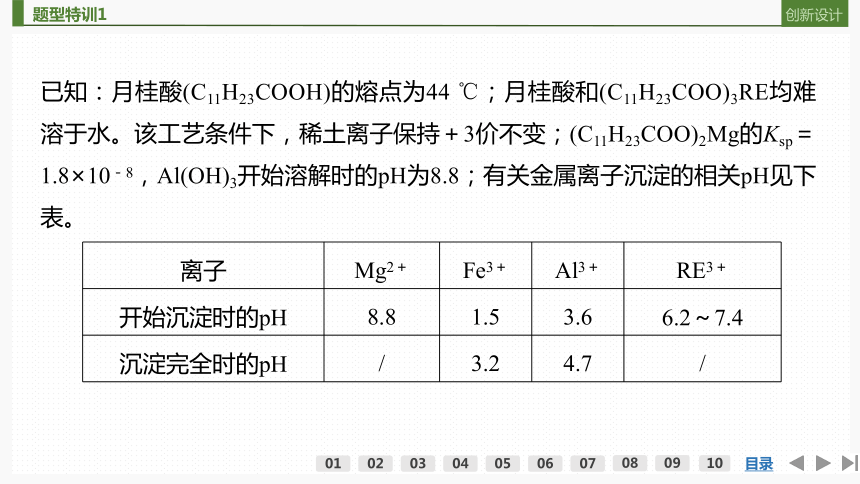
已知:月桂酸(C11H23COOH)的熔点为44 ℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化调pH”中,化合价有变化的金属离子是__________。
(2)“过滤1”前,用NaOH溶液调pH至______________的范围内,该过程中Al3+发生反应的离子方程式为________________________________________。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7 g·L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于__________ mol·L-1(保留两位有效数字)。
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是_________________________________________________________________。
②“操作X”的过程为先____________,再固液分离。
Fe2+
4.7≤pH<6.2
Al3++3OH-===Al(OH)3↓
4.0×10-4
加热搅拌可加快反应速率
冷却结晶
(5)该工艺中,可再生循环利用的物质有__________(写化学式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。
①还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 mol Pt3Y转移__________ mol电子。
②Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为_______________________________________________。
MgSO4
15
O2+4e-+2H2O===4OH-
2.(2022·河南重点高中调研)工业上常通过石煤灰渣(主要成分有SiO2、C、Al2O3、FeO、V2O3、CaO、MgO、K2O)回收钒的氧化物,有关工艺流程如图:
已知:①“焙烧”时,在空气的作用下,V2O3被氧化为V2O5。
②V2O5在稀硫酸作用下生成(VO2)2SO4。
根据所学知识,回答下列问题:
(1)在“焙烧”之前,要先将硫酸铵固体和石煤灰进行混磨处理,其目的是_________________________________________________________________。
(2)(VO2)2SO4中V的化合价为________,“浸渣”的主要成分除了SiO2,还有________(填化学式)。
(3)“氧化”时加入的试剂a常用H2O2,写出反应的离子方程式:_________________________________________________________________。
HNO3也能氧化Fe2+,工业生产中不选用HNO3的原因是_________________________________________________________________。
增大反应物的接触面积,提高原料利用率
+5价
CaSO4
H2O2+2Fe2++2H+===2Fe3++2H2O
硝酸的还原产物NO或NO2有毒,会污染大气
(4)在500 ℃灼烧脱氨可制得产品V2O5,写出该反应的化学方程式:
_________________________________________________________________。
在硫酸酸化条件下,V2O5可与草酸(H2C2O4)溶液反应得到含VO2+的溶液,
写出发生反应的离子方程式:
_____________________________________________________。
(5)5 t某批次的石煤灰渣中V2O3的含量为37.5%,工业生产中钒的浸出率为86%,若后续步骤中钒损耗为2%,则理论上制得的V2O5的质量最多为________ t(保留3位有效数字)。
4H++V2O5+H2C2O4===2VO2++3H2O+2CO2↑
1.92 t
3.(2022·云南联考)镍及其化合物在工业上有广泛应用,红土镍矿是镍资源的主要来源。以某地红土镍矿[主要成分Mg3Si2O5(OH)4、Fe2MgO4、NiO、FeO、Fe2O3]为原料,采用硫酸铵焙烧法选择性提取镍,可减少其他金属杂质浸出,工艺流程如图所示。
增大反应物的接触面积,加快反应速率,使反应物充分反应
(2)经分析矿样中大部分铁仍以氧化物形式存在于“浸渣”中,只有部分FeO在空气中焙烧时与(NH4)2SO4反应生成Fe2(SO4)3,该反应的化学方程式为
________________________________________________________________,
“浸渣”的主要成分除铁的氧化物外还有____________________(填化学式)。
(3)焙烧温度对浸出率的影响如图所示,
最佳焙烧温度是________(填序号)左右。
A.300 ℃ B.350 ℃
C.400 ℃ D.600 ℃
Fe(OH)3、SiO2
C
(4)若残留在浸出液中的铁完全转化为黄铵铁矾除去,“除铁”时通入NH3调节溶液pH的范围是____________________。该工艺条件下,Ni2+生成Ni(OH)2沉淀,Fe3+生成Fe(OH)3或黄铵铁矾沉淀,开始沉淀和沉淀完全时的pH如下表:
沉淀物 Ni(OH)2 Fe(OH)3 黄铵铁矾
开始沉淀时的pH 7.1 2.7 1.3
沉淀完全(c=1×10-5 mol/L)时的pH 9.2 3.7 2.3
2.3≤pH<7.1
(5)“沉镍”时pH调为8.0,滤液中Ni2+浓度约为__________________ mol/L
(100.4≈2.5)。
(6)流程中_____________(填化学式)可循环使用,减少污染。
(7)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式是_____________________________________________。
2.5×10-3
NH3
2Ni2++ClO-+4OH-===2NiOOH↓+Cl-+H2O
4.(2022·安徽十八校联盟模拟)硼酸(H3BO3)能溶于水,可用于玻璃、医药、纺织等工业;碳酸镁可用于制造防火涂料、牙膏等。某工厂以硼镁铁矿(主要成分为Mg2B2O5·H2O,杂质有SiO2、FeO、Fe2O3、Al2O3)为原料制备硼酸、碳酸镁的工艺流程如下图所示:
常温时实验条件下几种金属离子形成沉淀的pH
Fe3+ Fe2+ Al3+ Mg2+
开始沉淀 2.7 7.6 4.0 9.6
完全沉淀 3.2 9.6 5.2 11.1
(1)预处理的内容包括矿石的筛选、________,写出料渣1的一种用途_________________________________________________________________。
(2)X是常用的绿色氧化剂,如O2、__________________________________,
写出酸浸时Mg2B2O5·H2O与硫酸反应的化学方程式
_________________________________________________________________。
粉碎
用于生产光纤、制备单晶硅的原料
H2O2
Mg2B2O5·H2O+2H2SO4===2MgSO4+2H3BO3
(3)为提高产品纯度,试剂Y为____________________________(填化学式),写出加入NaHCO3溶液时的离子方程式
_____________________________________________________。
(4)为测量所得硼酸纯度,取3.00 g所制取的硼酸样品溶于甘露醇与蒸馏水混合溶液中,配成500 mL溶液,然后取出25.00 mL放入锥形瓶中并滴加3滴酚酞试液,用0.100 0 mol·L-1 NaOH标准溶液滴定,滴定终点时消耗22.00 mL标准溶液。则滴定终点时的现象是____________________________________
________________________________________________________________ ,
样品中硼酸的纯度为________(滴定反应为H3BO3+OH-===[B(OH)4]-
MgO或Mg(OH)2或MgCO3
滴加最后一滴(或半滴)标准溶液时,
溶液由无色变成浅红色且在30 s内保持不变
90.9%
5.(2022·河南百校大联考)三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3}是合成其他含钴配合物的重要原料。工业上以水钴矿(主要成分为Co2O3,还含有少量的Fe2O3、Al2O3、MgO、CaO、SiO2)为原料制备三氯化六氨合钴晶体。
已知:①Co2O3具有很强的氧化性,其产物为Co(Ⅱ);碱性条件下,Co(Ⅱ)能被O2氧化;[Co(NH3)6]Cl3易溶于热水,难溶于冷水;
②25 ℃时相关物质的Ksp如表:
物质 Co(OH)2 Fe(OH)2 Fe(OH)3 Al(OH)3
Ksp 1×10-13.8 1×10-16.3 1×10-38.6 1×10-32.3
物质 Mg(OH)2 Ca(OH)2 MgF2 CaF2
Ksp 1×10-11.2 1×10-7.8 1×10-10 5×10-11
请回答下列问题:
(1)“浸取”时,能提高浸取速率的措施是
___________________________________________________ (写出一条即可),
Co2O3发生反应的离子方程式为
__________________________________________________________________。
(2)滤渣Ⅱ的成分是Al(OH)3和Fe(OH)3,“氧化”时,NaClO3溶液的作用是
_________________________________________________________________。
(3)“除杂”时,CoF2可将Ca2+、Mg2+转化为沉淀过滤除去,若所得滤液中Mg2+刚好沉淀完全,则此时滤液中c(Ca2+)=________ mol·L-1(通常认为溶液中离子浓度≤10-5 mol·L-1时沉淀完全)。
将水钴矿粉碎、搅拌、适当增大稀硫酸浓度或加热等
将Fe2+氧化为Fe3+
5×10-6
(4)“转化”时,Co2+转化为[Co(NH3)6]3+,需水浴控温在50~60 ℃,温度不能过高的原因是_____________________________________________________,
其反应的离子方程式为
__________________________________________________________________,
“系列操作”为
____________________________________________________________________、
洗涤、干燥。
氨水受热易分解
在HCl氛围下蒸发浓缩、冷却结晶、减压过滤得到[Co(NH3)6]Cl3晶体
溶液由蓝色变为无色,且半分钟内不复原
6.(2022·成都名校联盟联考)黄钠铁矾渣的主要成分如下表所示,利用其制备镍锌铁氧体(Ni0.5Zn0.5Fe2O4)的工艺流程如下图所示:
元素 Fe(Ⅲ) Ni Mg Al
百分含量/% 28.750 2.625 0.031 0.452
元素 Pb SiO2 Ba Ca
百分含量/% 0.086 0.369 8.785 0.198
已知:i.浸取液中的阳离子有Fe2+、Ni2+、Mg2+、Al3+、Ca2+;
ii.晶体完整度与晶体中Ni、Zn、Fe的比例有关;
iii.Zn(OH)2是两性氢氧化物。
(1)无烟煤的主要作用是_____________________________________________,
控制其他条件不变,Fe和Ni的浸出率与浸出温度和浸出时间的关系如下图所示,则浸出过程中最适宜的条件是______________________________________。
为黄钠铁矾渣高温分解提供高温条件
温度77 ℃,时间40 min
(2)浸渣的主要成分除SiO2外还有_____________________________________。
(3)净化Ⅰ的目的是
__________________________________________________________________。
(4)为按计量制得镍锌铁氧体,加入试剂X是为了引入____________________
(填离子符号)。
(5)在Fe2+、Ni2+、Zn2+共沉淀过程中,若以Me代表Fe、Ni、Zn元素,则生成MeCO3·2Me(OH)2·H2O沉淀的离子方程式为
_________________________________________________________________。
BaSO4、PbSO4、CaSO4
使Fe3+变为Fe2+,同时调整溶液pH,使Al3+形成Al(OH)3沉淀除去
Zn2+、Ni2+
(6)检验沉淀已洗涤干净的操作和现象是
_________________________________________________________________
_________________________________________________________________ 。
(7)经测定,加入NH4HCO3调节pH=7.2时晶体完整度最高,pH不宜过高的原因是_________________________________________________________________
___________________________________________________________________
___________________________________________________________________
__________________________________________________________________ 。
取最后一次洗涤液少许放入试管中,向其中加入HNO3酸化,然后加入Ba(NO3)2溶液,若不变浑浊,则证明沉淀已经洗涤干净
7.(2022·黄山一模)铍是航天、航空、电子和核工业等领域不可替代的材料,有“超级金属”之称。以绿柱石[Be3Al2(SiO3)6]为原料制备金属铍的工艺如下:
增大固体的表面积,提高水浸的浸取率
(4)已知Ksp[Be(OH)2]=4.0×10-21,室温时0.40 mol·L-1 Be2+沉淀完全时的pH最小为________。
(5)“高温转化”反应产生的气体不能使澄清石灰水变浑浊,写出其化学方程式
_________________________________________________________________。
(6)“电解”NaCl-BeCl2熔融混合物制备金属铍,加入NaCl的主要目的是
_________________________________________________________________。
(7)绿色化学要求在工业生产中应有效利用原料,节约原料。本工艺过程可以循环利用的物质有__________________。
6.3
增强导电性
Na3FeF6、Cl2
8.(2022·湖北卓越千校联盟押题卷)纳米氧化锌作为一种新型功能材料,在橡胶、涂料、陶瓷、防晒化妆品等领域广泛应用。以某烟道灰(主要成分为ZnO,另外含有少量Fe2O3、CuO、SiO2、MnO等)为原料制备纳米ZnO的流程如图所示。已知常温时Ksp(CuS)=6×10-36,Ksp(ZnS)=3×10-25。回答下列问题:
CuS和ZnS
ZnO、ZnCO3等任意一种含锌的难溶于水能溶于酸的化合物
ZnO+2H+===Zn2++H2O
Mn2++ClO-+2H2O===MnO(OH)2↓+Cl-+2H+
5×1010
(5)草酸锌晶体(ZnC2O4·2H2O)加热过程中固体
质量随温度的变化情况如图所示
①图中A转化为B的过程中发生反应的化学方
程式为
_______________________________________。
②实验室中证明得到的ZnO是纳米材料的方法是
_________________________________________________________________
________________________________________________________________。
将适量的ZnO放入烧杯中,加入适量水并充分搅拌,然后用手电筒照向该烧杯,若观察到有一条光亮的通路,则证明得到的ZnO是纳米材料
9.(2022·贵阳五校联考)从砷盐净化渣(成分为Cu、As、Zn、ZnO、Co和SiO2)中回收有利用价值的金属,解决了长期以来影响砷盐净化工艺推广的技术难题,具有较强的实践指导意义。其工艺流程如图:
回答下列问题:
(1)在“选择浸Zn”时为提高效率可以采取的措施是
_________________________________________________________________
(任写一条)。其他条件不变时,Zn和Co的浸出率随pH变化如图所示,则“选择浸Zn”过程中,最好控制溶液的pH=________。
适当提高稀硫酸浓度、研磨砷盐净化渣等
3
(2)“氧化浸出”时,As转化为H3AsO4,则该反应中氧化剂和还原剂的物质的量之比为___________。“浸渣”的主要成分为________(填化学式)。
(3)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为
_________________________________________________________________。
(4)“碱浸”时,除回收得到Cu(OH)2外,还得到物质M,且M在该工艺流程中可循环利用,M的化学式为__________。
5∶2
SiO2
Na3AsO4
(5)“沉钴”中的离子方程式为_____________________________________。
所得草酸钴晶体洗涤后可得到纯净的晶体,证明晶体已经洗涤干净的操作是_________________________________________________________________
________________________________________________________________。
(6)在空气中煅烧草酸钴会生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2的体积为1.344 L(标准状况),则该钴氧化物的化学式为________。
取最后一次洗涤液少许于试管中,加入盐酸酸化后无明显现象,再加入少量氯化钡溶液,若无白色沉淀,则证明洗涤干净
Co3O4
10.(2022·安徽九师联盟质检)利用橄榄石尾矿[含MgSiO3、FeSiO3及少量Al2O3等]制备高纯Mg(OH)2及六硅酸镁的工艺流程如下:
已知常温下:①Ksp[Fe(OH)3]=4×10-38;Ksp[Al(OH)3]=1×10-32;
Ksp[Mg(OH)2]=1.0×10-11;
②Mg2+开始沉淀的pH为9.5;
③当溶液中离子浓度≤1×10-5 mol·L-1时,视为沉淀完全。
回答下列问题:
(1)“酸浸”时,为使金属元素充分浸出,除采用95~110 ℃温度外,还需采取的措施是________________________________________________________
(列举2条)。
(2)“氧化”时发生反应的离子方程式为
________________________________________________________________。
适当增大液固比、将矿物粉碎、适当延长浸取时间、充分搅拌等
2Fe2++H2O2+2H+===2Fe3++2H2O
(3)“调pH”时,理论上调节溶液的pH范围为___________________________;若溶液的pH调节至3,Fe3+是否沉淀完全?写出推断过程:
___________________________________________________________________
___________________________________________________________________。
(4)写出由滤渣1获得纯净的铁红(Fe2O3)的操作:
_________________________________________________________________。
5~9.5或5≤pH<9.5
用NaOH溶液溶解、过滤、水洗,滤渣干燥后高温煅烧
(5)六硅酸镁的化学式为MgO·3SiO2写出“合成”时生成六硅酸镁的化学方程式:
____________________________________________________________________
__________________________________________________________________。
MgCl2+3Na2SiO3+4NH4Cl===MgO·3SiO2↓+6NaCl+4NH3+2H2O(或2H2O+MgCl2+3Na2SiO3+4NH4Cl===MgO·3SiO2↓+6NaCl+4NH3·H2O)
解析 (5)“合成”时生成六硅酸镁的化学方程式:MgCl2+3Na2SiO3+4NH4Cl===MgO·3SiO2↓+6NaCl+4NH3+2H2O。
题型特训2 工艺流程与实验结合类无机综合题
1.(2022·浙江1月选考)某兴趣小组用四水醋酸锰[(CH3COO)2Mn·4H2O]和乙酰氯(CH3COCl)为原料制备无水二氯化锰,按如下流程开展了实验(夹持仪器已省略):
(1)步骤Ⅰ:所获固体主要成分是________________(用化学式表示)。
(2)步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,目的分别是
_________________________________________________________________
_________________________________________________________________。
(3)步骤Ⅲ:下列操作中正确的是________。
A.用蒸馏水润湿滤纸,微开水龙头,抽气 使滤纸紧贴在漏斗瓷板上
B.用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
C.用乙醇作为洗涤剂,在洗涤沉淀时,关小龙头,使洗涤剂缓慢通过沉淀物
D.洗涤结束后,将固体迅速转移至圆底烧瓶进行后续操作
(CH3COO)2Mn
步骤Ⅰ脱去四水醋酸锰的结晶水并防止生成MnCl2;步骤Ⅱ加热回流促进反应生成MnCl2
BD
(4)步骤Ⅳ:①将装有粗产品的圆底烧瓶接到纯化装置(图2)上,打开安全瓶上旋塞,打开抽气泵,关闭安全瓶上旋塞,开启加热器,进行纯化。请给出纯化完成后的操作排序:纯化完成→(________)→(________)→(________) →(________)→将产品转至干燥器中保存
a.拔出圆底烧瓶的瓶塞 b.关闭抽气泵
c.关闭加热器,待烧瓶冷却至室温 d.打开安全瓶上旋塞
②图2装置中U形管内NaOH固体的作用是
________________________________________________________________。
c
d
b
a
防止可能产生的酸性气体进入抽气泵;防止外部水蒸气进入样品
(5)用滴定分析法确定产品纯度。甲同学通过测定产品中锰元素的含量确定纯度;乙同学通过测定产品中氯元素的含量确定纯度。合理的是________(填“甲”或“乙”)同学的方法。
解析 (5)因为产品MnCl2中可能含有(CH3COO)2Mn,故测量产品中氯的含量才是确定纯度的合理方法。
乙
2.(2022·湛江联考)Ca(H2PO2)2(次磷酸钙,一元中强酸H3PO2的钙盐)是一种白色结晶粉末,能溶于水(常温时,溶解度为16.7 g/100 g水),可用作抗氧化剂以及制备次磷酸钠等。以白磷为原料制备Ca(H2PO2)2的工艺流程如下:
回答下列问题:
(1)“步骤1”的制备在如图所示装置中进行。
①仪器W的名称是________________;合适的加热方法是________________。
②实验开始前及整个过程中通入N2的主要目的是
_________________________________________________________________。
③制备Ca(H2PO2)2的化学方程式为
_________________________________________________________________。
④已知PH3是一种有剧毒的气体,具有强还原性,微溶于水,水溶液显弱碱性。处理含PH3的尾气(已知含PH的盐也有毒性),下列试剂合适的是________(填标号)。
A.澄清石灰水 B.稀盐酸 C.稀硫酸 D.NaClO溶液
三口(颈)烧瓶
油浴
排除装置内空气,防止白磷燃烧及Ca(H2PO2)2被氧化,并吹出PH3
D
(2)“步骤2”是过滤,用到的玻璃仪器有烧杯、漏斗和___________。
(3)“步骤3”通入适量CO2的目的是__________________________________。
(4)由“步骤3”得到产品还需调pH,调pH需要的试剂为________(填化学式)。
(5)由产品Ca(H2PO2)2制备NaH2PO2·H2O的实验方案:取一定量的Ca(H2PO2)2溶于水,加入Na2CO3溶液,静置,
________________________________________________________________,
将滤液减压蒸发浓缩、结晶,得到NaH2PO2·H2O。
玻璃棒
除去滤液中的Ca(OH)2
H3PO2
向上层清液中滴入Na2CO3溶液,若无沉淀,过滤
3.(2022·韶关武江中学月考)利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:
(1)“水解”时,产生的气体A能使湿润的红色石蕊试纸变蓝,铝灰在90 ℃水解生成A的化学方程式为___________________________________________;
为了加快该步骤的速率,可采取的方法有______________________________
(写出一种方法即可)。
适当升高温度、搅拌
(2)“酸溶”时溶液中的阳离子除了Al3+之外,还有_________________。
(3)“氧化”时,发生反应的离子方程式为
________________________________________________________________。
(4)“除杂”时,调节pH值使Fe3+沉淀而Al3+不沉淀,则pH的范围是________________;若pH值高于8.5则Al元素重新溶入溶液中,写出该反应的离子方程式_____________________________________________________。
已知几种金属离子沉淀的pH值如下表:
Fe2+ Fe3+ Al3+
开始沉淀的pH 7.5 3.2 5.5
完全沉淀的pH 9.7 3.7 8
H+、Fe2+
2Fe2++2H++ClO-===2Fe3++Cl-+H2O
3.7≤pH<5.5
防止Al(OH)2Cl水解生成Al(OH)3
N2
4.(2022·常州八校调研)某废催化剂主要成分为活性炭和(CH3COO)2Zn,以该废催化剂为原料回收活性炭并制备超细ZnO的实验流程如图:
(1)浸出时ZnO转化为[Zn(NH3)4]2+,参加反应的n(NH3·H2O)∶n(NH4HCO3)=3∶1,该反应的离子方程式为
_________________________________________________________________。
(2)蒸氨时控制温度为95 ℃左右,在装置b中[Zn(NH3)4]2+转化为碱式碳酸锌沉淀。实验室模拟蒸氨装置如图所示。
①用水蒸气对装置b加热时,连接装置a、b的导管应插入装置b的位置为________。(填字母序号)
A.液面上方但不接触液面
B.略伸入液面下
C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是____________________________________
____________________________________________________(写出一种)。
C
增加水蒸气的流速(或增加单位时间
通入的水蒸气用量,或在水蒸气出口采用多孔球泡等)
(3)46 ℃、pH约为6.8时,ZnSO4溶液与Na2CO3溶液反应可得碱式碳酸锌。实验室以含少量CuO的ZnO结块废催化剂为原料制备碱式碳酸锌,设计实验方案:______________________________________________________________
_________________________________________________________________
_________________________________________________________________
________________________________________________________________,
过滤,洗涤,干燥。(须使用的试剂:稀H2SO4、锌粉、Na2CO3溶液)
将废催化剂粉碎后,向其中加入略过量的稀硫酸,搅拌下充分
反应,再向其中加入足量锌粉,搅拌下充分反应,至溶液由蓝色转变为无色;过滤,控制温度为46 ℃,向滤液中逐渐加入Na2CO3溶液至pH约为6.8,充分反应至产生大量固体
1 016
5.(2022·新乡一模) NaBiO3(铋酸钠)是分析化学中的常用试剂,不溶于水。工业上以辉铋矿(主要成分是Bi2S3,含少量SiO2、Cu2S、FeS2)为原料制备铋酸钠的流程如下:
回答下列问题:
(1)用硝酸替代“盐酸、NaClO3”也可以实现“酸浸”,从环保角度考虑,存在的缺点是_______________________________________________________。
(2)“浸渣”的主要成分是____________(填化学式)。
(3)为检验“酸浸”液中是否含Fe2+,下列可选择的试剂是________(填标号)。
A.KSCN溶液 B.酸性KMnO4溶液
C.K3[Fe(CN)6]溶液 D.KSCN溶液和双氧水
(4)“除铁”的离子方程式为__________________________________________。
生成氮氧化物,污染环境
SiO2
C
2Fe3++3H2O+3CuO===2Fe(OH)3+3Cu2+
4.0×10-7
(6)探究NaBiO3的性质:
实验 操作 现象
Ⅰ 取少量NaBiO3固体于试管中,加入浓盐酸,振荡;用镊子夹一片湿润的淀粉-KI试纸放置在试管口上方 固体溶解,产生黄绿色气体,试纸变蓝
Ⅱ 在稀硫酸酸化的MnSO4溶液中加入NaBiO3粉末,振荡 无色溶液变紫红色
NaBiO3
溶液的酸碱性不同
工艺流程为主流的无机综合题
题型特训1 以工业废料及矿物为原料制备物质类工艺流程题
1.(2022·广东卷)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸(C11H23COOH)的熔点为44 ℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化调pH”中,化合价有变化的金属离子是__________。
(2)“过滤1”前,用NaOH溶液调pH至______________的范围内,该过程中Al3+发生反应的离子方程式为________________________________________。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7 g·L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于__________ mol·L-1(保留两位有效数字)。
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是_________________________________________________________________。
②“操作X”的过程为先____________,再固液分离。
Fe2+
4.7≤pH<6.2
Al3++3OH-===Al(OH)3↓
4.0×10-4
加热搅拌可加快反应速率
冷却结晶
(5)该工艺中,可再生循环利用的物质有__________(写化学式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。
①还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 mol Pt3Y转移__________ mol电子。
②Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为_______________________________________________。
MgSO4
15
O2+4e-+2H2O===4OH-
2.(2022·河南重点高中调研)工业上常通过石煤灰渣(主要成分有SiO2、C、Al2O3、FeO、V2O3、CaO、MgO、K2O)回收钒的氧化物,有关工艺流程如图:
已知:①“焙烧”时,在空气的作用下,V2O3被氧化为V2O5。
②V2O5在稀硫酸作用下生成(VO2)2SO4。
根据所学知识,回答下列问题:
(1)在“焙烧”之前,要先将硫酸铵固体和石煤灰进行混磨处理,其目的是_________________________________________________________________。
(2)(VO2)2SO4中V的化合价为________,“浸渣”的主要成分除了SiO2,还有________(填化学式)。
(3)“氧化”时加入的试剂a常用H2O2,写出反应的离子方程式:_________________________________________________________________。
HNO3也能氧化Fe2+,工业生产中不选用HNO3的原因是_________________________________________________________________。
增大反应物的接触面积,提高原料利用率
+5价
CaSO4
H2O2+2Fe2++2H+===2Fe3++2H2O
硝酸的还原产物NO或NO2有毒,会污染大气
(4)在500 ℃灼烧脱氨可制得产品V2O5,写出该反应的化学方程式:
_________________________________________________________________。
在硫酸酸化条件下,V2O5可与草酸(H2C2O4)溶液反应得到含VO2+的溶液,
写出发生反应的离子方程式:
_____________________________________________________。
(5)5 t某批次的石煤灰渣中V2O3的含量为37.5%,工业生产中钒的浸出率为86%,若后续步骤中钒损耗为2%,则理论上制得的V2O5的质量最多为________ t(保留3位有效数字)。
4H++V2O5+H2C2O4===2VO2++3H2O+2CO2↑
1.92 t
3.(2022·云南联考)镍及其化合物在工业上有广泛应用,红土镍矿是镍资源的主要来源。以某地红土镍矿[主要成分Mg3Si2O5(OH)4、Fe2MgO4、NiO、FeO、Fe2O3]为原料,采用硫酸铵焙烧法选择性提取镍,可减少其他金属杂质浸出,工艺流程如图所示。
增大反应物的接触面积,加快反应速率,使反应物充分反应
(2)经分析矿样中大部分铁仍以氧化物形式存在于“浸渣”中,只有部分FeO在空气中焙烧时与(NH4)2SO4反应生成Fe2(SO4)3,该反应的化学方程式为
________________________________________________________________,
“浸渣”的主要成分除铁的氧化物外还有____________________(填化学式)。
(3)焙烧温度对浸出率的影响如图所示,
最佳焙烧温度是________(填序号)左右。
A.300 ℃ B.350 ℃
C.400 ℃ D.600 ℃
Fe(OH)3、SiO2
C
(4)若残留在浸出液中的铁完全转化为黄铵铁矾除去,“除铁”时通入NH3调节溶液pH的范围是____________________。该工艺条件下,Ni2+生成Ni(OH)2沉淀,Fe3+生成Fe(OH)3或黄铵铁矾沉淀,开始沉淀和沉淀完全时的pH如下表:
沉淀物 Ni(OH)2 Fe(OH)3 黄铵铁矾
开始沉淀时的pH 7.1 2.7 1.3
沉淀完全(c=1×10-5 mol/L)时的pH 9.2 3.7 2.3
2.3≤pH<7.1
(5)“沉镍”时pH调为8.0,滤液中Ni2+浓度约为__________________ mol/L
(100.4≈2.5)。
(6)流程中_____________(填化学式)可循环使用,减少污染。
(7)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式是_____________________________________________。
2.5×10-3
NH3
2Ni2++ClO-+4OH-===2NiOOH↓+Cl-+H2O
4.(2022·安徽十八校联盟模拟)硼酸(H3BO3)能溶于水,可用于玻璃、医药、纺织等工业;碳酸镁可用于制造防火涂料、牙膏等。某工厂以硼镁铁矿(主要成分为Mg2B2O5·H2O,杂质有SiO2、FeO、Fe2O3、Al2O3)为原料制备硼酸、碳酸镁的工艺流程如下图所示:
常温时实验条件下几种金属离子形成沉淀的pH
Fe3+ Fe2+ Al3+ Mg2+
开始沉淀 2.7 7.6 4.0 9.6
完全沉淀 3.2 9.6 5.2 11.1
(1)预处理的内容包括矿石的筛选、________,写出料渣1的一种用途_________________________________________________________________。
(2)X是常用的绿色氧化剂,如O2、__________________________________,
写出酸浸时Mg2B2O5·H2O与硫酸反应的化学方程式
_________________________________________________________________。
粉碎
用于生产光纤、制备单晶硅的原料
H2O2
Mg2B2O5·H2O+2H2SO4===2MgSO4+2H3BO3
(3)为提高产品纯度,试剂Y为____________________________(填化学式),写出加入NaHCO3溶液时的离子方程式
_____________________________________________________。
(4)为测量所得硼酸纯度,取3.00 g所制取的硼酸样品溶于甘露醇与蒸馏水混合溶液中,配成500 mL溶液,然后取出25.00 mL放入锥形瓶中并滴加3滴酚酞试液,用0.100 0 mol·L-1 NaOH标准溶液滴定,滴定终点时消耗22.00 mL标准溶液。则滴定终点时的现象是____________________________________
________________________________________________________________ ,
样品中硼酸的纯度为________(滴定反应为H3BO3+OH-===[B(OH)4]-
MgO或Mg(OH)2或MgCO3
滴加最后一滴(或半滴)标准溶液时,
溶液由无色变成浅红色且在30 s内保持不变
90.9%
5.(2022·河南百校大联考)三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3}是合成其他含钴配合物的重要原料。工业上以水钴矿(主要成分为Co2O3,还含有少量的Fe2O3、Al2O3、MgO、CaO、SiO2)为原料制备三氯化六氨合钴晶体。
已知:①Co2O3具有很强的氧化性,其产物为Co(Ⅱ);碱性条件下,Co(Ⅱ)能被O2氧化;[Co(NH3)6]Cl3易溶于热水,难溶于冷水;
②25 ℃时相关物质的Ksp如表:
物质 Co(OH)2 Fe(OH)2 Fe(OH)3 Al(OH)3
Ksp 1×10-13.8 1×10-16.3 1×10-38.6 1×10-32.3
物质 Mg(OH)2 Ca(OH)2 MgF2 CaF2
Ksp 1×10-11.2 1×10-7.8 1×10-10 5×10-11
请回答下列问题:
(1)“浸取”时,能提高浸取速率的措施是
___________________________________________________ (写出一条即可),
Co2O3发生反应的离子方程式为
__________________________________________________________________。
(2)滤渣Ⅱ的成分是Al(OH)3和Fe(OH)3,“氧化”时,NaClO3溶液的作用是
_________________________________________________________________。
(3)“除杂”时,CoF2可将Ca2+、Mg2+转化为沉淀过滤除去,若所得滤液中Mg2+刚好沉淀完全,则此时滤液中c(Ca2+)=________ mol·L-1(通常认为溶液中离子浓度≤10-5 mol·L-1时沉淀完全)。
将水钴矿粉碎、搅拌、适当增大稀硫酸浓度或加热等
将Fe2+氧化为Fe3+
5×10-6
(4)“转化”时,Co2+转化为[Co(NH3)6]3+,需水浴控温在50~60 ℃,温度不能过高的原因是_____________________________________________________,
其反应的离子方程式为
__________________________________________________________________,
“系列操作”为
____________________________________________________________________、
洗涤、干燥。
氨水受热易分解
在HCl氛围下蒸发浓缩、冷却结晶、减压过滤得到[Co(NH3)6]Cl3晶体
溶液由蓝色变为无色,且半分钟内不复原
6.(2022·成都名校联盟联考)黄钠铁矾渣的主要成分如下表所示,利用其制备镍锌铁氧体(Ni0.5Zn0.5Fe2O4)的工艺流程如下图所示:
元素 Fe(Ⅲ) Ni Mg Al
百分含量/% 28.750 2.625 0.031 0.452
元素 Pb SiO2 Ba Ca
百分含量/% 0.086 0.369 8.785 0.198
已知:i.浸取液中的阳离子有Fe2+、Ni2+、Mg2+、Al3+、Ca2+;
ii.晶体完整度与晶体中Ni、Zn、Fe的比例有关;
iii.Zn(OH)2是两性氢氧化物。
(1)无烟煤的主要作用是_____________________________________________,
控制其他条件不变,Fe和Ni的浸出率与浸出温度和浸出时间的关系如下图所示,则浸出过程中最适宜的条件是______________________________________。
为黄钠铁矾渣高温分解提供高温条件
温度77 ℃,时间40 min
(2)浸渣的主要成分除SiO2外还有_____________________________________。
(3)净化Ⅰ的目的是
__________________________________________________________________。
(4)为按计量制得镍锌铁氧体,加入试剂X是为了引入____________________
(填离子符号)。
(5)在Fe2+、Ni2+、Zn2+共沉淀过程中,若以Me代表Fe、Ni、Zn元素,则生成MeCO3·2Me(OH)2·H2O沉淀的离子方程式为
_________________________________________________________________。
BaSO4、PbSO4、CaSO4
使Fe3+变为Fe2+,同时调整溶液pH,使Al3+形成Al(OH)3沉淀除去
Zn2+、Ni2+
(6)检验沉淀已洗涤干净的操作和现象是
_________________________________________________________________
_________________________________________________________________ 。
(7)经测定,加入NH4HCO3调节pH=7.2时晶体完整度最高,pH不宜过高的原因是_________________________________________________________________
___________________________________________________________________
___________________________________________________________________
__________________________________________________________________ 。
取最后一次洗涤液少许放入试管中,向其中加入HNO3酸化,然后加入Ba(NO3)2溶液,若不变浑浊,则证明沉淀已经洗涤干净
7.(2022·黄山一模)铍是航天、航空、电子和核工业等领域不可替代的材料,有“超级金属”之称。以绿柱石[Be3Al2(SiO3)6]为原料制备金属铍的工艺如下:
增大固体的表面积,提高水浸的浸取率
(4)已知Ksp[Be(OH)2]=4.0×10-21,室温时0.40 mol·L-1 Be2+沉淀完全时的pH最小为________。
(5)“高温转化”反应产生的气体不能使澄清石灰水变浑浊,写出其化学方程式
_________________________________________________________________。
(6)“电解”NaCl-BeCl2熔融混合物制备金属铍,加入NaCl的主要目的是
_________________________________________________________________。
(7)绿色化学要求在工业生产中应有效利用原料,节约原料。本工艺过程可以循环利用的物质有__________________。
6.3
增强导电性
Na3FeF6、Cl2
8.(2022·湖北卓越千校联盟押题卷)纳米氧化锌作为一种新型功能材料,在橡胶、涂料、陶瓷、防晒化妆品等领域广泛应用。以某烟道灰(主要成分为ZnO,另外含有少量Fe2O3、CuO、SiO2、MnO等)为原料制备纳米ZnO的流程如图所示。已知常温时Ksp(CuS)=6×10-36,Ksp(ZnS)=3×10-25。回答下列问题:
CuS和ZnS
ZnO、ZnCO3等任意一种含锌的难溶于水能溶于酸的化合物
ZnO+2H+===Zn2++H2O
Mn2++ClO-+2H2O===MnO(OH)2↓+Cl-+2H+
5×1010
(5)草酸锌晶体(ZnC2O4·2H2O)加热过程中固体
质量随温度的变化情况如图所示
①图中A转化为B的过程中发生反应的化学方
程式为
_______________________________________。
②实验室中证明得到的ZnO是纳米材料的方法是
_________________________________________________________________
________________________________________________________________。
将适量的ZnO放入烧杯中,加入适量水并充分搅拌,然后用手电筒照向该烧杯,若观察到有一条光亮的通路,则证明得到的ZnO是纳米材料
9.(2022·贵阳五校联考)从砷盐净化渣(成分为Cu、As、Zn、ZnO、Co和SiO2)中回收有利用价值的金属,解决了长期以来影响砷盐净化工艺推广的技术难题,具有较强的实践指导意义。其工艺流程如图:
回答下列问题:
(1)在“选择浸Zn”时为提高效率可以采取的措施是
_________________________________________________________________
(任写一条)。其他条件不变时,Zn和Co的浸出率随pH变化如图所示,则“选择浸Zn”过程中,最好控制溶液的pH=________。
适当提高稀硫酸浓度、研磨砷盐净化渣等
3
(2)“氧化浸出”时,As转化为H3AsO4,则该反应中氧化剂和还原剂的物质的量之比为___________。“浸渣”的主要成分为________(填化学式)。
(3)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为
_________________________________________________________________。
(4)“碱浸”时,除回收得到Cu(OH)2外,还得到物质M,且M在该工艺流程中可循环利用,M的化学式为__________。
5∶2
SiO2
Na3AsO4
(5)“沉钴”中的离子方程式为_____________________________________。
所得草酸钴晶体洗涤后可得到纯净的晶体,证明晶体已经洗涤干净的操作是_________________________________________________________________
________________________________________________________________。
(6)在空气中煅烧草酸钴会生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2的体积为1.344 L(标准状况),则该钴氧化物的化学式为________。
取最后一次洗涤液少许于试管中,加入盐酸酸化后无明显现象,再加入少量氯化钡溶液,若无白色沉淀,则证明洗涤干净
Co3O4
10.(2022·安徽九师联盟质检)利用橄榄石尾矿[含MgSiO3、FeSiO3及少量Al2O3等]制备高纯Mg(OH)2及六硅酸镁的工艺流程如下:
已知常温下:①Ksp[Fe(OH)3]=4×10-38;Ksp[Al(OH)3]=1×10-32;
Ksp[Mg(OH)2]=1.0×10-11;
②Mg2+开始沉淀的pH为9.5;
③当溶液中离子浓度≤1×10-5 mol·L-1时,视为沉淀完全。
回答下列问题:
(1)“酸浸”时,为使金属元素充分浸出,除采用95~110 ℃温度外,还需采取的措施是________________________________________________________
(列举2条)。
(2)“氧化”时发生反应的离子方程式为
________________________________________________________________。
适当增大液固比、将矿物粉碎、适当延长浸取时间、充分搅拌等
2Fe2++H2O2+2H+===2Fe3++2H2O
(3)“调pH”时,理论上调节溶液的pH范围为___________________________;若溶液的pH调节至3,Fe3+是否沉淀完全?写出推断过程:
___________________________________________________________________
___________________________________________________________________。
(4)写出由滤渣1获得纯净的铁红(Fe2O3)的操作:
_________________________________________________________________。
5~9.5或5≤pH<9.5
用NaOH溶液溶解、过滤、水洗,滤渣干燥后高温煅烧
(5)六硅酸镁的化学式为MgO·3SiO2写出“合成”时生成六硅酸镁的化学方程式:
____________________________________________________________________
__________________________________________________________________。
MgCl2+3Na2SiO3+4NH4Cl===MgO·3SiO2↓+6NaCl+4NH3+2H2O(或2H2O+MgCl2+3Na2SiO3+4NH4Cl===MgO·3SiO2↓+6NaCl+4NH3·H2O)
解析 (5)“合成”时生成六硅酸镁的化学方程式:MgCl2+3Na2SiO3+4NH4Cl===MgO·3SiO2↓+6NaCl+4NH3+2H2O。
题型特训2 工艺流程与实验结合类无机综合题
1.(2022·浙江1月选考)某兴趣小组用四水醋酸锰[(CH3COO)2Mn·4H2O]和乙酰氯(CH3COCl)为原料制备无水二氯化锰,按如下流程开展了实验(夹持仪器已省略):
(1)步骤Ⅰ:所获固体主要成分是________________(用化学式表示)。
(2)步骤Ⅰ在室温下反应,步骤Ⅱ在加热回流下反应,目的分别是
_________________________________________________________________
_________________________________________________________________。
(3)步骤Ⅲ:下列操作中正确的是________。
A.用蒸馏水润湿滤纸,微开水龙头,抽气 使滤纸紧贴在漏斗瓷板上
B.用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
C.用乙醇作为洗涤剂,在洗涤沉淀时,关小龙头,使洗涤剂缓慢通过沉淀物
D.洗涤结束后,将固体迅速转移至圆底烧瓶进行后续操作
(CH3COO)2Mn
步骤Ⅰ脱去四水醋酸锰的结晶水并防止生成MnCl2;步骤Ⅱ加热回流促进反应生成MnCl2
BD
(4)步骤Ⅳ:①将装有粗产品的圆底烧瓶接到纯化装置(图2)上,打开安全瓶上旋塞,打开抽气泵,关闭安全瓶上旋塞,开启加热器,进行纯化。请给出纯化完成后的操作排序:纯化完成→(________)→(________)→(________) →(________)→将产品转至干燥器中保存
a.拔出圆底烧瓶的瓶塞 b.关闭抽气泵
c.关闭加热器,待烧瓶冷却至室温 d.打开安全瓶上旋塞
②图2装置中U形管内NaOH固体的作用是
________________________________________________________________。
c
d
b
a
防止可能产生的酸性气体进入抽气泵;防止外部水蒸气进入样品
(5)用滴定分析法确定产品纯度。甲同学通过测定产品中锰元素的含量确定纯度;乙同学通过测定产品中氯元素的含量确定纯度。合理的是________(填“甲”或“乙”)同学的方法。
解析 (5)因为产品MnCl2中可能含有(CH3COO)2Mn,故测量产品中氯的含量才是确定纯度的合理方法。
乙
2.(2022·湛江联考)Ca(H2PO2)2(次磷酸钙,一元中强酸H3PO2的钙盐)是一种白色结晶粉末,能溶于水(常温时,溶解度为16.7 g/100 g水),可用作抗氧化剂以及制备次磷酸钠等。以白磷为原料制备Ca(H2PO2)2的工艺流程如下:
回答下列问题:
(1)“步骤1”的制备在如图所示装置中进行。
①仪器W的名称是________________;合适的加热方法是________________。
②实验开始前及整个过程中通入N2的主要目的是
_________________________________________________________________。
③制备Ca(H2PO2)2的化学方程式为
_________________________________________________________________。
④已知PH3是一种有剧毒的气体,具有强还原性,微溶于水,水溶液显弱碱性。处理含PH3的尾气(已知含PH的盐也有毒性),下列试剂合适的是________(填标号)。
A.澄清石灰水 B.稀盐酸 C.稀硫酸 D.NaClO溶液
三口(颈)烧瓶
油浴
排除装置内空气,防止白磷燃烧及Ca(H2PO2)2被氧化,并吹出PH3
D
(2)“步骤2”是过滤,用到的玻璃仪器有烧杯、漏斗和___________。
(3)“步骤3”通入适量CO2的目的是__________________________________。
(4)由“步骤3”得到产品还需调pH,调pH需要的试剂为________(填化学式)。
(5)由产品Ca(H2PO2)2制备NaH2PO2·H2O的实验方案:取一定量的Ca(H2PO2)2溶于水,加入Na2CO3溶液,静置,
________________________________________________________________,
将滤液减压蒸发浓缩、结晶,得到NaH2PO2·H2O。
玻璃棒
除去滤液中的Ca(OH)2
H3PO2
向上层清液中滴入Na2CO3溶液,若无沉淀,过滤
3.(2022·韶关武江中学月考)利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:
(1)“水解”时,产生的气体A能使湿润的红色石蕊试纸变蓝,铝灰在90 ℃水解生成A的化学方程式为___________________________________________;
为了加快该步骤的速率,可采取的方法有______________________________
(写出一种方法即可)。
适当升高温度、搅拌
(2)“酸溶”时溶液中的阳离子除了Al3+之外,还有_________________。
(3)“氧化”时,发生反应的离子方程式为
________________________________________________________________。
(4)“除杂”时,调节pH值使Fe3+沉淀而Al3+不沉淀,则pH的范围是________________;若pH值高于8.5则Al元素重新溶入溶液中,写出该反应的离子方程式_____________________________________________________。
已知几种金属离子沉淀的pH值如下表:
Fe2+ Fe3+ Al3+
开始沉淀的pH 7.5 3.2 5.5
完全沉淀的pH 9.7 3.7 8
H+、Fe2+
2Fe2++2H++ClO-===2Fe3++Cl-+H2O
3.7≤pH<5.5
防止Al(OH)2Cl水解生成Al(OH)3
N2
4.(2022·常州八校调研)某废催化剂主要成分为活性炭和(CH3COO)2Zn,以该废催化剂为原料回收活性炭并制备超细ZnO的实验流程如图:
(1)浸出时ZnO转化为[Zn(NH3)4]2+,参加反应的n(NH3·H2O)∶n(NH4HCO3)=3∶1,该反应的离子方程式为
_________________________________________________________________。
(2)蒸氨时控制温度为95 ℃左右,在装置b中[Zn(NH3)4]2+转化为碱式碳酸锌沉淀。实验室模拟蒸氨装置如图所示。
①用水蒸气对装置b加热时,连接装置a、b的导管应插入装置b的位置为________。(填字母序号)
A.液面上方但不接触液面
B.略伸入液面下
C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是____________________________________
____________________________________________________(写出一种)。
C
增加水蒸气的流速(或增加单位时间
通入的水蒸气用量,或在水蒸气出口采用多孔球泡等)
(3)46 ℃、pH约为6.8时,ZnSO4溶液与Na2CO3溶液反应可得碱式碳酸锌。实验室以含少量CuO的ZnO结块废催化剂为原料制备碱式碳酸锌,设计实验方案:______________________________________________________________
_________________________________________________________________
_________________________________________________________________
________________________________________________________________,
过滤,洗涤,干燥。(须使用的试剂:稀H2SO4、锌粉、Na2CO3溶液)
将废催化剂粉碎后,向其中加入略过量的稀硫酸,搅拌下充分
反应,再向其中加入足量锌粉,搅拌下充分反应,至溶液由蓝色转变为无色;过滤,控制温度为46 ℃,向滤液中逐渐加入Na2CO3溶液至pH约为6.8,充分反应至产生大量固体
1 016
5.(2022·新乡一模) NaBiO3(铋酸钠)是分析化学中的常用试剂,不溶于水。工业上以辉铋矿(主要成分是Bi2S3,含少量SiO2、Cu2S、FeS2)为原料制备铋酸钠的流程如下:
回答下列问题:
(1)用硝酸替代“盐酸、NaClO3”也可以实现“酸浸”,从环保角度考虑,存在的缺点是_______________________________________________________。
(2)“浸渣”的主要成分是____________(填化学式)。
(3)为检验“酸浸”液中是否含Fe2+,下列可选择的试剂是________(填标号)。
A.KSCN溶液 B.酸性KMnO4溶液
C.K3[Fe(CN)6]溶液 D.KSCN溶液和双氧水
(4)“除铁”的离子方程式为__________________________________________。
生成氮氧化物,污染环境
SiO2
C
2Fe3++3H2O+3CuO===2Fe(OH)3+3Cu2+
4.0×10-7
(6)探究NaBiO3的性质:
实验 操作 现象
Ⅰ 取少量NaBiO3固体于试管中,加入浓盐酸,振荡;用镊子夹一片湿润的淀粉-KI试纸放置在试管口上方 固体溶解,产生黄绿色气体,试纸变蓝
Ⅱ 在稀硫酸酸化的MnSO4溶液中加入NaBiO3粉末,振荡 无色溶液变紫红色
NaBiO3
溶液的酸碱性不同
同课章节目录
