3.1 物质的聚集状态与晶体常识(含解析)
文档属性
| 名称 | 3.1 物质的聚集状态与晶体常识(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 368.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 11:19:43 | ||
图片预览



文档简介
3.1 物质的聚集状态与晶体常识
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列不属于晶体的特点的是( )
A.一定有规则的几何外形
B.一定有各向异性
C.一定有固定的熔点
D.一定是无色透明的固体
2.某晶体的一部分如图所示,这种晶体中A、B、C三种微粒数之比是
A.3:9:4 B.1:4:2 C.2:9:4 D.3:8:5
3.下列说法不正确的是
A.碘单质升华过程中只需克服分子间作用力
B.BaCl2属于离子化合物,晶体中只存在离子键
C.在N2、CO2和SiO2中都存在共价键,它们都是由分子构成
D.金刚石和足球烯(C60)晶体类型不同
4.冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
下列有关冰晶胞说法正确的是
A.冰晶胞内水分子间以共价键结合
B.每个冰晶胞平均含有4个水分子
C.水分子间的氢键是共价键,具有方向性和饱和性
D.实验测得冰中氢键的作用力为18.5kJ/mol,而冰的熔化热为5.0kJ/mol,这说明冰熔化成水,氢键部分被破坏
5.已知在晶体中仍保持一定几何形状的最小单位称为晶胞。干冰晶胞是一个面心立方体,在该晶体中每个顶角各有1个二氧化碳分子,每个面心各有一个二氧化碳分子。实验测得25℃时干冰晶体的晶胞边长为acm,其摩尔质量为Mg/mol,则该干冰晶体的密度为(单位:g/cm3)( )
A. B. C. D.
6.关于下列实验的叙述,不正确的是
A.缺角的硫酸铜晶体在饱和溶液中可以变为规则的晶块
B.在隔绝空气的条件下,用酒精喷灯加热可以将石墨晶体熔化
C.透过灯光,红宝石在不同方向上的色泽可能有所不同
D.将一小块AgCl固体投入氨水中,振荡,固体可以溶解
7.下列有关说法正确的是
A.SO2溶于水所得溶液能导电,所以SO2是电解质
B.的空间构型为平面三角形
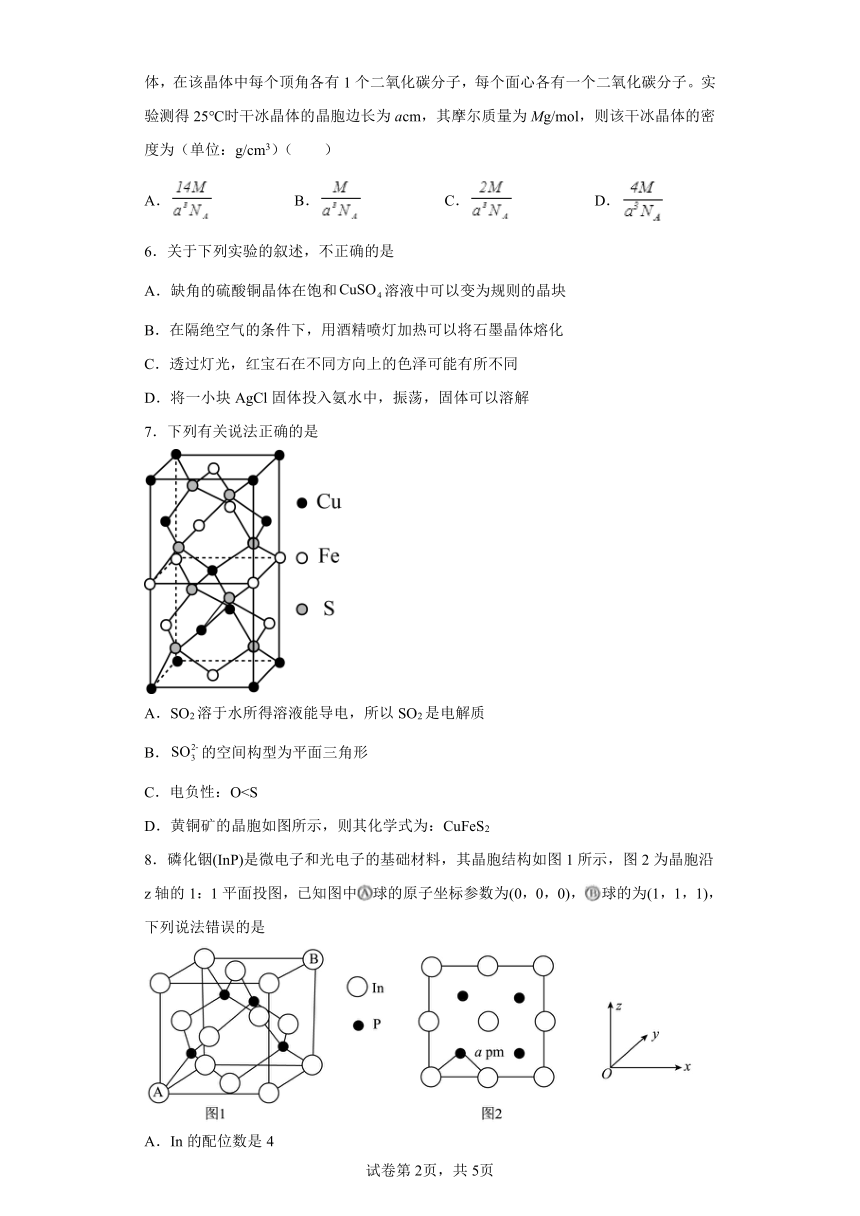
C.电负性:OD.黄铜矿的晶胞如图所示,则其化学式为:CuFeS2
8.磷化铟(InP)是微电子和光电子的基础材料,其晶胞结构如图1所示,图2为晶胞沿z轴的1:1平面投图,已知图中球的原子坐标参数为(0,0,0),球的为(1,1,1),下列说法错误的是
A.In的配位数是4
B.晶胞边长为2apm
C.晶胞中离球距离最远的黑球的坐标参数为(,,)
D.晶胞中与In原子距离最近且相等的In原子有8个
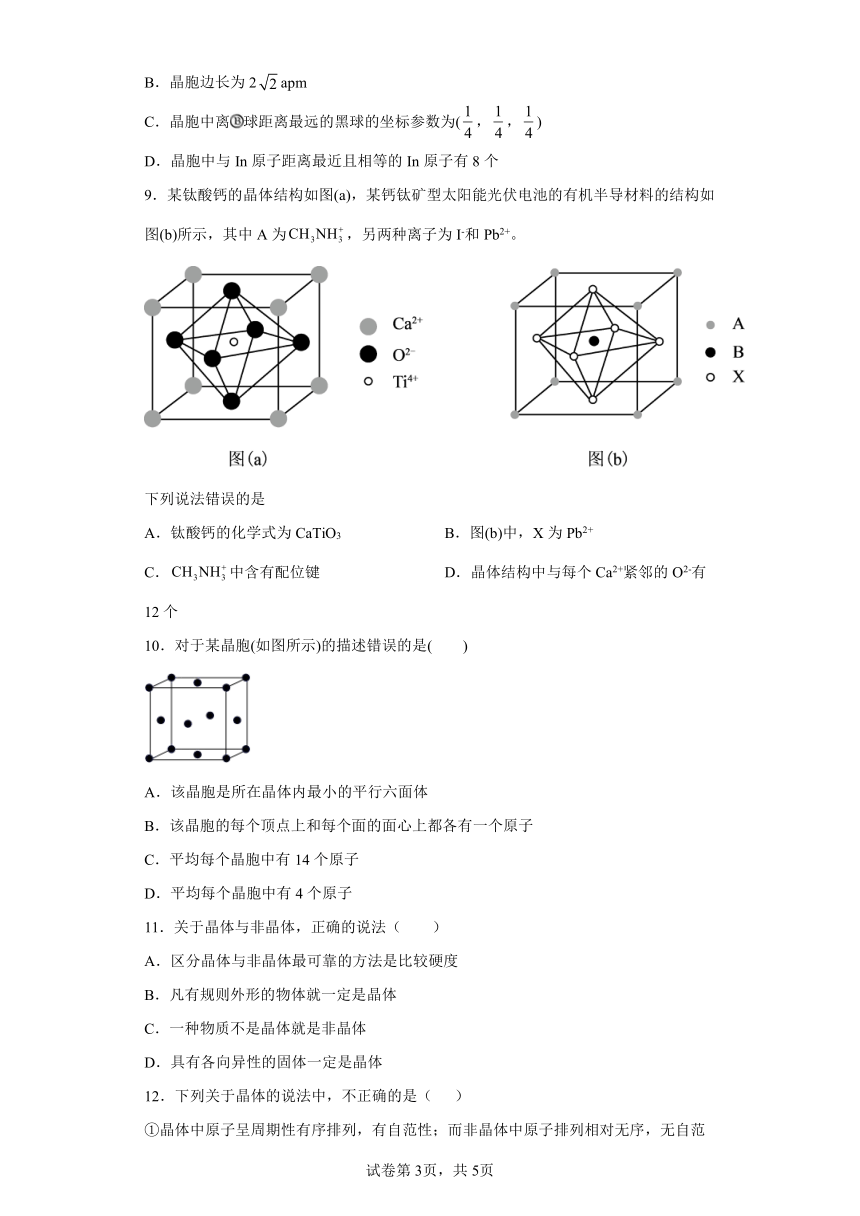
9.某钛酸钙的晶体结构如图(a),某钙钛矿型太阳能光伏电池的有机半导材料的结构如图(b)所示,其中A为,另两种离子为I-和Pb2+。
下列说法错误的是
A.钛酸钙的化学式为CaTiO3 B.图(b)中,X为Pb2+
C.中含有配位键 D.晶体结构中与每个Ca2+紧邻的O2-有12个
10.对于某晶胞(如图所示)的描述错误的是( )
A.该晶胞是所在晶体内最小的平行六面体
B.该晶胞的每个顶点上和每个面的面心上都各有一个原子
C.平均每个晶胞中有14个原子
D.平均每个晶胞中有4个原子
11.关于晶体与非晶体,正确的说法( )
A.区分晶体与非晶体最可靠的方法是比较硬度
B.凡有规则外形的物体就一定是晶体
C.一种物质不是晶体就是非晶体
D.具有各向异性的固体一定是晶体
12.下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性 ②含有金属阳离子的晶体一定是离子晶体 ③共价键可决定分子晶体的熔、沸点 ④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小 ⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列 ⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定 ⑦干冰晶体中,一个CO2分子周围有8个CO2分子紧邻
A.①②③ B.②③④ C.④⑤⑥ D.②③⑦
二、填空题
13.现有八种物质:①干冰 ②碳化硅 ③氮化硼 ④晶体硫 ⑤过氧化钠 ⑥二氧化硅晶体 ⑦氯化铵 ⑧氖。请用编号填写下列空白。
(1)固态时属于原子晶体的是________________________
(2)固态时属于分子晶体的是________________________
(3)属于分子晶体,且分子为直线形的是______________
(4)由单原子分子构成的分子晶体是__________________
(5)通过极性键形成的原子晶体是_____________________
14.A、B、C为三种短周期元素,A原子最外层电子数是次外层的2倍,B原子比A原子多一个质子,C2+与Ne具有相同的核外电子排布,试推断:
(1)B与C形成的化合物属于________晶体。
(2)工业上已合成一种硬度比金刚石还大的由A和B组成的晶体,在该晶体中B显-3价,则该晶体的化学式为________,属于________晶体。
三、实验题
15.三氯化硼(BCl3)是一种重要的化工原料,实验室采用三氟化硼(BF3)与氯化铝(AlCl3)加热的方法制备BCl3,装置如下图所示(夹持装置及加热装置略)。
已知:1.三氟化硼(BF3)易与水反应:三氯化硼(BCl3)易潮解:三氯化铝(AlCl3)沸点低、易升华。Ⅱ.部分物质的常点如下表所示。
物质 BF3 BCl3 AlCl3
沸点/℃ -101 12.5 180
回答下列问题:
(1)BF3中B的杂化方式为______,AlCl3属于______晶体,C中仪器a的名称为______(每空1分,共3分)
(2)将氟硼酸钾(KBF4)和硼酐(B2O3)一起研磨均匀加入A中的圆底烧瓶,滴入浓硫酸并加热,除产生气体外,还生成一种酸式盐,分别写出气体和酸式盐的化学式______、______。
(3)实验开始时,两处加热装置应先加热______(填“A”或“C”)。
(4)装置B中盛放的是浓硫酸,其作用是______。
(5)装置D的作用是______。
(6)C中2.50 g无水氯化铝完全反应后,取下U形管并注入水,完全反应生成盐酸和硼酸(H3BO3是一元弱酸)将所得溶液加水稀释到250 mL,取10 mL加入锥形瓶中滴入2滴酚酞溶液,用0.1000 mol/L的NaOH溶液滴定至终点,消耗NaOH溶液的体积为28.00 mL,则BCl3的产率为______%(保留四位有效数字)。
四、有机推断题
16.A、B、C、D、E为原子序数依次增大的前36号元素,其中A与D、B与C同主族,D与E同周期。A为原子半径最小的元素,B的最外层电子数是次外层电子数的3倍,E的原子序数是B和C两元素原子序数之和。回答下列问题:
(1)D元素的原子结构示意图为____________,E元素的电子排布式为________。
(2)A2B2能以任意比例与水互溶,请推测其主要原因是____________________,A2B2分子是否为手性分子_____(填“是”或“否”)。
(3)E的原子半径为r,摩尔质量为,阿伏伽德罗常数值为,E单质晶体中原子的空间利用率为68%,则E单质晶体中E原子的配位数为_____,其晶体密度为_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】晶体和非晶体的区别:晶体有规则的几何外形、晶体有固定的熔点、晶体有各向异性的特点;晶体不一定是无色透明的固体,例如硫酸铜晶体为蓝色,但有些非晶体无色透明,如玻璃,故一定是无色透明的固体不属于晶体的特点,答案选D。
2.B
【详解】A为顶点、B为面上棱和侧边上棱、C为晶胞内;根据均摊法,一个晶胞中粒子A的个数为6=0.5,粒子B的个数为=2,粒子C的个数为1,所以A、B、C三种粒子数之比为0.5:2:1=1:4:2;
故选B。
3.C
【详解】A.碘单质为分子晶体,升华时只需克服分子间作用力,故A正确;
B.氯化钡是由钡离子和氯离子形成的离子化合物,属于离子晶体,晶体中只存在离子键,故B正确;
C.二氧化硅是由原子构成的原子晶体,故C错误;
D.金刚石是由原子构成的原子晶体,足球烯是由分子构成的分子晶体,两者的晶体类型不同,故D正确;
故选C。
4.D
【详解】A.冰晶胞内水分子间作用力是氢键,描述错误,不符题意;
B.每个冰晶胞平均占有分子个数=4+×8+×6=8,描述错误,不符题意;
C.氢键有饱和性和方向性,每个H原子只能形成一个氢键,但不属于化学键,描述错误,不符题意;
D.冰中氢键的作用能为18.5kJ mol-1,而冰熔化热为5.0kJ mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,并且液态水中分子间仍存在氢键,描述正确,符合题意;
综上,本题选D。
5.D
【详解】每个顶点上的二氧化碳分子被8个晶胞共用,每个面心上的二氧化碳分子被两个晶胞共用,所以该晶胞中二氧化碳分子个数8×+6×=4;ρ= ,所以有=4,解得ρ=,答案选D。
6.B
【详解】A.根据饱和溶液的定义可知,在不改变温度的条件下,向饱和硫酸铜溶液中加入缺角的硫酸铜晶体,此时硫酸铜的溶解速率和结晶速率相等;根据晶体具有自范性的性质,缺角的硫酸铜晶体可以变为规则的晶块,A正确;
B.酒精喷灯的火焰温度在1000摄氏度左右,而石墨的熔点在3600摄氏度以上,因此在隔绝空气的条件下,用酒精喷灯加热不能将石墨晶体熔化,B错误;
C.晶体具有各向异性,指的是晶体全部或部分化学、物理等性质随着方向的改变而有所变化,在方向上呈现出差异的性质。因此,透过灯光,红宝石在不同方向上的色泽可能有所不同,C正确;
D.将一小块AgCl固体投入氨水中,振荡,发生反应:AgCl+2NH3·H2O=Ag(NH3)2Cl+2H2O,沉淀溶解,D正确;
故选B。
7.D
【详解】A.二氧化硫溶于水得到的溶液能导电,但电离出阴阳离子的物质是亚硫酸而不是二氧化硫,所以二氧化硫是非电解质,故A错误;
B.SO32-的价层电子对数为3+×(6+2 3×2)=4,故S原子的杂化类型为sp3杂化,但由于S有一对孤电子对,故其空间构型为三角锥,故B错误;
C.非金属性越强,电负性越大,同一主族元素从上到下电负性逐渐变小,则电负性O>S,故C错误;
D.在该晶胞中含有的Cu原子个数:8×+4×+1=4,含有的Fe原子个数为:4×+6×=4,含有的S原子个数为8个,故晶体的化学式为最简比即CuFeS2,故D正确;
故选:D。
8.D
【详解】A.根据图示可知:距离In原子距离相等且最近的P原子个数是4个,故In的配位数是4,A正确;
B.根据图示可知In、P最小距离为a pm,二者的距离为晶胞体对角线的,则晶胞的边长L==2apm,B正确;
C.晶胞中离B球距离最远的黑球为左下角的黑球,在x、y、z轴上的都是,所以离B球距离最远的黑球的坐标参数(,,),C正确;
D.晶胞中离In原子距离相等且最近的In原子分别位于通过该In原子的三个面的面心上,通过该In原子可以形成8个晶胞,每个面上的In原子被重复计算了2次,则距离In原子距离相等且最近的In原子数目为,D错误;
故合理选项是D。
9.B
【详解】A.根据图(a)所示晶胞结构可知:在一个晶胞中含有Ca2+原子数目是8×=1;含有Ti原子数目是1,含有O2-数目是6×=3,故该晶体化学式为CaTiO3,A正确;
B.根据图(b)晶胞结构可知其中含有位于晶胞顶点,其数目是1个,B为1个,X为3个,由于X、B是I-和Pb2+中的一种,根据化合物中化合价代数和为0,结合微粒数目可知B为Pb2+,X为I-,B错误;
C.是CH3NH2的N原子与H+通过配位键结合形成的阳离子,故其中含有配位键,C正确;
D.以顶点Ca2+为研究对象,在一个晶胞中与该Ca2+距离相等且最近的O2-有3个,分别位于通过该顶点Ca2+的三个面心上,通过该Ca2+可以形成8个晶胞,每个O2-被重复计算了2次,则与该Ca2+距离相等且最近的O2-数目为:个,D正确;
故合理选项是B。
10.C
【详解】A. 晶胞是最小的重复单元,为六方面心结构,A正确;
B. 该晶胞是六方面心结构,在晶胞的每个顶点上和每个面的面心上都各有一个原子,B正确;
C. 由于顶点为8个晶胞所共有,面为2个晶胞所共有,所以平均每个晶胞中含有的原子个数为8×+6×=4个,即平均每个晶胞中有4个原子,C错误;
D. 根据选项C分析可知每个晶胞中有4个原子,D正确;
答案选C。
11.D
【分析】A.比较硬度的方法区分晶体与非晶体不可靠;
B.是否为晶体,与物体有没有规则外形无关;
C.二氧化硅为反例;
D.具有各向异性的固体一定是晶体;
【详解】A.区分晶体与非晶体最可靠的方法是X-射线衍射实验,故A项错误;
B.晶体与非晶体的区别在于晶体有固定的熔点,非晶体没有固定的熔点,与物体有没有规则外形无关,故B项错误;
C.二氧化硅有晶体和非晶体两种形式,故C项错误;
D.具有各向异性的固体一定是晶体,故D项正确,本题选D。
12.D
【详解】①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性,故①正确;
②含有金属阳离子的晶体可能是离子晶体,也可能是金属晶体,故②错误;
③分子晶体熔化过程中破坏的主要是分子间作用力,分子间作用力大小决定分子晶体的熔、沸点高低,与共价键无关,故③错误;
④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小,故④正确;
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列,故⑤正确;
⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定,故⑥正确;
⑦干冰晶体中,一个CO2分子周围有12个CO2分子紧邻,故⑦错误。
综上所述,以上叙述中②③⑦错误,故选项D正确。
13. ②③⑥ ①④⑧ ① ⑧ ②③⑥
【详解】(1)固态时属于原子晶体的是②碳化硅、③氮化硼、⑥二氧化硅晶体;正确答案:②③⑥。
(2)固态时属于分子晶体的是①干冰、④晶体硫、⑧氖;正确答案:①④⑧。
(3)属于分子晶体有①干冰、④晶体硫、⑧氖,其中二氧化碳分子为直线形;正确答案:①。
(4)属于分子晶体有①干冰、④晶体硫、⑧氖,由单原子分子构成的分子晶体是⑧氖; 正确答案:⑧。
(5)固态时属于原子晶体的是②碳化硅、③氮化硼、⑥二氧化硅晶体,三种晶体内部存在C-Si 键、B-N键、Si-O键均为极性键;正确答案②③⑥。
14. 离子 C3N4 原子
【详解】A、B、C为三种短周期元素,A原子最外层电子数是次外层的2倍,则A为碳;B原子比A原子多一个质子,则B为氮;C2+与Ne具有相同的核外电子排布,则C为镁。(1)B与C形成的化合物Mg3N2为离子化合物,属于离子晶体;(2)工业上已合成一种硬度比金刚石还大的由A和B组成的晶体,所以为原子晶体,在该晶体中B显-3价,则A为+4价,则该晶体的化学式为C3N4,属于原子晶体。
15.(1) sp2 分子 球形冷凝管
(2) BF3 KHSO4
(3)A
(4)干燥除水,观察气泡,控制气体流速
(5)冷凝收集BCl3
(6)93.45
【分析】三氟化硼(BF3)与氯化铝(AlCl3)加热的方法制备BCl3,装置A中利用氟硼酸钾(KBF4)、硼酐(B2O3)和浓硫酸反应制取BF3气体,经装置B中浓硫酸干燥后进入装置C与AlCl3反应,AlCl3易升华,所以用装置a冷凝回流,装置D中冷凝收集BCl3,为防止BCl3水解,装置E中盛放碱石灰吸收水蒸气,装置F处理尾气。
【详解】(1)BF3分子中B原子形成3个共价键,B原子上无孤对电子,所以B原子杂化类型是sp2杂化;
AlCl3的物质沸点是180℃,沸点比较低,故氯化铝属于分子晶体;
装置C中仪器a的名称是球形冷凝管;
(2)装置A中发生的反应为非氧化还原反应,且产生一种酸式盐,可判断酸式盐为KHSO4,气体为BF3;
(3)BCl3是强酸弱碱盐,易水解,先加热A处,可以利用A处产生的BF3气体排除装置内空气,防正水蒸气干扰实验;
(4)装置B中盛有浓硫酸作干燥剂,同时也可以通过观察装置B中产生的气流大小来控制气体流速;
(5)装置D采用用冰水浴,其作用是冷凝收集BCl3;
(6)2.50 g无水AlCl3的物质的量n(AlCl3)=,则理论上制取Cl元素守恒,可知制取BCl3的物质的量n(BCl3)=,BCl3和水反应产生H3BO3、HCl,该反应的化学方程式为BCl3+3H2O=H3BO3+3HCl,所以得到的溶液中H3BO3和HCl的物质的量之比为1:3,10 mL待测液共消耗NaOH的物质的量n(NaOH)=0.1000 mol/L×0.028 L=0.0028 mol,所以10 mL待测液中含有H3BO3的物质的量n(H3BO3)=n(NaOH)=0.0007 mol,250 mL待测液中含有H3BO3的物质的量n(H3BO3)=0.0007 mol×=0.0175 mol,根据B元素守恒可知BCl3的物质的量为0.0175 mol,所以产率为。
16. ; 1s22s22p63s23p63d5s4s1 H2O2(或A2B2)分子与水分子间能形成氢键( 是 8
【分析】A、B、C、D、E为原子序数依次增大的前36号元素,A为原子半径最小的元素,则A为H元素;B的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则B为O元素;B与C同主族,则C为S元素;A与D同主族,D的原子序数大于S,故D为K元素;E的原子序数是B和C两元素原子序数之和,则E的原子序数为8+16=24,故E为Cr元素,据此解答。
【详解】A、B、C、D、E为原子序数依次增大的前36号元素,A为原子半径最小的元素,则A为H元素;B的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则B为O元素;B与C同主族,则C为S元素;A与D同主族,D的原子序数大于S,故D为K元素;E的原子序数是B和C两元素原子序数之和,则E的原子序数为8+16=24,故E为Cr元素;
(1)D为K元素,原子结构示意图为,E为Cr元素,电子排布式为:1s22s22p63s23p63d5s4s1;
答案是:;1s22s22p63s23p63d5s4s1;
(2)H2O2能以任意比例与水互溶,可能原因是:H2O2分子与水分子间能形成氢键,H2O2分子为展开书页型结构,分子中正负电荷重心不重合,属于极性分子;
因此,本题正确答案是:H2O2分子与水分子间能形成氢键;是;
(3)E单质晶体中原子的空间利用率为68%,为体心立方密堆积,则E单质晶体中E原子的配位数为8,E的原子半径为rcm,则晶胞棱长为acm,则3a2=(4r)2,故a=4√3r/3,晶胞中E原子数目为1+8×1/8=2,晶胞质量为2M/NAg,则晶体密度为:2M/NA÷(4√3r/3)3=3√3M/32NAr3g/cm3;
答案是:8;3√3M/32NAr3。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列不属于晶体的特点的是( )
A.一定有规则的几何外形
B.一定有各向异性
C.一定有固定的熔点
D.一定是无色透明的固体
2.某晶体的一部分如图所示,这种晶体中A、B、C三种微粒数之比是
A.3:9:4 B.1:4:2 C.2:9:4 D.3:8:5
3.下列说法不正确的是
A.碘单质升华过程中只需克服分子间作用力
B.BaCl2属于离子化合物,晶体中只存在离子键
C.在N2、CO2和SiO2中都存在共价键,它们都是由分子构成
D.金刚石和足球烯(C60)晶体类型不同
4.冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
下列有关冰晶胞说法正确的是
A.冰晶胞内水分子间以共价键结合
B.每个冰晶胞平均含有4个水分子
C.水分子间的氢键是共价键,具有方向性和饱和性
D.实验测得冰中氢键的作用力为18.5kJ/mol,而冰的熔化热为5.0kJ/mol,这说明冰熔化成水,氢键部分被破坏
5.已知在晶体中仍保持一定几何形状的最小单位称为晶胞。干冰晶胞是一个面心立方体,在该晶体中每个顶角各有1个二氧化碳分子,每个面心各有一个二氧化碳分子。实验测得25℃时干冰晶体的晶胞边长为acm,其摩尔质量为Mg/mol,则该干冰晶体的密度为(单位:g/cm3)( )
A. B. C. D.
6.关于下列实验的叙述,不正确的是
A.缺角的硫酸铜晶体在饱和溶液中可以变为规则的晶块
B.在隔绝空气的条件下,用酒精喷灯加热可以将石墨晶体熔化
C.透过灯光,红宝石在不同方向上的色泽可能有所不同
D.将一小块AgCl固体投入氨水中,振荡,固体可以溶解
7.下列有关说法正确的是
A.SO2溶于水所得溶液能导电,所以SO2是电解质
B.的空间构型为平面三角形
C.电负性:O
8.磷化铟(InP)是微电子和光电子的基础材料,其晶胞结构如图1所示,图2为晶胞沿z轴的1:1平面投图,已知图中球的原子坐标参数为(0,0,0),球的为(1,1,1),下列说法错误的是
A.In的配位数是4
B.晶胞边长为2apm
C.晶胞中离球距离最远的黑球的坐标参数为(,,)
D.晶胞中与In原子距离最近且相等的In原子有8个
9.某钛酸钙的晶体结构如图(a),某钙钛矿型太阳能光伏电池的有机半导材料的结构如图(b)所示,其中A为,另两种离子为I-和Pb2+。
下列说法错误的是
A.钛酸钙的化学式为CaTiO3 B.图(b)中,X为Pb2+
C.中含有配位键 D.晶体结构中与每个Ca2+紧邻的O2-有12个
10.对于某晶胞(如图所示)的描述错误的是( )
A.该晶胞是所在晶体内最小的平行六面体
B.该晶胞的每个顶点上和每个面的面心上都各有一个原子
C.平均每个晶胞中有14个原子
D.平均每个晶胞中有4个原子
11.关于晶体与非晶体,正确的说法( )
A.区分晶体与非晶体最可靠的方法是比较硬度
B.凡有规则外形的物体就一定是晶体
C.一种物质不是晶体就是非晶体
D.具有各向异性的固体一定是晶体
12.下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性 ②含有金属阳离子的晶体一定是离子晶体 ③共价键可决定分子晶体的熔、沸点 ④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小 ⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列 ⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定 ⑦干冰晶体中,一个CO2分子周围有8个CO2分子紧邻
A.①②③ B.②③④ C.④⑤⑥ D.②③⑦
二、填空题
13.现有八种物质:①干冰 ②碳化硅 ③氮化硼 ④晶体硫 ⑤过氧化钠 ⑥二氧化硅晶体 ⑦氯化铵 ⑧氖。请用编号填写下列空白。
(1)固态时属于原子晶体的是________________________
(2)固态时属于分子晶体的是________________________
(3)属于分子晶体,且分子为直线形的是______________
(4)由单原子分子构成的分子晶体是__________________
(5)通过极性键形成的原子晶体是_____________________
14.A、B、C为三种短周期元素,A原子最外层电子数是次外层的2倍,B原子比A原子多一个质子,C2+与Ne具有相同的核外电子排布,试推断:
(1)B与C形成的化合物属于________晶体。
(2)工业上已合成一种硬度比金刚石还大的由A和B组成的晶体,在该晶体中B显-3价,则该晶体的化学式为________,属于________晶体。
三、实验题
15.三氯化硼(BCl3)是一种重要的化工原料,实验室采用三氟化硼(BF3)与氯化铝(AlCl3)加热的方法制备BCl3,装置如下图所示(夹持装置及加热装置略)。
已知:1.三氟化硼(BF3)易与水反应:三氯化硼(BCl3)易潮解:三氯化铝(AlCl3)沸点低、易升华。Ⅱ.部分物质的常点如下表所示。
物质 BF3 BCl3 AlCl3
沸点/℃ -101 12.5 180
回答下列问题:
(1)BF3中B的杂化方式为______,AlCl3属于______晶体,C中仪器a的名称为______(每空1分,共3分)
(2)将氟硼酸钾(KBF4)和硼酐(B2O3)一起研磨均匀加入A中的圆底烧瓶,滴入浓硫酸并加热,除产生气体外,还生成一种酸式盐,分别写出气体和酸式盐的化学式______、______。
(3)实验开始时,两处加热装置应先加热______(填“A”或“C”)。
(4)装置B中盛放的是浓硫酸,其作用是______。
(5)装置D的作用是______。
(6)C中2.50 g无水氯化铝完全反应后,取下U形管并注入水,完全反应生成盐酸和硼酸(H3BO3是一元弱酸)将所得溶液加水稀释到250 mL,取10 mL加入锥形瓶中滴入2滴酚酞溶液,用0.1000 mol/L的NaOH溶液滴定至终点,消耗NaOH溶液的体积为28.00 mL,则BCl3的产率为______%(保留四位有效数字)。
四、有机推断题
16.A、B、C、D、E为原子序数依次增大的前36号元素,其中A与D、B与C同主族,D与E同周期。A为原子半径最小的元素,B的最外层电子数是次外层电子数的3倍,E的原子序数是B和C两元素原子序数之和。回答下列问题:
(1)D元素的原子结构示意图为____________,E元素的电子排布式为________。
(2)A2B2能以任意比例与水互溶,请推测其主要原因是____________________,A2B2分子是否为手性分子_____(填“是”或“否”)。
(3)E的原子半径为r,摩尔质量为,阿伏伽德罗常数值为,E单质晶体中原子的空间利用率为68%,则E单质晶体中E原子的配位数为_____,其晶体密度为_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】晶体和非晶体的区别:晶体有规则的几何外形、晶体有固定的熔点、晶体有各向异性的特点;晶体不一定是无色透明的固体,例如硫酸铜晶体为蓝色,但有些非晶体无色透明,如玻璃,故一定是无色透明的固体不属于晶体的特点,答案选D。
2.B
【详解】A为顶点、B为面上棱和侧边上棱、C为晶胞内;根据均摊法,一个晶胞中粒子A的个数为6=0.5,粒子B的个数为=2,粒子C的个数为1,所以A、B、C三种粒子数之比为0.5:2:1=1:4:2;
故选B。
3.C
【详解】A.碘单质为分子晶体,升华时只需克服分子间作用力,故A正确;
B.氯化钡是由钡离子和氯离子形成的离子化合物,属于离子晶体,晶体中只存在离子键,故B正确;
C.二氧化硅是由原子构成的原子晶体,故C错误;
D.金刚石是由原子构成的原子晶体,足球烯是由分子构成的分子晶体,两者的晶体类型不同,故D正确;
故选C。
4.D
【详解】A.冰晶胞内水分子间作用力是氢键,描述错误,不符题意;
B.每个冰晶胞平均占有分子个数=4+×8+×6=8,描述错误,不符题意;
C.氢键有饱和性和方向性,每个H原子只能形成一个氢键,但不属于化学键,描述错误,不符题意;
D.冰中氢键的作用能为18.5kJ mol-1,而冰熔化热为5.0kJ mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,并且液态水中分子间仍存在氢键,描述正确,符合题意;
综上,本题选D。
5.D
【详解】每个顶点上的二氧化碳分子被8个晶胞共用,每个面心上的二氧化碳分子被两个晶胞共用,所以该晶胞中二氧化碳分子个数8×+6×=4;ρ= ,所以有=4,解得ρ=,答案选D。
6.B
【详解】A.根据饱和溶液的定义可知,在不改变温度的条件下,向饱和硫酸铜溶液中加入缺角的硫酸铜晶体,此时硫酸铜的溶解速率和结晶速率相等;根据晶体具有自范性的性质,缺角的硫酸铜晶体可以变为规则的晶块,A正确;
B.酒精喷灯的火焰温度在1000摄氏度左右,而石墨的熔点在3600摄氏度以上,因此在隔绝空气的条件下,用酒精喷灯加热不能将石墨晶体熔化,B错误;
C.晶体具有各向异性,指的是晶体全部或部分化学、物理等性质随着方向的改变而有所变化,在方向上呈现出差异的性质。因此,透过灯光,红宝石在不同方向上的色泽可能有所不同,C正确;
D.将一小块AgCl固体投入氨水中,振荡,发生反应:AgCl+2NH3·H2O=Ag(NH3)2Cl+2H2O,沉淀溶解,D正确;
故选B。
7.D
【详解】A.二氧化硫溶于水得到的溶液能导电,但电离出阴阳离子的物质是亚硫酸而不是二氧化硫,所以二氧化硫是非电解质,故A错误;
B.SO32-的价层电子对数为3+×(6+2 3×2)=4,故S原子的杂化类型为sp3杂化,但由于S有一对孤电子对,故其空间构型为三角锥,故B错误;
C.非金属性越强,电负性越大,同一主族元素从上到下电负性逐渐变小,则电负性O>S,故C错误;
D.在该晶胞中含有的Cu原子个数:8×+4×+1=4,含有的Fe原子个数为:4×+6×=4,含有的S原子个数为8个,故晶体的化学式为最简比即CuFeS2,故D正确;
故选:D。
8.D
【详解】A.根据图示可知:距离In原子距离相等且最近的P原子个数是4个,故In的配位数是4,A正确;
B.根据图示可知In、P最小距离为a pm,二者的距离为晶胞体对角线的,则晶胞的边长L==2apm,B正确;
C.晶胞中离B球距离最远的黑球为左下角的黑球,在x、y、z轴上的都是,所以离B球距离最远的黑球的坐标参数(,,),C正确;
D.晶胞中离In原子距离相等且最近的In原子分别位于通过该In原子的三个面的面心上,通过该In原子可以形成8个晶胞,每个面上的In原子被重复计算了2次,则距离In原子距离相等且最近的In原子数目为,D错误;
故合理选项是D。
9.B
【详解】A.根据图(a)所示晶胞结构可知:在一个晶胞中含有Ca2+原子数目是8×=1;含有Ti原子数目是1,含有O2-数目是6×=3,故该晶体化学式为CaTiO3,A正确;
B.根据图(b)晶胞结构可知其中含有位于晶胞顶点,其数目是1个,B为1个,X为3个,由于X、B是I-和Pb2+中的一种,根据化合物中化合价代数和为0,结合微粒数目可知B为Pb2+,X为I-,B错误;
C.是CH3NH2的N原子与H+通过配位键结合形成的阳离子,故其中含有配位键,C正确;
D.以顶点Ca2+为研究对象,在一个晶胞中与该Ca2+距离相等且最近的O2-有3个,分别位于通过该顶点Ca2+的三个面心上,通过该Ca2+可以形成8个晶胞,每个O2-被重复计算了2次,则与该Ca2+距离相等且最近的O2-数目为:个,D正确;
故合理选项是B。
10.C
【详解】A. 晶胞是最小的重复单元,为六方面心结构,A正确;
B. 该晶胞是六方面心结构,在晶胞的每个顶点上和每个面的面心上都各有一个原子,B正确;
C. 由于顶点为8个晶胞所共有,面为2个晶胞所共有,所以平均每个晶胞中含有的原子个数为8×+6×=4个,即平均每个晶胞中有4个原子,C错误;
D. 根据选项C分析可知每个晶胞中有4个原子,D正确;
答案选C。
11.D
【分析】A.比较硬度的方法区分晶体与非晶体不可靠;
B.是否为晶体,与物体有没有规则外形无关;
C.二氧化硅为反例;
D.具有各向异性的固体一定是晶体;
【详解】A.区分晶体与非晶体最可靠的方法是X-射线衍射实验,故A项错误;
B.晶体与非晶体的区别在于晶体有固定的熔点,非晶体没有固定的熔点,与物体有没有规则外形无关,故B项错误;
C.二氧化硅有晶体和非晶体两种形式,故C项错误;
D.具有各向异性的固体一定是晶体,故D项正确,本题选D。
12.D
【详解】①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性,故①正确;
②含有金属阳离子的晶体可能是离子晶体,也可能是金属晶体,故②错误;
③分子晶体熔化过程中破坏的主要是分子间作用力,分子间作用力大小决定分子晶体的熔、沸点高低,与共价键无关,故③错误;
④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小,故④正确;
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列,故⑤正确;
⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定,故⑥正确;
⑦干冰晶体中,一个CO2分子周围有12个CO2分子紧邻,故⑦错误。
综上所述,以上叙述中②③⑦错误,故选项D正确。
13. ②③⑥ ①④⑧ ① ⑧ ②③⑥
【详解】(1)固态时属于原子晶体的是②碳化硅、③氮化硼、⑥二氧化硅晶体;正确答案:②③⑥。
(2)固态时属于分子晶体的是①干冰、④晶体硫、⑧氖;正确答案:①④⑧。
(3)属于分子晶体有①干冰、④晶体硫、⑧氖,其中二氧化碳分子为直线形;正确答案:①。
(4)属于分子晶体有①干冰、④晶体硫、⑧氖,由单原子分子构成的分子晶体是⑧氖; 正确答案:⑧。
(5)固态时属于原子晶体的是②碳化硅、③氮化硼、⑥二氧化硅晶体,三种晶体内部存在C-Si 键、B-N键、Si-O键均为极性键;正确答案②③⑥。
14. 离子 C3N4 原子
【详解】A、B、C为三种短周期元素,A原子最外层电子数是次外层的2倍,则A为碳;B原子比A原子多一个质子,则B为氮;C2+与Ne具有相同的核外电子排布,则C为镁。(1)B与C形成的化合物Mg3N2为离子化合物,属于离子晶体;(2)工业上已合成一种硬度比金刚石还大的由A和B组成的晶体,所以为原子晶体,在该晶体中B显-3价,则A为+4价,则该晶体的化学式为C3N4,属于原子晶体。
15.(1) sp2 分子 球形冷凝管
(2) BF3 KHSO4
(3)A
(4)干燥除水,观察气泡,控制气体流速
(5)冷凝收集BCl3
(6)93.45
【分析】三氟化硼(BF3)与氯化铝(AlCl3)加热的方法制备BCl3,装置A中利用氟硼酸钾(KBF4)、硼酐(B2O3)和浓硫酸反应制取BF3气体,经装置B中浓硫酸干燥后进入装置C与AlCl3反应,AlCl3易升华,所以用装置a冷凝回流,装置D中冷凝收集BCl3,为防止BCl3水解,装置E中盛放碱石灰吸收水蒸气,装置F处理尾气。
【详解】(1)BF3分子中B原子形成3个共价键,B原子上无孤对电子,所以B原子杂化类型是sp2杂化;
AlCl3的物质沸点是180℃,沸点比较低,故氯化铝属于分子晶体;
装置C中仪器a的名称是球形冷凝管;
(2)装置A中发生的反应为非氧化还原反应,且产生一种酸式盐,可判断酸式盐为KHSO4,气体为BF3;
(3)BCl3是强酸弱碱盐,易水解,先加热A处,可以利用A处产生的BF3气体排除装置内空气,防正水蒸气干扰实验;
(4)装置B中盛有浓硫酸作干燥剂,同时也可以通过观察装置B中产生的气流大小来控制气体流速;
(5)装置D采用用冰水浴,其作用是冷凝收集BCl3;
(6)2.50 g无水AlCl3的物质的量n(AlCl3)=,则理论上制取Cl元素守恒,可知制取BCl3的物质的量n(BCl3)=,BCl3和水反应产生H3BO3、HCl,该反应的化学方程式为BCl3+3H2O=H3BO3+3HCl,所以得到的溶液中H3BO3和HCl的物质的量之比为1:3,10 mL待测液共消耗NaOH的物质的量n(NaOH)=0.1000 mol/L×0.028 L=0.0028 mol,所以10 mL待测液中含有H3BO3的物质的量n(H3BO3)=n(NaOH)=0.0007 mol,250 mL待测液中含有H3BO3的物质的量n(H3BO3)=0.0007 mol×=0.0175 mol,根据B元素守恒可知BCl3的物质的量为0.0175 mol,所以产率为。
16. ; 1s22s22p63s23p63d5s4s1 H2O2(或A2B2)分子与水分子间能形成氢键( 是 8
【分析】A、B、C、D、E为原子序数依次增大的前36号元素,A为原子半径最小的元素,则A为H元素;B的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则B为O元素;B与C同主族,则C为S元素;A与D同主族,D的原子序数大于S,故D为K元素;E的原子序数是B和C两元素原子序数之和,则E的原子序数为8+16=24,故E为Cr元素,据此解答。
【详解】A、B、C、D、E为原子序数依次增大的前36号元素,A为原子半径最小的元素,则A为H元素;B的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则B为O元素;B与C同主族,则C为S元素;A与D同主族,D的原子序数大于S,故D为K元素;E的原子序数是B和C两元素原子序数之和,则E的原子序数为8+16=24,故E为Cr元素;
(1)D为K元素,原子结构示意图为,E为Cr元素,电子排布式为:1s22s22p63s23p63d5s4s1;
答案是:;1s22s22p63s23p63d5s4s1;
(2)H2O2能以任意比例与水互溶,可能原因是:H2O2分子与水分子间能形成氢键,H2O2分子为展开书页型结构,分子中正负电荷重心不重合,属于极性分子;
因此,本题正确答案是:H2O2分子与水分子间能形成氢键;是;
(3)E单质晶体中原子的空间利用率为68%,为体心立方密堆积,则E单质晶体中E原子的配位数为8,E的原子半径为rcm,则晶胞棱长为acm,则3a2=(4r)2,故a=4√3r/3,晶胞中E原子数目为1+8×1/8=2,晶胞质量为2M/NAg,则晶体密度为:2M/NA÷(4√3r/3)3=3√3M/32NAr3g/cm3;
答案是:8;3√3M/32NAr3。
答案第1页,共2页
答案第1页,共2页
