3.2 分子晶体与共价晶体(含解析)
文档属性
| 名称 | 3.2 分子晶体与共价晶体(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 635.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 11:20:30 | ||
图片预览



文档简介
3.2 分子晶体与共价晶体
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关共价晶体的叙述不正确的是
A.金刚石和二氧化硅晶体的最小结构单元都是正四面体
B.含1molC的金刚石中C-C键数目是,晶体中Si-O键数目是
C.水晶和干冰在熔化时,晶体中的共价键都会断裂
D.晶体是共价晶体,所以晶体中不存在分子,不是它的分子式
2.化学与生产、生活、科技息息相关,下列叙述错误的是
A.华为首款5G手机搭载了智能7nm制程SoC“麒麟980”手机芯片主要成分是二氧化硅
B.国产飞机C919用到氮化硅陶瓷是新型无机非金属材料
C.富勒烯、碳纳米管均属于无机非金属材料
D.碳化硅陶瓷可用于制造砂纸和砂轮的磨料
3.下列关于晶体空间立体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶点
B.最小的环为3个Si原子和3个O原子组成的六元环
C.最小的环上实际占有的Si原子和O原子个数之比为1:1
D.最小的环为6个Si原子和6个O原子组成的十二元环
4.HF分子晶体、NH3分子晶体与冰的结构极为相似,在HF分子晶体中,与F原子距离最近的HF分子的个数为
A.3 B.4 C.5 D.12
5.AB型化合物形成的晶体结构多种多样。下图所示的几种结构所表示的物质最有可能是分子晶体的是( )
A.①③ B.②⑤ C.⑤⑥ D.③④⑤⑥
6.下列有关原子晶体的叙述错误的是
A.原子晶体中,只存在共价键 B.原子晶体具有空间网状结构
C.原子晶体中不存在独立的分子 D.原子晶体熔化时不破坏共价键
7.下列说法错误的是
A.水汽化和水分解的变化过程中,都需要破坏共价键
B.CaC2、Na2O2晶体中的阴、阳离子个数比分别为1∶1、1∶2
C.基态碳原子核外有三种能量不同的电子
D.区分晶体Ni和非晶体Ni最可靠的科学方法是X-射线衍射法
8.陈述I和陈述II均正确,且具有因果关系的是
选项 陈述I 陈述II
A 甲苯可使酸性高锰酸钾溶液褪色 甲苯中甲基使苯环活化
B 乙醇与足量反应生成 乙醇分子中氢氧键极性大,易断裂;碳氢键极性小,不易断裂
C SiO2的熔点比干冰高 SiO2分子间的范德华力比干冰大
D 某些金属盐灼烧呈现不同焰色 电子从低能轨道跃迁至高能轨道时吸收光波长不同
A.A B.B C.C D.D
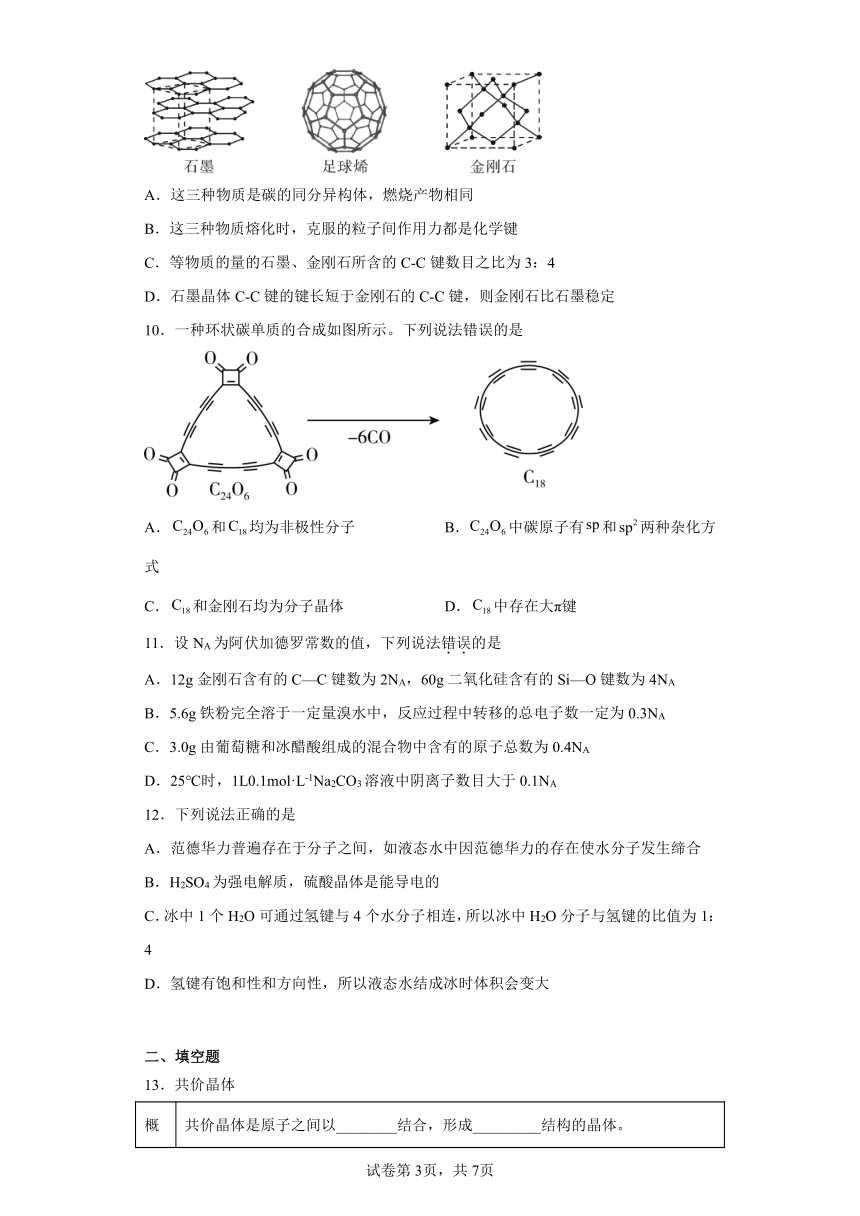
9.如图是石墨、足球烯()、金刚石三种晶体的结构图,下列说法正确的是
A.这三种物质是碳的同分异构体,燃烧产物相同
B.这三种物质熔化时,克服的粒子间作用力都是化学键
C.等物质的量的石墨、金刚石所含的C-C键数目之比为3:4
D.石墨晶体C-C键的键长短于金刚石的C-C键,则金刚石比石墨稳定
10.一种环状碳单质的合成如图所示。下列说法错误的是
A.和均为非极性分子 B.中碳原子有和两种杂化方式
C.和金刚石均为分子晶体 D.中存在大π键
11.设NA为阿伏加德罗常数的值,下列说法错误的是
A.12g金刚石含有的C—C键数为2NA,60g二氧化硅含有的Si—O键数为4NA
B.5.6g铁粉完全溶于一定量溴水中,反应过程中转移的总电子数一定为0.3NA
C.3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.4NA
D.25℃时,1L0.1mol·L-1Na2CO3溶液中阴离子数目大于0.1NA
12.下列说法正确的是
A.范德华力普遍存在于分子之间,如液态水中因范德华力的存在使水分子发生缔合
B.H2SO4为强电解质,硫酸晶体是能导电的
C.冰中1个H2O可通过氢键与4个水分子相连,所以冰中H2O分子与氢键的比值为1:4
D.氢键有饱和性和方向性,所以液态水结成冰时体积会变大
二、填空题
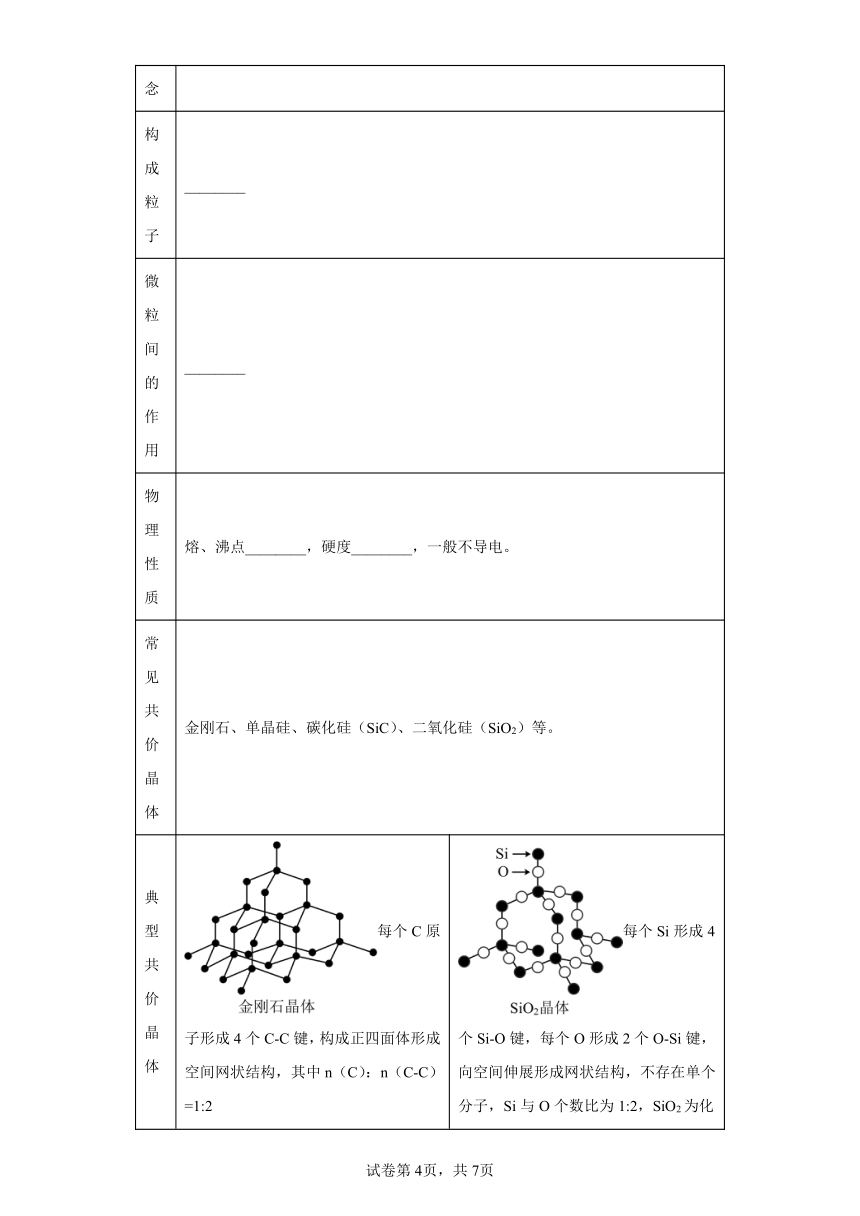
13.共价晶体
概念 共价晶体是原子之间以________结合,形成_________结构的晶体。
构成粒子 ________
微粒间的作用 ________
物理性质 熔、沸点________,硬度________,一般不导电。
常见共价晶体 金刚石、单晶硅、碳化硅(SiC)、二氧化硅(SiO2)等。
典型共价晶体 每个C原子形成4个C-C键,构成正四面体形成空间网状结构,其中n(C):n(C-C)=1:2 每个Si形成4个Si-O键,每个O形成2个O-Si键,向空间伸展形成网状结构,不存在单个分子,Si与O个数比为1:2,SiO2为化学式
14.(1)已知:碳化硅()是一种具有类似金刚石结构的晶体,其中碳原子和硅原子是交替排列的。在下列晶体:①晶体硅、②金刚石、③碳化硅、④干冰、⑤冰中,它们的熔点由高到低的顺序是______(填序号)。
(2)继后,科学家又合成了、。已知熔点:,而破坏分子所需要的能量:,其原因是______。
15.研究发现,在低压合成甲醇反应()中,氧化物负载的氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)和分子中原子的杂化形式分别为__________和__________。
(2)在低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为____,原因是_____。
(3)硝酸锰是制备上述反应催化剂的原料,中的化学键除了键外,还存在__________。
三、实验题
16.青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物。已知: 青蒿素是烃的含氧衍生物,为无色针状晶体,可溶于乙醇、乙醚,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素 60℃以上易分解。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的。
(1)从青蒿中提取青蒿素的流程如下:研究团队经历了使用不同溶剂和不同温度的探究过程,实验结果如下:
溶剂 水 乙醇 乙醚
沸点/℃ 100 78 34.5
提取效率 几乎为 0 35% 95%
①分离残渣与提取液的实验操作是___________;操作Ⅱ的名称是___________。
②提取青蒿素使用的溶剂最好选择___________。
③研究发现,青蒿素分子中的某个基团受热不稳定,据此分析用乙醇作溶剂,提取效率偏低,不能达到理想效果的原因是___________。
④操作Ⅲ的主要过程可能是___________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶 B.加 95%的乙醇,浓缩、结晶、过滤 C.加入乙醚进行萃取分液
(2)某学生对青蒿素的性质进行探究。将青蒿素加入含有 NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与______ (填字母)具有相似的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(3)青蒿素的质谱数据中有一个峰值与另一种抗疟药鹰爪素相同,而鹰爪素的该质谱峰对应过氧基团,于是推测青蒿素中也含有过氧基团,请写出过氧基的电子式:___________。青蒿素所属晶体类型为___________晶体。
(4)研究还发现,将青蒿素通过下面反应转化为双氢青蒿素,治疗疟疾的效果更好。
该反应的反应类型是___________反应。
(5)科学家对 H2O2分子结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:甲:、乙: H—O—O—H,甲式中 O→O 表示配位键,在化学反应中 O→O 键遇到还原剂时易断裂。化学家 Baeyer 和 Villiyer 为研究 H2O2的分子结构,设计并完成了下列实验:
a.将 C2H5OH 与浓 H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与 H2O2反应,只生成 A 和 H2SO4;
c.将生成的 A 与 H2反应(已知该反应中 H2作还原剂)。
①如果 H2O2的结构如甲所示,实验 c 中化学反应方程式为(A 写结构简式)___________。
②为了进一步确定 H2O2的结构,还需要在实验 c 后添加一步实验 d,请设计 d 的实验方案:___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.金刚石是1个中心C原子连接4个C原子,二氧化硅是1个中心原子连接4个O原子,均为正四面体,A项正确;
B.金刚石中,1个C原子与另外4个C原子形成4个键,这个C原子对每个单键的贡献只有,所以原子形成的键为,而晶体中1个原子分别与4个O原子形成4个键,则晶体中键为,B项正确;
C.干冰熔化时只破坏分子间作用力,共价键不会断裂,C项错误;
D.共价晶体的构成微粒是原子不是分子,D项正确。
故选:C。
2.A
【详解】A.硅是良好的半导体材料,手机芯片的主要成分是硅,不是二氧化硅,A错误;
B.氮化硅陶瓷具有耐高温、耐磨损、超硬物质,是新型无机非金属材料,B正确;
C.富勒烯、碳纳米管均属于非金属单质,属于无机非金属材料,C正确;
D.碳化硅陶瓷具有超硬性能,可用于制造砂纸和砂轮的磨料,D正确;
答案选A。
3.D
【详解】A.晶体中存在四面体结构单元,每个原子能形成4个共价键,每个O原子能形成2个共价键,处于中心,O处于4个顶点,故A错误;
B.最小的环为6个原子和6个O原子组成的十二元环,故B错误;
C.每个环实际占有的原子数为,O原子数为,故最小的环上实际占有的原子和O原子个数之比为1:2,故C错误;
D.最小的环为6个原子和6个O原子组成的十二元环,故D正确;
故选D。
4.B
【详解】根据HF分子晶体与冰结构相似可知,每个HF分子周围有4个HF分子与之最近,构成正四面体,故B项正确;
答案选B。
5.B
【详解】从结构上看:①③④⑥构成晶体的结构单元都是向外延伸和扩展的,符合离子晶体和原子晶体的结构特点,而②和⑤的结构没有这种特点,不能再以化学键与其它原子结合,该结构可以看成一个分子,所以可能是分子晶体。
故选B。
6.D
【详解】A.原子晶体中原子之间通过共价键相连,在原子晶体中只存在共价键,故A正确;
B.原子晶体是相邻原子之间通过共价键结合而形成的空间网状结构的晶体,故B正确;
C.原子晶体是由原子以共价键相结合而形成的,不存在独立的分子,故C正确;
D.原子晶体是原子间通过共价键结合而形成的,熔化时需要破坏共价键,故D错误;
故答案选D。
【点睛】在分子晶体中存在独立的分子,在大多数的分子内部存在共价键,分子间还存在分子间作用力。在离子晶体中,有部分离子晶体如NaOH晶体中存在离子键,还存在氧和氢之间的共价键。
7.A
【详解】A.水汽化破坏的是氢键和范德华力,水分解则需破坏共价键,故A错误;
B.CaC2、Na2O2晶体中的阴、阳离子个数比分别为1∶1、1∶2,故B正确;
C.基态碳原子的核外电子排布式为1s22s22p2,占据1s、2s、2p三个能级,所以有三种能量不同的电子,故C正确;
D.区分晶体和非晶体最可靠的科学方法是X—射线衍射法,D项正确。
故答案为A。
8.B
【详解】A.甲苯可使酸性高锰酸钾溶液褪色、反应生成苯甲酸,则甲苯中苯环使甲基活化,A错误;
B.乙醇与足量反应生成,说明乙醇分子中有1个活泼氢原子、乙醇的结构简式为CH3CH2OH,则乙醇分子中氢氧键极性大,易断裂;碳氢键极性小,不易断裂,B正确;
C.SiO2的熔点比干冰高,因为SiO2属于共价晶体、干冰属于分子晶体,共价键键能比分子间的范德华力大,C错误;
D.某些金属盐灼烧呈现不同焰色即焰色试验,是因为电子从高能轨道跃迁至低能轨道时释放光波长不同,D错误;
答案选B。
9.C
【详解】A.石墨、足球烯()、金刚石均是碳元素形成的单质,因此这三种物质是碳的同素异形体,选项A错误。
B.石墨是混合晶体,足球烯是分子晶体,二者熔化时还要破坏分子间作用力,不都是化学键,选项B错误。
C.1 mol石墨所含的C-C键数目为,1 mol金刚石所含的C-C键数目为,其C-C键数目之比为3:4,选项C正确。
D.石墨晶体C-C键的键长小于金刚石的C-C键,所以石墨晶体C-C的键能大于金刚石的C-C键,则石墨比金刚石稳定,选项D错误。
答案选C。
10.C
【详解】A.由环状碳单质的合成示意图可知,和均为结构对称的非极性分子,故A正确;
B.由结构示意图可知,分子中只含有三键碳原子和双键碳原子,其中三键碳原子为sp杂化,双键碳原子为sp2杂化,故B正确;
C.金刚石是由碳原子形成的共价晶体,故C错误;
D.由结构示意图可知,分子中三键碳原子为sp杂化,未参与杂化的p电子能形成大π键,故D正确;
故选C。
11.B
【详解】A.12g金刚石中含碳原子1mol,每个碳原子单键连接四个碳原子,每两个碳原子共享一条共价单键,所以1mol C之间有C—C共价键,即2NA个C—C共价键;60g二氧化硅中有1mol Si原子,每个Si原子连接4个O原子,每个O原子连接2个Si原子,所以每有1mol SiO2,结构中有4mol Si—O键,即4NA个Si—O键,描述正确,不符题意;
B.5.6g铁物质的量是0.1mol,与溴水反应,若只生成FeBr3,转移电子确是0.3NA,但是在水溶液中,若铁粉过量,Fe会与溶液中的Fe3+发生氧化还原反应,有Fe2+生成,1mol Fe转化成Fe3+及部分Fe2+,转移电子数就不足0.3NA,描述错误,符合l题意;
C.葡萄糖(C6H12O6)和冰醋酸(C2H4O2)的最简式都是(CH2O)n,按最简式对应的摩尔质量与有机物质量求得n(CH2O) ==0.1mol,所以其原子总的物质的量是0.1mol×4 = 0.4mol,即有原子0.4NA个,描述正确,不符题意;
D.在水溶液中有少量水解,故物质的量为0.1mol在水溶液中能产生比0.1mol多的阴离子,故阴离子树目大于0.1NA,描述正确,不符题意;
综上,本题选B。
12.D
【详解】A.范德华力普遍存在于分子之间,但液态水中因分子间氢键的存在使水分子发生缔合,A错误;
B.虽然H2SO4为强电解质,但是硫酸晶体是分子晶体,不含自由移动的离子,不能导电,B错误;
C.冰中1个H2O可通过氢键与4个水分子相连,一个氢键被两个水分子共用,所以冰中H2O分子与氢键的比值为1:2,C错误;
D.氢键有饱和性和方向性,所以液态水结成冰时水分子之间的空隙变大,故其体积会变大,D正确;
答案选D。
13. 共价键 空间网状 原子 共价键 高 大
【解析】略
14. ②③①⑤④ 一般情况下,对于组成与结构相似的分了晶体,分子晶体的相对分子质量越大,分子间作用力越强,熔化所需的能量越多,故熔点:;而破坏分子需断开化学键,元素电负性越强其形成的化学键越稳定,断键时所需能量越多,故破坏分子所需要的能量:
【详解】(1)题述晶体中属于共价晶体的是①②③,属于分子晶体的是④⑤。一般来说,共价晶体的熔点>分子晶体的熔点;对于共价晶体,键长:键>键键,相应键能:键键键,故熔点:金刚石>碳化硅>晶体硅。故答案为:②③①⑤④;
(2)分子晶体熔点与分子间作用力有关,而破坏分子则是破坏分子内的共价键。故答案为:一般情况下,对于组成与结构相似的分了晶体,分子晶体的相对分子质量越大,分子间作用力越强,熔化所需的能量越多,故熔点:;而破坏分子需断开化学键,元素电负性越强其形成的化学键越稳定,断键时所需能量越多,故破坏分子所需要的能量:。
15. 与均为极性分子,中氢键比甲醇多;与均为非极性分子,分子量较大、范德华力较大 离子键和键(键)
【详解】(1)中的价层电子对数为2,所以为杂化, 分子中C的价层电子对数为4,故为杂化,故答案为:;;
(2)水和甲醇均为极性分子,常温常压下两种物质均呈液态;二氧化碳和氢气均为非极性分子,常温常压下两种物质均呈气态,根据四种物质在相同条件下的状态可以判断出水甲醇的沸点均高于二氧化碳、氢气的沸点。由于水分子中的2个氢原子都能参与氢键的形成,而甲醇分子中只有羟基上的氢原子能够形成氢键,所以水中的氢键比甲醇多,则水的沸点高于甲醇的沸点。二氧化碳和氢气都属于分子晶体,但由于二氧化碳的相对分子质量大于氢气,所以二氧化碳的沸点高于氢气的沸点,故答案为:;与均为极性分子,中氢键比甲醇多;与均为非极性分子,分子量较大、范德华力较大;
(3)是离子化合物,存在离子键;此外在中,3个O原子和中心原子之间还形成一个4中心6电子的大键(键),所以中的化学键有键、键和离子键,故答案为:离子键和键(键)。
16.(1) 过滤 蒸馏 乙醚 乙醇沸点相对乙醚来说较高,分离时易造成青蒿素受热被破坏,导致其提取效率偏低 B
(2)C
(3) 分子晶体
(4)还原反应
(5) +H2→C2H5OC2H5+H2O 用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)
【分析】本题是一道从青蒿中提取青蒿素的实验题,首先用乙醚从青蒿干燥破碎中萃取出青蒿素,之后过滤得到提取液,再通过蒸馏的方式分离乙醚和粗品,再对粗品提纯即可得到精品,以此解题。
(1)
①分离残渣与提取液的操作是分离难溶性固体与液体混合物,该实验操作方法是名称是过滤;操作Ⅱ为分离互溶的两种液体的操作,应该用蒸馏的方法;
②由已知信息可知:青蒿素不溶于水,在酒精中溶解度不大,而易溶于乙醚,而且水与乙醇互溶,而与乙醚互不相溶,所以提取青蒿素使用的溶剂最好选择乙醚;
③用乙醇作溶剂,提取效率偏低,不能达到理想效果的原因是乙醇沸点相对乙醚来说较高,分离时易造成青蒿素受热被破坏,导致其提取效率偏低;
④操作Ⅲ为提纯青蒿素的过程得到精品青蒿素;
A.青蒿素在水中几乎不溶,不能用水溶解,A错误;
B.青蒿素在乙醇中可溶解,加95%的乙醇,浓缩、结晶、过滤可以提纯青蒿素, B正确;
C.加入乙醚分液后得到的还是混合液,不是精品,C错误;
故选B。
(2)
A.乙醇易溶于水,A错误;
B.乙酸易溶于水,B错误;
C.乙酸乙酯在水中的溶解度不大,加入含有NaOH、酚酞的水溶液后水解生成乙酸,且水解的碱性减弱,溶液红色变浅,C正确;
D.葡萄糖易溶于水,D错误;
故选C;
(3)
过氧基里两个氧之间有一对共用电子对,另外两个氧还各有一个单电子,故其电子式为: ;青蒿素的熔点为156~157℃,熔点较低,属于分子晶体;
(4)
根据青蒿素与双氢青蒿素分子结构的不同,可知是青蒿素分子中的羰基变为羟基,由于得氢被还原,得氧被氧化,所以反应类型为还原反应;
(5)
①根据原子守恒可知,A的分子式为C4H10O2,所以如果双氧水的结构如甲所示,O→O键遇到还原剂时易断裂,则c中的反应为+H2→C2H5OC2H5+H2O;②如果双氧水的结构如乙所示,则反应为C2H5O-OC2H5 + H2 → 2CH3CH2OH,两者的区别之一为是否有水生成,所以可利用无水硫酸铜检验,故答案为:+H2→C2H5OC2H5+H2O;用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关共价晶体的叙述不正确的是
A.金刚石和二氧化硅晶体的最小结构单元都是正四面体
B.含1molC的金刚石中C-C键数目是,晶体中Si-O键数目是
C.水晶和干冰在熔化时,晶体中的共价键都会断裂
D.晶体是共价晶体,所以晶体中不存在分子,不是它的分子式
2.化学与生产、生活、科技息息相关,下列叙述错误的是
A.华为首款5G手机搭载了智能7nm制程SoC“麒麟980”手机芯片主要成分是二氧化硅
B.国产飞机C919用到氮化硅陶瓷是新型无机非金属材料
C.富勒烯、碳纳米管均属于无机非金属材料
D.碳化硅陶瓷可用于制造砂纸和砂轮的磨料
3.下列关于晶体空间立体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶点
B.最小的环为3个Si原子和3个O原子组成的六元环
C.最小的环上实际占有的Si原子和O原子个数之比为1:1
D.最小的环为6个Si原子和6个O原子组成的十二元环
4.HF分子晶体、NH3分子晶体与冰的结构极为相似,在HF分子晶体中,与F原子距离最近的HF分子的个数为
A.3 B.4 C.5 D.12
5.AB型化合物形成的晶体结构多种多样。下图所示的几种结构所表示的物质最有可能是分子晶体的是( )
A.①③ B.②⑤ C.⑤⑥ D.③④⑤⑥
6.下列有关原子晶体的叙述错误的是
A.原子晶体中,只存在共价键 B.原子晶体具有空间网状结构
C.原子晶体中不存在独立的分子 D.原子晶体熔化时不破坏共价键
7.下列说法错误的是
A.水汽化和水分解的变化过程中,都需要破坏共价键
B.CaC2、Na2O2晶体中的阴、阳离子个数比分别为1∶1、1∶2
C.基态碳原子核外有三种能量不同的电子
D.区分晶体Ni和非晶体Ni最可靠的科学方法是X-射线衍射法
8.陈述I和陈述II均正确,且具有因果关系的是
选项 陈述I 陈述II
A 甲苯可使酸性高锰酸钾溶液褪色 甲苯中甲基使苯环活化
B 乙醇与足量反应生成 乙醇分子中氢氧键极性大,易断裂;碳氢键极性小,不易断裂
C SiO2的熔点比干冰高 SiO2分子间的范德华力比干冰大
D 某些金属盐灼烧呈现不同焰色 电子从低能轨道跃迁至高能轨道时吸收光波长不同
A.A B.B C.C D.D
9.如图是石墨、足球烯()、金刚石三种晶体的结构图,下列说法正确的是
A.这三种物质是碳的同分异构体,燃烧产物相同
B.这三种物质熔化时,克服的粒子间作用力都是化学键
C.等物质的量的石墨、金刚石所含的C-C键数目之比为3:4
D.石墨晶体C-C键的键长短于金刚石的C-C键,则金刚石比石墨稳定
10.一种环状碳单质的合成如图所示。下列说法错误的是
A.和均为非极性分子 B.中碳原子有和两种杂化方式
C.和金刚石均为分子晶体 D.中存在大π键
11.设NA为阿伏加德罗常数的值,下列说法错误的是
A.12g金刚石含有的C—C键数为2NA,60g二氧化硅含有的Si—O键数为4NA
B.5.6g铁粉完全溶于一定量溴水中,反应过程中转移的总电子数一定为0.3NA
C.3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.4NA
D.25℃时,1L0.1mol·L-1Na2CO3溶液中阴离子数目大于0.1NA
12.下列说法正确的是
A.范德华力普遍存在于分子之间,如液态水中因范德华力的存在使水分子发生缔合
B.H2SO4为强电解质,硫酸晶体是能导电的
C.冰中1个H2O可通过氢键与4个水分子相连,所以冰中H2O分子与氢键的比值为1:4
D.氢键有饱和性和方向性,所以液态水结成冰时体积会变大
二、填空题
13.共价晶体
概念 共价晶体是原子之间以________结合,形成_________结构的晶体。
构成粒子 ________
微粒间的作用 ________
物理性质 熔、沸点________,硬度________,一般不导电。
常见共价晶体 金刚石、单晶硅、碳化硅(SiC)、二氧化硅(SiO2)等。
典型共价晶体 每个C原子形成4个C-C键,构成正四面体形成空间网状结构,其中n(C):n(C-C)=1:2 每个Si形成4个Si-O键,每个O形成2个O-Si键,向空间伸展形成网状结构,不存在单个分子,Si与O个数比为1:2,SiO2为化学式
14.(1)已知:碳化硅()是一种具有类似金刚石结构的晶体,其中碳原子和硅原子是交替排列的。在下列晶体:①晶体硅、②金刚石、③碳化硅、④干冰、⑤冰中,它们的熔点由高到低的顺序是______(填序号)。
(2)继后,科学家又合成了、。已知熔点:,而破坏分子所需要的能量:,其原因是______。
15.研究发现,在低压合成甲醇反应()中,氧化物负载的氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)和分子中原子的杂化形式分别为__________和__________。
(2)在低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为____,原因是_____。
(3)硝酸锰是制备上述反应催化剂的原料,中的化学键除了键外,还存在__________。
三、实验题
16.青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物。已知: 青蒿素是烃的含氧衍生物,为无色针状晶体,可溶于乙醇、乙醚,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素 60℃以上易分解。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的。
(1)从青蒿中提取青蒿素的流程如下:研究团队经历了使用不同溶剂和不同温度的探究过程,实验结果如下:
溶剂 水 乙醇 乙醚
沸点/℃ 100 78 34.5
提取效率 几乎为 0 35% 95%
①分离残渣与提取液的实验操作是___________;操作Ⅱ的名称是___________。
②提取青蒿素使用的溶剂最好选择___________。
③研究发现,青蒿素分子中的某个基团受热不稳定,据此分析用乙醇作溶剂,提取效率偏低,不能达到理想效果的原因是___________。
④操作Ⅲ的主要过程可能是___________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶 B.加 95%的乙醇,浓缩、结晶、过滤 C.加入乙醚进行萃取分液
(2)某学生对青蒿素的性质进行探究。将青蒿素加入含有 NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与______ (填字母)具有相似的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(3)青蒿素的质谱数据中有一个峰值与另一种抗疟药鹰爪素相同,而鹰爪素的该质谱峰对应过氧基团,于是推测青蒿素中也含有过氧基团,请写出过氧基的电子式:___________。青蒿素所属晶体类型为___________晶体。
(4)研究还发现,将青蒿素通过下面反应转化为双氢青蒿素,治疗疟疾的效果更好。
该反应的反应类型是___________反应。
(5)科学家对 H2O2分子结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:甲:、乙: H—O—O—H,甲式中 O→O 表示配位键,在化学反应中 O→O 键遇到还原剂时易断裂。化学家 Baeyer 和 Villiyer 为研究 H2O2的分子结构,设计并完成了下列实验:
a.将 C2H5OH 与浓 H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与 H2O2反应,只生成 A 和 H2SO4;
c.将生成的 A 与 H2反应(已知该反应中 H2作还原剂)。
①如果 H2O2的结构如甲所示,实验 c 中化学反应方程式为(A 写结构简式)___________。
②为了进一步确定 H2O2的结构,还需要在实验 c 后添加一步实验 d,请设计 d 的实验方案:___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.金刚石是1个中心C原子连接4个C原子,二氧化硅是1个中心原子连接4个O原子,均为正四面体,A项正确;
B.金刚石中,1个C原子与另外4个C原子形成4个键,这个C原子对每个单键的贡献只有,所以原子形成的键为,而晶体中1个原子分别与4个O原子形成4个键,则晶体中键为,B项正确;
C.干冰熔化时只破坏分子间作用力,共价键不会断裂,C项错误;
D.共价晶体的构成微粒是原子不是分子,D项正确。
故选:C。
2.A
【详解】A.硅是良好的半导体材料,手机芯片的主要成分是硅,不是二氧化硅,A错误;
B.氮化硅陶瓷具有耐高温、耐磨损、超硬物质,是新型无机非金属材料,B正确;
C.富勒烯、碳纳米管均属于非金属单质,属于无机非金属材料,C正确;
D.碳化硅陶瓷具有超硬性能,可用于制造砂纸和砂轮的磨料,D正确;
答案选A。
3.D
【详解】A.晶体中存在四面体结构单元,每个原子能形成4个共价键,每个O原子能形成2个共价键,处于中心,O处于4个顶点,故A错误;
B.最小的环为6个原子和6个O原子组成的十二元环,故B错误;
C.每个环实际占有的原子数为,O原子数为,故最小的环上实际占有的原子和O原子个数之比为1:2,故C错误;
D.最小的环为6个原子和6个O原子组成的十二元环,故D正确;
故选D。
4.B
【详解】根据HF分子晶体与冰结构相似可知,每个HF分子周围有4个HF分子与之最近,构成正四面体,故B项正确;
答案选B。
5.B
【详解】从结构上看:①③④⑥构成晶体的结构单元都是向外延伸和扩展的,符合离子晶体和原子晶体的结构特点,而②和⑤的结构没有这种特点,不能再以化学键与其它原子结合,该结构可以看成一个分子,所以可能是分子晶体。
故选B。
6.D
【详解】A.原子晶体中原子之间通过共价键相连,在原子晶体中只存在共价键,故A正确;
B.原子晶体是相邻原子之间通过共价键结合而形成的空间网状结构的晶体,故B正确;
C.原子晶体是由原子以共价键相结合而形成的,不存在独立的分子,故C正确;
D.原子晶体是原子间通过共价键结合而形成的,熔化时需要破坏共价键,故D错误;
故答案选D。
【点睛】在分子晶体中存在独立的分子,在大多数的分子内部存在共价键,分子间还存在分子间作用力。在离子晶体中,有部分离子晶体如NaOH晶体中存在离子键,还存在氧和氢之间的共价键。
7.A
【详解】A.水汽化破坏的是氢键和范德华力,水分解则需破坏共价键,故A错误;
B.CaC2、Na2O2晶体中的阴、阳离子个数比分别为1∶1、1∶2,故B正确;
C.基态碳原子的核外电子排布式为1s22s22p2,占据1s、2s、2p三个能级,所以有三种能量不同的电子,故C正确;
D.区分晶体和非晶体最可靠的科学方法是X—射线衍射法,D项正确。
故答案为A。
8.B
【详解】A.甲苯可使酸性高锰酸钾溶液褪色、反应生成苯甲酸,则甲苯中苯环使甲基活化,A错误;
B.乙醇与足量反应生成,说明乙醇分子中有1个活泼氢原子、乙醇的结构简式为CH3CH2OH,则乙醇分子中氢氧键极性大,易断裂;碳氢键极性小,不易断裂,B正确;
C.SiO2的熔点比干冰高,因为SiO2属于共价晶体、干冰属于分子晶体,共价键键能比分子间的范德华力大,C错误;
D.某些金属盐灼烧呈现不同焰色即焰色试验,是因为电子从高能轨道跃迁至低能轨道时释放光波长不同,D错误;
答案选B。
9.C
【详解】A.石墨、足球烯()、金刚石均是碳元素形成的单质,因此这三种物质是碳的同素异形体,选项A错误。
B.石墨是混合晶体,足球烯是分子晶体,二者熔化时还要破坏分子间作用力,不都是化学键,选项B错误。
C.1 mol石墨所含的C-C键数目为,1 mol金刚石所含的C-C键数目为,其C-C键数目之比为3:4,选项C正确。
D.石墨晶体C-C键的键长小于金刚石的C-C键,所以石墨晶体C-C的键能大于金刚石的C-C键,则石墨比金刚石稳定,选项D错误。
答案选C。
10.C
【详解】A.由环状碳单质的合成示意图可知,和均为结构对称的非极性分子,故A正确;
B.由结构示意图可知,分子中只含有三键碳原子和双键碳原子,其中三键碳原子为sp杂化,双键碳原子为sp2杂化,故B正确;
C.金刚石是由碳原子形成的共价晶体,故C错误;
D.由结构示意图可知,分子中三键碳原子为sp杂化,未参与杂化的p电子能形成大π键,故D正确;
故选C。
11.B
【详解】A.12g金刚石中含碳原子1mol,每个碳原子单键连接四个碳原子,每两个碳原子共享一条共价单键,所以1mol C之间有C—C共价键,即2NA个C—C共价键;60g二氧化硅中有1mol Si原子,每个Si原子连接4个O原子,每个O原子连接2个Si原子,所以每有1mol SiO2,结构中有4mol Si—O键,即4NA个Si—O键,描述正确,不符题意;
B.5.6g铁物质的量是0.1mol,与溴水反应,若只生成FeBr3,转移电子确是0.3NA,但是在水溶液中,若铁粉过量,Fe会与溶液中的Fe3+发生氧化还原反应,有Fe2+生成,1mol Fe转化成Fe3+及部分Fe2+,转移电子数就不足0.3NA,描述错误,符合l题意;
C.葡萄糖(C6H12O6)和冰醋酸(C2H4O2)的最简式都是(CH2O)n,按最简式对应的摩尔质量与有机物质量求得n(CH2O) ==0.1mol,所以其原子总的物质的量是0.1mol×4 = 0.4mol,即有原子0.4NA个,描述正确,不符题意;
D.在水溶液中有少量水解,故物质的量为0.1mol在水溶液中能产生比0.1mol多的阴离子,故阴离子树目大于0.1NA,描述正确,不符题意;
综上,本题选B。
12.D
【详解】A.范德华力普遍存在于分子之间,但液态水中因分子间氢键的存在使水分子发生缔合,A错误;
B.虽然H2SO4为强电解质,但是硫酸晶体是分子晶体,不含自由移动的离子,不能导电,B错误;
C.冰中1个H2O可通过氢键与4个水分子相连,一个氢键被两个水分子共用,所以冰中H2O分子与氢键的比值为1:2,C错误;
D.氢键有饱和性和方向性,所以液态水结成冰时水分子之间的空隙变大,故其体积会变大,D正确;
答案选D。
13. 共价键 空间网状 原子 共价键 高 大
【解析】略
14. ②③①⑤④ 一般情况下,对于组成与结构相似的分了晶体,分子晶体的相对分子质量越大,分子间作用力越强,熔化所需的能量越多,故熔点:;而破坏分子需断开化学键,元素电负性越强其形成的化学键越稳定,断键时所需能量越多,故破坏分子所需要的能量:
【详解】(1)题述晶体中属于共价晶体的是①②③,属于分子晶体的是④⑤。一般来说,共价晶体的熔点>分子晶体的熔点;对于共价晶体,键长:键>键键,相应键能:键键键,故熔点:金刚石>碳化硅>晶体硅。故答案为:②③①⑤④;
(2)分子晶体熔点与分子间作用力有关,而破坏分子则是破坏分子内的共价键。故答案为:一般情况下,对于组成与结构相似的分了晶体,分子晶体的相对分子质量越大,分子间作用力越强,熔化所需的能量越多,故熔点:;而破坏分子需断开化学键,元素电负性越强其形成的化学键越稳定,断键时所需能量越多,故破坏分子所需要的能量:。
15. 与均为极性分子,中氢键比甲醇多;与均为非极性分子,分子量较大、范德华力较大 离子键和键(键)
【详解】(1)中的价层电子对数为2,所以为杂化, 分子中C的价层电子对数为4,故为杂化,故答案为:;;
(2)水和甲醇均为极性分子,常温常压下两种物质均呈液态;二氧化碳和氢气均为非极性分子,常温常压下两种物质均呈气态,根据四种物质在相同条件下的状态可以判断出水甲醇的沸点均高于二氧化碳、氢气的沸点。由于水分子中的2个氢原子都能参与氢键的形成,而甲醇分子中只有羟基上的氢原子能够形成氢键,所以水中的氢键比甲醇多,则水的沸点高于甲醇的沸点。二氧化碳和氢气都属于分子晶体,但由于二氧化碳的相对分子质量大于氢气,所以二氧化碳的沸点高于氢气的沸点,故答案为:;与均为极性分子,中氢键比甲醇多;与均为非极性分子,分子量较大、范德华力较大;
(3)是离子化合物,存在离子键;此外在中,3个O原子和中心原子之间还形成一个4中心6电子的大键(键),所以中的化学键有键、键和离子键,故答案为:离子键和键(键)。
16.(1) 过滤 蒸馏 乙醚 乙醇沸点相对乙醚来说较高,分离时易造成青蒿素受热被破坏,导致其提取效率偏低 B
(2)C
(3) 分子晶体
(4)还原反应
(5) +H2→C2H5OC2H5+H2O 用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)
【分析】本题是一道从青蒿中提取青蒿素的实验题,首先用乙醚从青蒿干燥破碎中萃取出青蒿素,之后过滤得到提取液,再通过蒸馏的方式分离乙醚和粗品,再对粗品提纯即可得到精品,以此解题。
(1)
①分离残渣与提取液的操作是分离难溶性固体与液体混合物,该实验操作方法是名称是过滤;操作Ⅱ为分离互溶的两种液体的操作,应该用蒸馏的方法;
②由已知信息可知:青蒿素不溶于水,在酒精中溶解度不大,而易溶于乙醚,而且水与乙醇互溶,而与乙醚互不相溶,所以提取青蒿素使用的溶剂最好选择乙醚;
③用乙醇作溶剂,提取效率偏低,不能达到理想效果的原因是乙醇沸点相对乙醚来说较高,分离时易造成青蒿素受热被破坏,导致其提取效率偏低;
④操作Ⅲ为提纯青蒿素的过程得到精品青蒿素;
A.青蒿素在水中几乎不溶,不能用水溶解,A错误;
B.青蒿素在乙醇中可溶解,加95%的乙醇,浓缩、结晶、过滤可以提纯青蒿素, B正确;
C.加入乙醚分液后得到的还是混合液,不是精品,C错误;
故选B。
(2)
A.乙醇易溶于水,A错误;
B.乙酸易溶于水,B错误;
C.乙酸乙酯在水中的溶解度不大,加入含有NaOH、酚酞的水溶液后水解生成乙酸,且水解的碱性减弱,溶液红色变浅,C正确;
D.葡萄糖易溶于水,D错误;
故选C;
(3)
过氧基里两个氧之间有一对共用电子对,另外两个氧还各有一个单电子,故其电子式为: ;青蒿素的熔点为156~157℃,熔点较低,属于分子晶体;
(4)
根据青蒿素与双氢青蒿素分子结构的不同,可知是青蒿素分子中的羰基变为羟基,由于得氢被还原,得氧被氧化,所以反应类型为还原反应;
(5)
①根据原子守恒可知,A的分子式为C4H10O2,所以如果双氧水的结构如甲所示,O→O键遇到还原剂时易断裂,则c中的反应为+H2→C2H5OC2H5+H2O;②如果双氧水的结构如乙所示,则反应为C2H5O-OC2H5 + H2 → 2CH3CH2OH,两者的区别之一为是否有水生成,所以可利用无水硫酸铜检验,故答案为:+H2→C2H5OC2H5+H2O;用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)。
答案第1页,共2页
答案第1页,共2页
