2.4.分子间作用力课件2022-2023学年下学期高二化学鲁科版(2019)选择性必修2(共60张PPT)
文档属性
| 名称 | 2.4.分子间作用力课件2022-2023学年下学期高二化学鲁科版(2019)选择性必修2(共60张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 00:00:00 | ||
图片预览





文档简介
(共60张PPT)
第四节 分子间作用力
单击此处添加大标题内容
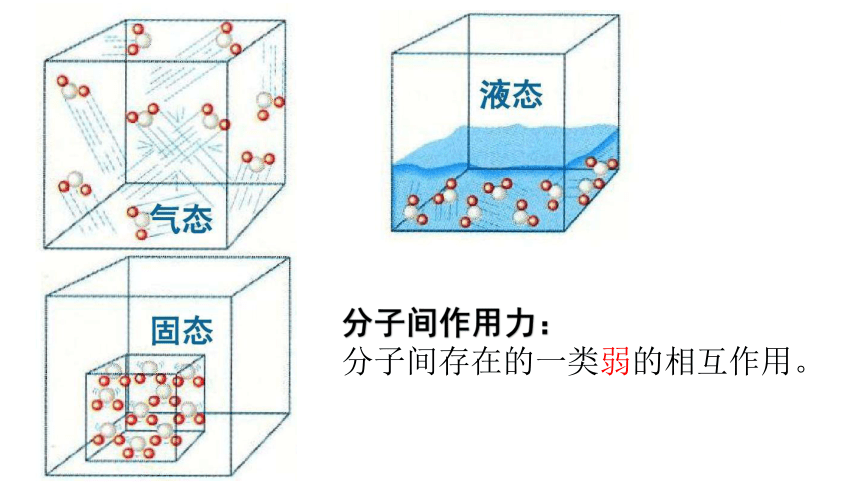
实验事实1:在通常情况下,将水加热到100℃时,水便会沸腾气化;
实验事实2:在通常情况下,将水加热至2200℃时,才会有水部分分解成氢气和氧气。
分子间作用力:
分子间存在的一类弱的相互作用。
范德华力是分子间作用力比键能小很多
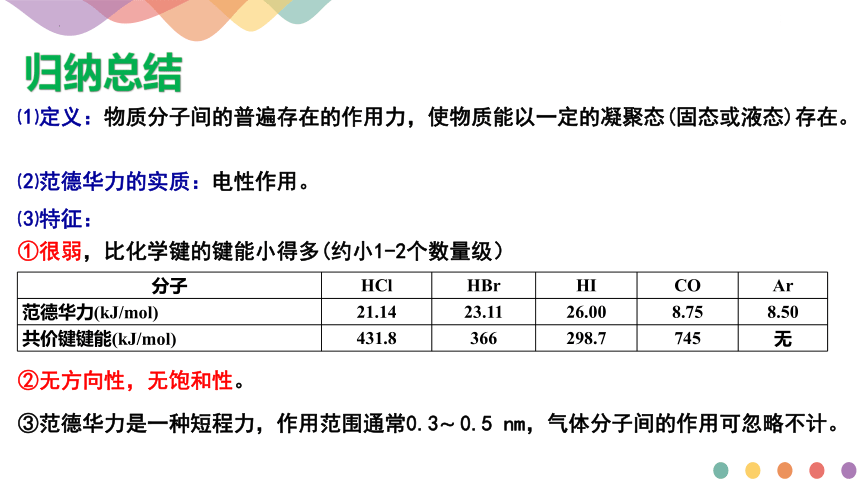
分子 HCl HBr HI CO Ar
范德华力(kJ/mol) 21.14 23.11 26.00 8.75 8.50
共价键键能(kJ/mol) 431.8 366 298.7 745 无
比化学键的键能小得多(约小1-2个数量级)
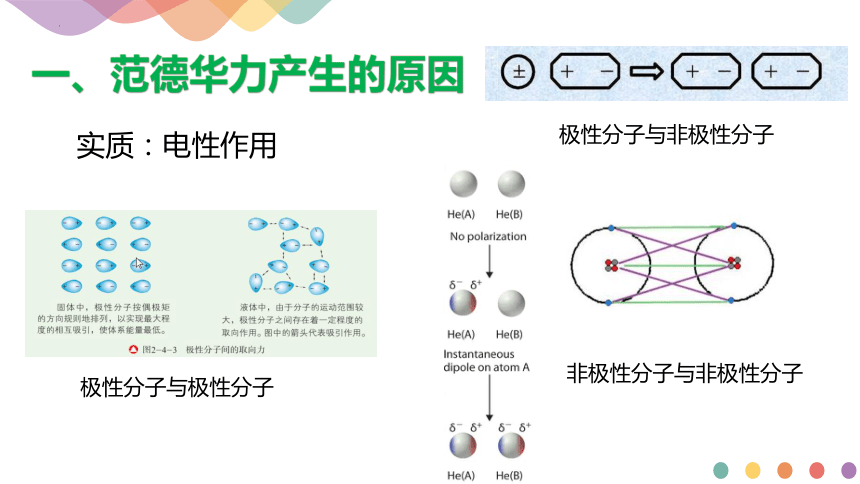
一、范德华力产生的原因
实质:电性作用
极性分子与极性分子
极性分子与非极性分子
非极性分子与非极性分子
极性分子相互靠近时,一个分子的正电荷端与另一个分子的负电荷端相互吸引,这种静电吸引力称为取向力。分子极性越强,取向力就越大。
一个分子受到极性分子的诱导作用,导致正电荷重心与负电荷重心不重合或距离加大,进而使两种分子之间产生吸引力或吸引力增强,这种吸引力称为诱导力。
由于原子核和电子总是在不停地运动,因此即使对非极性分子来说,其正电荷重心与负电荷重心也会发生瞬间不重合。当分子相互靠近时,分子之间会产生静电吸引力,这种静电吸引力叫作色散力。分子越大,分子内的电子越多,分子越容易变形,色散力就越大。除了极性特别强的极性分子间的范德华力以取向力为主以外,其他分子间的范德华力往往以色散力为主。
拓展视野
范德华力的成因
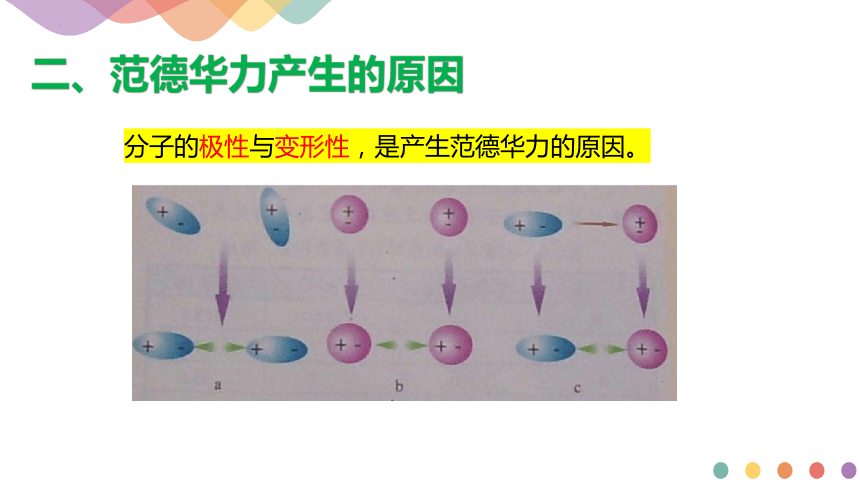
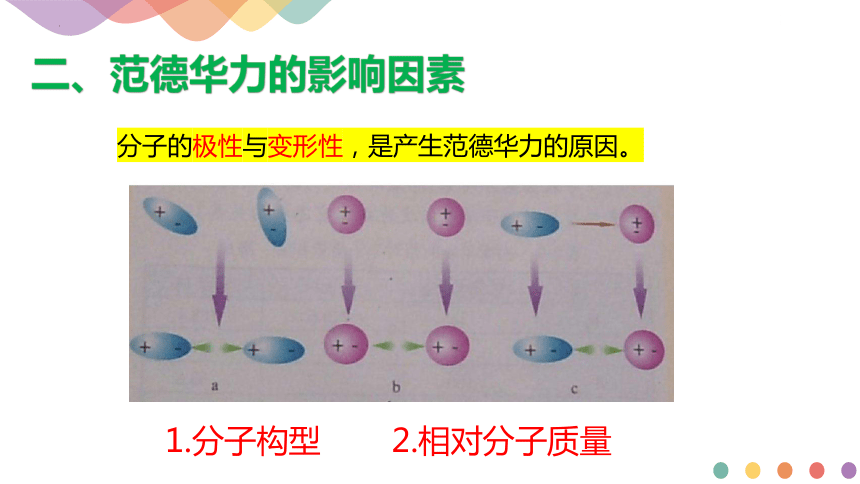
分子的极性与变形性,是产生范德华力的原因。
二、范德华力产生的原因
分子的极性与变形性,是产生范德华力的原因。
归纳总结
⑴定义:物质分子间的普遍存在的作用力,使物质能以一定的凝聚态(固态或液态)存在。
⑵范德华力的实质:电性作用。
⑶特征:
①很弱,比化学键的键能小得多(约小1-2个数量级)
②无方向性,无饱和性。
③范德华力是一种短程力,作用范围通常0.3 0.5 nm,气体分子间的作用可忽略不计。
分子 HCl HBr HI CO Ar
范德华力(kJ/mol) 21.14 23.11 26.00 8.75 8.50
共价键键能(kJ/mol) 431.8 366 298.7 745 无
二、范德华力的影响因素
分子的极性与变形性,是产生范德华力的原因。
1.分子构型
2.相对分子质量
二、范德华力的影响因素
1.分子构型
2.相对分子质量
结构和组成相似的分子,相对分子质量越大,范德华力越大
二、范德华力的影响因素
1.分子构型
2.相对分子质量
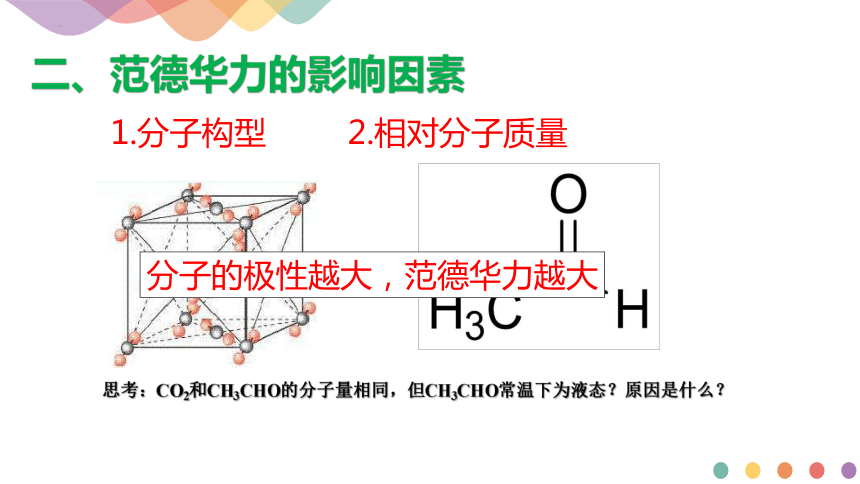
思考:CO2和CH3CHO的分子量相同,但CH3CHO常温下为液态?原因是什么?
分子的极性越大,范德华力越大
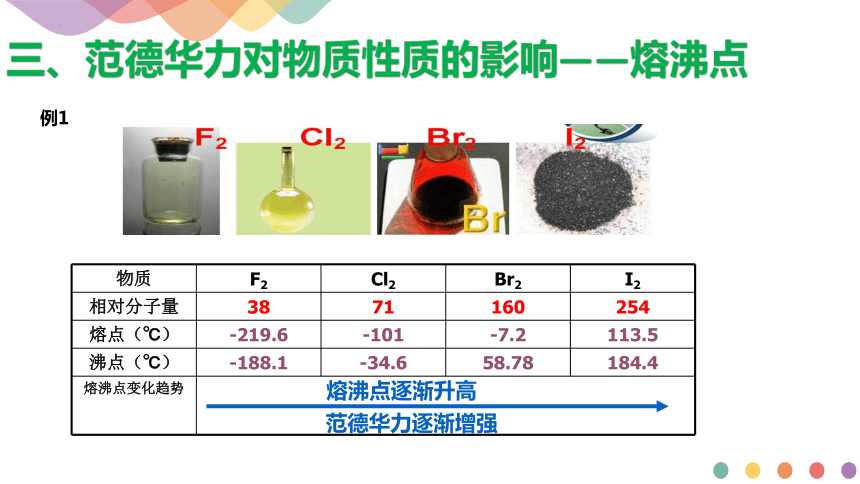
物质 F2 Cl2 Br2 I2
相对分子量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势
熔沸点逐渐升高
范德华力逐渐增强
例1
三、范德华力对物质性质的影响——熔沸点
例2 石油的分馏
低沸点
高沸点
烷烃的沸点随M的增大而增大
例3
极性增大,分子间作用力也增大
CH CH CH
CH3OCH3
CH3CHO
沸点
231K
248K
294K
例4
沸点
309.4K
282.7K
303K
同分异构体,支链越多,范德华力越小,熔沸点越低。
CCl4
H2O
I2
C2H5OH
三、范德华力对物质性质的影响——溶解度
相似相溶原理:极性分子组成的溶质易溶于极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂
乙醚:弱极性
在脂类物质中溶解度大
大脑神经
麻醉剂
拓展视野
为了研究气体分子的运动规律,科学家提出了一种理想气体模型,假设气体分子不具有体积,并且气体分子之间不存在相互作用。根据这种模型提出的理想气体方程对气体分子运动规律的描述与实验事实出现了偏差。荷兰物理学家范德华(J.van der Waals)修正了关于气体分子运动的以上假设,指出气体分子本身具有体积,并且分子间存在引力。由此,范德华提出了描述实际气体行为的范德华气态方程,根据这个方程计算的结果与实验事实十分吻合。由于是范德华首次将分子间作用力的概念引入气态方程,人们将这种分子间相互作用力称为范德华力。
拓展视野
范德华力概念的提出
荷兰物理学家
约翰内斯·迪德里·范·德·瓦耳斯
化学键 范德华力
概念 分子内相邻的原子间强烈的相互作用 把分子聚集在一起的作用力
存在 分子内(或晶体内)原子或离子间 分子间(近距离)
强弱 较强 比化学键弱得多
对物质性质的影响 影响化学性质和物理性质 主要影响物理性质
2.对范德华力存在的理解(1)离子化合物中只存在化学键,不存在范德华力。(2)范德华力只存在于由共价键形成的多数共价化合物和绝大多数非金属单质分子之间及稀有气体分子之间。但像二氧化硅、金刚石等由共价键形成的物质的微粒之间不存在范德华力。
归纳总结
1.化学键与范德华力的比较
思考:
额外的分子间作用力
1.熔沸点反常的原因?
2.为什么存在于NH3 H2O HF
一、氢键的形成条件
元素 电负性 原子半径/pm 元素 电负性 原子半径/pm
F 4.0 71 Cl 3.0 99
O 3.5 73 S 2.5 102
N 3.0 75 P 2.1 106
C 2.5 77
N O F: 电负性大,原子半径小,共价键极性强
H原子:裸露的质子
归纳总结
(1) 氢键的概念:
当氢原子与电负性大的原子X以共价键结合时,氢原子与另一个电负性大的原子Y之间的静电作用。
(2)表示形式:
通常用X—H…Y表示氢键,其中X—H表示氢原子和X原子以共价键相结合。
(3) 氢键的实质:
静电作用
(特殊的分子间作用力)
(4) 氢键的种类:
F-H F
O-H O
N-H N
(5)氢键的特征:
具有方向性和饱和性
每个水分子最多可与四个水分子形成四个氢键
键能、键长:
化学键 氢键 范德华力
键能:是指X-H···Y分解为X-H 和Y所需的能量;
键长:是指X和Y之间的距离。
KJ/mol 100-600 10-40 2-15
化学键>氢键>范德华力
(6)氢键作用力的大小:
(7)氢键的形成条件:
① 分子内含有氢原子
②用X—H…Y表示氢键,X、Y元素电负性大,原子半径小,如N、O、F等。
(8)氢键X—H …Y—的强弱判断:
X和Y的电负性越大,吸引电子能力越强,则氢键越强。
氢键强弱顺序:
F—H…F> O—H…O> O—H…N > N—H…N
二、氢键对物质性质的影响
1.氢键对熔沸点的影响
分子之间存在氢键,
分子间作用力大,
熔沸点高
二、氢键对物质性质的影响
1.氢键对熔沸点的影响
思考:HF NH3 H2O 哪种物质的氢键强?
HF H2O
熔点 -83.37℃ 0℃
沸点 19..51℃ 100℃
尿素(60)、醋酸(60)、硝酸(63)是相对分子质量相近的三种分子,但这三种物质的熔点和沸点相差较大。
尿素熔点在 200 ℃ 以上,常温下是固体;
醋酸的熔点为 16.6 ℃ ,在温度低于 16.6 ℃ 时即凝结成冰状的固体;
硝酸的熔点为-41.59℃,常温下硝酸是一种具有挥发性的液体。
请根据以下问题与同学交流讨论造成这三种物质的熔沸点相差较大的可能原因。
(1)以上三种物质中都存在氢键,为什么硝酸的熔点很低?
(2)尿素和醋酸比较,尿素常温下是固体,说明了什么?分子间作用力的强弱与分子中可形成氢键的氢原子个数有何关系?
内
间
间
1.氢键对熔沸点的影响
二、氢键对物质性质的影响
1.氢键对熔沸点的影响
邻羟基苯甲醛形成分子内氢键
对羟基苯甲醛形成分子间氢键
二、氢键对物质性质的影响
1.氢键对熔沸点的影响
总结:
存在氢键
氢键数目
分子间氢键和分子内氢键
二、氢键对物质性质的影响
1.哪种物质的熔沸点高?为什么?
2.哪种物质的酸性强?为什么?
二、氢键对物质性质的影响
2.氢键对化学性质的影响
(1)哪种物质的熔沸点高?为什么?
(2)哪种物质的酸性强?为什么?
二、氢键对物质性质的影响
2.氢键对化学性质的影响
二、氢键对物质性质的影响
3.氢键对在水中溶解度的影响
(1)溶解度比较:NH3 PH3
(2)甲醛溶于水可以形成氢键吗?
总结:如果溶质分子与溶剂分子间可以生成氢键,则溶质的溶解度增大。
二、氢键对物质性质的影响
3.氢键对在水中溶解度的影响
拓展(了解):溶解度比较 Na2CO3 NaHCO3
二、氢键对物质性质的影响
3.氢键对在水中溶解度的影响
拓展(了解):溶解度比较 Na2CO3 NaHCO3
水中氢键
(1)1mol水中有多少mol氢键?
水中氢键
(2)冰为什么浮在水上?
水分子之间存在着氢键,使水的沸点比硫化氢的沸点高出139 ℃,导致在通常状况下水为液态,地球上因此有了生命。冰中的水分子之间最大程度地形成氢键。由于氢键有方向性,每个水分子的两对孤对电子和两个氢原子只能沿着四个sp3杂化轨道的方向分别与相邻水分子形成氢键,因此每个水分子只能与周围四个水分子接触。水分子之间形成的孔穴造成冰晶体的微观空间存在空隙,反映在宏观性质上就是冰的密度比水的密度小。正是由于冰的这一独特结构,使冰可以浮在水面上,从而使水中生物在寒冷的冬季得以在冰层下的水中存活。
冰中每个氢原子分享到一个氢键,折合每摩尔冰有 2NA个氢键(NA为阿伏加德罗常数)。冰中氢键的作用能为 18.8 kJ·mol-1,而冰的熔化热只有5.0 kJ·mol-1。当在0 ℃冰融化成水时,即使熔化热全部用于破坏氢键,也只能使大约 13%的氢键遭到破坏,水中仍存在着许多由氢键作用而形成的小集团(H2O)n。温度升高使冰融化为水的过程,实际上包括两种过程∶水分子间的氢键减少,使水的密度变大,水分子的热运动即热膨胀作用使水的密度减小。随着温度升高,前一过程的作用由强变弱,后一过程的作用由弱变强,在 4 ℃时两种作用达到平衡。所以,当温度升高时,由0 ℃到 4 ℃时水的密度逐渐增大,4 ℃时水的密度达到最大,4℃后水的密度变小。
追根寻源
为什么水呈现出独特的物理性质
化学与生命
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制机理的化学基础。
化学与生命
DNA双螺旋结构中的氢键
范德华力、氢键与共价键的比较
作用力 范德华力 氢键 共价键
概念 物质分子之间普遍存在的一种相互作用力 已经与电负性很大的原子形成共价键的氢原子与另一个分子中电负性很大的原子之间的作用力 原子间通过共用电子对所形成的相互作用
分类 分子内氢键、分子间氢键 极性共价键、非极性共价键
特征 无方向性、无饱和性 有方向性、有饱和性 有方向性、有饱和性
强度比较 共价键>氢键>范德华力
影响强度的因素 ①随着分子极性和相对分子质量的增大而增大;②组成和结构相似的物质,相对分子质量越大,分子间作用力越大 对于X—H…Y,X、Y的电负性越大,X、Y原子的半径越小,作用能越大 成键原子半径越小,键长越短,键能越大,共价键越稳定
对物质性质的影响 影响物质的熔、沸点及溶解度等物理性质;如熔、沸点F2H2S,HF>HCl,NH3>PH3 ①影响分子的稳定性;②共价键键能越大,分子稳定性越强
归纳总结
大家知道,羊毛织品水洗后会变形,这是什么原因呢 羊毛纤维是蛋白质构成的,蛋白质上的氨基和羰基可能会形成氢键。羊毛在浸水和干燥的过程中,会在这些氢键处纳入水和去除水,而且其变化往往是不可逆的,从而改变了原先蛋白质的构造,即原先的氢键部位可能发生移动,由此引起羊毛织品变形。
追根寻源
羊毛织品水洗后为什么会变形
课堂小结
分子间作用力与物质性质
范德华力与物质性质
氢键与物质性质
范德华力的定义
范德华力对物质性质的影响
本质
类型
特征
静电作用
分子间氢键
分子内氢键
饱和性
方向性
限时训练环节
1.下列叙述与范德华力无关的是
A.CO2加压时形成干冰
B.通常状况下氯化氢为气体
C.氟、氯、溴、碘单质的熔、沸点依次升高
D.氯化钾的熔点较高
√
解析 氯化钾是由离子组成的物质,不存在范德华力。
2.下列物质中不存在氢键的是
A.冰醋酸中醋酸分子之间
B.液态氟化氢中氟化氢分子之间
C.NH3·H2O中的NH3与H2O分子之间
D.可燃冰(CH4·8H2O)中甲烷分子与水分子之间
√
解析 只有非金属性很强的元素与氢元素形成强极性的共价键,分子之间才可能形成氢键(如N、O、F)。C—H键不是强极性共价键,CH4与H2O分子间不存在氢键。
3.(2020·宁夏石嘴山三中高二期中考试)人们熟悉的影片《蜘蛛侠》为我们塑造了一个能飞檐走壁、过高楼如履平地的蜘蛛侠,现实中的蜘蛛也能在天花板等比较滑的板面上爬行,蜘蛛之所以不会从天花板上掉下的主要原因是
A.蜘蛛的脚尖端锋利,能抓住天花板
B.蜘蛛的脚上有“胶水”,从而能使蜘蛛粘在天花板上
C.蜘蛛脚上的大量细毛与天花板之间存在范德华力,这一“黏力”使蜘
蛛不致坠落
D.蜘蛛有特异功能,能抓住任何物体
√
解析 蜘蛛不会掉下的主要原因是蜘蛛脚上的大量细毛与天花板之间存在范德华力。
4.中科院国家纳米科学中心科研员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。下列有关氢键的说法不正确的是
A.由于氢键的存在,冰能浮在水面上
B.乙醇比甲醚更易溶于水,与氢键无关
C.由于氢键的存在,沸点:HF>HCl>HBr>HI
D.由于氢键的存在,影响了蛋白质分子独特的结构
√
√
解析 冰中水分子排列有序,氢键数目比液态水多,体积膨胀,密度减小,所以冰能浮在水面上,A项正确;
乙醇与水分子间存在氢键,增大了乙醇在水中的溶解度,B项不正确;
卤素的氢化物中只有HF分子间存在氢键,故沸点:HF>HI>HBr>HCl,C项错误;
蛋白质分子中可能会形成氢键,氢键具有方向性和饱和性,所以氢键的存在,影响了蛋白质分子独特的结构,D项正确。
5.比较下列熔、沸点高低并且说明原因。
(1)H2O___H2S,原因:_________________________________________。
(2)HF___HCl,原因:___________________________________________。
(3)Br2____I2,原因:____________________________。
(4)CH4____CCl4,原因:________________________________。
>
H2O分子之间存在氢键而H2S分子之间没有氢键
>
HF分子之间存在氢键而HCl分子之间没有氢键
<
Br2的相对分子质量没有I2的大
<
CH4的相对分子质量没有CCl4的大
6.下列叙述与范德华力无关的是
A.气体物质加压或降温时能凝结或凝固
B.熔、沸点高低:CH3CH3C.干冰易升华,SO2固体不易升华
D.氯化钠的熔点较高
√
解析
7.现有下列两组命题,②组命题正确,且能用①组命题正确解释的是
选项 ①组 ②组
A H—I键的键能大于H—Cl键的键能 HI比HCl稳定
B H—I键的键能小于H—Cl键的键能 HI比HCl稳定
C HI分子间的范德华力大于HCl的 HI的沸点比HCl的高
D HI分子间的范德华力小于HCl的 HI的沸点比HCl的低
√
解析 HCl比HI稳定,是由于H—Cl键键能大于H—I键键能,故A、B错误;
HI的沸点比HCl的高,是由于HI的相对分子质量大于HCl的相对分子质量,HI分子间作用力(范德华力)大于HCl分子间作用力(范德华力),故C正确、D错误。
8.下列与氢键有关的说法错误的是
A.氨水中存在分子间氢键
B.形成氢键A—H…B的三个原子总在一条直线上
C.卤化氢中HF沸点较高,是由于HF分子间存在氢键
D.邻羟基苯甲醛( )的熔、沸点比对羟基苯甲醛( )
的熔、沸点低
√
解析 氨水中氨分子之间、水分子之间以及氨分子与水分子之间都存在氢键,A正确;
氢键具有一定的方向性,但不是一定在一条直线上,如 ,B错误;
HF分子间存在氢键F—H…F,使氟化氢分子间作用力增大,所以氟化氢的沸点较高,C正确;
邻羟基苯甲醛主要形成分子内氢键,而对羟基苯甲醛则形成分子间氢键,所以邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低,D正确。
9.关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
√
解析 A项,水分子内不存在氢键,错误;
B项,气态的水分子是单个水分子,不存在氢键,错误;
D项,水分子的稳定性是由于O—H之间的共价键键能大,与分子间作用力没关系,错误。
10.下列实验事实与氢键有关的是
A.乙醇可与水以任意比互溶
B.H2O的热稳定性比H2S强
C.HF能与SiO2反应生成SiF4,故氢氟酸不能盛放在玻璃瓶中
D.NH3能与HCl反应
√
解析 A选项中乙醇易溶于水是由于乙醇与水分子间可以形成O—H…O氢键,从而增大了溶解度;
B选项中由于H—O键的键长比H—S键的键长短,键能大,故H2O分子稳定;
C选项中由于HF能与SiO2发生化学反应;
D选项是NH3的化学性质。
第四节 分子间作用力
单击此处添加大标题内容
实验事实1:在通常情况下,将水加热到100℃时,水便会沸腾气化;
实验事实2:在通常情况下,将水加热至2200℃时,才会有水部分分解成氢气和氧气。
分子间作用力:
分子间存在的一类弱的相互作用。
范德华力是分子间作用力比键能小很多
分子 HCl HBr HI CO Ar
范德华力(kJ/mol) 21.14 23.11 26.00 8.75 8.50
共价键键能(kJ/mol) 431.8 366 298.7 745 无
比化学键的键能小得多(约小1-2个数量级)
一、范德华力产生的原因
实质:电性作用
极性分子与极性分子
极性分子与非极性分子
非极性分子与非极性分子
极性分子相互靠近时,一个分子的正电荷端与另一个分子的负电荷端相互吸引,这种静电吸引力称为取向力。分子极性越强,取向力就越大。
一个分子受到极性分子的诱导作用,导致正电荷重心与负电荷重心不重合或距离加大,进而使两种分子之间产生吸引力或吸引力增强,这种吸引力称为诱导力。
由于原子核和电子总是在不停地运动,因此即使对非极性分子来说,其正电荷重心与负电荷重心也会发生瞬间不重合。当分子相互靠近时,分子之间会产生静电吸引力,这种静电吸引力叫作色散力。分子越大,分子内的电子越多,分子越容易变形,色散力就越大。除了极性特别强的极性分子间的范德华力以取向力为主以外,其他分子间的范德华力往往以色散力为主。
拓展视野
范德华力的成因
分子的极性与变形性,是产生范德华力的原因。
二、范德华力产生的原因
分子的极性与变形性,是产生范德华力的原因。
归纳总结
⑴定义:物质分子间的普遍存在的作用力,使物质能以一定的凝聚态(固态或液态)存在。
⑵范德华力的实质:电性作用。
⑶特征:
①很弱,比化学键的键能小得多(约小1-2个数量级)
②无方向性,无饱和性。
③范德华力是一种短程力,作用范围通常0.3 0.5 nm,气体分子间的作用可忽略不计。
分子 HCl HBr HI CO Ar
范德华力(kJ/mol) 21.14 23.11 26.00 8.75 8.50
共价键键能(kJ/mol) 431.8 366 298.7 745 无
二、范德华力的影响因素
分子的极性与变形性,是产生范德华力的原因。
1.分子构型
2.相对分子质量
二、范德华力的影响因素
1.分子构型
2.相对分子质量
结构和组成相似的分子,相对分子质量越大,范德华力越大
二、范德华力的影响因素
1.分子构型
2.相对分子质量
思考:CO2和CH3CHO的分子量相同,但CH3CHO常温下为液态?原因是什么?
分子的极性越大,范德华力越大
物质 F2 Cl2 Br2 I2
相对分子量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势
熔沸点逐渐升高
范德华力逐渐增强
例1
三、范德华力对物质性质的影响——熔沸点
例2 石油的分馏
低沸点
高沸点
烷烃的沸点随M的增大而增大
例3
极性增大,分子间作用力也增大
CH CH CH
CH3OCH3
CH3CHO
沸点
231K
248K
294K
例4
沸点
309.4K
282.7K
303K
同分异构体,支链越多,范德华力越小,熔沸点越低。
CCl4
H2O
I2
C2H5OH
三、范德华力对物质性质的影响——溶解度
相似相溶原理:极性分子组成的溶质易溶于极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂
乙醚:弱极性
在脂类物质中溶解度大
大脑神经
麻醉剂
拓展视野
为了研究气体分子的运动规律,科学家提出了一种理想气体模型,假设气体分子不具有体积,并且气体分子之间不存在相互作用。根据这种模型提出的理想气体方程对气体分子运动规律的描述与实验事实出现了偏差。荷兰物理学家范德华(J.van der Waals)修正了关于气体分子运动的以上假设,指出气体分子本身具有体积,并且分子间存在引力。由此,范德华提出了描述实际气体行为的范德华气态方程,根据这个方程计算的结果与实验事实十分吻合。由于是范德华首次将分子间作用力的概念引入气态方程,人们将这种分子间相互作用力称为范德华力。
拓展视野
范德华力概念的提出
荷兰物理学家
约翰内斯·迪德里·范·德·瓦耳斯
化学键 范德华力
概念 分子内相邻的原子间强烈的相互作用 把分子聚集在一起的作用力
存在 分子内(或晶体内)原子或离子间 分子间(近距离)
强弱 较强 比化学键弱得多
对物质性质的影响 影响化学性质和物理性质 主要影响物理性质
2.对范德华力存在的理解(1)离子化合物中只存在化学键,不存在范德华力。(2)范德华力只存在于由共价键形成的多数共价化合物和绝大多数非金属单质分子之间及稀有气体分子之间。但像二氧化硅、金刚石等由共价键形成的物质的微粒之间不存在范德华力。
归纳总结
1.化学键与范德华力的比较
思考:
额外的分子间作用力
1.熔沸点反常的原因?
2.为什么存在于NH3 H2O HF
一、氢键的形成条件
元素 电负性 原子半径/pm 元素 电负性 原子半径/pm
F 4.0 71 Cl 3.0 99
O 3.5 73 S 2.5 102
N 3.0 75 P 2.1 106
C 2.5 77
N O F: 电负性大,原子半径小,共价键极性强
H原子:裸露的质子
归纳总结
(1) 氢键的概念:
当氢原子与电负性大的原子X以共价键结合时,氢原子与另一个电负性大的原子Y之间的静电作用。
(2)表示形式:
通常用X—H…Y表示氢键,其中X—H表示氢原子和X原子以共价键相结合。
(3) 氢键的实质:
静电作用
(特殊的分子间作用力)
(4) 氢键的种类:
F-H F
O-H O
N-H N
(5)氢键的特征:
具有方向性和饱和性
每个水分子最多可与四个水分子形成四个氢键
键能、键长:
化学键 氢键 范德华力
键能:是指X-H···Y分解为X-H 和Y所需的能量;
键长:是指X和Y之间的距离。
KJ/mol 100-600 10-40 2-15
化学键>氢键>范德华力
(6)氢键作用力的大小:
(7)氢键的形成条件:
① 分子内含有氢原子
②用X—H…Y表示氢键,X、Y元素电负性大,原子半径小,如N、O、F等。
(8)氢键X—H …Y—的强弱判断:
X和Y的电负性越大,吸引电子能力越强,则氢键越强。
氢键强弱顺序:
F—H…F> O—H…O> O—H…N > N—H…N
二、氢键对物质性质的影响
1.氢键对熔沸点的影响
分子之间存在氢键,
分子间作用力大,
熔沸点高
二、氢键对物质性质的影响
1.氢键对熔沸点的影响
思考:HF NH3 H2O 哪种物质的氢键强?
HF H2O
熔点 -83.37℃ 0℃
沸点 19..51℃ 100℃
尿素(60)、醋酸(60)、硝酸(63)是相对分子质量相近的三种分子,但这三种物质的熔点和沸点相差较大。
尿素熔点在 200 ℃ 以上,常温下是固体;
醋酸的熔点为 16.6 ℃ ,在温度低于 16.6 ℃ 时即凝结成冰状的固体;
硝酸的熔点为-41.59℃,常温下硝酸是一种具有挥发性的液体。
请根据以下问题与同学交流讨论造成这三种物质的熔沸点相差较大的可能原因。
(1)以上三种物质中都存在氢键,为什么硝酸的熔点很低?
(2)尿素和醋酸比较,尿素常温下是固体,说明了什么?分子间作用力的强弱与分子中可形成氢键的氢原子个数有何关系?
内
间
间
1.氢键对熔沸点的影响
二、氢键对物质性质的影响
1.氢键对熔沸点的影响
邻羟基苯甲醛形成分子内氢键
对羟基苯甲醛形成分子间氢键
二、氢键对物质性质的影响
1.氢键对熔沸点的影响
总结:
存在氢键
氢键数目
分子间氢键和分子内氢键
二、氢键对物质性质的影响
1.哪种物质的熔沸点高?为什么?
2.哪种物质的酸性强?为什么?
二、氢键对物质性质的影响
2.氢键对化学性质的影响
(1)哪种物质的熔沸点高?为什么?
(2)哪种物质的酸性强?为什么?
二、氢键对物质性质的影响
2.氢键对化学性质的影响
二、氢键对物质性质的影响
3.氢键对在水中溶解度的影响
(1)溶解度比较:NH3 PH3
(2)甲醛溶于水可以形成氢键吗?
总结:如果溶质分子与溶剂分子间可以生成氢键,则溶质的溶解度增大。
二、氢键对物质性质的影响
3.氢键对在水中溶解度的影响
拓展(了解):溶解度比较 Na2CO3 NaHCO3
二、氢键对物质性质的影响
3.氢键对在水中溶解度的影响
拓展(了解):溶解度比较 Na2CO3 NaHCO3
水中氢键
(1)1mol水中有多少mol氢键?
水中氢键
(2)冰为什么浮在水上?
水分子之间存在着氢键,使水的沸点比硫化氢的沸点高出139 ℃,导致在通常状况下水为液态,地球上因此有了生命。冰中的水分子之间最大程度地形成氢键。由于氢键有方向性,每个水分子的两对孤对电子和两个氢原子只能沿着四个sp3杂化轨道的方向分别与相邻水分子形成氢键,因此每个水分子只能与周围四个水分子接触。水分子之间形成的孔穴造成冰晶体的微观空间存在空隙,反映在宏观性质上就是冰的密度比水的密度小。正是由于冰的这一独特结构,使冰可以浮在水面上,从而使水中生物在寒冷的冬季得以在冰层下的水中存活。
冰中每个氢原子分享到一个氢键,折合每摩尔冰有 2NA个氢键(NA为阿伏加德罗常数)。冰中氢键的作用能为 18.8 kJ·mol-1,而冰的熔化热只有5.0 kJ·mol-1。当在0 ℃冰融化成水时,即使熔化热全部用于破坏氢键,也只能使大约 13%的氢键遭到破坏,水中仍存在着许多由氢键作用而形成的小集团(H2O)n。温度升高使冰融化为水的过程,实际上包括两种过程∶水分子间的氢键减少,使水的密度变大,水分子的热运动即热膨胀作用使水的密度减小。随着温度升高,前一过程的作用由强变弱,后一过程的作用由弱变强,在 4 ℃时两种作用达到平衡。所以,当温度升高时,由0 ℃到 4 ℃时水的密度逐渐增大,4 ℃时水的密度达到最大,4℃后水的密度变小。
追根寻源
为什么水呈现出独特的物理性质
化学与生命
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制机理的化学基础。
化学与生命
DNA双螺旋结构中的氢键
范德华力、氢键与共价键的比较
作用力 范德华力 氢键 共价键
概念 物质分子之间普遍存在的一种相互作用力 已经与电负性很大的原子形成共价键的氢原子与另一个分子中电负性很大的原子之间的作用力 原子间通过共用电子对所形成的相互作用
分类 分子内氢键、分子间氢键 极性共价键、非极性共价键
特征 无方向性、无饱和性 有方向性、有饱和性 有方向性、有饱和性
强度比较 共价键>氢键>范德华力
影响强度的因素 ①随着分子极性和相对分子质量的增大而增大;②组成和结构相似的物质,相对分子质量越大,分子间作用力越大 对于X—H…Y,X、Y的电负性越大,X、Y原子的半径越小,作用能越大 成键原子半径越小,键长越短,键能越大,共价键越稳定
对物质性质的影响 影响物质的熔、沸点及溶解度等物理性质;如熔、沸点F2
归纳总结
大家知道,羊毛织品水洗后会变形,这是什么原因呢 羊毛纤维是蛋白质构成的,蛋白质上的氨基和羰基可能会形成氢键。羊毛在浸水和干燥的过程中,会在这些氢键处纳入水和去除水,而且其变化往往是不可逆的,从而改变了原先蛋白质的构造,即原先的氢键部位可能发生移动,由此引起羊毛织品变形。
追根寻源
羊毛织品水洗后为什么会变形
课堂小结
分子间作用力与物质性质
范德华力与物质性质
氢键与物质性质
范德华力的定义
范德华力对物质性质的影响
本质
类型
特征
静电作用
分子间氢键
分子内氢键
饱和性
方向性
限时训练环节
1.下列叙述与范德华力无关的是
A.CO2加压时形成干冰
B.通常状况下氯化氢为气体
C.氟、氯、溴、碘单质的熔、沸点依次升高
D.氯化钾的熔点较高
√
解析 氯化钾是由离子组成的物质,不存在范德华力。
2.下列物质中不存在氢键的是
A.冰醋酸中醋酸分子之间
B.液态氟化氢中氟化氢分子之间
C.NH3·H2O中的NH3与H2O分子之间
D.可燃冰(CH4·8H2O)中甲烷分子与水分子之间
√
解析 只有非金属性很强的元素与氢元素形成强极性的共价键,分子之间才可能形成氢键(如N、O、F)。C—H键不是强极性共价键,CH4与H2O分子间不存在氢键。
3.(2020·宁夏石嘴山三中高二期中考试)人们熟悉的影片《蜘蛛侠》为我们塑造了一个能飞檐走壁、过高楼如履平地的蜘蛛侠,现实中的蜘蛛也能在天花板等比较滑的板面上爬行,蜘蛛之所以不会从天花板上掉下的主要原因是
A.蜘蛛的脚尖端锋利,能抓住天花板
B.蜘蛛的脚上有“胶水”,从而能使蜘蛛粘在天花板上
C.蜘蛛脚上的大量细毛与天花板之间存在范德华力,这一“黏力”使蜘
蛛不致坠落
D.蜘蛛有特异功能,能抓住任何物体
√
解析 蜘蛛不会掉下的主要原因是蜘蛛脚上的大量细毛与天花板之间存在范德华力。
4.中科院国家纳米科学中心科研员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。下列有关氢键的说法不正确的是
A.由于氢键的存在,冰能浮在水面上
B.乙醇比甲醚更易溶于水,与氢键无关
C.由于氢键的存在,沸点:HF>HCl>HBr>HI
D.由于氢键的存在,影响了蛋白质分子独特的结构
√
√
解析 冰中水分子排列有序,氢键数目比液态水多,体积膨胀,密度减小,所以冰能浮在水面上,A项正确;
乙醇与水分子间存在氢键,增大了乙醇在水中的溶解度,B项不正确;
卤素的氢化物中只有HF分子间存在氢键,故沸点:HF>HI>HBr>HCl,C项错误;
蛋白质分子中可能会形成氢键,氢键具有方向性和饱和性,所以氢键的存在,影响了蛋白质分子独特的结构,D项正确。
5.比较下列熔、沸点高低并且说明原因。
(1)H2O___H2S,原因:_________________________________________。
(2)HF___HCl,原因:___________________________________________。
(3)Br2____I2,原因:____________________________。
(4)CH4____CCl4,原因:________________________________。
>
H2O分子之间存在氢键而H2S分子之间没有氢键
>
HF分子之间存在氢键而HCl分子之间没有氢键
<
Br2的相对分子质量没有I2的大
<
CH4的相对分子质量没有CCl4的大
6.下列叙述与范德华力无关的是
A.气体物质加压或降温时能凝结或凝固
B.熔、沸点高低:CH3CH3
D.氯化钠的熔点较高
√
解析
7.现有下列两组命题,②组命题正确,且能用①组命题正确解释的是
选项 ①组 ②组
A H—I键的键能大于H—Cl键的键能 HI比HCl稳定
B H—I键的键能小于H—Cl键的键能 HI比HCl稳定
C HI分子间的范德华力大于HCl的 HI的沸点比HCl的高
D HI分子间的范德华力小于HCl的 HI的沸点比HCl的低
√
解析 HCl比HI稳定,是由于H—Cl键键能大于H—I键键能,故A、B错误;
HI的沸点比HCl的高,是由于HI的相对分子质量大于HCl的相对分子质量,HI分子间作用力(范德华力)大于HCl分子间作用力(范德华力),故C正确、D错误。
8.下列与氢键有关的说法错误的是
A.氨水中存在分子间氢键
B.形成氢键A—H…B的三个原子总在一条直线上
C.卤化氢中HF沸点较高,是由于HF分子间存在氢键
D.邻羟基苯甲醛( )的熔、沸点比对羟基苯甲醛( )
的熔、沸点低
√
解析 氨水中氨分子之间、水分子之间以及氨分子与水分子之间都存在氢键,A正确;
氢键具有一定的方向性,但不是一定在一条直线上,如 ,B错误;
HF分子间存在氢键F—H…F,使氟化氢分子间作用力增大,所以氟化氢的沸点较高,C正确;
邻羟基苯甲醛主要形成分子内氢键,而对羟基苯甲醛则形成分子间氢键,所以邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低,D正确。
9.关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
√
解析 A项,水分子内不存在氢键,错误;
B项,气态的水分子是单个水分子,不存在氢键,错误;
D项,水分子的稳定性是由于O—H之间的共价键键能大,与分子间作用力没关系,错误。
10.下列实验事实与氢键有关的是
A.乙醇可与水以任意比互溶
B.H2O的热稳定性比H2S强
C.HF能与SiO2反应生成SiF4,故氢氟酸不能盛放在玻璃瓶中
D.NH3能与HCl反应
√
解析 A选项中乙醇易溶于水是由于乙醇与水分子间可以形成O—H…O氢键,从而增大了溶解度;
B选项中由于H—O键的键长比H—S键的键长短,键能大,故H2O分子稳定;
C选项中由于HF能与SiO2发生化学反应;
D选项是NH3的化学性质。
