第5章初识酸和碱检测题(含答案)---2022-2023学年九年级化学沪教版(上海)第二学期
文档属性
| 名称 | 第5章初识酸和碱检测题(含答案)---2022-2023学年九年级化学沪教版(上海)第二学期 |  | |
| 格式 | docx | ||
| 文件大小 | 150.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 10:47:30 | ||
图片预览



文档简介
第5章《初识酸和碱》检测题
一、单选题
1.某课外兴趣小组的同学,通过实验测定浓硫酸吸水性的有关数据,绘制成下图的函数图像,其中横坐标表示时间,纵坐标可以表示:①溶质的质量分数;②溶液的质量;③溶液的体积;④溶液中所含水的质量.其中正确的是
A.①② B.②③ C.②③④ D.①②③④
2.下列关于盐酸、硫酸的叙述正确的是
A.打开浓盐酸试剂瓶瓶塞,瓶口冒白雾
B.浓盐酸敞口放置后,其溶质质量分数增大
C.浓硫酸具有脱水性,故能做干燥剂
D.浓硫酸溶于水时会吸热
3.下列关于溶液的说法中,正确的是( )
A.硝酸铵固体溶于水放出热量,使溶液温度明显升高
B.蔗糖溶液上半部分的甜度比下半部分的甜度低
C.稀硫酸能导电,因为溶液中有较多自由移动的离子
D.硝酸钾饱和溶液在任何条件下都不能再溶解硝酸钾
4.推理是化学学习中常用的思维方法,下列推理正确的是
A.酸溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的溶液一定是酸溶液
B.同种元素的粒子质子数相同,所以质子数相同的粒子一定是同种元素
C.化合物是由不同种元素组成,所以由同种元素组成的物质一定不是化合物
D.锌粒和稀硫酸反应会产生氢气,所以能和稀硫酸反应产生气体的物质一定是金属
5.下列关于浓硫酸的描述正确的是( )
A.有脱水性可以作干燥剂
B.与铁反应生成硫酸亚铁和氢气
C.有吸水性可以用来干燥氨气
D.稀释浓硫酸时,切不可将水倒进浓硫酸中
6.下列有关实验设计方案或实验事实的叙述错误的是( )
A.打开盛有浓盐酸的试剂瓶瓶盖,瓶口上方出现大量白雾
B.红磷在空气中燃烧产生大量的白烟
C.用干燥的红色石蕊试纸检验氨气时,试纸会变为蓝色
D.向氯化钙溶液中通入二氧化碳不会出现大量白色沉淀
7.推理是学习化学常用的思维方法,下列推理正确的是
A.化学变化中原子不能再分,所以化学变化中分子也不能再分
B.洗涤剂除油污的原理是乳化,所以氢氧化钠除油污的原理也是乳化
C.碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐
D.化合物是由不同种元素组成的物质,所以由同种元素组成的物质一定不是化合物
8.下列实验现象描述正确的是
A.红磷在空气中燃烧产生大量白色烟雾 B.铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
C.打开盛有浓盐酸的试剂瓶,瓶口有白烟出现 D.将肥皂水加入硬水中振荡,泡沫丰富
9.现有18.6g NaOH与Na2CO3的固体混合物,测得其中钠元素与碳元素的质量比为23:3。在室温下,将该混合物与100g稀硫酸混合,恰好完全反应,所得不饱和溶液的质量为114.2g,则原固体混合物中含有钠元素的质量为
A.2.3g B.9.2g C.4.6g D.6.9g
10.下列有关生活常识的说法中,正确的是( )
A.发现家里煤气泄露时,立即打开排气扇
B.用工业酒精兑制白酒
C.用食醋除去水壶中的水垢
D.用铁桶配制农药波尔多液
11.下列现象描述错误的是
A.打开盛有浓盐酸的试剂瓶瓶盖,出现白雾
B.CO2通入紫色石蕊溶液,溶液变蓝
C.将浓硫酸滴到白纸上,白纸变黑
D.铁丝在氧气中剧烈燃烧,火星四射,产生黑色固体
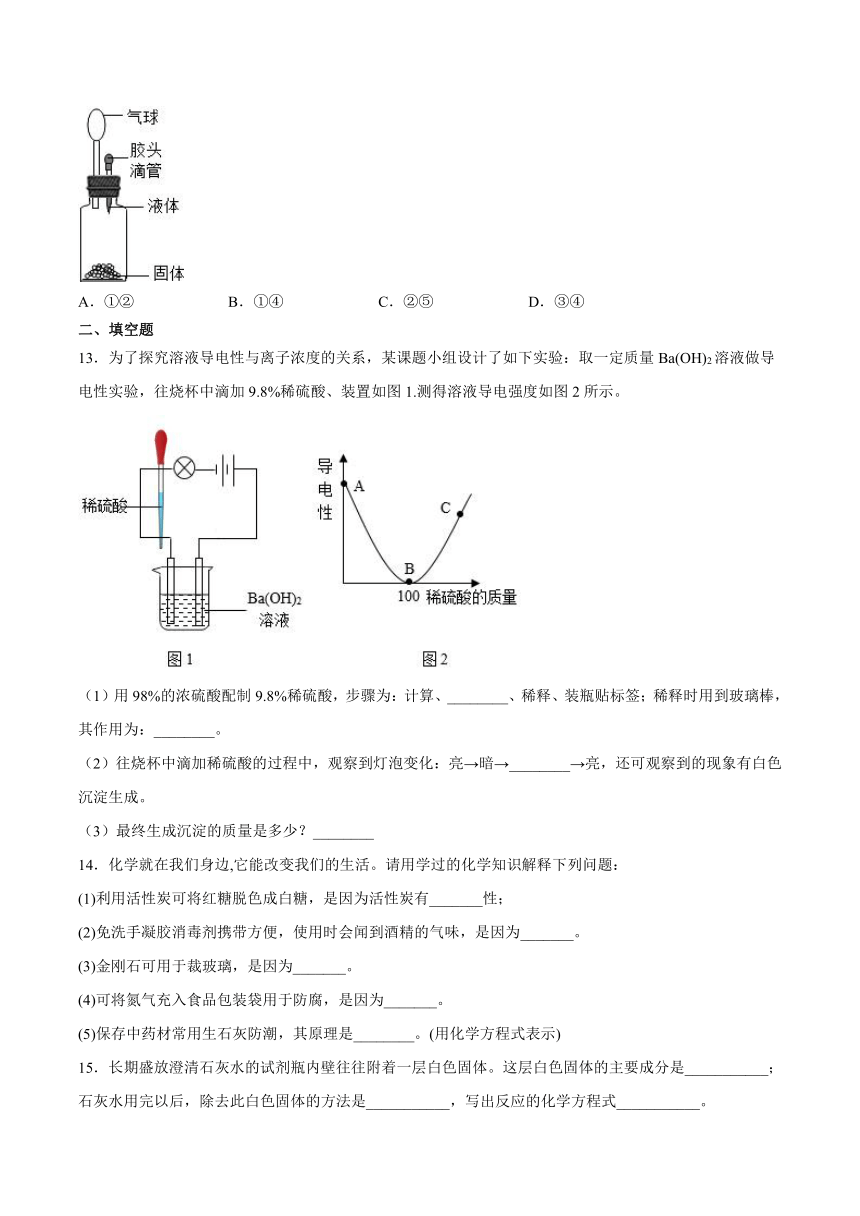
12.要使如图装置中的小气球鼓起来,则使用的固体和液体可以是:①生石灰和水②硝酸铵和水③氯化钠和水④氢氧化钠和稀硫酸⑤硝酸钾和水
A.①② B.①④ C.②⑤ D.③④
二、填空题
13.为了探究溶液导电性与离子浓度的关系,某课题小组设计了如下实验:取一定质量Ba(OH)2溶液做导电性实验,往烧杯中滴加9.8%稀硫酸、装置如图1.测得溶液导电强度如图2所示。
(1)用98%的浓硫酸配制9.8%稀硫酸,步骤为:计算、________、稀释、装瓶贴标签;稀释时用到玻璃棒,其作用为:________。
(2)往烧杯中滴加稀硫酸的过程中,观察到灯泡变化:亮→暗→________→亮,还可观察到的现象有白色沉淀生成。
(3)最终生成沉淀的质量是多少?________
14.化学就在我们身边,它能改变我们的生活。请用学过的化学知识解释下列问题:
(1)利用活性炭可将红糖脱色成白糖,是因为活性炭有_______性;
(2)免洗手凝胶消毒剂携带方便,使用时会闻到酒精的气味,是因为_______。
(3)金刚石可用于裁玻璃,是因为_______。
(4)可将氮气充入食品包装袋用于防腐,是因为_______。
(5)保存中药材常用生石灰防潮,其原理是________。(用化学方程式表示)
15.长期盛放澄清石灰水的试剂瓶内壁往往附着一层白色固体。这层白色固体的主要成分是___________;石灰水用完以后,除去此白色固体的方法是___________,写出反应的化学方程式___________。
三、推断题
16.如图是初中化学常见六种物质之间的关系图。(物质是溶液的只考虑溶质)图中用“一”表示两端的物质能发生化学反应,“→”表示一种物质可以转化为另一种物质(部分反应物或生成物及反应条件已略去)。A与B两溶液可以发生中和反应生成一种厨房中常用的调味剂,C在农业上可用来配制波尔多液,D可用于制玻璃,请回答下列问题:
(1)请分别写出下列物质的化学式(或溶质的化学式):
B___;D___。
(2)写出E转化为C的化学方程式___。
(3)若F为铁锈的主要成分,写出F与足量A反应的实验现象___。
17.A-I是初中化学所学的物质,其转化关系如图所示,按单质、氧化物、酸、碱、盐分类,A、B、D、E、F是不同类别的物质,C、G、B、I、F也是不同类别的物质;A、B、C中含有同种元素,B是导致“温室效应”的一种气体,I是一种蓝色絮状沉淀,图中“一”表示两端的物质能发生化学反应,“→”表示物质间存在相应的转化关系(部分反应物、生成物和反应条件未标出)。请回答:
(1)物质B的化学式:______;
(2)反应②基本反应类型是______;
(3)反应①的化学方程式是______;
(4)物质F的用途______。
四、实验题
18.某学习小组在学习了酸的性质后,为验证酸的性质做了如下实验:
(1)甲同学在收集干燥的氧气时,将氧气通过浓硫酸,利用了浓硫酸的____________性。
I.验证酸与金属及金属氧化物的反应:
(2)乙和丙同学在实验室利用锌、氧化铜、稀硫酸制取铜,两人分别写出了自己的实验原理,请你将表格内的空缺位置补充完整:
乙同学 丙同学
实验原理 第一步: 第一步:__________________。
第二步:________________。 第二步:
通过乙、丙同学的实验,得出酸的化学性质为________________。
Ⅱ.验证酸与碱的反应:
(3)室温下,丁同学将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度传感器测出烧杯中溶液温度变化的曲线如图所示。
请解释AB段温度变化的原因________________,B点的溶质为_______________。
19.化学学习小组在实验室进行关于气体的实验,所用的部分仪器如图 1 所示。
(1)甲同学选用装置 A 制取氧气,发生反应的方程式是_______,为得到较纯净的氧气 可选择的收集装置是________。
(2)乙同学选用装置 B 加热固体混合物制取氧气,反应方程式是_________。若用装置 F收集氧气,导管口__________(填“a”或“b”)连接发生装置。
(3)丙同学选用图 2 装置制取二氧化碳,与 A 装置相比,它的优点是________。图中所 示的状态表示反应处于________(填“发生”或“停止”)的状态。
(4)实验室常用加热氯化铵与熟石灰固体来制取氨气。常温下 NH3 是一种无色、有刺激 性气味的气体,密度比空气小,极易溶于水,对人体特别是黏膜组织有腐蚀作用。
①写出制取氨气的反应化学方程式__________。
②干燥时不能选用下列干燥剂中的__________。
A.固体氢氧化钠 B.浓硫酸 C.生石灰
③某同学用图 3 的 G、H、I 组合收集氨气。I 装置用于吸收多余的氨气,发生化合反应生成铵盐。写出 I 装置中发生的化学方程式__________。
五、计算题
20.长期使用的烧水壶底有一层水垢,主要成分是碳酸钙和氢氧化镁,用酸可以除去。某同学要通过实验测定水垢中碳酸钙的质量分数:取12.5g水垢样品研成粉末状,加入足量的稀盐酸,将产生的气体通入足量浓氢氧化钠溶液中充分吸收,测得氢氧化钠溶液质量增加4.4g。
(1)将水垢样品研成粉末状的原因是___________。
(2)计算水垢中碳酸钙的质量分数(写出计算过程)。
参考答案:
1.C 2.A 3.C 4.C 5.D 6.C 7.D 8.B 9.B 10.C 11.B 12.B
13. 量取 搅拌,使热量及时的扩散 灭 23.3g
14.(1)吸附
(2)分子在不断运动
(3)金刚石硬度大
(4)氮气的化学性质稳定
(5)
15. 碳酸钙/CaCO3 用稀盐酸清洗
16. NaOH Na2CO3 CaO+H2O=Ca(OH)2 红棕色固体逐渐减少至消失,溶液由无色变成黄色
17. CO2 复分解反应 Cu+2AgNO3=Cu(NO3)2+2Ag 除铁锈
18. 吸水 能与活动性较强的金属(氢前金属)反应,能与金属氧化物反应 氢氧化钠与盐酸反应时放出热量,随着反应的进行,反应放出的热量增加,溶液温度升高 氯化钠和氢氧化钠(或NaCl和NaOH)
19. 2H2O2 2H2O + O2↑ C 2KMnO4 K2MnO4 + MnO2 + O2↑ a 可以控制反应的发生和停止 发生 Ca(OH)2 + 2NH4Cl CaCl2 + 2H2O + 2NH3↑ B 2NH3 + H2SO4 = (NH4)2SO4
20.(1)增大反应物之间的接触面积,加快反应速率
(2)氢氧化钠溶液增加的质量即为水垢与稀盐酸反应生成的二氧化碳的质量;氢氧化钠溶液质量增加4.4g,因此生成的二氧化碳的质量为4.4g;
设水垢中碳酸钙的质量为x
水垢中碳酸钙的质量分数为:
答:水垢中碳酸钙的质量分数为80%
一、单选题
1.某课外兴趣小组的同学,通过实验测定浓硫酸吸水性的有关数据,绘制成下图的函数图像,其中横坐标表示时间,纵坐标可以表示:①溶质的质量分数;②溶液的质量;③溶液的体积;④溶液中所含水的质量.其中正确的是
A.①② B.②③ C.②③④ D.①②③④
2.下列关于盐酸、硫酸的叙述正确的是
A.打开浓盐酸试剂瓶瓶塞,瓶口冒白雾
B.浓盐酸敞口放置后,其溶质质量分数增大
C.浓硫酸具有脱水性,故能做干燥剂
D.浓硫酸溶于水时会吸热
3.下列关于溶液的说法中,正确的是( )
A.硝酸铵固体溶于水放出热量,使溶液温度明显升高
B.蔗糖溶液上半部分的甜度比下半部分的甜度低
C.稀硫酸能导电,因为溶液中有较多自由移动的离子
D.硝酸钾饱和溶液在任何条件下都不能再溶解硝酸钾
4.推理是化学学习中常用的思维方法,下列推理正确的是
A.酸溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的溶液一定是酸溶液
B.同种元素的粒子质子数相同,所以质子数相同的粒子一定是同种元素
C.化合物是由不同种元素组成,所以由同种元素组成的物质一定不是化合物
D.锌粒和稀硫酸反应会产生氢气,所以能和稀硫酸反应产生气体的物质一定是金属
5.下列关于浓硫酸的描述正确的是( )
A.有脱水性可以作干燥剂
B.与铁反应生成硫酸亚铁和氢气
C.有吸水性可以用来干燥氨气
D.稀释浓硫酸时,切不可将水倒进浓硫酸中
6.下列有关实验设计方案或实验事实的叙述错误的是( )
A.打开盛有浓盐酸的试剂瓶瓶盖,瓶口上方出现大量白雾
B.红磷在空气中燃烧产生大量的白烟
C.用干燥的红色石蕊试纸检验氨气时,试纸会变为蓝色
D.向氯化钙溶液中通入二氧化碳不会出现大量白色沉淀
7.推理是学习化学常用的思维方法,下列推理正确的是
A.化学变化中原子不能再分,所以化学变化中分子也不能再分
B.洗涤剂除油污的原理是乳化,所以氢氧化钠除油污的原理也是乳化
C.碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐
D.化合物是由不同种元素组成的物质,所以由同种元素组成的物质一定不是化合物
8.下列实验现象描述正确的是
A.红磷在空气中燃烧产生大量白色烟雾 B.铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
C.打开盛有浓盐酸的试剂瓶,瓶口有白烟出现 D.将肥皂水加入硬水中振荡,泡沫丰富
9.现有18.6g NaOH与Na2CO3的固体混合物,测得其中钠元素与碳元素的质量比为23:3。在室温下,将该混合物与100g稀硫酸混合,恰好完全反应,所得不饱和溶液的质量为114.2g,则原固体混合物中含有钠元素的质量为
A.2.3g B.9.2g C.4.6g D.6.9g
10.下列有关生活常识的说法中,正确的是( )
A.发现家里煤气泄露时,立即打开排气扇
B.用工业酒精兑制白酒
C.用食醋除去水壶中的水垢
D.用铁桶配制农药波尔多液
11.下列现象描述错误的是
A.打开盛有浓盐酸的试剂瓶瓶盖,出现白雾
B.CO2通入紫色石蕊溶液,溶液变蓝
C.将浓硫酸滴到白纸上,白纸变黑
D.铁丝在氧气中剧烈燃烧,火星四射,产生黑色固体
12.要使如图装置中的小气球鼓起来,则使用的固体和液体可以是:①生石灰和水②硝酸铵和水③氯化钠和水④氢氧化钠和稀硫酸⑤硝酸钾和水
A.①② B.①④ C.②⑤ D.③④
二、填空题
13.为了探究溶液导电性与离子浓度的关系,某课题小组设计了如下实验:取一定质量Ba(OH)2溶液做导电性实验,往烧杯中滴加9.8%稀硫酸、装置如图1.测得溶液导电强度如图2所示。
(1)用98%的浓硫酸配制9.8%稀硫酸,步骤为:计算、________、稀释、装瓶贴标签;稀释时用到玻璃棒,其作用为:________。
(2)往烧杯中滴加稀硫酸的过程中,观察到灯泡变化:亮→暗→________→亮,还可观察到的现象有白色沉淀生成。
(3)最终生成沉淀的质量是多少?________
14.化学就在我们身边,它能改变我们的生活。请用学过的化学知识解释下列问题:
(1)利用活性炭可将红糖脱色成白糖,是因为活性炭有_______性;
(2)免洗手凝胶消毒剂携带方便,使用时会闻到酒精的气味,是因为_______。
(3)金刚石可用于裁玻璃,是因为_______。
(4)可将氮气充入食品包装袋用于防腐,是因为_______。
(5)保存中药材常用生石灰防潮,其原理是________。(用化学方程式表示)
15.长期盛放澄清石灰水的试剂瓶内壁往往附着一层白色固体。这层白色固体的主要成分是___________;石灰水用完以后,除去此白色固体的方法是___________,写出反应的化学方程式___________。
三、推断题
16.如图是初中化学常见六种物质之间的关系图。(物质是溶液的只考虑溶质)图中用“一”表示两端的物质能发生化学反应,“→”表示一种物质可以转化为另一种物质(部分反应物或生成物及反应条件已略去)。A与B两溶液可以发生中和反应生成一种厨房中常用的调味剂,C在农业上可用来配制波尔多液,D可用于制玻璃,请回答下列问题:
(1)请分别写出下列物质的化学式(或溶质的化学式):
B___;D___。
(2)写出E转化为C的化学方程式___。
(3)若F为铁锈的主要成分,写出F与足量A反应的实验现象___。
17.A-I是初中化学所学的物质,其转化关系如图所示,按单质、氧化物、酸、碱、盐分类,A、B、D、E、F是不同类别的物质,C、G、B、I、F也是不同类别的物质;A、B、C中含有同种元素,B是导致“温室效应”的一种气体,I是一种蓝色絮状沉淀,图中“一”表示两端的物质能发生化学反应,“→”表示物质间存在相应的转化关系(部分反应物、生成物和反应条件未标出)。请回答:
(1)物质B的化学式:______;
(2)反应②基本反应类型是______;
(3)反应①的化学方程式是______;
(4)物质F的用途______。
四、实验题
18.某学习小组在学习了酸的性质后,为验证酸的性质做了如下实验:
(1)甲同学在收集干燥的氧气时,将氧气通过浓硫酸,利用了浓硫酸的____________性。
I.验证酸与金属及金属氧化物的反应:
(2)乙和丙同学在实验室利用锌、氧化铜、稀硫酸制取铜,两人分别写出了自己的实验原理,请你将表格内的空缺位置补充完整:
乙同学 丙同学
实验原理 第一步: 第一步:__________________。
第二步:________________。 第二步:
通过乙、丙同学的实验,得出酸的化学性质为________________。
Ⅱ.验证酸与碱的反应:
(3)室温下,丁同学将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度传感器测出烧杯中溶液温度变化的曲线如图所示。
请解释AB段温度变化的原因________________,B点的溶质为_______________。
19.化学学习小组在实验室进行关于气体的实验,所用的部分仪器如图 1 所示。
(1)甲同学选用装置 A 制取氧气,发生反应的方程式是_______,为得到较纯净的氧气 可选择的收集装置是________。
(2)乙同学选用装置 B 加热固体混合物制取氧气,反应方程式是_________。若用装置 F收集氧气,导管口__________(填“a”或“b”)连接发生装置。
(3)丙同学选用图 2 装置制取二氧化碳,与 A 装置相比,它的优点是________。图中所 示的状态表示反应处于________(填“发生”或“停止”)的状态。
(4)实验室常用加热氯化铵与熟石灰固体来制取氨气。常温下 NH3 是一种无色、有刺激 性气味的气体,密度比空气小,极易溶于水,对人体特别是黏膜组织有腐蚀作用。
①写出制取氨气的反应化学方程式__________。
②干燥时不能选用下列干燥剂中的__________。
A.固体氢氧化钠 B.浓硫酸 C.生石灰
③某同学用图 3 的 G、H、I 组合收集氨气。I 装置用于吸收多余的氨气,发生化合反应生成铵盐。写出 I 装置中发生的化学方程式__________。
五、计算题
20.长期使用的烧水壶底有一层水垢,主要成分是碳酸钙和氢氧化镁,用酸可以除去。某同学要通过实验测定水垢中碳酸钙的质量分数:取12.5g水垢样品研成粉末状,加入足量的稀盐酸,将产生的气体通入足量浓氢氧化钠溶液中充分吸收,测得氢氧化钠溶液质量增加4.4g。
(1)将水垢样品研成粉末状的原因是___________。
(2)计算水垢中碳酸钙的质量分数(写出计算过程)。
参考答案:
1.C 2.A 3.C 4.C 5.D 6.C 7.D 8.B 9.B 10.C 11.B 12.B
13. 量取 搅拌,使热量及时的扩散 灭 23.3g
14.(1)吸附
(2)分子在不断运动
(3)金刚石硬度大
(4)氮气的化学性质稳定
(5)
15. 碳酸钙/CaCO3 用稀盐酸清洗
16. NaOH Na2CO3 CaO+H2O=Ca(OH)2 红棕色固体逐渐减少至消失,溶液由无色变成黄色
17. CO2 复分解反应 Cu+2AgNO3=Cu(NO3)2+2Ag 除铁锈
18. 吸水 能与活动性较强的金属(氢前金属)反应,能与金属氧化物反应 氢氧化钠与盐酸反应时放出热量,随着反应的进行,反应放出的热量增加,溶液温度升高 氯化钠和氢氧化钠(或NaCl和NaOH)
19. 2H2O2 2H2O + O2↑ C 2KMnO4 K2MnO4 + MnO2 + O2↑ a 可以控制反应的发生和停止 发生 Ca(OH)2 + 2NH4Cl CaCl2 + 2H2O + 2NH3↑ B 2NH3 + H2SO4 = (NH4)2SO4
20.(1)增大反应物之间的接触面积,加快反应速率
(2)氢氧化钠溶液增加的质量即为水垢与稀盐酸反应生成的二氧化碳的质量;氢氧化钠溶液质量增加4.4g,因此生成的二氧化碳的质量为4.4g;
设水垢中碳酸钙的质量为x
水垢中碳酸钙的质量分数为:
答:水垢中碳酸钙的质量分数为80%
