北京市一六一中学2022-2023学年高二下学期4月月考化学试题(含答案)
文档属性
| 名称 | 北京市一六一中学2022-2023学年高二下学期4月月考化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 11:58:41 | ||
图片预览



文档简介
北京市一六一中学2022-2023学年高二下学期4月月考
化学
班级__________姓名__________学号__________
本试卷共5页,共100分。考试时长90分钟。考生务必将答案写在答题纸上,在试卷上作答无效。
一、选择题:本大题共20道小题,每小题2分,共40分。在每小题给出的四个选项中,只有一项符合题目的要求。把正确答案涂写在答题卡上相应的位置。
可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 N 14 Fe 56 Mn 55 S 32 Na 23 Cr 52 I 127
1.下列化学用语不正确的是( )
A.甲烷的球棍模型: B.乙烯的空间填充模型:
C.乙酸的分子式: D.乙烯的实验式
2.下列说法不正确的是( )
A.和互为同位素 B.金刚石和石墨互为同素异形体
C.乙醇的结构简式: D.和互为同分异构体
3.关于和的说法中,正确的是( )
A.和上都没有孤电子对
B.和都是杂化
C.分子中含有极性共价键,是极性分子
D.的空间结构是直线型,的空间结构是Ⅴ型
4.下列说法正确的是( )
A.原子的电子排布式:
B.同一原子中,2p、3p、4p能级的轨道数依次增多
C.基态碳原子电子排布式违反了洪特规则
D.电子云图中的小黑点越密,表示该原子核外空间的电子越多
5.元素周期表中铬元素的数据见图。下列说法中,不正确的是( )
A.铬元素位于第四周期ⅥB族 B.铬原子的价层电子排布式是
C.铬原子第3能层有5个未成对电子 D.的第一电离能小于的第一电离能
6.a、b、c、d均为短周期元素,原子序数依次增大,其基态原子的结构特点如下:a最高能级的电子占据3个轨道,且自旋平行;b的最外层电子数是其电子层数的3倍;c有2个末成对电子;d的核外电子总数是其最外层电子数的3倍。下列说法错误的是( )
A.电负性: B.原子半径:
C.第一电离能: D.简单气态氢化物的稳定性:
7.氰气的化学式为,结构式为,其性质与卤素气体单质相似,氰气可用于有机合成、制农药,也可用作消毒、杀虫的熏蒸剂等。下列叙述正确的是( )
A.氰气分子中键的键长大于键的键长
B.1个氰气分子中含有3个键和4个键
C.不能与氢氧化钠溶液发生反应
D.在所有气体单质分子中,一定有键,可能有键
8.结合下表数据分析,下列关于乙醇、乙二醇的说法,不合理的是( )
物质 分子式 沸点 溶解性
乙醇 78.5 与水以任意比混溶
乙二醇 197.3 与水和乙醇以任意比混溶
A.二者的溶解性与其在水中能够形成氢键有关
B.可以采用蒸馏的方法将二者进行分离
C.丙三醇的沸点应该高于乙二醇的沸点
D.二者组成和结构相似,互为同系物
9.下列说法中正确的是( )
A.分子是三角雉形,这是因为原子是以杂化的结果
B.杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个杂化轨道
C.凡中心原子采取杂化的分子,其VSEPR模型都是四面体形
D.型的分子空间构型必为平面三角形
10.元素X、Y、Z和R在周期表中的位置如下图所示。R位于第四周期,X、Y、Z原子的最外层电子数之和为17。下列说法正确的是( )
A.X基态原子的核外电子排布式为
B.电负性:
C.的溶液的约等于1
D.还原性:
11.下列所述的粒子(均为36号以前的元素),按半径由大到小的顺序排列正确的是( )
①基态X原子的结构示意图为
②基态的价电子排布式为
③基态的轨道表示式为
④基态的最高能级的电子对数等于其最高能层的电子层数
A.②>③>① B.④>③>② C.③>②>④ D.④>②>③
12.以下事实中不能用“相似相溶”原理说明的是( )
A.易溶于水 B.易溶于中
C.可溶于水 D.难溶于苯中
13.下列现象不能用氢键解释的是( )
A.氨易液化 B.比分子更稳定
C.水在常温下呈液态 D.的沸点小于
14.下列各组物质性质的比较,结论正确的是( )
A.在水中的溶解度:
B.溶液酸性:
C.分子的极性:
D.沸点:>
15.下列各种烷烃进行一氯取代反应后,只能生成四种沸点不同的产物的是( )
A. B.
C. D.
16.叶蝉散对水稻叶蝉和飞虱具有较强的触杀作用,防效迅速,但残效不长。工业上用邻异丙基苯酚合成叶蝉散的过程如下,下列有关说法正确的是( )
A.邻异丙基苯酚的分子式是 B.叶蝉散分子中含有羧基
C.叶蝉散分子中有8种等效氢
D.邻异丙基苯酚与互为同系物
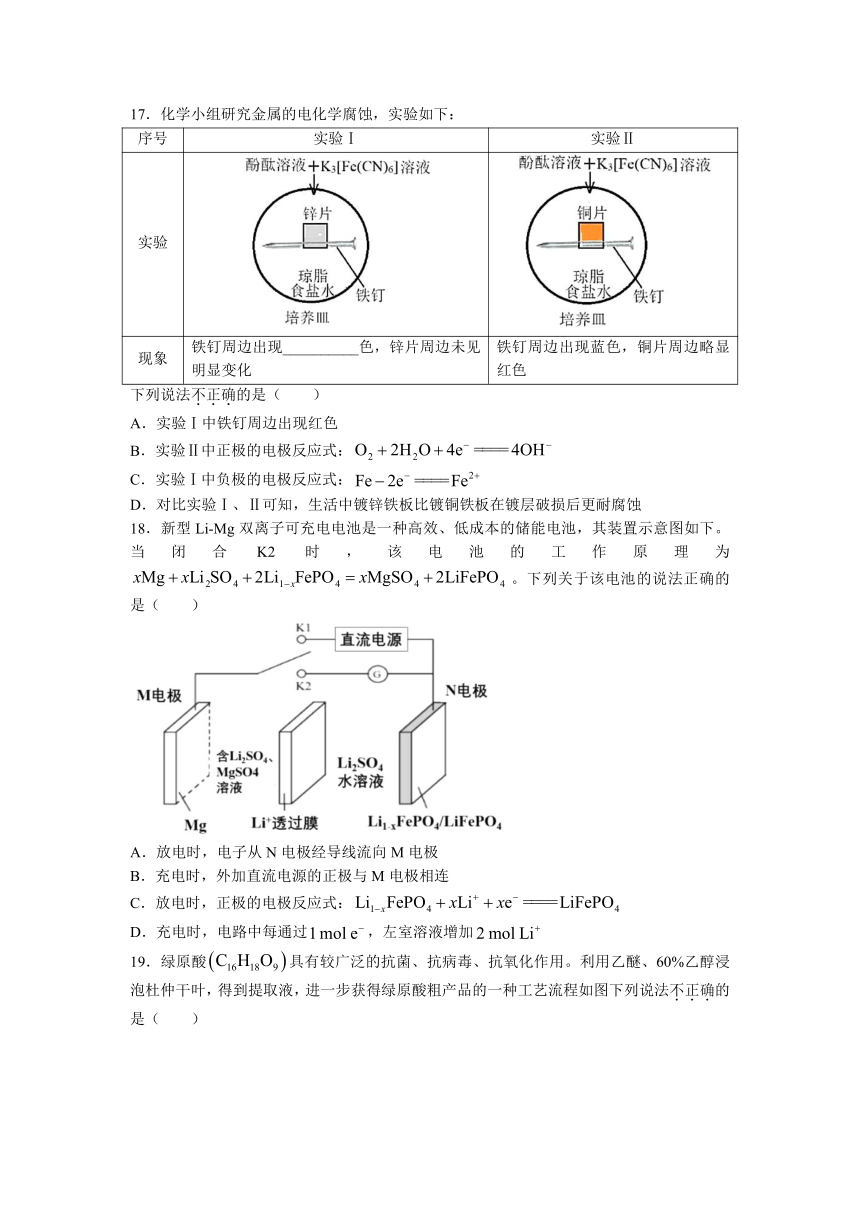
17.化学小组研究金属的电化学腐蚀,实验如下:
序号 实验Ⅰ 实验Ⅱ
实验
现象 铁钉周边出现__________色,锌片周边未见明显变化 铁钉周边出现蓝色,铜片周边略显红色
下列说法不正确的是( )
A.实验Ⅰ中铁钉周边出现红色
B.实验Ⅱ中正极的电极反应式:
C.实验Ⅰ中负极的电极反应式:
D.对比实验Ⅰ、Ⅱ可知,生活中镀锌铁板比镀铜铁板在镀层破损后更耐腐蚀
18.新型Li-Mg双离子可充电电池是一种高效、低成本的储能电池,其装置示意图如下。当闭合K2时,该电池的工作原理为。下列关于该电池的说法正确的是( )
A.放电时,电子从N电极经导线流向M电极
B.充电时,外加直流电源的正极与M电极相连
C.放电时,正极的电极反应式:
D.充电时,电路中每通过,左室溶液增加
19.绿原酸具有较广泛的抗菌、抗病毒、抗氧化作用。利用乙醚、60%乙醇浸泡杜仲干叶,得到提取液,进一步获得绿原酸粗产品的一种工艺流程如图下列说法不正确的是( )
A.得到有机层的实验操作为萃取、分液
B.减压蒸馏的目的是防止温度过高,绿原酸变质
C.绿原酸粗产品可以通过重结晶法进一步提纯
D.绿原酸在温水中的溶解度小于在冷水中的溶解度
20.某小组同学研究沉婝之间的转化,实验过程及现象如下。下列实验分析中说法不正确的是( )
已知:为白色固体;为黄色固体
序号 实验1 实验2 实验3
实验过程
实验现象 白色沉淀全部变为黄色 ,沉淀颜色仍为黄色 ,沉淀颜色变为乳白色 沉淀颜色仍为黄色
A.实验1中现象可推知,溶解度小于
B.实验2中现象可推知,溶液浓度能影响与沉淀的转化
C.实验3的目的,是为了排除高浓度可能对沉淀转化的影响
D.根据以上实验可知,沉淀转化总是向着溶解度更小的方向进行
二、非选择题:本大题共5小题,共60分。把答案填在答题纸中相应的横线上。
21.(6分)的资源化利用是解决温室效应的重要途径。科学家致力于与反应制的研究。
(1)分子中碳原子的杂化轨道类型为__________。
干冰是很好的致冷剂,干冰升华时,需要克服的作用力是__________。
(2)所含有的三种元素电负性从大到小的顺序为__________(用元素符号表示)。
(3)的沸点比高,主要原因是__________。
(4)被氧化为,继续被氧化可生成。分子的空间结构为__________,分子内键与键个数之比为__________。
22.(15分)大豆黄酮主要存在于大豆及其他豆科植物中。大豆黄酮是一种天然的有效活性成分,具有雌激素和抗雌激素作用、抗氧化作用、提高机体免疫力及影响内分泌系统等多种生物学功能。
(1)①大豆黄酮的结构简式如图所示,它的分子式是__________,分子中含有__________个苯环,分子中碳原子的杂化方式为__________。
②写出该有机物所含的所有官能团的名称:_____________________________。
(2)分子中含有30个氢原子的饱和链状烷烃的分子式为____________。
(3)某芳香族化合物分子式为,写出其结构中含有一个的同分异构的结构简式____________。
(4)写出分子式为且含有“”的所有同分异构体(不考虑立体异构)
____________________________________________________________________________________
(5)下列有机物:
① ② ③ ④ ⑤
⑥ ⑦ ⑧ ⑨ ⑩
(1)上述有机物中一定互为同系物的是__________(填字母)。
(2)上述有机物中一定互为同分异构体的是__________(填字母)。
23.(11分)是汽车尾气中的主要污染物,在汽车尾气系统中装配倠化转化器,可有效降低的排放。
(1)当尾气中空气不足时,(以为主)在萑化转化器中被还原成排出。
(1)基态碳原子中,电子占据最高能级的电子云轮廓图的形状是__________。
(2)氧的基态原子的轨道表示式为__________。
(3)C、N、O第一电离能由大到小顺序为__________,结合原子结构和价电子排布式解释排序原因__________。
(2)当尾气中空气过量时,催化转化器中的金属氧化物吸收生成盐。其吸收能力顺序如下:。
已知:镁、钙、锶、钡的部分电离能数据如下表所示。
无素 Mg Ca Sr Ba
电离能() 738 589.7 549 502.9
1451 1145 1064 965.2
7733 4910 a 3600
(1)推测Sr的第三电离能a的范围:__________。
(2)、、、对的吸收能力增强,从原子结构角度解释原因:____________________
________________________________________元素的金属性逐渐增强,金属氧化物对的吸收能力逐渐增强。
(3)研究作为脱硝催化剂的性能时发现:在上适当掺杂不同的金属氧化物如、、、、等有利于提高催化脱硝性能。
(1)基态Ⅴ原子的核外电子排布式为__________。
(2)若继续寻找使催化性能更好的掺杂金属氧化物,可以在元素周期表__________区寻找恰当元素(填序号)。
A.s B.p C.d D.ds
24.(15分)红矾钠可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含、、、、和),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
已知:i.溶液中存在以下平衡:
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 开始沉淀的pH 沉淀完全的pH
4.3 5.6
7.1 9.2
(1)Ⅰ中,溶液呈酸性,结合化学用语说明其原因:________________________________________
_______________________________________________________________________________________________
(2)Ⅱ中,加入调节至___________(填字母序号)。
a.4.3~5.6 b.4.3~7.1 c.5.6~7.1 d.7.1~9.2
(3)Ⅲ中,氧化沉淀的化学方程式为:____________________________________________
______________________________________________________________________________________________
(4)Ⅲ中,在投料比、反应时间均相同时,若温度过高,的产率反而降低,可能的原因是________
_______________________________________________________________________________________________
(5)Ⅳ中,加入的作用是____________________(结合平衡移动原理解释)。
(6)为了测定获得红矾钠的纯度,称取上述流程中的产品a g配成溶液,取出放于锥形 中,加入稀硫酸和足量的溶液,置于暗处充分反应至全部转化为后,滴入2~3滴淀粉溶液,最后用浓度为的标准溶液滴定,共消耗。(已知:)
①滴定终点的现象为______________________________________________
②所得(摩尔质量为)的纯度的表达式为:______________(用质量分数表示)。
(7)常温下
在化学分析中,以标准液滴定溶液中的时,可以采用上述步骤Ⅲ制得的为指示剂,利用与反应生成砖红色沉淀为指示滴定终点。可以通过定量计算解释可选择作为指示剂的原因:
当溶液中恰好沉淀完全时,此时溶液中__________,需达到__________可以出现砖红色沉淀。
25.(13分)某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 编号 电极A 溶液B 操作及现象
Ⅰ Fe 的 连接装置后,石墨表面产生无色气泡;电压表指针偏转
Ⅱ Cu 的 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是:________________________________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其理论判断依据是:________________________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是:__________________________________。
(2)同学们仍用上述装置并用和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响氧化性的因素。
编号 溶液B 操作及现象
Ⅲ 经煮沸的的 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b
Ⅳ 的 在石墨一侧缓慢通入并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓溶液混合后,插入电极,保持通入,电压表读数仍为c
Ⅴ 的NaOH 在石墨一侧缓慢通入并连接装置,电压表指针偏转,记录读数为d
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:,请解释原因:______________________________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究___________对氧化性的影响。
③实验Ⅳ中加入溶液的目的是______________________
④为达到丁同学的目的,经讨论,同学们认为应改用右图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是______________________;重复实验时,记录电压表读数依次为、,且,由此得出的结论是:____________________________________________________________________________________________。
高二化学参考答案
一、选择题:本大题共20道小题,每小题2分,共40分。
1 2 3 4 5 6 7 8 9 10
A D D C D C B D C D
11 12 13 14 15 16 17 18 19 20
C C B D B C C C D D
二、非选择题:本大题共5小题,共60分。
21.(每空1分,共6分)
(1)sp杂化 范徳华力
(2)
(3)分子间存在氢键
(4)平面三角形
22.(除特殊说明外,每个1分,共15分)
(1)① 2
②羟基,酮羰基,醚键 碳碳双键(每个0.5分)
(2)
(3)(每个1分)
(4)4种(略)(每个0.5分)
(5)① ①和②④ ③/⑥和②(1分) ② ②和⑤
23.(除特殊说明外,每个1分,共11分)
(1)①哑铃形
②
③;
C,N层数相同,但核电荷数,所以的原子核对电子吸引力强,失电子难,所以
原子的价电子排布式,p轨道为半充满状态,相对稳定,所以(2分)
(2)①
②Mg、Ca、Sr、Ba为同主族元素,随着原子序数增大,电子层数逐渐增多,原子半径逐渐增大,元素的金属性逐渐增强,金属氧化物对的吸收能力逐渐增强。(2分)
(3)① ②C、D(2分)
24.(15分)
(1)溶液中,同时存在和,的电离程度大于水解程度,,因此溶液呈酸性(2分)
(2)c(1分)
(3)(2分)
(4)温度过高,分解速率加快,导致浓度降低,产率降低(1分)
(5)加入后,增大,逆向移动,得到更多的(2分)
(6)①溶液蓝色褪去,且不变色(1分)
②(2分)
(7)(2分) (2分)
25.(13分)
(1)①(1分)
②在金属活动性顺序中,在后,不能置换出(1分) (2分)
(2)①浓度越大,其氧化性越强,使电压值增大(2分)
②溶液的酸碱性(1分)
③排除溶液中的(或)对实验的可能干扰(2分)
④排除在酸碱性不同的溶液中,其还原性不同对该实验结果的影响(2分)
溶液酸性越强,的氧化性越强(介质或环境的pH影响物质的氧化性)(2分)
化学
班级__________姓名__________学号__________
本试卷共5页,共100分。考试时长90分钟。考生务必将答案写在答题纸上,在试卷上作答无效。
一、选择题:本大题共20道小题,每小题2分,共40分。在每小题给出的四个选项中,只有一项符合题目的要求。把正确答案涂写在答题卡上相应的位置。
可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5 N 14 Fe 56 Mn 55 S 32 Na 23 Cr 52 I 127
1.下列化学用语不正确的是( )
A.甲烷的球棍模型: B.乙烯的空间填充模型:
C.乙酸的分子式: D.乙烯的实验式
2.下列说法不正确的是( )
A.和互为同位素 B.金刚石和石墨互为同素异形体
C.乙醇的结构简式: D.和互为同分异构体
3.关于和的说法中,正确的是( )
A.和上都没有孤电子对
B.和都是杂化
C.分子中含有极性共价键,是极性分子
D.的空间结构是直线型,的空间结构是Ⅴ型
4.下列说法正确的是( )
A.原子的电子排布式:
B.同一原子中,2p、3p、4p能级的轨道数依次增多
C.基态碳原子电子排布式违反了洪特规则
D.电子云图中的小黑点越密,表示该原子核外空间的电子越多
5.元素周期表中铬元素的数据见图。下列说法中,不正确的是( )
A.铬元素位于第四周期ⅥB族 B.铬原子的价层电子排布式是
C.铬原子第3能层有5个未成对电子 D.的第一电离能小于的第一电离能
6.a、b、c、d均为短周期元素,原子序数依次增大,其基态原子的结构特点如下:a最高能级的电子占据3个轨道,且自旋平行;b的最外层电子数是其电子层数的3倍;c有2个末成对电子;d的核外电子总数是其最外层电子数的3倍。下列说法错误的是( )
A.电负性: B.原子半径:
C.第一电离能: D.简单气态氢化物的稳定性:
7.氰气的化学式为,结构式为,其性质与卤素气体单质相似,氰气可用于有机合成、制农药,也可用作消毒、杀虫的熏蒸剂等。下列叙述正确的是( )
A.氰气分子中键的键长大于键的键长
B.1个氰气分子中含有3个键和4个键
C.不能与氢氧化钠溶液发生反应
D.在所有气体单质分子中,一定有键,可能有键
8.结合下表数据分析,下列关于乙醇、乙二醇的说法,不合理的是( )
物质 分子式 沸点 溶解性
乙醇 78.5 与水以任意比混溶
乙二醇 197.3 与水和乙醇以任意比混溶
A.二者的溶解性与其在水中能够形成氢键有关
B.可以采用蒸馏的方法将二者进行分离
C.丙三醇的沸点应该高于乙二醇的沸点
D.二者组成和结构相似,互为同系物
9.下列说法中正确的是( )
A.分子是三角雉形,这是因为原子是以杂化的结果
B.杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个杂化轨道
C.凡中心原子采取杂化的分子,其VSEPR模型都是四面体形
D.型的分子空间构型必为平面三角形
10.元素X、Y、Z和R在周期表中的位置如下图所示。R位于第四周期,X、Y、Z原子的最外层电子数之和为17。下列说法正确的是( )
A.X基态原子的核外电子排布式为
B.电负性:
C.的溶液的约等于1
D.还原性:
11.下列所述的粒子(均为36号以前的元素),按半径由大到小的顺序排列正确的是( )
①基态X原子的结构示意图为
②基态的价电子排布式为
③基态的轨道表示式为
④基态的最高能级的电子对数等于其最高能层的电子层数
A.②>③>① B.④>③>② C.③>②>④ D.④>②>③
12.以下事实中不能用“相似相溶”原理说明的是( )
A.易溶于水 B.易溶于中
C.可溶于水 D.难溶于苯中
13.下列现象不能用氢键解释的是( )
A.氨易液化 B.比分子更稳定
C.水在常温下呈液态 D.的沸点小于
14.下列各组物质性质的比较,结论正确的是( )
A.在水中的溶解度:
B.溶液酸性:
C.分子的极性:
D.沸点:>
15.下列各种烷烃进行一氯取代反应后,只能生成四种沸点不同的产物的是( )
A. B.
C. D.
16.叶蝉散对水稻叶蝉和飞虱具有较强的触杀作用,防效迅速,但残效不长。工业上用邻异丙基苯酚合成叶蝉散的过程如下,下列有关说法正确的是( )
A.邻异丙基苯酚的分子式是 B.叶蝉散分子中含有羧基
C.叶蝉散分子中有8种等效氢
D.邻异丙基苯酚与互为同系物
17.化学小组研究金属的电化学腐蚀,实验如下:
序号 实验Ⅰ 实验Ⅱ
实验
现象 铁钉周边出现__________色,锌片周边未见明显变化 铁钉周边出现蓝色,铜片周边略显红色
下列说法不正确的是( )
A.实验Ⅰ中铁钉周边出现红色
B.实验Ⅱ中正极的电极反应式:
C.实验Ⅰ中负极的电极反应式:
D.对比实验Ⅰ、Ⅱ可知,生活中镀锌铁板比镀铜铁板在镀层破损后更耐腐蚀
18.新型Li-Mg双离子可充电电池是一种高效、低成本的储能电池,其装置示意图如下。当闭合K2时,该电池的工作原理为。下列关于该电池的说法正确的是( )
A.放电时,电子从N电极经导线流向M电极
B.充电时,外加直流电源的正极与M电极相连
C.放电时,正极的电极反应式:
D.充电时,电路中每通过,左室溶液增加
19.绿原酸具有较广泛的抗菌、抗病毒、抗氧化作用。利用乙醚、60%乙醇浸泡杜仲干叶,得到提取液,进一步获得绿原酸粗产品的一种工艺流程如图下列说法不正确的是( )
A.得到有机层的实验操作为萃取、分液
B.减压蒸馏的目的是防止温度过高,绿原酸变质
C.绿原酸粗产品可以通过重结晶法进一步提纯
D.绿原酸在温水中的溶解度小于在冷水中的溶解度
20.某小组同学研究沉婝之间的转化,实验过程及现象如下。下列实验分析中说法不正确的是( )
已知:为白色固体;为黄色固体
序号 实验1 实验2 实验3
实验过程
实验现象 白色沉淀全部变为黄色 ,沉淀颜色仍为黄色 ,沉淀颜色变为乳白色 沉淀颜色仍为黄色
A.实验1中现象可推知,溶解度小于
B.实验2中现象可推知,溶液浓度能影响与沉淀的转化
C.实验3的目的,是为了排除高浓度可能对沉淀转化的影响
D.根据以上实验可知,沉淀转化总是向着溶解度更小的方向进行
二、非选择题:本大题共5小题,共60分。把答案填在答题纸中相应的横线上。
21.(6分)的资源化利用是解决温室效应的重要途径。科学家致力于与反应制的研究。
(1)分子中碳原子的杂化轨道类型为__________。
干冰是很好的致冷剂,干冰升华时,需要克服的作用力是__________。
(2)所含有的三种元素电负性从大到小的顺序为__________(用元素符号表示)。
(3)的沸点比高,主要原因是__________。
(4)被氧化为,继续被氧化可生成。分子的空间结构为__________,分子内键与键个数之比为__________。
22.(15分)大豆黄酮主要存在于大豆及其他豆科植物中。大豆黄酮是一种天然的有效活性成分,具有雌激素和抗雌激素作用、抗氧化作用、提高机体免疫力及影响内分泌系统等多种生物学功能。
(1)①大豆黄酮的结构简式如图所示,它的分子式是__________,分子中含有__________个苯环,分子中碳原子的杂化方式为__________。
②写出该有机物所含的所有官能团的名称:_____________________________。
(2)分子中含有30个氢原子的饱和链状烷烃的分子式为____________。
(3)某芳香族化合物分子式为,写出其结构中含有一个的同分异构的结构简式____________。
(4)写出分子式为且含有“”的所有同分异构体(不考虑立体异构)
____________________________________________________________________________________
(5)下列有机物:
① ② ③ ④ ⑤
⑥ ⑦ ⑧ ⑨ ⑩
(1)上述有机物中一定互为同系物的是__________(填字母)。
(2)上述有机物中一定互为同分异构体的是__________(填字母)。
23.(11分)是汽车尾气中的主要污染物,在汽车尾气系统中装配倠化转化器,可有效降低的排放。
(1)当尾气中空气不足时,(以为主)在萑化转化器中被还原成排出。
(1)基态碳原子中,电子占据最高能级的电子云轮廓图的形状是__________。
(2)氧的基态原子的轨道表示式为__________。
(3)C、N、O第一电离能由大到小顺序为__________,结合原子结构和价电子排布式解释排序原因__________。
(2)当尾气中空气过量时,催化转化器中的金属氧化物吸收生成盐。其吸收能力顺序如下:。
已知:镁、钙、锶、钡的部分电离能数据如下表所示。
无素 Mg Ca Sr Ba
电离能() 738 589.7 549 502.9
1451 1145 1064 965.2
7733 4910 a 3600
(1)推测Sr的第三电离能a的范围:__________。
(2)、、、对的吸收能力增强,从原子结构角度解释原因:____________________
________________________________________元素的金属性逐渐增强,金属氧化物对的吸收能力逐渐增强。
(3)研究作为脱硝催化剂的性能时发现:在上适当掺杂不同的金属氧化物如、、、、等有利于提高催化脱硝性能。
(1)基态Ⅴ原子的核外电子排布式为__________。
(2)若继续寻找使催化性能更好的掺杂金属氧化物,可以在元素周期表__________区寻找恰当元素(填序号)。
A.s B.p C.d D.ds
24.(15分)红矾钠可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含、、、、和),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
已知:i.溶液中存在以下平衡:
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 开始沉淀的pH 沉淀完全的pH
4.3 5.6
7.1 9.2
(1)Ⅰ中,溶液呈酸性,结合化学用语说明其原因:________________________________________
_______________________________________________________________________________________________
(2)Ⅱ中,加入调节至___________(填字母序号)。
a.4.3~5.6 b.4.3~7.1 c.5.6~7.1 d.7.1~9.2
(3)Ⅲ中,氧化沉淀的化学方程式为:____________________________________________
______________________________________________________________________________________________
(4)Ⅲ中,在投料比、反应时间均相同时,若温度过高,的产率反而降低,可能的原因是________
_______________________________________________________________________________________________
(5)Ⅳ中,加入的作用是____________________(结合平衡移动原理解释)。
(6)为了测定获得红矾钠的纯度,称取上述流程中的产品a g配成溶液,取出放于锥形 中,加入稀硫酸和足量的溶液,置于暗处充分反应至全部转化为后,滴入2~3滴淀粉溶液,最后用浓度为的标准溶液滴定,共消耗。(已知:)
①滴定终点的现象为______________________________________________
②所得(摩尔质量为)的纯度的表达式为:______________(用质量分数表示)。
(7)常温下
在化学分析中,以标准液滴定溶液中的时,可以采用上述步骤Ⅲ制得的为指示剂,利用与反应生成砖红色沉淀为指示滴定终点。可以通过定量计算解释可选择作为指示剂的原因:
当溶液中恰好沉淀完全时,此时溶液中__________,需达到__________可以出现砖红色沉淀。
25.(13分)某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 编号 电极A 溶液B 操作及现象
Ⅰ Fe 的 连接装置后,石墨表面产生无色气泡;电压表指针偏转
Ⅱ Cu 的 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是:________________________________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其理论判断依据是:________________________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是:__________________________________。
(2)同学们仍用上述装置并用和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响氧化性的因素。
编号 溶液B 操作及现象
Ⅲ 经煮沸的的 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b
Ⅳ 的 在石墨一侧缓慢通入并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓溶液混合后,插入电极,保持通入,电压表读数仍为c
Ⅴ 的NaOH 在石墨一侧缓慢通入并连接装置,电压表指针偏转,记录读数为d
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:,请解释原因:______________________________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究___________对氧化性的影响。
③实验Ⅳ中加入溶液的目的是______________________
④为达到丁同学的目的,经讨论,同学们认为应改用右图装置对Ⅳ、Ⅴ重复进行实验,其设计意图是______________________;重复实验时,记录电压表读数依次为、,且,由此得出的结论是:____________________________________________________________________________________________。
高二化学参考答案
一、选择题:本大题共20道小题,每小题2分,共40分。
1 2 3 4 5 6 7 8 9 10
A D D C D C B D C D
11 12 13 14 15 16 17 18 19 20
C C B D B C C C D D
二、非选择题:本大题共5小题,共60分。
21.(每空1分,共6分)
(1)sp杂化 范徳华力
(2)
(3)分子间存在氢键
(4)平面三角形
22.(除特殊说明外,每个1分,共15分)
(1)① 2
②羟基,酮羰基,醚键 碳碳双键(每个0.5分)
(2)
(3)(每个1分)
(4)4种(略)(每个0.5分)
(5)① ①和②④ ③/⑥和②(1分) ② ②和⑤
23.(除特殊说明外,每个1分,共11分)
(1)①哑铃形
②
③;
C,N层数相同,但核电荷数,所以的原子核对电子吸引力强,失电子难,所以
原子的价电子排布式,p轨道为半充满状态,相对稳定,所以(2分)
(2)①
②Mg、Ca、Sr、Ba为同主族元素,随着原子序数增大,电子层数逐渐增多,原子半径逐渐增大,元素的金属性逐渐增强,金属氧化物对的吸收能力逐渐增强。(2分)
(3)① ②C、D(2分)
24.(15分)
(1)溶液中,同时存在和,的电离程度大于水解程度,,因此溶液呈酸性(2分)
(2)c(1分)
(3)(2分)
(4)温度过高,分解速率加快,导致浓度降低,产率降低(1分)
(5)加入后,增大,逆向移动,得到更多的(2分)
(6)①溶液蓝色褪去,且不变色(1分)
②(2分)
(7)(2分) (2分)
25.(13分)
(1)①(1分)
②在金属活动性顺序中,在后,不能置换出(1分) (2分)
(2)①浓度越大,其氧化性越强,使电压值增大(2分)
②溶液的酸碱性(1分)
③排除溶液中的(或)对实验的可能干扰(2分)
④排除在酸碱性不同的溶液中,其还原性不同对该实验结果的影响(2分)
溶液酸性越强,的氧化性越强(介质或环境的pH影响物质的氧化性)(2分)
同课章节目录
