7.2.1氨气课件(18张)2022-2023学年高一下学期化学苏教版(2019)必修第二册
文档属性
| 名称 | 7.2.1氨气课件(18张)2022-2023学年高一下学期化学苏教版(2019)必修第二册 |

|
|
| 格式 | zip | ||
| 文件大小 | 17.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 16:56:11 | ||
图片预览





文档简介
(共18张PPT)
专题七第二单元
重要的含氮化工原料
01
氨气
导入
弗利茨·哈伯——合成氨之父
德国化学家,第一个从空气中制造出氨的科学家,使人类从此摆脱了依靠天然氮肥的被动局面,加速了世界农业的发展,因此获得1918年诺贝尔化学奖。
“他是天使,为人类带来丰收和喜悦
是用空气制造面包的圣人”
N2+3H2 2NH3
一、氨气的物理性质
颜色 气味 溶解性 密度 特性-沸点
无色气体 刺激性气味 小于空气 -33.5℃易液化
极易溶于水,1体积水大约能溶解700体积的氨气
水枪喷淋处理
喷泉实验
液态氨汽化时要吸收大量的热,使周围的温度急剧下降,所以液态氨在工业上常用来作制冷剂。
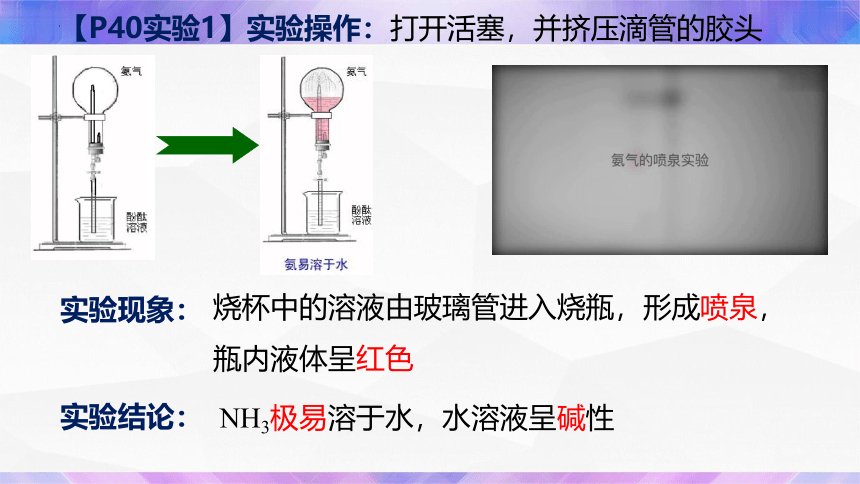
【P40实验1】实验操作:打开活塞,并挤压滴管的胶头
实验现象:
烧杯中的溶液由玻璃管进入烧瓶,形成喷泉,瓶内液体呈红色
实验结论:
NH3极易溶于水,水溶液呈碱性
思考
1.溶液为什么呈红色?
NH 3+H2O NH 3·H 2O
NH 3·H 2O NH4 ++OH-
氨水具有弱碱性,
能使酚酞溶液变红色(或使湿润的红色石蕊试纸变蓝色)。
思考
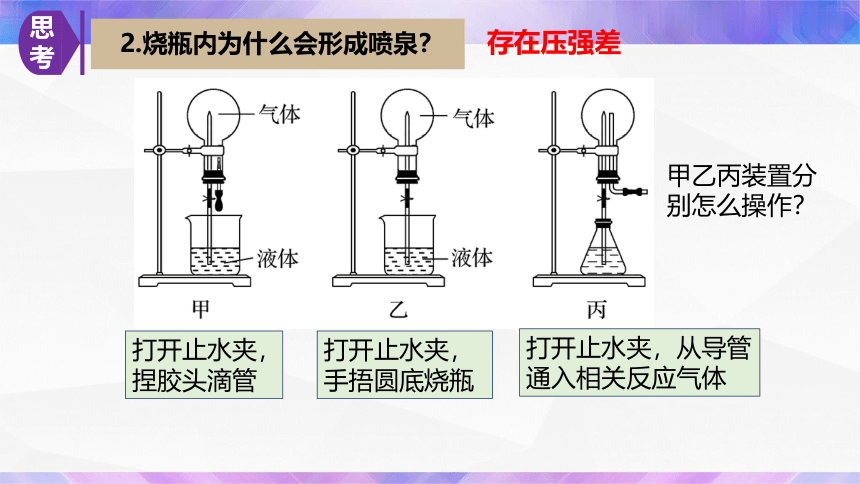
2.烧瓶内为什么会形成喷泉?
存在压强差
打开止水夹,捏胶头滴管
打开止水夹,手捂圆底烧瓶
打开止水夹,从导管通入相关反应气体
甲乙丙装置分别怎么操作?
3.氨气的喷泉实验成功的关键是什么?
(1)装置的气密性良好。
(2)圆底烧瓶要保持干燥。
(3)圆底烧瓶内要充满气体。
(4)烧杯内装入足量的水,以防止因水量不足而造成喷泉停止或不发生。
思考
4.喷泉实验的试剂可以是哪些?
气体
吸收剂
HCl
水或NaOH溶液
NH3
水或盐酸
CO2、Cl2、SO2、H2S
NaOH溶液
NO2与O2
水
思考
二、氨气的化学性质
1.与水反应
一水合氨不稳定:NH3·H2O = NH3↑+ H2O
NH3+H2O
NH3·H2O(一水合氨)
拓展
氨气:高中阶段唯一的一种碱性气体
它溶于水所得的溶液叫氨水
1.NH3·H2O化学式不能写成NH4OH。
2.易挥发,不稳定,易分解。保存:使用棕色试剂瓶,避光密封。
3.检验方法:能使湿润的红色石蕊试纸变蓝。
思考:氨水作氮肥的优缺点?
优缺点:用氨水作氮肥,成本较低,氨水对眼睛、呼吸道等有强烈的刺激作用,贮存、运输和施用的要求也比较高。
氨水与液氨有何区别?
纯净物
混合物
NH3分子
NH3、NH3·H2O、H2O、NH4+、OH-、H+
不具有碱性
具有碱的通性,受热易分解
常温常压下不存在
常温常压下可存在
2.NH3与酸反应
实验现象:浓氨水挥发出来的NH3 与浓盐酸会发出的HCl相遇形_____
白烟
NH3 + HCl = NH4Cl (白烟)
反应方程式:
氨几乎能与所有的酸(难溶性酸如H2SiO3除外)反应生成盐,如:
NH3 + HCl === NH4Cl
NH3 + HNO3 === NH4NO3
2NH3 + H2SO4 === (NH4)2SO4
本质:NH3+H+===NH4 +
应用:可检验NH3或HCl
是不是所有的酸与氨反应,都能产生白烟?
不是。只有挥发性的酸与氨气反应,才产生白烟,如浓盐酸,浓硝酸。
氨气与酸反应生成铵盐,铵盐大多是无色晶体,运输、储存比较方便,并且都能溶于水,易于被农作物吸收。固态氮肥已经代替了氨水,成为目前使用最广泛的化肥。
3. NH 3与氧气反应
NH3
-3
4NH3(g) + 5O2(g) 4NO(g) + 6H2O(l) ΔH= -904 kJ·mol-1
处于最低价态,因此NH3具有还原性
这个反应叫氨的催化氧化,是工业上制硝酸的基础。
三、氨气的用途
课堂小结
作业布置
1.完成配套练习册到P48
2.导学案7.2.1课后练习
3.预习7.2.2
反应物质 反应现象 变化原因
酚酞溶液
FeCl3溶液
湿润的 红色石蕊试纸
浓盐酸
溶液由无色变为红色
产生红褐色沉淀
有白烟生成
变蓝
3NH3·H2O+Fe3+
=Fe(OH)3↓+3NH4+
NH3·H2O NH4++OH-
NH3 + HCl = NH4Cl (白烟)
NH3·H2O NH4++OH-
1.根据氨气的性质,试着写出下列实验的现象以及原因。
课堂练习
补充:过量氨水与AlCl3反应的离子方程式:
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
2.利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
(1)若要在烧瓶Ⅰ中产生“红色喷泉”,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是__ __ __。
(2)若要烧瓶Ⅱ中产生“蓝色喷泉”,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是____________________________________。
(3)若关闭b活塞,打开a、c活塞,再挤压胶头滴管,在烧瓶中可观察到的现象是____________________。
(4)若要在该装置中产生“红蓝双色喷泉”现象,其操作方法是_________________________。
打开b、c活塞,再用热毛巾捂热烧瓶Ⅰ
先打开a、b活塞,再挤压胶头滴管
烧瓶Ⅱ中导管口处产生白烟
先打开a、c活塞,再挤压胶头滴管,片刻后,再打开b活塞
3.某化学兴趣小组利用下列图示装置探究氨气的性质。
(1)①中湿润的红色石蕊试纸变蓝;说明氨气水溶液呈_____性,化学方程式为________________________________。
(2)向②中滴入浓盐酸,现象为__________,反应的化学方程式:______________________________________。
(3)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧化的方程式_______________________,该反应为_______ (填“吸热”或“放热”)反应,锥形瓶中出现白烟,该物质的化学式为_________,瓶中红棕色气体为________(填化学式)。
碱
NH 3+H2O NH 3·H 2O
产生白烟
NH3+HCl ===NH4Cl
4NH3+ 5O2 4NO+ 6H2O
放热
NH4NO3
NO2
专题七第二单元
重要的含氮化工原料
01
氨气
导入
弗利茨·哈伯——合成氨之父
德国化学家,第一个从空气中制造出氨的科学家,使人类从此摆脱了依靠天然氮肥的被动局面,加速了世界农业的发展,因此获得1918年诺贝尔化学奖。
“他是天使,为人类带来丰收和喜悦
是用空气制造面包的圣人”
N2+3H2 2NH3
一、氨气的物理性质
颜色 气味 溶解性 密度 特性-沸点
无色气体 刺激性气味 小于空气 -33.5℃易液化
极易溶于水,1体积水大约能溶解700体积的氨气
水枪喷淋处理
喷泉实验
液态氨汽化时要吸收大量的热,使周围的温度急剧下降,所以液态氨在工业上常用来作制冷剂。
【P40实验1】实验操作:打开活塞,并挤压滴管的胶头
实验现象:
烧杯中的溶液由玻璃管进入烧瓶,形成喷泉,瓶内液体呈红色
实验结论:
NH3极易溶于水,水溶液呈碱性
思考
1.溶液为什么呈红色?
NH 3+H2O NH 3·H 2O
NH 3·H 2O NH4 ++OH-
氨水具有弱碱性,
能使酚酞溶液变红色(或使湿润的红色石蕊试纸变蓝色)。
思考
2.烧瓶内为什么会形成喷泉?
存在压强差
打开止水夹,捏胶头滴管
打开止水夹,手捂圆底烧瓶
打开止水夹,从导管通入相关反应气体
甲乙丙装置分别怎么操作?
3.氨气的喷泉实验成功的关键是什么?
(1)装置的气密性良好。
(2)圆底烧瓶要保持干燥。
(3)圆底烧瓶内要充满气体。
(4)烧杯内装入足量的水,以防止因水量不足而造成喷泉停止或不发生。
思考
4.喷泉实验的试剂可以是哪些?
气体
吸收剂
HCl
水或NaOH溶液
NH3
水或盐酸
CO2、Cl2、SO2、H2S
NaOH溶液
NO2与O2
水
思考
二、氨气的化学性质
1.与水反应
一水合氨不稳定:NH3·H2O = NH3↑+ H2O
NH3+H2O
NH3·H2O(一水合氨)
拓展
氨气:高中阶段唯一的一种碱性气体
它溶于水所得的溶液叫氨水
1.NH3·H2O化学式不能写成NH4OH。
2.易挥发,不稳定,易分解。保存:使用棕色试剂瓶,避光密封。
3.检验方法:能使湿润的红色石蕊试纸变蓝。
思考:氨水作氮肥的优缺点?
优缺点:用氨水作氮肥,成本较低,氨水对眼睛、呼吸道等有强烈的刺激作用,贮存、运输和施用的要求也比较高。
氨水与液氨有何区别?
纯净物
混合物
NH3分子
NH3、NH3·H2O、H2O、NH4+、OH-、H+
不具有碱性
具有碱的通性,受热易分解
常温常压下不存在
常温常压下可存在
2.NH3与酸反应
实验现象:浓氨水挥发出来的NH3 与浓盐酸会发出的HCl相遇形_____
白烟
NH3 + HCl = NH4Cl (白烟)
反应方程式:
氨几乎能与所有的酸(难溶性酸如H2SiO3除外)反应生成盐,如:
NH3 + HCl === NH4Cl
NH3 + HNO3 === NH4NO3
2NH3 + H2SO4 === (NH4)2SO4
本质:NH3+H+===NH4 +
应用:可检验NH3或HCl
是不是所有的酸与氨反应,都能产生白烟?
不是。只有挥发性的酸与氨气反应,才产生白烟,如浓盐酸,浓硝酸。
氨气与酸反应生成铵盐,铵盐大多是无色晶体,运输、储存比较方便,并且都能溶于水,易于被农作物吸收。固态氮肥已经代替了氨水,成为目前使用最广泛的化肥。
3. NH 3与氧气反应
NH3
-3
4NH3(g) + 5O2(g) 4NO(g) + 6H2O(l) ΔH= -904 kJ·mol-1
处于最低价态,因此NH3具有还原性
这个反应叫氨的催化氧化,是工业上制硝酸的基础。
三、氨气的用途
课堂小结
作业布置
1.完成配套练习册到P48
2.导学案7.2.1课后练习
3.预习7.2.2
反应物质 反应现象 变化原因
酚酞溶液
FeCl3溶液
湿润的 红色石蕊试纸
浓盐酸
溶液由无色变为红色
产生红褐色沉淀
有白烟生成
变蓝
3NH3·H2O+Fe3+
=Fe(OH)3↓+3NH4+
NH3·H2O NH4++OH-
NH3 + HCl = NH4Cl (白烟)
NH3·H2O NH4++OH-
1.根据氨气的性质,试着写出下列实验的现象以及原因。
课堂练习
补充:过量氨水与AlCl3反应的离子方程式:
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
2.利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
(1)若要在烧瓶Ⅰ中产生“红色喷泉”,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是__ __ __。
(2)若要烧瓶Ⅱ中产生“蓝色喷泉”,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是____________________________________。
(3)若关闭b活塞,打开a、c活塞,再挤压胶头滴管,在烧瓶中可观察到的现象是____________________。
(4)若要在该装置中产生“红蓝双色喷泉”现象,其操作方法是_________________________。
打开b、c活塞,再用热毛巾捂热烧瓶Ⅰ
先打开a、b活塞,再挤压胶头滴管
烧瓶Ⅱ中导管口处产生白烟
先打开a、c活塞,再挤压胶头滴管,片刻后,再打开b活塞
3.某化学兴趣小组利用下列图示装置探究氨气的性质。
(1)①中湿润的红色石蕊试纸变蓝;说明氨气水溶液呈_____性,化学方程式为________________________________。
(2)向②中滴入浓盐酸,现象为__________,反应的化学方程式:______________________________________。
(3)将灼热的铂丝伸入③中锥形瓶,可观察到铂丝保持红热,有红棕色气体及少量白烟生成。该过程会同时发生多个反应,写出NH3和O2催化氧化的方程式_______________________,该反应为_______ (填“吸热”或“放热”)反应,锥形瓶中出现白烟,该物质的化学式为_________,瓶中红棕色气体为________(填化学式)。
碱
NH 3+H2O NH 3·H 2O
产生白烟
NH3+HCl ===NH4Cl
4NH3+ 5O2 4NO+ 6H2O
放热
NH4NO3
NO2
