江苏省泰州市姜堰区2022-2023学年高二下学期4月阶段测试(期中)化学试卷(PDF版含答案)
文档属性
| 名称 | 江苏省泰州市姜堰区2022-2023学年高二下学期4月阶段测试(期中)化学试卷(PDF版含答案) |

|
|
| 格式 | |||
| 文件大小 | 757.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 00:00:00 | ||
图片预览


文档简介
泰州市姜堰区2022—2023学年度高二阶段测试
(化学试卷)
考试时间:75分钟 总分:100分
可能用到的相对原子质量:H:1 C:12 O:16 F:19 Ce:140
一、单项选择题:共 14题,每题 3分,共 42分。每题只.有.一.个.选项最符合题意。
- +
1.下列措施能促进水的电离,并使 c(OH )>c(H )的是
A.向水中加入少量 NaCl B.将水加热煮沸
C.向水中加入少量 CH3COONa D.向水中加入少量 NH4NO3
2.次氯酸可以和丙烯发生加成反应 CH3CH=CH2+HClO→CH3CH(OH) CH2 Cl,以
CH3CH(OH) CH2Cl 为原料可以合成 CH3CH(OH) COOH,进一步合成新型降解材料聚乳酸。
下列化学用语表示正确的是
A.原子核内有8 个中子的碳原子: B.丙烯分子的球棍模型:
C.次氯酸的电子式: D.聚乳酸的结构简式:
3.向 N.aAlO2溶液中滴加适量 NaHCO3溶液可生成 Al(OH)3沉淀。下列说法正确的是 r (O2- 3+A. 半径大小: )χ(Na) C 碱性强弱:NaOH<Al(OH)3 D. 电离能大小: I1(C)>I1(O) 4.下列有关物质的性质与用途具有对应关系的是 A.Al(OH)3具有两性,可用作塑料制品的阻燃剂 B.石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体
C.过氧乙酸具有强氧化性,可用于杀菌消毒
D.铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀
阅读下列资料,完成 5-7题:氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化
可以合成氨、氮的氧化物、硝酸等重要的化工原料;NO 能被 FeSO4溶液吸收生成配合物
[Fe(NO)(H2O)5]SO4,减少环境污染。
5.下列说法正确的是
A.自然固氮和人工固氮都是将 N2转化为 NH3
B.利用 HNO3的强氧化性与 NH3反应制备硝酸铵
C.常温下可用铝制容器盛装稀硝酸
D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
高二化学 第1页(共 7页)
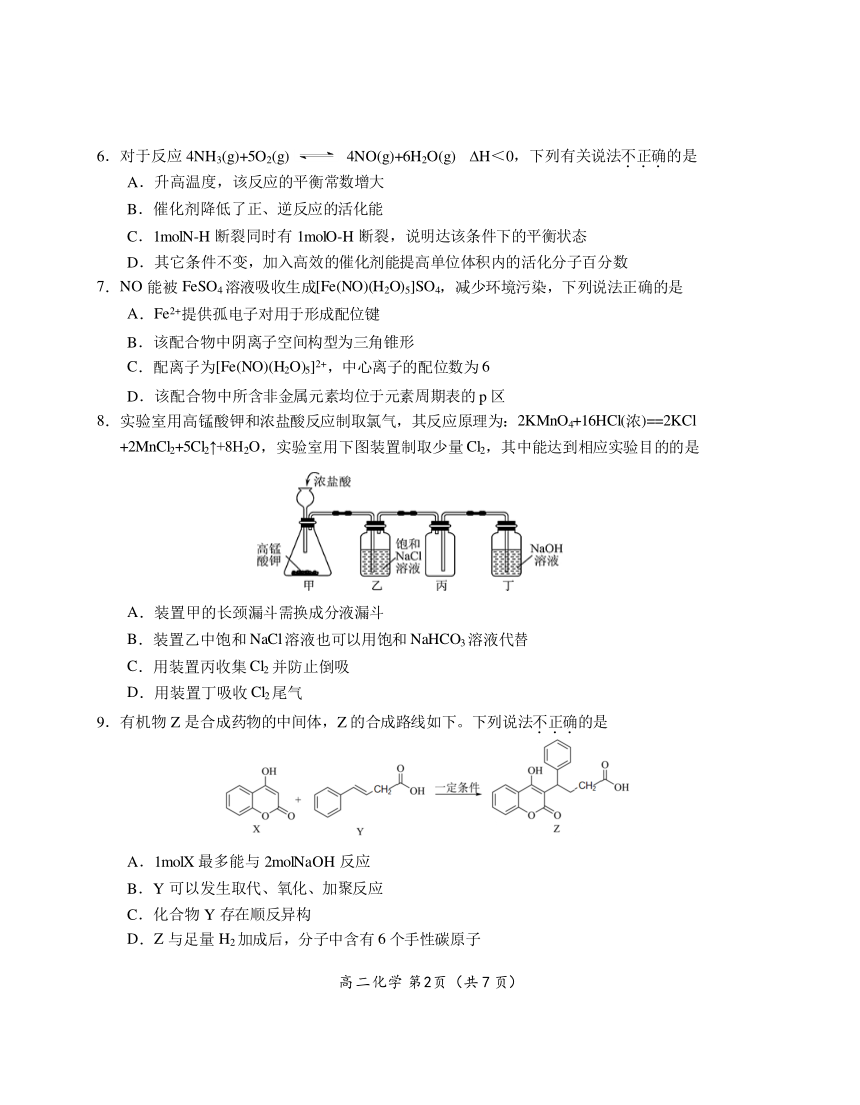
6.对于反应 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) H<0,下列有关说法不.正.确.的是
A.升高温度,该反应的平衡常数增大
B.催化剂降低了正、逆反应的活化能
C.1molN-H 断裂同时有 1molO-H 断裂,说明达该条件下的平衡状态
D.其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数
7.NO 能被 FeSO4溶液吸收生成[Fe(NO)(H2O)5]SO4,减少环境污染,下列说法正确的是
A.Fe2+提供孤电子对用于形成配位键
B.该配合物中阴离子空间构型为三角锥形
C.配离子为[Fe(NO)(H2O) ]2+5 ,中心离子的配位数为 6
D.该配合物中所含非金属元素均位于元素周期表的 p 区
8.实验室用高锰酸钾和浓盐酸反应制取氯气,其反应原理为:2KMnO4+16HCl(浓)==2KCl
+2MnCl2+5Cl2↑+8H2O,实验室用下图装置制取少量 Cl2,其中能达到相应实验目的的是
A.装置甲的长颈漏斗需换成分液漏斗
B.装置乙中饱和 NaCl溶液也可以用饱和 NaHCO3溶液代替
C.用装置丙收集 Cl2 并防止倒吸
D.用装置丁吸收 Cl2尾气
9.有机物 Z 是合成药物的中间体,Z 的合成路线如下。下列说法不.正.确.的是
A.1molX 最多能与 2molNaOH 反应
B.Y 可以发生取代、氧化、加聚反应
C.化合物 Y 存在顺反异构
D.Z 与足量 H2加成后,分子中含有 6 个手性碳原子
高二化学 第2页(共 7页)
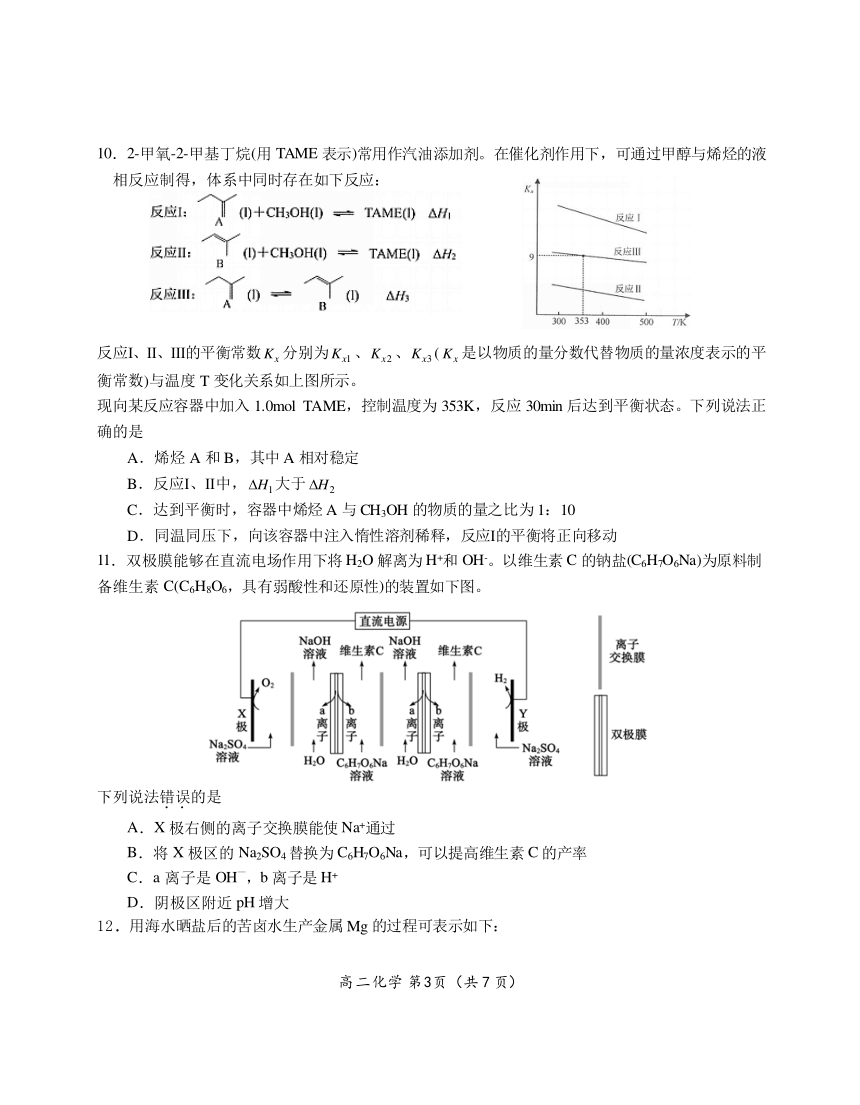
10.2-甲氧-2-甲基丁烷(用 TAME 表示)常用作汽油添加剂。在催化剂作用下,可通过甲醇与烯烃的液
相反应制得,体系中同时存在如下反应:
反应Ⅰ、Ⅱ、Ⅲ的平衡常数Kx 分别为Kx1 、Kx2 、Kx3 ( Kx 是以物质的量分数代替物质的量浓度表示的平
衡常数)与温度 T 变化关系如上图所示。
现向某反应容器中加入 1.0mol TAME,控制温度为 353K,反应 30min 后达到平衡状态。下列说法正
确的是
A.烯烃 A 和 B,其中 A 相对稳定
B.反应Ⅰ、Ⅱ中, H1大于 H2
C.达到平衡时,容器中烯烃 A 与 CH3OH 的物质的量之比为 1:10
D.同温同压下,向该容器中注入惰性溶剂稀释,反应Ⅰ的平衡将正向移动
11.双极膜能够在直流电场作用下将H2O 解离为 H+和 OH-。以维生素 C 的钠盐(C6H7O6Na)为原料制
备维生素 C(C6H8O6,具有弱酸性和还原性)的装置如下图。
下列说法错.误.的是
A.X 极右侧的离子交换膜能使 Na+通过
B.将 X 极区的 Na2SO4替换为 C6H7O6Na,可以提高维生素 C 的产率
—
C.a 离子是 OH ,b 离子是 H+
D.阴极区附近 pH 增大
12.用海水晒盐后的苦卤水生产金属 Mg 的过程可表示如下:
高二化学 第3页(共 7页)
熔融
苦卤水→Mg(OH)2→MgCl2(aq)→MgCl2(s)――→ Mg
电解
下列说法正确的是
A.工业上将苦卤水生成 Mg(OH)2(s)用氢氧化钠溶液
+ -
B.常温下,Mg(OH)2溶于盐酸所得 MgCl -142溶液中 c(H )·c(OH )>10
C.将 MgCl2·6H2O 晶体在 HCl 气流中蒸干可得到无水 MgCl2
D.电解熔融 MgCl2在阳极获得金属 Mg
13.利用烟道气中 SO2的生产 NaHSO3晶体的工艺流程如下所示。下列说法正确的是
SO2 Na2CO3固体 SO2
Na2CO3
Ⅰ Ⅱ Ⅲ 结晶脱水 NaHSO
饱和溶液 3
pH=4.1 pH=7~8 pH=4.1
- -
A.步骤 I 可得 NaHSO3溶液中有 c(OH )= c(H+)+c(SO 23 )+c(H2SO3)
B.步骤Ⅲ所得溶液中有 Ka1(H2SO3)·Ka2(H2SO3)- - - -
C.步骤Ⅱ中发生的反应为 HSO 2 23 +CO3 = SO3 +HCO3 ,则 H2SO3的 Ka2大于 H2CO3的 Ka2
D.向 Na2CO3饱和溶液中通入 SO2的过程,水的电离程度先增大后减小
14.丙烷经催化脱氢制丙烯的反应为 C3H8(g)==C3H6(g)+H2(g)。600℃,将固定浓度的 C3H8通入有催
化剂的恒容反应器,逐渐提高 CO2浓度,经相同时间,测得出口处 C3H6、CO 和 H2浓度随初始 CO2
浓度的变化关系如图所示。下列说法不.正.确.的是
A.丙烷脱氢制丙烯反应的化学平衡常数 K=
B.c(H2)和 c(C3H6)变化差异的原因:CO2+H2 CO+H2O
C.其他条件不变,投料比 c(C3H8)/c(CO2)越大,C3H8转化率越小
D.若体系只有 C3H6、H2、CO 和 H2O 生成,则出口处物质浓度
c 之间一定存在关系:2c(C3H6)=2c(H2)+c(CO)+2c(H2O)
二、非选择题:共 4题,共 58分。
15.(14 分)二氧化铈(CeO2)可用作玻璃工业添加剂和有机反应催化剂。以氟碳铈矿(主要
含有 CeFCO3)为原料制备二氧化铈的一种工艺流程如图所示。
高二化学 第4页(共 7页)
— — —
已知:①Ce4+能与 F 结合成 CeF3+,Al3+也能与 F 结合成 AlF 36 ;
②Ce4+能被萃取剂 TBP 萃取,而 Ce3+不能。
回答下列问题:
(1)“氧化焙烧”生成固体产物 CeO2和 CeF4,写出该反应的化学方程式 ▲ 。
—
(2)TBP 是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP CeTBP4++F ,氟洗液中添加 Al3+
的作用是 ▲ 。
(3)“反萃取”时加入 H2SO4和 H2O2的混合液,H2O2的作用为 ▲ 。
— —
(4)“反萃取”后的水层溶液中 c(Ce3+)=1.0mol L 1,c(Al3+)=0.01mol L 1。室温下,“调 pH”时,先
除去 Al3+,若忽略过程中溶液的体积变化,则加入 NaOH 调节溶液 pH 的范围是 ▲ ,过滤后,
再向滤液中加入 NaOH 使 Ce3+沉淀完全。
已知:①室温下,当溶液中的离子浓度 c≤1.0×10—5mol L—1时,可认为该离子沉淀完全。
—
②K 32
—
sp[Al(OH)3]=1.0×10 ,Ksp[Ce(OH)3]=1.0×10 21
(5)“氧化”时发生反应的离子方程式为 ▲ 。
(6)用 10 吨含 70%CeFCO3的矿石,按上述工艺生产,制得 4.3 吨 CeO2,则 CeO2的产率为 ▲ (保
留 3 位有效数字,写出计算过程)。
16.(15 分)化合物 G 是一种酪氨酸激酶抑制剂中间体,其合成路线之一如下:
NO NH2
H CO NaNO2 H CO 2 NH2 H CO HCOOC2H 3 3 53 H3CO Fe
H3CO HNO H3CO H3CO 正丁醇钠 H3CO 3 CHO
O O CH3COOH O OH
A B C D
N
H3CO
Cl OH
N H3CO
二噁烷 H3CO
POCl3 N
H3CO H2N
H3CO 甲苯 H3CO O
NaH,DMSO
Cl
OH Cl H2N
E F G
(1)A 分子中碳原子的杂化轨道类型为 ▲ 。(2)B C 的反应类型为 ▲ 。
(3)C 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: ▲ 。
①分子中有 4种不同化学环境的氢,能与 FeCl3发生显色反应,但不能与溴水发生取代反应。
②在碱性条件下发生水解反应,酸化后产物之一苯环上含有 2 种含氧官能团。
(4)D到 E的反应需经历 D M E 的过程,M的分子式为 C11H13NO4。M的结构简式为 ▲ 。
(5)请写出以 — C H = C H 2 和甲酸乙酯为原料制备 的合成路线流程图
CHO
Cl
▲ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
高二化学 第5页(共 7页)
17.(13 分)消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
-
(1) 已知:N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol 1
-
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol 1
-
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol 1
-
则反应 8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) △H= ▲ kJ·mol 1
(2) 氮肥厂的废水中氮元素以 NH3 H2O、NH
+
3和 NH 4 的形式存在,对氨氮废水无害化处理已成为全
球科学研究热点,下面是两种电化学除氨氮的方法。
I. 方法一:电化学氧化法
有研究表明,当以碳材料为阴极,O2可在阴极生成 H2O2,并进一步生成
氧化性更强的·OH,·OH 可以将水中氨氮氧化为 N2。
①写出·OH 去除氨气的化学反应方程式 ▲ 。
②阴极区加入 Fe2+可进一步提高氨氮的去除率,分析 Fe2+的作
用 ▲ ,结合右图用必要的文字和化学用语解释 ▲ 。
II. 方法二:电化学沉淀法
已知:常温下 MgNH4PO4 6H2O、Mg3(PO4)2和 Mg(OH)2的溶度积如下
物质 MgNH4PO4 6H2O Mg3(PO4)2 Mg(OH)2
溶度积 2.5×10 13 1.04×10 24 1.8×10 11
用 0.01 mol/L NH4H2PO4溶液模拟氨氮废水,电解沉淀原理如图甲,调节溶液初始 pH=7,氨氮的
去除率和溶液 pH 随时间的变化情况如图乙所示。
- -
①用离子方程式表示磷酸铵镁沉淀的原理:Mg-2e === Mg2+,2H O+2e 2 === H2↑+2OH-,
▲ 。
②反应 1 h 以后,氨氮的去除率随时间的延长反而下降的原因 ▲ 。
18.(15 分) CO2的资源化利用技术是世界各国研究的热点。
I.CO2与 H2合成二甲醚(CH3OCH3)。该工艺主要涉及三个反应:
高二化学 第6页(共 7页)
-
反应 A:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-49.01 kJ·mol 1
-
反应 B:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.17 kJ·mol 1
-
反应 C:2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH=-24.52 kJ·mol 1
(1)一定温度下,向 1 L 恒容密闭容器中加入 0.25 mol CO2和 1.0 mol H2发生上述 3个反应,达
到平衡时测得部分物质的浓度如下表所示:
成分 CO CO2 CH3OCH3
- - -
浓度/ mol·L 1 8×10 3 0.17 3×10 2
则 CO2的平衡转化率 α= ▲ ,平衡时 CO2转化为 CH3OCH3的选择性= ▲ ,(选
择性是指生成指定物质消耗的CO2占 CO2消耗总量的百分比)。
n(H2)
(2)在压强 3.0 MPa, =4 时,不同温度下 CO 2
n(CO ) 2
的平衡转化率和产物的选择性如图-1 所示。
①当温度超过 290℃,CO2的平衡转化率随温度
升高而增大的原因是 ▲ 。
②不改变反应时间和温度,一定能提高 CH3OCH3
选择性的措施有 ▲ 。 H2 CO2
(3)生成的甲醇电解可制得 H2,其原理如
稀 质子
图-2 所示。阳极的电极反应式为 ▲ 。 硫 交换
酸 树脂 甲醇
水溶液
电源
图—2
II.CO2与 CH4吸附在固体催化剂表面生成合成气。主要发生反应的热化学方程式为
反应 A:CH4(g)+CO2(g)=2CO(g)+2H2(g)
20 100
反应 B:CO2(g)+H2(g)=CO(g)+H2O(g)
15 曲线Y 75
反应 C:CH4(g)+H2O(g)=CO(g)+3H2(g)
10 50曲线X
不同温度下,分别向若干体积相等的密闭容器中充入等量 5 25
CH 0 04和 CO2。反应相同时间,实验测得原料气的转化率 873
和水的物质的量随温度变化的曲线如图-3 所示。 800 1000 1200 1400 1600
温度/K
(4)图中表示 CO2的转化率随温度变化的曲线是 ▲ 。
(填 X 或 Y)
n(CH4)
(5)其他条件不变,起始 较小或较大时,CO2的转化率都较低的原因是 ▲ 。
n(CO2)
高二化学 第7页(共 7页)
水的物质的量/mol
转化率/%
泰州市姜堰区2022—2023学年度高二阶段测试
(化学试卷参考答案)
单项选择题:共 14题,每题 3分,共 42分。每题只.有.一.个.选项最符合题意。
题号 1 2 3 4 5 6 7
答案 C B B C D A C
题号 8 9 10 11 12 13 14
答案 A D C B C C D
非选择题:共 4题,共 58分。
15.(14 分)
(1)4CeFCO3+O2 3CeO2+CeF4+4CO2 (2 分)
- -
(2)Al3+与 F 结合成 AlF 3 ,促进 CeF3++TBP CeTBP4+
- -
6 +F 正向进行,有利于洗去 F
(2 分)
(3)还原剂,将 CeTBP4+中的 Ce(IV)还原为 Ce(III) (2 分,写到“还原剂”即给 2 分)
(4)5≤pH<7 (2 分)
— —
(5)2Ce(OH)3+ClO +H2O==2Ce(OH)4+Cl (3 分)
(6)78.2% (3 分)
16.(15 分)
(1)sp2 sp3 (2 分,各 1 分)
(2)还原反应 (2 分)
CH3 CH3
H3C— —CH3 HO— —OH
(3) H O — — O H 或 H 3 C — — C H 3 (3 分)
C O C O
NH
2
NH2
H
N
H3CO OH
(4) H 3 C O (3 分)
OH
(5) —CH=CH2 HCl —CH—CH3 NaOH/H2O —CH—CH3 O2
Cl △ Cu,△ OH
HCOOC2H5 POCl3
—C—CH3
正 丁 醇 钠 C H O 甲 苯 C HO
O
OH Cl
(每步 1分,共 5分)
高二化学(答案) 第1页(共 2页)
17.(13 分)
(1)2c-3b-7a(2 分)
(2)I:①6·OH+2NH3=N2 +6H2O (2 分)
②催化作用(1 分);
具体描述:H O 与 Fe2+2 2 反应生成 Fe3+和 OH,Fe3+向阴极移动,阴极 Fe3++e =Fe2+,Fe2+再
生,循环使用(2 分)
II. ①Mg2+
+ -
+2OH-+ NH4 + H2PO4 =MgNH4PO4↓+2H2O (3 分)
②反应 1 h后,随着溶液中 c(Mg2+)和 c(OH-)的增大,会形成 Mg3(PO4)2或 Mg(OH)2沉淀(或
者碱性条件下生成的 MgNH4PO4 6H2O 沉淀会部分转化为 Mg3(PO4)2或 Mg(OH)2沉淀,释放铵根
离子,促使溶液中氨氮的去除率下降。)(3 分)
18.(16 分)
(1)32% (2 分) 75% (2 分)
(2)①反应 B 的 ΔH>0,反应 A 的 ΔH<0,温度升高,使 CO2转化为 CO 的平衡转化率上升,
使 CO2转化为 CH3OH 的平衡转化率下降,且上升幅度超过下降的幅度 ( 3 分,从平衡移
动视角回答给 2 分)
②增大压强,使用对反应 AC 催化活性更高的催化剂 (2 分)
-
(3)CH3OH+H2O-6e === CO ↑+6H+ 2 (2 分)
(4)Y (2 分)
n(CH4) n(CH4)
(5)起始 较小时,CH4的浓度相对较低,反应速率较慢,CO2转化率较低;起始 较
n(CO2) n(CO2)
大时,CH4的浓度相对较大,过多占据催化剂活性中心,阻碍了 CO2的吸附,导致反应速率
减慢,CO2转化率亦较低 (3 分)
高二化学(答案) 第2页(共 2页)
(化学试卷)
考试时间:75分钟 总分:100分
可能用到的相对原子质量:H:1 C:12 O:16 F:19 Ce:140
一、单项选择题:共 14题,每题 3分,共 42分。每题只.有.一.个.选项最符合题意。
- +
1.下列措施能促进水的电离,并使 c(OH )>c(H )的是
A.向水中加入少量 NaCl B.将水加热煮沸
C.向水中加入少量 CH3COONa D.向水中加入少量 NH4NO3
2.次氯酸可以和丙烯发生加成反应 CH3CH=CH2+HClO→CH3CH(OH) CH2 Cl,以
CH3CH(OH) CH2Cl 为原料可以合成 CH3CH(OH) COOH,进一步合成新型降解材料聚乳酸。
下列化学用语表示正确的是
A.原子核内有8 个中子的碳原子: B.丙烯分子的球棍模型:
C.次氯酸的电子式: D.聚乳酸的结构简式:
3.向 N.aAlO2溶液中滴加适量 NaHCO3溶液可生成 Al(OH)3沉淀。下列说法正确的是 r (O2- 3+A. 半径大小: )
C.过氧乙酸具有强氧化性,可用于杀菌消毒
D.铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀
阅读下列资料,完成 5-7题:氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化
可以合成氨、氮的氧化物、硝酸等重要的化工原料;NO 能被 FeSO4溶液吸收生成配合物
[Fe(NO)(H2O)5]SO4,减少环境污染。
5.下列说法正确的是
A.自然固氮和人工固氮都是将 N2转化为 NH3
B.利用 HNO3的强氧化性与 NH3反应制备硝酸铵
C.常温下可用铝制容器盛装稀硝酸
D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
高二化学 第1页(共 7页)
6.对于反应 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) H<0,下列有关说法不.正.确.的是
A.升高温度,该反应的平衡常数增大
B.催化剂降低了正、逆反应的活化能
C.1molN-H 断裂同时有 1molO-H 断裂,说明达该条件下的平衡状态
D.其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数
7.NO 能被 FeSO4溶液吸收生成[Fe(NO)(H2O)5]SO4,减少环境污染,下列说法正确的是
A.Fe2+提供孤电子对用于形成配位键
B.该配合物中阴离子空间构型为三角锥形
C.配离子为[Fe(NO)(H2O) ]2+5 ,中心离子的配位数为 6
D.该配合物中所含非金属元素均位于元素周期表的 p 区
8.实验室用高锰酸钾和浓盐酸反应制取氯气,其反应原理为:2KMnO4+16HCl(浓)==2KCl
+2MnCl2+5Cl2↑+8H2O,实验室用下图装置制取少量 Cl2,其中能达到相应实验目的的是
A.装置甲的长颈漏斗需换成分液漏斗
B.装置乙中饱和 NaCl溶液也可以用饱和 NaHCO3溶液代替
C.用装置丙收集 Cl2 并防止倒吸
D.用装置丁吸收 Cl2尾气
9.有机物 Z 是合成药物的中间体,Z 的合成路线如下。下列说法不.正.确.的是
A.1molX 最多能与 2molNaOH 反应
B.Y 可以发生取代、氧化、加聚反应
C.化合物 Y 存在顺反异构
D.Z 与足量 H2加成后,分子中含有 6 个手性碳原子
高二化学 第2页(共 7页)
10.2-甲氧-2-甲基丁烷(用 TAME 表示)常用作汽油添加剂。在催化剂作用下,可通过甲醇与烯烃的液
相反应制得,体系中同时存在如下反应:
反应Ⅰ、Ⅱ、Ⅲ的平衡常数Kx 分别为Kx1 、Kx2 、Kx3 ( Kx 是以物质的量分数代替物质的量浓度表示的平
衡常数)与温度 T 变化关系如上图所示。
现向某反应容器中加入 1.0mol TAME,控制温度为 353K,反应 30min 后达到平衡状态。下列说法正
确的是
A.烯烃 A 和 B,其中 A 相对稳定
B.反应Ⅰ、Ⅱ中, H1大于 H2
C.达到平衡时,容器中烯烃 A 与 CH3OH 的物质的量之比为 1:10
D.同温同压下,向该容器中注入惰性溶剂稀释,反应Ⅰ的平衡将正向移动
11.双极膜能够在直流电场作用下将H2O 解离为 H+和 OH-。以维生素 C 的钠盐(C6H7O6Na)为原料制
备维生素 C(C6H8O6,具有弱酸性和还原性)的装置如下图。
下列说法错.误.的是
A.X 极右侧的离子交换膜能使 Na+通过
B.将 X 极区的 Na2SO4替换为 C6H7O6Na,可以提高维生素 C 的产率
—
C.a 离子是 OH ,b 离子是 H+
D.阴极区附近 pH 增大
12.用海水晒盐后的苦卤水生产金属 Mg 的过程可表示如下:
高二化学 第3页(共 7页)
熔融
苦卤水→Mg(OH)2→MgCl2(aq)→MgCl2(s)――→ Mg
电解
下列说法正确的是
A.工业上将苦卤水生成 Mg(OH)2(s)用氢氧化钠溶液
+ -
B.常温下,Mg(OH)2溶于盐酸所得 MgCl -142溶液中 c(H )·c(OH )>10
C.将 MgCl2·6H2O 晶体在 HCl 气流中蒸干可得到无水 MgCl2
D.电解熔融 MgCl2在阳极获得金属 Mg
13.利用烟道气中 SO2的生产 NaHSO3晶体的工艺流程如下所示。下列说法正确的是
SO2 Na2CO3固体 SO2
Na2CO3
Ⅰ Ⅱ Ⅲ 结晶脱水 NaHSO
饱和溶液 3
pH=4.1 pH=7~8 pH=4.1
- -
A.步骤 I 可得 NaHSO3溶液中有 c(OH )= c(H+)+c(SO 23 )+c(H2SO3)
B.步骤Ⅲ所得溶液中有 Ka1(H2SO3)·Ka2(H2SO3)
C.步骤Ⅱ中发生的反应为 HSO 2 23 +CO3 = SO3 +HCO3 ,则 H2SO3的 Ka2大于 H2CO3的 Ka2
D.向 Na2CO3饱和溶液中通入 SO2的过程,水的电离程度先增大后减小
14.丙烷经催化脱氢制丙烯的反应为 C3H8(g)==C3H6(g)+H2(g)。600℃,将固定浓度的 C3H8通入有催
化剂的恒容反应器,逐渐提高 CO2浓度,经相同时间,测得出口处 C3H6、CO 和 H2浓度随初始 CO2
浓度的变化关系如图所示。下列说法不.正.确.的是
A.丙烷脱氢制丙烯反应的化学平衡常数 K=
B.c(H2)和 c(C3H6)变化差异的原因:CO2+H2 CO+H2O
C.其他条件不变,投料比 c(C3H8)/c(CO2)越大,C3H8转化率越小
D.若体系只有 C3H6、H2、CO 和 H2O 生成,则出口处物质浓度
c 之间一定存在关系:2c(C3H6)=2c(H2)+c(CO)+2c(H2O)
二、非选择题:共 4题,共 58分。
15.(14 分)二氧化铈(CeO2)可用作玻璃工业添加剂和有机反应催化剂。以氟碳铈矿(主要
含有 CeFCO3)为原料制备二氧化铈的一种工艺流程如图所示。
高二化学 第4页(共 7页)
— — —
已知:①Ce4+能与 F 结合成 CeF3+,Al3+也能与 F 结合成 AlF 36 ;
②Ce4+能被萃取剂 TBP 萃取,而 Ce3+不能。
回答下列问题:
(1)“氧化焙烧”生成固体产物 CeO2和 CeF4,写出该反应的化学方程式 ▲ 。
—
(2)TBP 是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP CeTBP4++F ,氟洗液中添加 Al3+
的作用是 ▲ 。
(3)“反萃取”时加入 H2SO4和 H2O2的混合液,H2O2的作用为 ▲ 。
— —
(4)“反萃取”后的水层溶液中 c(Ce3+)=1.0mol L 1,c(Al3+)=0.01mol L 1。室温下,“调 pH”时,先
除去 Al3+,若忽略过程中溶液的体积变化,则加入 NaOH 调节溶液 pH 的范围是 ▲ ,过滤后,
再向滤液中加入 NaOH 使 Ce3+沉淀完全。
已知:①室温下,当溶液中的离子浓度 c≤1.0×10—5mol L—1时,可认为该离子沉淀完全。
—
②K 32
—
sp[Al(OH)3]=1.0×10 ,Ksp[Ce(OH)3]=1.0×10 21
(5)“氧化”时发生反应的离子方程式为 ▲ 。
(6)用 10 吨含 70%CeFCO3的矿石,按上述工艺生产,制得 4.3 吨 CeO2,则 CeO2的产率为 ▲ (保
留 3 位有效数字,写出计算过程)。
16.(15 分)化合物 G 是一种酪氨酸激酶抑制剂中间体,其合成路线之一如下:
NO NH2
H CO NaNO2 H CO 2 NH2 H CO HCOOC2H 3 3 53 H3CO Fe
H3CO HNO H3CO H3CO 正丁醇钠 H3CO 3 CHO
O O CH3COOH O OH
A B C D
N
H3CO
Cl OH
N H3CO
二噁烷 H3CO
POCl3 N
H3CO H2N
H3CO 甲苯 H3CO O
NaH,DMSO
Cl
OH Cl H2N
E F G
(1)A 分子中碳原子的杂化轨道类型为 ▲ 。(2)B C 的反应类型为 ▲ 。
(3)C 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: ▲ 。
①分子中有 4种不同化学环境的氢,能与 FeCl3发生显色反应,但不能与溴水发生取代反应。
②在碱性条件下发生水解反应,酸化后产物之一苯环上含有 2 种含氧官能团。
(4)D到 E的反应需经历 D M E 的过程,M的分子式为 C11H13NO4。M的结构简式为 ▲ 。
(5)请写出以 — C H = C H 2 和甲酸乙酯为原料制备 的合成路线流程图
CHO
Cl
▲ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
高二化学 第5页(共 7页)
17.(13 分)消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
-
(1) 已知:N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol 1
-
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol 1
-
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol 1
-
则反应 8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) △H= ▲ kJ·mol 1
(2) 氮肥厂的废水中氮元素以 NH3 H2O、NH
+
3和 NH 4 的形式存在,对氨氮废水无害化处理已成为全
球科学研究热点,下面是两种电化学除氨氮的方法。
I. 方法一:电化学氧化法
有研究表明,当以碳材料为阴极,O2可在阴极生成 H2O2,并进一步生成
氧化性更强的·OH,·OH 可以将水中氨氮氧化为 N2。
①写出·OH 去除氨气的化学反应方程式 ▲ 。
②阴极区加入 Fe2+可进一步提高氨氮的去除率,分析 Fe2+的作
用 ▲ ,结合右图用必要的文字和化学用语解释 ▲ 。
II. 方法二:电化学沉淀法
已知:常温下 MgNH4PO4 6H2O、Mg3(PO4)2和 Mg(OH)2的溶度积如下
物质 MgNH4PO4 6H2O Mg3(PO4)2 Mg(OH)2
溶度积 2.5×10 13 1.04×10 24 1.8×10 11
用 0.01 mol/L NH4H2PO4溶液模拟氨氮废水,电解沉淀原理如图甲,调节溶液初始 pH=7,氨氮的
去除率和溶液 pH 随时间的变化情况如图乙所示。
- -
①用离子方程式表示磷酸铵镁沉淀的原理:Mg-2e === Mg2+,2H O+2e 2 === H2↑+2OH-,
▲ 。
②反应 1 h 以后,氨氮的去除率随时间的延长反而下降的原因 ▲ 。
18.(15 分) CO2的资源化利用技术是世界各国研究的热点。
I.CO2与 H2合成二甲醚(CH3OCH3)。该工艺主要涉及三个反应:
高二化学 第6页(共 7页)
-
反应 A:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-49.01 kJ·mol 1
-
反应 B:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.17 kJ·mol 1
-
反应 C:2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH=-24.52 kJ·mol 1
(1)一定温度下,向 1 L 恒容密闭容器中加入 0.25 mol CO2和 1.0 mol H2发生上述 3个反应,达
到平衡时测得部分物质的浓度如下表所示:
成分 CO CO2 CH3OCH3
- - -
浓度/ mol·L 1 8×10 3 0.17 3×10 2
则 CO2的平衡转化率 α= ▲ ,平衡时 CO2转化为 CH3OCH3的选择性= ▲ ,(选
择性是指生成指定物质消耗的CO2占 CO2消耗总量的百分比)。
n(H2)
(2)在压强 3.0 MPa, =4 时,不同温度下 CO 2
n(CO ) 2
的平衡转化率和产物的选择性如图-1 所示。
①当温度超过 290℃,CO2的平衡转化率随温度
升高而增大的原因是 ▲ 。
②不改变反应时间和温度,一定能提高 CH3OCH3
选择性的措施有 ▲ 。 H2 CO2
(3)生成的甲醇电解可制得 H2,其原理如
稀 质子
图-2 所示。阳极的电极反应式为 ▲ 。 硫 交换
酸 树脂 甲醇
水溶液
电源
图—2
II.CO2与 CH4吸附在固体催化剂表面生成合成气。主要发生反应的热化学方程式为
反应 A:CH4(g)+CO2(g)=2CO(g)+2H2(g)
20 100
反应 B:CO2(g)+H2(g)=CO(g)+H2O(g)
15 曲线Y 75
反应 C:CH4(g)+H2O(g)=CO(g)+3H2(g)
10 50曲线X
不同温度下,分别向若干体积相等的密闭容器中充入等量 5 25
CH 0 04和 CO2。反应相同时间,实验测得原料气的转化率 873
和水的物质的量随温度变化的曲线如图-3 所示。 800 1000 1200 1400 1600
温度/K
(4)图中表示 CO2的转化率随温度变化的曲线是 ▲ 。
(填 X 或 Y)
n(CH4)
(5)其他条件不变,起始 较小或较大时,CO2的转化率都较低的原因是 ▲ 。
n(CO2)
高二化学 第7页(共 7页)
水的物质的量/mol
转化率/%
泰州市姜堰区2022—2023学年度高二阶段测试
(化学试卷参考答案)
单项选择题:共 14题,每题 3分,共 42分。每题只.有.一.个.选项最符合题意。
题号 1 2 3 4 5 6 7
答案 C B B C D A C
题号 8 9 10 11 12 13 14
答案 A D C B C C D
非选择题:共 4题,共 58分。
15.(14 分)
(1)4CeFCO3+O2 3CeO2+CeF4+4CO2 (2 分)
- -
(2)Al3+与 F 结合成 AlF 3 ,促进 CeF3++TBP CeTBP4+
- -
6 +F 正向进行,有利于洗去 F
(2 分)
(3)还原剂,将 CeTBP4+中的 Ce(IV)还原为 Ce(III) (2 分,写到“还原剂”即给 2 分)
(4)5≤pH<7 (2 分)
— —
(5)2Ce(OH)3+ClO +H2O==2Ce(OH)4+Cl (3 分)
(6)78.2% (3 分)
16.(15 分)
(1)sp2 sp3 (2 分,各 1 分)
(2)还原反应 (2 分)
CH3 CH3
H3C— —CH3 HO— —OH
(3) H O — — O H 或 H 3 C — — C H 3 (3 分)
C O C O
NH
2
NH2
H
N
H3CO OH
(4) H 3 C O (3 分)
OH
(5) —CH=CH2 HCl —CH—CH3 NaOH/H2O —CH—CH3 O2
Cl △ Cu,△ OH
HCOOC2H5 POCl3
—C—CH3
正 丁 醇 钠 C H O 甲 苯 C HO
O
OH Cl
(每步 1分,共 5分)
高二化学(答案) 第1页(共 2页)
17.(13 分)
(1)2c-3b-7a(2 分)
(2)I:①6·OH+2NH3=N2 +6H2O (2 分)
②催化作用(1 分);
具体描述:H O 与 Fe2+2 2 反应生成 Fe3+和 OH,Fe3+向阴极移动,阴极 Fe3++e =Fe2+,Fe2+再
生,循环使用(2 分)
II. ①Mg2+
+ -
+2OH-+ NH4 + H2PO4 =MgNH4PO4↓+2H2O (3 分)
②反应 1 h后,随着溶液中 c(Mg2+)和 c(OH-)的增大,会形成 Mg3(PO4)2或 Mg(OH)2沉淀(或
者碱性条件下生成的 MgNH4PO4 6H2O 沉淀会部分转化为 Mg3(PO4)2或 Mg(OH)2沉淀,释放铵根
离子,促使溶液中氨氮的去除率下降。)(3 分)
18.(16 分)
(1)32% (2 分) 75% (2 分)
(2)①反应 B 的 ΔH>0,反应 A 的 ΔH<0,温度升高,使 CO2转化为 CO 的平衡转化率上升,
使 CO2转化为 CH3OH 的平衡转化率下降,且上升幅度超过下降的幅度 ( 3 分,从平衡移
动视角回答给 2 分)
②增大压强,使用对反应 AC 催化活性更高的催化剂 (2 分)
-
(3)CH3OH+H2O-6e === CO ↑+6H+ 2 (2 分)
(4)Y (2 分)
n(CH4) n(CH4)
(5)起始 较小时,CH4的浓度相对较低,反应速率较慢,CO2转化率较低;起始 较
n(CO2) n(CO2)
大时,CH4的浓度相对较大,过多占据催化剂活性中心,阻碍了 CO2的吸附,导致反应速率
减慢,CO2转化率亦较低 (3 分)
高二化学(答案) 第2页(共 2页)
同课章节目录
