高中化学人教版(2019)必修二 第六章第二节化学反应的速率与限度第二课时学案(含答案)
文档属性
| 名称 | 高中化学人教版(2019)必修二 第六章第二节化学反应的速率与限度第二课时学案(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 53.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 00:00:00 | ||
图片预览

文档简介
第六章第二节化学反应的速率与限度
第二课时学案
【学习目标】
1.结合实例体会可逆反应存在限度,理解化学平衡状态的特征,发展“变化观念与平衡思想”的学科核心素养。
2.能从化学反应限度和快慢的角度解释生产、生活中简单的化学现象。体会从两个方面认识和调控化学反应的重要性,认识控制反应条件在生产和科研中的作用。
【目标一】化学反应的限度
1.可逆反应
概念:一定条件下,既能向 进行同时又能向 进行的化学反应叫可逆反应。
例如:合成氨的反应:N2 + 3H2 2NH3,
SO2和O2化合生成SO3的反应:2SO2 + O22SO3等。
【思考感悟】
1.在密闭容器中加入1 mol H2和1 mol I2发生反应:H2(g) + I2(g)2HI(g) ,请分析:
⑴ 当反应刚开始时,反应物和生成物的浓度哪个大?
⑵ 当反应刚开始时,正向反应与逆向反应哪个反应速率大?
⑶ 随着反应的进行,反应物和生成物浓度如何变化?
⑷ 随着反应的进行,υ(正)与υ(逆)怎样变化?
⑸ 反应进行到什么时候会“停止”?
⑹ 此时,反应物和生成物浓度如何变化?
⑺ 给这个状态命名
⑻ 反应真的停止了吗?
2.既然可逆反应进行不彻底,有一定的限度,那么如何表示这样的限度呢?
【分析】可用平衡时已转化了的某反应物的量与反应前(初始时)该反应物的量之比来表示反应在该条件下的最大限度。
平衡转化率(α)
【导练1】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:
3A(g) + B(g)2C(g) + xD(g)。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol/L,
求:⑴ x的值 ⑵ B的转化率
【目标二】化学平衡状态——化学平衡
1.化学平衡的建立:以CO(g) + H2O(g)CO2(g) + H2(g) 反应为例。
在一定条件下,将0.1 mol CO和0.1 mol H2O(g)通入1L密闭容器中,开始反应:
⑴ 反应刚开始时:反应物的浓度 ,正反应速率 。
生成物的浓度为 ,逆反应速率为 。
⑵ 反应进行中: 反应物的浓度 ,正反应速率 。
生成物的浓度 ,逆反应速率 。
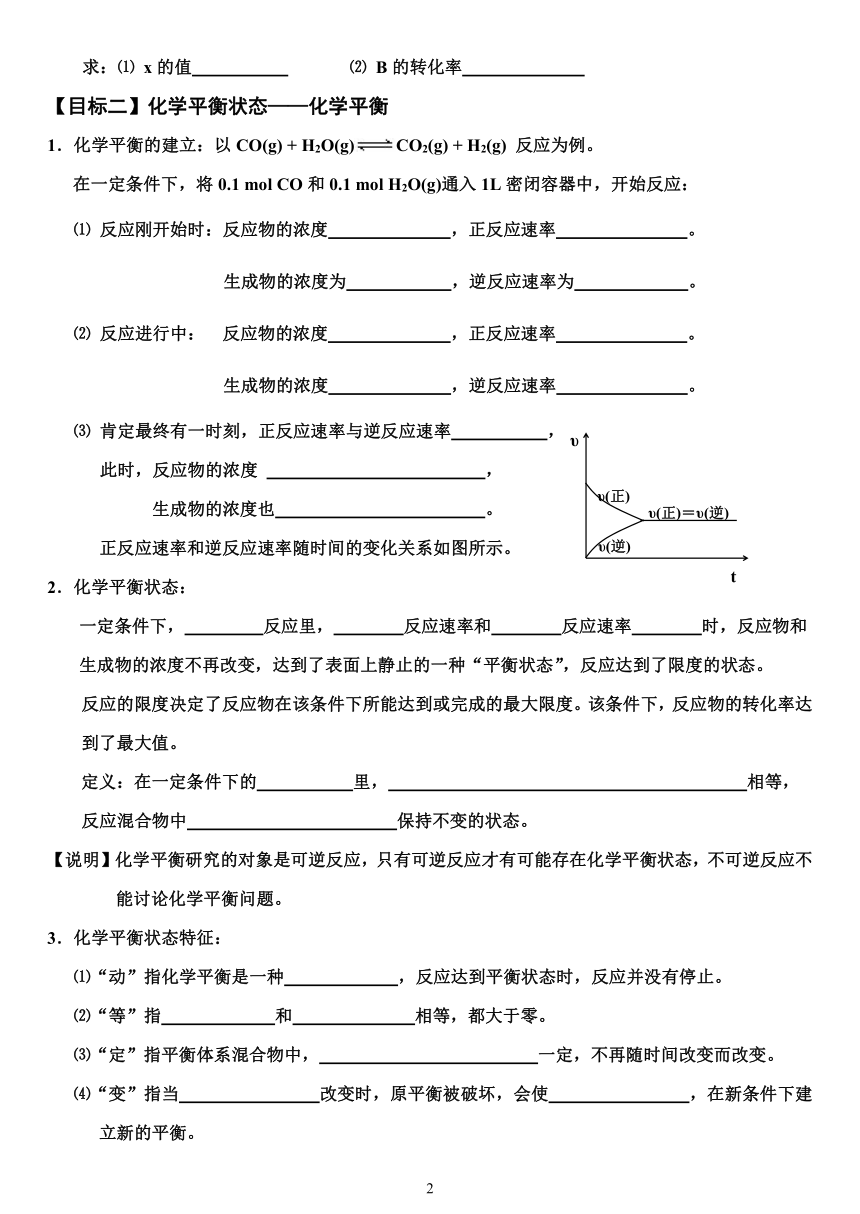
⑶ 肯定最终有一时刻,正反应速率与逆反应速率 ,
此时,反应物的浓度 ,
生成物的浓度也 。
正反应速率和逆反应速率随时间的变化关系如图所示。
2.化学平衡状态:
一定条件下, 反应里, 反应速率和 反应速率 时,反应物和
生成物的浓度不再改变,达到了表面上静止的一种“平衡状态”,反应达到了限度的状态。
反应的限度决定了反应物在该条件下所能达到或完成的最大限度。该条件下,反应物的转化率达到了最大值。
定义:在一定条件下的 里, 相等,
反应混合物中 保持不变的状态。
【说明】化学平衡研究的对象是可逆反应,只有可逆反应才有可能存在化学平衡状态,不可逆反应不能讨论化学平衡问题。
3.化学平衡状态特征:
⑴“动”指化学平衡是一种 ,反应达到平衡状态时,反应并没有停止。
⑵“等”指 和 相等,都大于零。
⑶“定”指平衡体系混合物中, 一定,不再随时间改变而改变。
⑷“变”指当 改变时,原平衡被破坏,会使 ,在新条件下建立新的平衡。
【说明】化学平衡状态是可逆反应进行到最大限度的结果,反应混合体系中各组分的浓度不变。一经建立化学平衡状态,不会因时间的变化而变化,但因外部条件的改变会引起化学平衡的改变。
【导练2】在密闭容器中充入PCl5,发生化学反应:PCl5(g)PCl3(g) + Cl2(g),反应一段时间后又向其中加入37Cl2,在重新达到化学平衡状态后,37Cl原子存在于( )
A.PCl5中 B.PCl3中 C.Cl2中 D.三种物质中都有
4.化学反应达到平衡状态的标志
(一)直接标志:以 mA(g) + nB(g)pC(g) 为例
⑴ 速率关系:同一物质正反应速率与逆反应速率相等,A的消耗速率与A的生成速率相等;
A消耗速率与C的消耗速率之比等于m∶p
B生成速率与C的生成速率之比等于n∶p
⑵ 混合物中各物质的物质的量浓度、体积、体积分数、物质的量、物质的量分数、质量、质量分数等保持不变,均可判断该反应达到平衡状态。
例如:一定条件下,可逆反应N2 + 3H22NH3,对该可逆反应,表示正、逆反应速率可以用N2或H2或NH3来表示:
① 单位时间内,有1 mol N2反应掉,同时有1 mol N2生成
② 单位时间内,有3 mol H2反应掉,同时有2 mol NH3反应掉
③ 单位时间内,有1 mol N2生成,同时有2 mol NH3生成
以上均表示υ(正)=υ(逆)
规律:化学平衡状态的判断原则:同时、双向进行。
(二)间接标志:
反应① N2(g) + 3H2(g)2NH3(g) 反应② H2(g) + I2(g) 2HI(g)
根据以下标志,判断反应①、反应②是否达到平衡状态:
⑴ 混合气体的总物质的量不再改变: 反应① ,反应②
⑵ 在恒温、恒压条件下,混合气体的总体积不再改变:反应① ,反应②
⑶ 在恒温、恒容条件下,混合气体的压强不再改变: 反应① ,反应②
⑷ 反应混合体系中各组分的浓度不再改变: 反应① ,反应②
⑸ 反应混合体系中各气体的体积分数不再改变: 反应① ,反应②
⑹ 混合气体的平均相对分子质量M不再改变: 反应① ,反应②
⑺ 反应混合体系中的温度不再改变: 反应① ,反应②
⑻ 恒容条件下,反应混合气体的密度不再改变: 反应① ,反应②
⑼ 恒压条件下,反应混合气体的密度不再改变: 反应① ,反应②
⑽ 反应混合体系中,气体的颜色不再改变: 反应① ,反应②
【目标三】化学反应条件的控制
1.控制化学反应条件的目的
化学反应有的快、有的慢,有的进行程度大、有的进行程度小,有的对我们有利、有的对我们不利。控制反应条件,促进有利的化学反应(提高反应物的转化率即原料的利用率,加快反应速率等),抑制有害的化学反应(减缓反应速率,减少甚至消除有害物质的产生,控制副反应的发生等),使化学反应向着对我们有利的方向转化。
2.控制化学反应条件的基本措施
⑴ 通过改变反应温度、溶液浓度、气体压强(或浓度)、固体表面积以及催化剂的使用等,改变化学反应的速率。
⑵ 通过改变可逆反应体系的温度、溶液浓度、气体压强(或浓度)等,改变可逆反应进行的限度。
3.燃料燃烧的条件
⑴ 燃料与 接触,且空气要适当过量
⑵ 温度达到燃料的
4.提高燃料燃烧效率的措施
⑴ 尽可能使燃料充分燃烧,提高能量的
关键是燃料与 尽可能充分接触,且 要适当过量。
⑵ 尽可能充分地利用燃料燃烧所释放出的热能,提高热能的利用率。
【思考感悟】结合燃料燃烧的条件分析灭火的措施有哪些?
υ
t
υ(正)
υ(正)=υ(逆)
υ(逆)
PAGE
3
第二课时学案
【学习目标】
1.结合实例体会可逆反应存在限度,理解化学平衡状态的特征,发展“变化观念与平衡思想”的学科核心素养。
2.能从化学反应限度和快慢的角度解释生产、生活中简单的化学现象。体会从两个方面认识和调控化学反应的重要性,认识控制反应条件在生产和科研中的作用。
【目标一】化学反应的限度
1.可逆反应
概念:一定条件下,既能向 进行同时又能向 进行的化学反应叫可逆反应。
例如:合成氨的反应:N2 + 3H2 2NH3,
SO2和O2化合生成SO3的反应:2SO2 + O22SO3等。
【思考感悟】
1.在密闭容器中加入1 mol H2和1 mol I2发生反应:H2(g) + I2(g)2HI(g) ,请分析:
⑴ 当反应刚开始时,反应物和生成物的浓度哪个大?
⑵ 当反应刚开始时,正向反应与逆向反应哪个反应速率大?
⑶ 随着反应的进行,反应物和生成物浓度如何变化?
⑷ 随着反应的进行,υ(正)与υ(逆)怎样变化?
⑸ 反应进行到什么时候会“停止”?
⑹ 此时,反应物和生成物浓度如何变化?
⑺ 给这个状态命名
⑻ 反应真的停止了吗?
2.既然可逆反应进行不彻底,有一定的限度,那么如何表示这样的限度呢?
【分析】可用平衡时已转化了的某反应物的量与反应前(初始时)该反应物的量之比来表示反应在该条件下的最大限度。
平衡转化率(α)
【导练1】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:
3A(g) + B(g)2C(g) + xD(g)。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol/L,
求:⑴ x的值 ⑵ B的转化率
【目标二】化学平衡状态——化学平衡
1.化学平衡的建立:以CO(g) + H2O(g)CO2(g) + H2(g) 反应为例。
在一定条件下,将0.1 mol CO和0.1 mol H2O(g)通入1L密闭容器中,开始反应:
⑴ 反应刚开始时:反应物的浓度 ,正反应速率 。
生成物的浓度为 ,逆反应速率为 。
⑵ 反应进行中: 反应物的浓度 ,正反应速率 。
生成物的浓度 ,逆反应速率 。
⑶ 肯定最终有一时刻,正反应速率与逆反应速率 ,
此时,反应物的浓度 ,
生成物的浓度也 。
正反应速率和逆反应速率随时间的变化关系如图所示。
2.化学平衡状态:
一定条件下, 反应里, 反应速率和 反应速率 时,反应物和
生成物的浓度不再改变,达到了表面上静止的一种“平衡状态”,反应达到了限度的状态。
反应的限度决定了反应物在该条件下所能达到或完成的最大限度。该条件下,反应物的转化率达到了最大值。
定义:在一定条件下的 里, 相等,
反应混合物中 保持不变的状态。
【说明】化学平衡研究的对象是可逆反应,只有可逆反应才有可能存在化学平衡状态,不可逆反应不能讨论化学平衡问题。
3.化学平衡状态特征:
⑴“动”指化学平衡是一种 ,反应达到平衡状态时,反应并没有停止。
⑵“等”指 和 相等,都大于零。
⑶“定”指平衡体系混合物中, 一定,不再随时间改变而改变。
⑷“变”指当 改变时,原平衡被破坏,会使 ,在新条件下建立新的平衡。
【说明】化学平衡状态是可逆反应进行到最大限度的结果,反应混合体系中各组分的浓度不变。一经建立化学平衡状态,不会因时间的变化而变化,但因外部条件的改变会引起化学平衡的改变。
【导练2】在密闭容器中充入PCl5,发生化学反应:PCl5(g)PCl3(g) + Cl2(g),反应一段时间后又向其中加入37Cl2,在重新达到化学平衡状态后,37Cl原子存在于( )
A.PCl5中 B.PCl3中 C.Cl2中 D.三种物质中都有
4.化学反应达到平衡状态的标志
(一)直接标志:以 mA(g) + nB(g)pC(g) 为例
⑴ 速率关系:同一物质正反应速率与逆反应速率相等,A的消耗速率与A的生成速率相等;
A消耗速率与C的消耗速率之比等于m∶p
B生成速率与C的生成速率之比等于n∶p
⑵ 混合物中各物质的物质的量浓度、体积、体积分数、物质的量、物质的量分数、质量、质量分数等保持不变,均可判断该反应达到平衡状态。
例如:一定条件下,可逆反应N2 + 3H22NH3,对该可逆反应,表示正、逆反应速率可以用N2或H2或NH3来表示:
① 单位时间内,有1 mol N2反应掉,同时有1 mol N2生成
② 单位时间内,有3 mol H2反应掉,同时有2 mol NH3反应掉
③ 单位时间内,有1 mol N2生成,同时有2 mol NH3生成
以上均表示υ(正)=υ(逆)
规律:化学平衡状态的判断原则:同时、双向进行。
(二)间接标志:
反应① N2(g) + 3H2(g)2NH3(g) 反应② H2(g) + I2(g) 2HI(g)
根据以下标志,判断反应①、反应②是否达到平衡状态:
⑴ 混合气体的总物质的量不再改变: 反应① ,反应②
⑵ 在恒温、恒压条件下,混合气体的总体积不再改变:反应① ,反应②
⑶ 在恒温、恒容条件下,混合气体的压强不再改变: 反应① ,反应②
⑷ 反应混合体系中各组分的浓度不再改变: 反应① ,反应②
⑸ 反应混合体系中各气体的体积分数不再改变: 反应① ,反应②
⑹ 混合气体的平均相对分子质量M不再改变: 反应① ,反应②
⑺ 反应混合体系中的温度不再改变: 反应① ,反应②
⑻ 恒容条件下,反应混合气体的密度不再改变: 反应① ,反应②
⑼ 恒压条件下,反应混合气体的密度不再改变: 反应① ,反应②
⑽ 反应混合体系中,气体的颜色不再改变: 反应① ,反应②
【目标三】化学反应条件的控制
1.控制化学反应条件的目的
化学反应有的快、有的慢,有的进行程度大、有的进行程度小,有的对我们有利、有的对我们不利。控制反应条件,促进有利的化学反应(提高反应物的转化率即原料的利用率,加快反应速率等),抑制有害的化学反应(减缓反应速率,减少甚至消除有害物质的产生,控制副反应的发生等),使化学反应向着对我们有利的方向转化。
2.控制化学反应条件的基本措施
⑴ 通过改变反应温度、溶液浓度、气体压强(或浓度)、固体表面积以及催化剂的使用等,改变化学反应的速率。
⑵ 通过改变可逆反应体系的温度、溶液浓度、气体压强(或浓度)等,改变可逆反应进行的限度。
3.燃料燃烧的条件
⑴ 燃料与 接触,且空气要适当过量
⑵ 温度达到燃料的
4.提高燃料燃烧效率的措施
⑴ 尽可能使燃料充分燃烧,提高能量的
关键是燃料与 尽可能充分接触,且 要适当过量。
⑵ 尽可能充分地利用燃料燃烧所释放出的热能,提高热能的利用率。
【思考感悟】结合燃料燃烧的条件分析灭火的措施有哪些?
υ
t
υ(正)
υ(正)=υ(逆)
υ(逆)
PAGE
3
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
