高中化学人教版(2019)必修二 第六章第一节化学反应与能量变化第一课时学案(含答案)
文档属性
| 名称 | 高中化学人教版(2019)必修二 第六章第一节化学反应与能量变化第一课时学案(含答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 370.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 17:12:56 | ||
图片预览


文档简介
第六章第一节化学反应与能量变化
第一课时 学案
【学习目标】
1.认识物质具有能量,知道常见的吸热反应与放热反应。
2.能从反应物与生成物所具有的能量、化学键的断裂与形成两个角度理解化学反应中能量变化的主要原因。
3.知道化学反应可以实现化学能与其他能量形式的转化。
【目标一】化学反应中存在热量变化
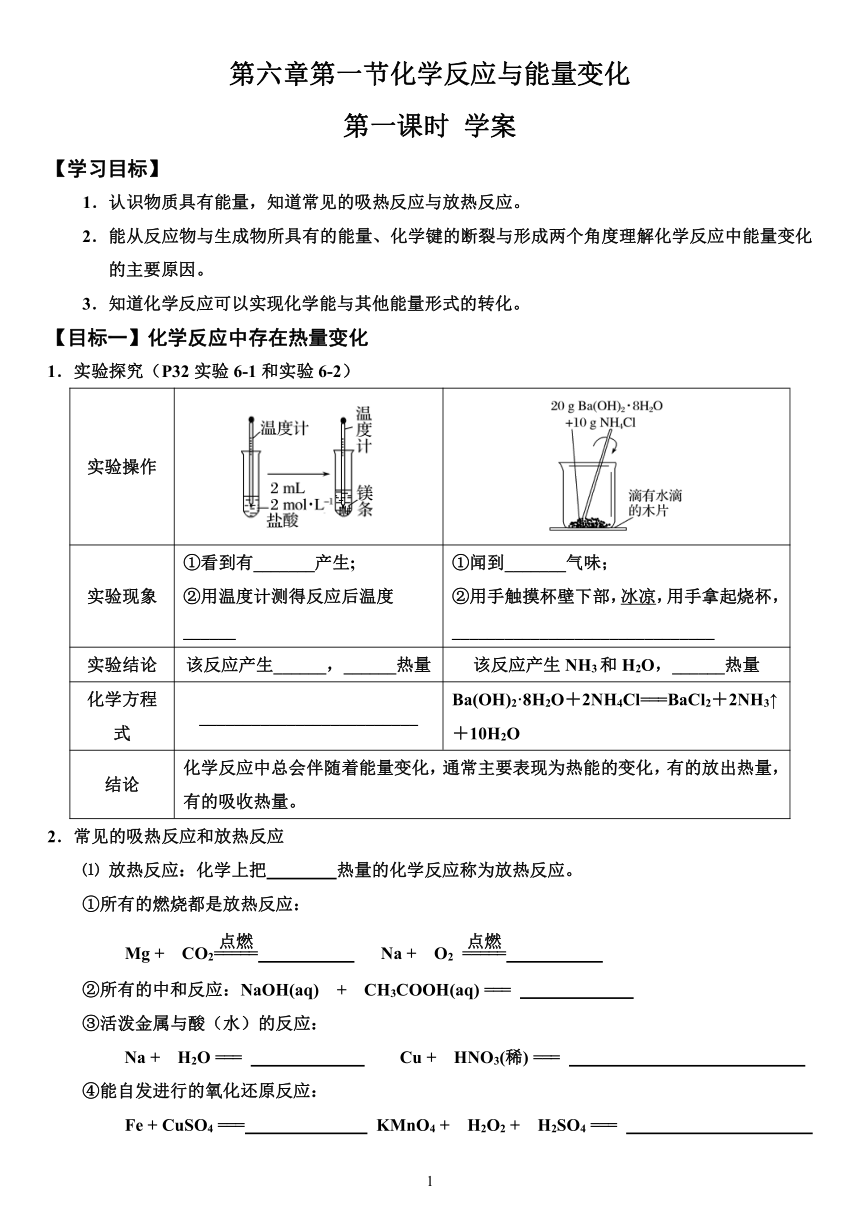
1.实验探究(P32实验6-1和实验6-2)
实验操作
实验现象 ①看到有_______产生; ②用温度计测得反应后温度______ ①闻到_______气味; ②用手触摸杯壁下部,冰凉,用手拿起烧杯,______________________________
实验结论 该反应产生______,______热量 该反应产生NH3和H2O,______热量
化学方程式 _________________________ Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O
结论 化学反应中总会伴随着能量变化,通常主要表现为热能的变化,有的放出热量,有的吸收热量。
2.常见的吸热反应和放热反应
⑴ 放热反应:化学上把 热量的化学反应称为放热反应。
①所有的燃烧都是放热反应:
Mg + CO2 Na + O2
②所有的中和反应:NaOH(aq) + CH3COOH(aq) ===
③活泼金属与酸(水)的反应:
Na + H2O === Cu + HNO3(稀) ===
④能自发进行的氧化还原反应:
Fe + CuSO4 === KMnO4 + H2O2 + H2SO4 ===
⑤大多数化合反应: Mg + N2 Fe + S
另外,一些强酸、强碱溶于水(如浓H2SO4、NaOH(s))属于放热过程。
⑵ 吸热反应:化学上把 热量的化学反应称为吸热反应。
①较典型的反应:
Ba(OH)2·8H2O和NH4Cl反应:
②大多数分解反应: KClO3
③以C、CO、H2为还原剂的氧化还原反应:C + H2O(g)
【注意】大多数化合反应都是放热的,大多数分解反应都是吸热的。也有例外:
如:H2 + I2 N2 + O2 CO2 + C
另外,弱电解质的电离(如NH3·H2O H2O )
及一些物质溶于水(如NH4NO3、NH4Cl)属于吸热过程。
【目标二】化学反应中能量变化的原因
1.化学反应中的能量变化
【导思】化学反应中为什么会有能量变化?为什么有的化学反应释放能量,有的化学反应吸收能量?
【理论分析】
物质中的原子是通过化学键相结合的,任何化学反应的发生都可以看作是 (旧键)的断裂和 (新键)的形成的过程。物质发生化学反应时,断开反应物中的化学键要 能量,而形成生成物中化学键要 能量。
【实例】 (25 ℃和101 kPa的条件下) H2(g)+Cl2(g)===2HCl(g)
①该反应过程中共吸收 kJ能量,共放出 kJ能量。
②该反应 (填“放出”或“吸收”) kJ热量,为 反应。
2.化学反应中能量变化的本质原因
是化学反应中能量变化的主要原因。
E1 E2,反应吸收能量(吸热反应);
E1 E2,反应放出能量(放热反应)。
3.化学反应中能量变化的决定因素
【导思】物质都储存有化学能,化学反应中的能量变化与物质本身的能量有什么关系呢?
【理论分析】
从物质本身的能量看,各种物质都具有 ,不同的物质所具有的能量 ,
因此化学反应在发生物质变化的同时必然伴随着 变化。通常主要变现为热量的____________。
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于
。
放热反应 吸热反应
反应过程图示
当反应物总能量 生成物总能量时,反应为 反应;
当反应物总能量 生成物总能量时,反应为 反应。
【方法技巧】利用化学键计算化学反应中的能量变化
用Q(吸)表示反应物分子化学键断裂时吸收的总能量,Q(放)表示生成物分子化学键形成时放出的总能量。
⑴ 计算公式:ΔQ=Q(吸)-Q(放)
⑵ 举例:
化学键变化 能量变化
拆开1 mol N≡N 吸收946 kJ
拆开1 mol H-H 吸收436 kJ
形成1 mol N-H 放出391 kJ
则反应:N2 + 3H2 2NH3的能量变化
计算公式为:ΔQ=Q(吸)-Q(放)=
ΔQ如果为正值,意味着是吸热反应,ΔQ如果是负值,意味着是放热反应
4.两条基本的自然定律
⑴ 质量守恒定律:自然界的物质发生转化时,________不变。
⑵ 能量守恒定律:一种形式的能量可以转化为另一种形式的能量,但是体系包含的_____不变。
【目标三】化学能与热能相互转化的应用
1.人类利用能源的三个阶段
⑴ 柴草时期:该时期从火的发现至18世纪产业革命,以树枝杂草为主要能源。
⑵ 化石能源时期:从18世纪中期到现代,人类获取热能的主要途径是: ,使用最多的常规能源是: 。
⑶ 多能源结构时期:以________能源和清洁能源(______能源)为主要能源,主要包括_____________________等。
2.化石燃料获取能量面临的问题
⑴ 储量有限,短期内不可再生。
⑵ 影响环境:煤、石油产品燃烧排放的 等是大气污染物的主要来源。
3.节能减排的措施
⑴ 燃料燃烧阶段提高燃料的燃烧效率。
⑵ 能量利用阶段提高能源的利用率。
⑶ 开发使用新能源,目前人们比较关注的新能源有 等。
【导练1】下列说法中不正确的是( )
A.任何化学反应都伴随着热量的变化
B.化学反应的特征是有新物质生成
C.经过加热而发生的化学反应不一定都是吸热反应
D.只要有化学键的断裂,一定发生化学反应
【导练2】下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.化学反应中的能量变化都表现为热量变化
C.任何放热反应在常温下一定能发生
D.反应物和生成物所具有的总能量的相对大小决定了反应是放热还是吸热
(
2
)
第一课时 学案
【学习目标】
1.认识物质具有能量,知道常见的吸热反应与放热反应。
2.能从反应物与生成物所具有的能量、化学键的断裂与形成两个角度理解化学反应中能量变化的主要原因。
3.知道化学反应可以实现化学能与其他能量形式的转化。
【目标一】化学反应中存在热量变化
1.实验探究(P32实验6-1和实验6-2)
实验操作
实验现象 ①看到有_______产生; ②用温度计测得反应后温度______ ①闻到_______气味; ②用手触摸杯壁下部,冰凉,用手拿起烧杯,______________________________
实验结论 该反应产生______,______热量 该反应产生NH3和H2O,______热量
化学方程式 _________________________ Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O
结论 化学反应中总会伴随着能量变化,通常主要表现为热能的变化,有的放出热量,有的吸收热量。
2.常见的吸热反应和放热反应
⑴ 放热反应:化学上把 热量的化学反应称为放热反应。
①所有的燃烧都是放热反应:
Mg + CO2 Na + O2
②所有的中和反应:NaOH(aq) + CH3COOH(aq) ===
③活泼金属与酸(水)的反应:
Na + H2O === Cu + HNO3(稀) ===
④能自发进行的氧化还原反应:
Fe + CuSO4 === KMnO4 + H2O2 + H2SO4 ===
⑤大多数化合反应: Mg + N2 Fe + S
另外,一些强酸、强碱溶于水(如浓H2SO4、NaOH(s))属于放热过程。
⑵ 吸热反应:化学上把 热量的化学反应称为吸热反应。
①较典型的反应:
Ba(OH)2·8H2O和NH4Cl反应:
②大多数分解反应: KClO3
③以C、CO、H2为还原剂的氧化还原反应:C + H2O(g)
【注意】大多数化合反应都是放热的,大多数分解反应都是吸热的。也有例外:
如:H2 + I2 N2 + O2 CO2 + C
另外,弱电解质的电离(如NH3·H2O H2O )
及一些物质溶于水(如NH4NO3、NH4Cl)属于吸热过程。
【目标二】化学反应中能量变化的原因
1.化学反应中的能量变化
【导思】化学反应中为什么会有能量变化?为什么有的化学反应释放能量,有的化学反应吸收能量?
【理论分析】
物质中的原子是通过化学键相结合的,任何化学反应的发生都可以看作是 (旧键)的断裂和 (新键)的形成的过程。物质发生化学反应时,断开反应物中的化学键要 能量,而形成生成物中化学键要 能量。
【实例】 (25 ℃和101 kPa的条件下) H2(g)+Cl2(g)===2HCl(g)
①该反应过程中共吸收 kJ能量,共放出 kJ能量。
②该反应 (填“放出”或“吸收”) kJ热量,为 反应。
2.化学反应中能量变化的本质原因
是化学反应中能量变化的主要原因。
E1 E2,反应吸收能量(吸热反应);
E1 E2,反应放出能量(放热反应)。
3.化学反应中能量变化的决定因素
【导思】物质都储存有化学能,化学反应中的能量变化与物质本身的能量有什么关系呢?
【理论分析】
从物质本身的能量看,各种物质都具有 ,不同的物质所具有的能量 ,
因此化学反应在发生物质变化的同时必然伴随着 变化。通常主要变现为热量的____________。
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于
。
放热反应 吸热反应
反应过程图示
当反应物总能量 生成物总能量时,反应为 反应;
当反应物总能量 生成物总能量时,反应为 反应。
【方法技巧】利用化学键计算化学反应中的能量变化
用Q(吸)表示反应物分子化学键断裂时吸收的总能量,Q(放)表示生成物分子化学键形成时放出的总能量。
⑴ 计算公式:ΔQ=Q(吸)-Q(放)
⑵ 举例:
化学键变化 能量变化
拆开1 mol N≡N 吸收946 kJ
拆开1 mol H-H 吸收436 kJ
形成1 mol N-H 放出391 kJ
则反应:N2 + 3H2 2NH3的能量变化
计算公式为:ΔQ=Q(吸)-Q(放)=
ΔQ如果为正值,意味着是吸热反应,ΔQ如果是负值,意味着是放热反应
4.两条基本的自然定律
⑴ 质量守恒定律:自然界的物质发生转化时,________不变。
⑵ 能量守恒定律:一种形式的能量可以转化为另一种形式的能量,但是体系包含的_____不变。
【目标三】化学能与热能相互转化的应用
1.人类利用能源的三个阶段
⑴ 柴草时期:该时期从火的发现至18世纪产业革命,以树枝杂草为主要能源。
⑵ 化石能源时期:从18世纪中期到现代,人类获取热能的主要途径是: ,使用最多的常规能源是: 。
⑶ 多能源结构时期:以________能源和清洁能源(______能源)为主要能源,主要包括_____________________等。
2.化石燃料获取能量面临的问题
⑴ 储量有限,短期内不可再生。
⑵ 影响环境:煤、石油产品燃烧排放的 等是大气污染物的主要来源。
3.节能减排的措施
⑴ 燃料燃烧阶段提高燃料的燃烧效率。
⑵ 能量利用阶段提高能源的利用率。
⑶ 开发使用新能源,目前人们比较关注的新能源有 等。
【导练1】下列说法中不正确的是( )
A.任何化学反应都伴随着热量的变化
B.化学反应的特征是有新物质生成
C.经过加热而发生的化学反应不一定都是吸热反应
D.只要有化学键的断裂,一定发生化学反应
【导练2】下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.化学反应中的能量变化都表现为热量变化
C.任何放热反应在常温下一定能发生
D.反应物和生成物所具有的总能量的相对大小决定了反应是放热还是吸热
(
2
)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
