高中化学人教版(2019)必修二 第六章第一节化学反应与能量变化第二课时学案(含答案)
文档属性
| 名称 | 高中化学人教版(2019)必修二 第六章第一节化学反应与能量变化第二课时学案(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 878.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 17:17:05 | ||
图片预览

文档简介
第六章第一节化学反应与能量变化
第二课时学案
【学习目标】
1.认识化学能可以转化为电能,从氧化还原反应的角度初步认识原电池的工作原理。
2.通过探究实验,能辨识原电池的构成要素;能设计简单原电池。
3.能正确判断原电池的正负极;能够正确书写电极反应及总反应方程式。
【目标一】火力发电(间接转变)
1.我国目前电能主要来自_____发电,其次来自_____发电。
2.火力发电原理:通过化石燃料燃烧,使_______转变为_____,加热使水汽化为蒸汽以推动蒸汽轮机,然后带动发电机发电。
(
燃料燃烧
化学能
) (
蒸汽轮机
) (
发电机
)3.火力发电流程:
(
能
) (
电能
) (
能
)
其中能量转换的关键环节是______________。
4.火力发电缺点:①转换环节多;②发电效率低;③能源浪费多;④环境污染严重等。
5.燃烧的氧化还原反应本质:
氧化剂与还原剂之间发生电子转移,引起化学键重新组合,同时伴随有能量变化。
【思考】能否将氧化还原反应释放的能量直接转化为电能呢?
【目标二】原电池工作原理
1.实验探究(实验6-3)
实验装置 实验现象 实验结论或解释
锌片: ,有 产生 铜片: 锌与稀硫酸反应生成 ,铜与稀硫酸
锌片: 铜片: 电流表:指针 锌 电子,变为 ,电子经过导线流向 ,产生电流, 在铜片上 电子生成 ,反应过程中产生了
2.原电池的概念:
定义:把___________转化为_______的装置。其反应本质是________________。
从理论上讲,能自发进行的氧化还原反应(即符合强氧化剂与强还原剂反应生成弱的氧化剂
与弱的还原剂的反应),都可设计为原电池。
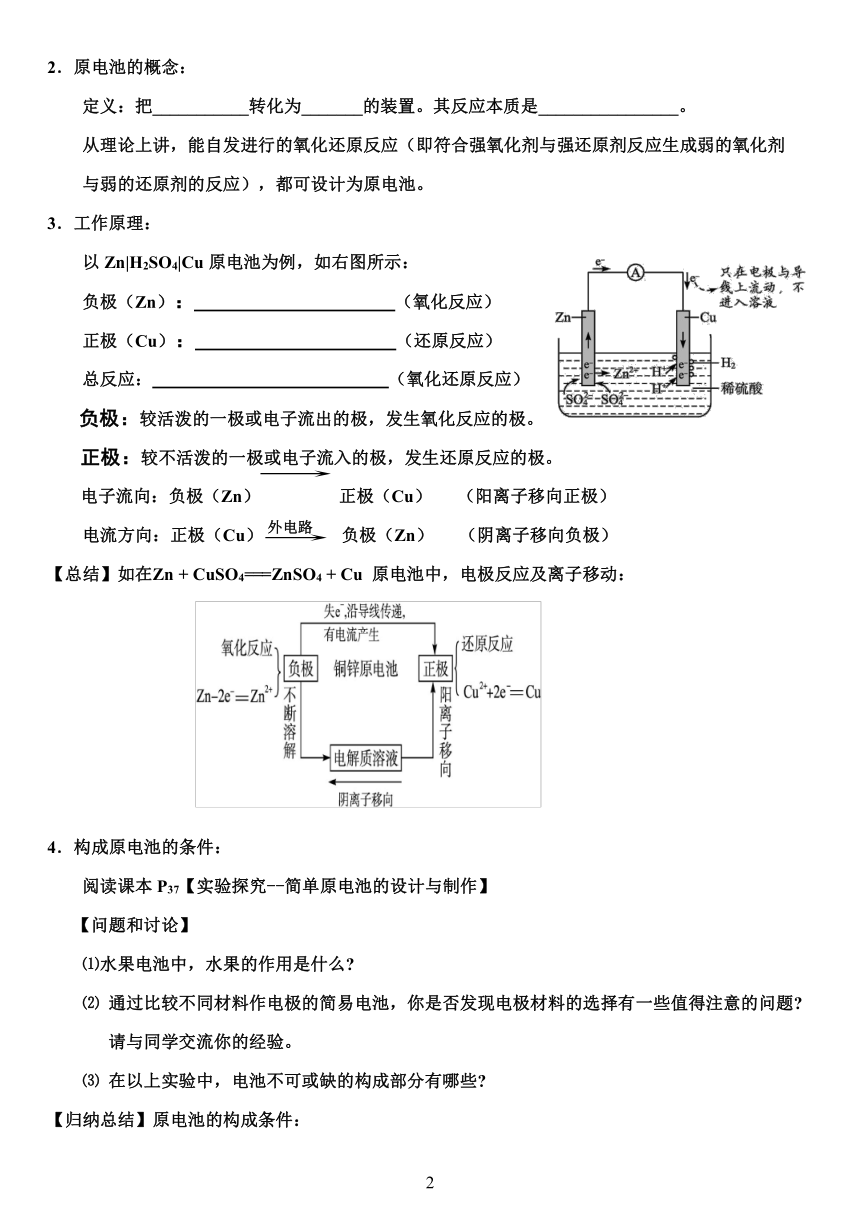
3.工作原理:
以Zn|H2SO4|Cu原电池为例,如右图所示:
负极(Zn): (氧化反应)
正极(Cu): (还原反应)
总反应: (氧化还原反应)
负极:较活泼的一极或电子流出的极,发生氧化反应的极。
(
外电路
)正极:较不活泼的一极或电子流入的极,发生还原反应的极。
(
外电路
)电子流向:负极(Zn) 正极(Cu) (阳离子移向正极)
电流方向:正极(Cu) 负极(Zn) (阴离子移向负极)
【总结】如在Zn + CuSO4===ZnSO4 + Cu 原电池中,电极反应及离子移动:
4.构成原电池的条件:
阅读课本P37【实验探究--简单原电池的设计与制作】
【问题和讨论】
⑴水果电池中,水果的作用是什么
⑵ 通过比较不同材料作电极的简易电池,你是否发现电极材料的选择有一些值得注意的问题 请与同学交流你的经验。
⑶ 在以上实验中,电池不可或缺的构成部分有哪些
【归纳总结】原电池的构成条件:
⑴ ⑵
⑶ ⑷本质条件:
【导练1】下列装置能构成原电池的是( )
(
Zn
H
2
SO
4
Zn
Zn
C
2
H
5
OH
Cu
Zn
H
2
SO
4
Cu
Zn
HCl
Cu
Fe
HCl
A B C D E
)
【特别注意】:
⑴ 电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成一个完整的闭合回路。
⑵ 在原电池中,电子不能通过电解质溶液。
⑶ 原电池的负极失去电子的总数等于正极得到电子的总数。
5.电极反应式的书写
【导练2】将下列反应设计成原电池:
⑴ Zn与CuSO4反应:负极(材料为 ): ( 反应)
正极(材料为 ): ( 反应)
总化学反应式:
⑵ Fe与FeCl3反应: 负极(材料为 ): ( 反应)
正极(材料为 ): ( 反应)
总化学反应式:
6.原电池正负极的判断:
⑴ 根据电极材料判断,一般情况下相对活泼的金属作 ,活泼性较弱的金属或非金属导体作 。
【说明】此判定一定要注意实际情况,如:Mg-Al-NaOH,Al才是负极;Al-Cu-浓硝酸,Cu才是负极;如果是由金属和非金属导体(或金属氧化物导体)作电极,金属是负极,非金属导体(或金属氧化物导体) 作正极。
⑵ 根据氧化反应、还原反应发生的位置判定,发生氧化反应的极(或失电子的极)为 ,
即(负失氧);发生还原反应的极(或得电子的极)为 ,即(正得还)。
⑶ 根据电子流出或电流流入的电极为 ,相反为 。
⑷ 根据电解质溶液内离子流动方向判断:阳离子移向的电极为 ,阴离子移向的电极为 。
⑸ 根据原电池的两极发生的现象判断:
溶解或质量减轻的电极为 ,有气体或金属析出的电极为 。
7.原电池的应用:
⑴ 比较金属的活动性强弱。一般来说,原电池的负极金属比正极金属活动性强。
⑵ 加快氧化还原反应的速率。
在原电池中,氧化反应和还原反应分别在两极进行,使溶液中粒子运动相互间的干扰减小,使反应速率增大。
⑶ 用于金属保护:将被保护的金属与比其活泼的金属连接,形成原电池。
【导练3】为了加快锌粒和稀硫酸反应放出氢气的速率,可以采取的措施有__________。
①将锌粒换为锌粉 ②向体系中加入比原硫酸浓度大的稀硫酸
③向体系中加入醋酸钠 ④向体系中加入铜粉 ⑤向体系中加入少量硝酸
【导练4】把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,d极上发生氧化反应,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b C.c > a > b > d D.b > d > c > a
【导练5】图所示,两电极一极为碳棒,一极为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
(
1
)
第二课时学案
【学习目标】
1.认识化学能可以转化为电能,从氧化还原反应的角度初步认识原电池的工作原理。
2.通过探究实验,能辨识原电池的构成要素;能设计简单原电池。
3.能正确判断原电池的正负极;能够正确书写电极反应及总反应方程式。
【目标一】火力发电(间接转变)
1.我国目前电能主要来自_____发电,其次来自_____发电。
2.火力发电原理:通过化石燃料燃烧,使_______转变为_____,加热使水汽化为蒸汽以推动蒸汽轮机,然后带动发电机发电。
(
燃料燃烧
化学能
) (
蒸汽轮机
) (
发电机
)3.火力发电流程:
(
能
) (
电能
) (
能
)
其中能量转换的关键环节是______________。
4.火力发电缺点:①转换环节多;②发电效率低;③能源浪费多;④环境污染严重等。
5.燃烧的氧化还原反应本质:
氧化剂与还原剂之间发生电子转移,引起化学键重新组合,同时伴随有能量变化。
【思考】能否将氧化还原反应释放的能量直接转化为电能呢?
【目标二】原电池工作原理
1.实验探究(实验6-3)
实验装置 实验现象 实验结论或解释
锌片: ,有 产生 铜片: 锌与稀硫酸反应生成 ,铜与稀硫酸
锌片: 铜片: 电流表:指针 锌 电子,变为 ,电子经过导线流向 ,产生电流, 在铜片上 电子生成 ,反应过程中产生了
2.原电池的概念:
定义:把___________转化为_______的装置。其反应本质是________________。
从理论上讲,能自发进行的氧化还原反应(即符合强氧化剂与强还原剂反应生成弱的氧化剂
与弱的还原剂的反应),都可设计为原电池。
3.工作原理:
以Zn|H2SO4|Cu原电池为例,如右图所示:
负极(Zn): (氧化反应)
正极(Cu): (还原反应)
总反应: (氧化还原反应)
负极:较活泼的一极或电子流出的极,发生氧化反应的极。
(
外电路
)正极:较不活泼的一极或电子流入的极,发生还原反应的极。
(
外电路
)电子流向:负极(Zn) 正极(Cu) (阳离子移向正极)
电流方向:正极(Cu) 负极(Zn) (阴离子移向负极)
【总结】如在Zn + CuSO4===ZnSO4 + Cu 原电池中,电极反应及离子移动:
4.构成原电池的条件:
阅读课本P37【实验探究--简单原电池的设计与制作】
【问题和讨论】
⑴水果电池中,水果的作用是什么
⑵ 通过比较不同材料作电极的简易电池,你是否发现电极材料的选择有一些值得注意的问题 请与同学交流你的经验。
⑶ 在以上实验中,电池不可或缺的构成部分有哪些
【归纳总结】原电池的构成条件:
⑴ ⑵
⑶ ⑷本质条件:
【导练1】下列装置能构成原电池的是( )
(
Zn
H
2
SO
4
Zn
Zn
C
2
H
5
OH
Cu
Zn
H
2
SO
4
Cu
Zn
HCl
Cu
Fe
HCl
A B C D E
)
【特别注意】:
⑴ 电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成一个完整的闭合回路。
⑵ 在原电池中,电子不能通过电解质溶液。
⑶ 原电池的负极失去电子的总数等于正极得到电子的总数。
5.电极反应式的书写
【导练2】将下列反应设计成原电池:
⑴ Zn与CuSO4反应:负极(材料为 ): ( 反应)
正极(材料为 ): ( 反应)
总化学反应式:
⑵ Fe与FeCl3反应: 负极(材料为 ): ( 反应)
正极(材料为 ): ( 反应)
总化学反应式:
6.原电池正负极的判断:
⑴ 根据电极材料判断,一般情况下相对活泼的金属作 ,活泼性较弱的金属或非金属导体作 。
【说明】此判定一定要注意实际情况,如:Mg-Al-NaOH,Al才是负极;Al-Cu-浓硝酸,Cu才是负极;如果是由金属和非金属导体(或金属氧化物导体)作电极,金属是负极,非金属导体(或金属氧化物导体) 作正极。
⑵ 根据氧化反应、还原反应发生的位置判定,发生氧化反应的极(或失电子的极)为 ,
即(负失氧);发生还原反应的极(或得电子的极)为 ,即(正得还)。
⑶ 根据电子流出或电流流入的电极为 ,相反为 。
⑷ 根据电解质溶液内离子流动方向判断:阳离子移向的电极为 ,阴离子移向的电极为 。
⑸ 根据原电池的两极发生的现象判断:
溶解或质量减轻的电极为 ,有气体或金属析出的电极为 。
7.原电池的应用:
⑴ 比较金属的活动性强弱。一般来说,原电池的负极金属比正极金属活动性强。
⑵ 加快氧化还原反应的速率。
在原电池中,氧化反应和还原反应分别在两极进行,使溶液中粒子运动相互间的干扰减小,使反应速率增大。
⑶ 用于金属保护:将被保护的金属与比其活泼的金属连接,形成原电池。
【导练3】为了加快锌粒和稀硫酸反应放出氢气的速率,可以采取的措施有__________。
①将锌粒换为锌粉 ②向体系中加入比原硫酸浓度大的稀硫酸
③向体系中加入醋酸钠 ④向体系中加入铜粉 ⑤向体系中加入少量硝酸
【导练4】把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,d极上发生氧化反应,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b C.c > a > b > d D.b > d > c > a
【导练5】图所示,两电极一极为碳棒,一极为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
(
1
)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
