2023届高考化学二轮复习:离子的检验 课件(共17张PPT)
文档属性
| 名称 | 2023届高考化学二轮复习:离子的检验 课件(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 556.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 19:00:57 | ||
图片预览






文档简介
(共16张PPT)
离子反应的应用
迁移运用
1.胃酸过多的病人服可用什么样的药物呢?
常见胃药主要成分:氢氧化镁、碳酸镁、碳酸氢钠、干燥氢氧化铝凝胶等。
违背了客观事实。
1.铁与稀盐酸反应
2Fe+6H+ = 2Fe3++3H2↑
违背了质量守恒
2.铝与稀盐酸反应
Al+3H+ = Al3++H2↑
3.FeCl3与Fe反应
Fe3++Fe = 2Fe2+
违背了电荷守恒
离子方程式正误判断
化学物质拆写是否确?
4.碳酸钡和稀硝酸反应
CO32-+2H+ = H2O+CO2↑
BaCO3+2H+ = Ba2++H2O+CO2↑
离子方程式正误判断
√
5.氢氧化钡和稀硫酸
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
√
6.氢氧化镁与稀盐酸混合:
Mg(OH)2+2H+=Mg2++2H2O
√
小组讨论完成:检验溶液中Cl-、SO42-、NH4+的基本方法。(书写涉及的离子方程式)
①Cl-:取样,加入稀硝酸酸化的硝酸银溶液,生成白色沉淀。
②SO42-:取样,先加稀盐酸,无明显现象,再加BaCl2,产生白色沉淀。
③NH4+:取样液于试管中,先加浓的氢氧化钠溶液,并加热,若试管口湿润的红色石蕊试纸变蓝,则溶液中有NH4+。
任务一、离子的检验
问题1.检验时用到哪些方法?
D
例1.在某无色的强酸性溶液中,能大量共存的离子组是 ( )
A.N、Cu2+、Cl-、Br- B.Na+、K+、C、Cl-
C.K+、Fe3+、I-、S D.K+、Mg2+、S、Cl-
例2.下列体系中,离子可能大量共存的是 ( )
A.滴加紫色石蕊显红色的溶液:N、K+、Cl-、HC
B.常温下,无色的溶液:Fe2+、Mg2+、S、N
C.使酚酞试剂显红色的溶液:Na+、Ba2+、N、K+
D.加入Fe能产生H2的溶液:K+、CH3COO-、N、Cl-
C
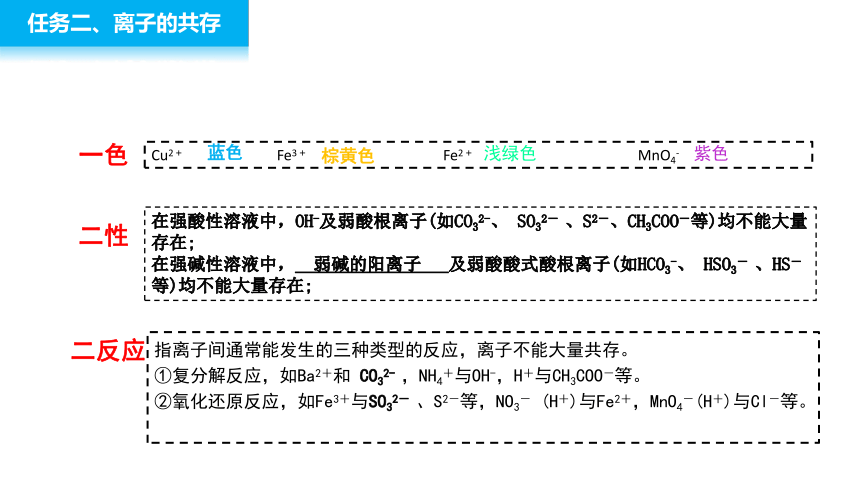
任务二、离子的共存
Cu2+ Fe3+ Fe2+ MnO4-
在强酸性溶液中,OH-及弱酸根离子(如CO32-、 SO32- 、S2-、CH3COO-等)均不能大量存在;
在强碱性溶液中, 弱碱的阳离子 及弱酸酸式酸根离子(如HCO3-、 HSO3- 、HS-等)均不能大量存在;
蓝色
浅绿色
紫色
棕黄色
指离子间通常能发生的三种类型的反应,离子不能大量共存。
①复分解反应,如Ba2+和 CO32- ,NH4+与OH-,H+与CH3COO-等。
②氧化还原反应,如Fe3+与SO32- 、S2-等,NO3- (H+)与Fe2+,MnO4-(H+)与Cl-等。
一色
二性
二反应
任务二、离子的共存
自测题
1、在下列溶液中,各组离子能否能大量共存,不能共存的说明原因
(1)NH4+、H+、NO3-、HCO3-
(2)Ca2+、H+、CO32-、NO3-
(3) H+、 Na+、 SO42- 、OH-
(4)使酚酞试液变红的溶液:
Na+、 Cl- 、SO42-、Cu2+
(5)使紫色石蕊试液变红的溶液:
K+、Na+、NO3-、CH3COO-
2、某无色溶液中,可大量共存的离子组是( )
条件类型 题中的常见表述 难点透析
常见的 限制条件
常见的 易错点
有色离子不能大量存在
溶液显酸性或碱性
只能是氧化性离子和还原性离子不能大量共存,不包括其他类型反应的离子
“透明”也可“有色”
“无色”
“pH=1”或
“pH=13”
“因发生氧化还原反应而不能大量共存”
“透明”
问题2.混有泥沙、Ca2+、Mg2+、SO42-的粗盐,如何进行提纯?依次写出离子方程式。
任务三、离子的除杂
由实验(1) 可能含有SO42-、CO32-
结合实验(2) SO42-、CO32-都有,与之不能大量共存的Ca2+无
溶液电中性 有K+
实验(1)中引入了Cl-,导致无法确定原溶液有Cl-
任务四、离子的推断
加入的试剂引入原溶液中可能存在的离子。
阴、阳离子的总电荷数是守恒的,即溶液呈电中性。
题给条件实验现象
肯定性原则
互斥性原则
进出性原则
电中性原则
判断溶液一定有的离子和不可能有的离子。
利用判断出一定有的离子,将不能与之大
量共存的离子排除。
例1.(2017.4)某固体混合物中可能含有:K+、Na+、Clˉ、CO32-、SO42-等离子,将该固体溶解所得到的溶液进行如下实验:
溶液
黄色
焰色反应
过量Ba(NO3)2
AgNO3/HNO3
溶液
白色沉淀
沉淀溶解
白色沉淀
过量盐酸
下列说法正确的是
A.该混合物一定是K2CO3和NaCl B.该混合物可能是Na2CO3和KCl
C.该混合物可能是Na2SO4和Na2CO3 D.该混合物一定是Na2CO3和NaCl
含有Cl-
含有CO32-无SO42-
含有Na+可能有K+
B
例2.某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀。
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)。
下列说法正确的是
A.该固体中一定含有NH4+、CO32-、SO42-、Na+
B.该固体中一定没有Cu2+、Cl-、Na+
C.该固体中只含有NH4+、CO32-、SO42-、Cl-
D.根据以上实验,无法确定该固体中有Na+
NH4+的物质的量为0.03mol
SO42-的物质的量为0.02mol
CO32-的物质的量为0.01mol
A
03 难点透析
肯定性原则
互斥性原则
进出性原则
电中性原则
注意审题
整合条件
定性与定量相结合
整合四项基本原则
灵活运用
离子反应的应用
迁移运用
1.胃酸过多的病人服可用什么样的药物呢?
常见胃药主要成分:氢氧化镁、碳酸镁、碳酸氢钠、干燥氢氧化铝凝胶等。
违背了客观事实。
1.铁与稀盐酸反应
2Fe+6H+ = 2Fe3++3H2↑
违背了质量守恒
2.铝与稀盐酸反应
Al+3H+ = Al3++H2↑
3.FeCl3与Fe反应
Fe3++Fe = 2Fe2+
违背了电荷守恒
离子方程式正误判断
化学物质拆写是否确?
4.碳酸钡和稀硝酸反应
CO32-+2H+ = H2O+CO2↑
BaCO3+2H+ = Ba2++H2O+CO2↑
离子方程式正误判断
√
5.氢氧化钡和稀硫酸
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
√
6.氢氧化镁与稀盐酸混合:
Mg(OH)2+2H+=Mg2++2H2O
√
小组讨论完成:检验溶液中Cl-、SO42-、NH4+的基本方法。(书写涉及的离子方程式)
①Cl-:取样,加入稀硝酸酸化的硝酸银溶液,生成白色沉淀。
②SO42-:取样,先加稀盐酸,无明显现象,再加BaCl2,产生白色沉淀。
③NH4+:取样液于试管中,先加浓的氢氧化钠溶液,并加热,若试管口湿润的红色石蕊试纸变蓝,则溶液中有NH4+。
任务一、离子的检验
问题1.检验时用到哪些方法?
D
例1.在某无色的强酸性溶液中,能大量共存的离子组是 ( )
A.N、Cu2+、Cl-、Br- B.Na+、K+、C、Cl-
C.K+、Fe3+、I-、S D.K+、Mg2+、S、Cl-
例2.下列体系中,离子可能大量共存的是 ( )
A.滴加紫色石蕊显红色的溶液:N、K+、Cl-、HC
B.常温下,无色的溶液:Fe2+、Mg2+、S、N
C.使酚酞试剂显红色的溶液:Na+、Ba2+、N、K+
D.加入Fe能产生H2的溶液:K+、CH3COO-、N、Cl-
C
任务二、离子的共存
Cu2+ Fe3+ Fe2+ MnO4-
在强酸性溶液中,OH-及弱酸根离子(如CO32-、 SO32- 、S2-、CH3COO-等)均不能大量存在;
在强碱性溶液中, 弱碱的阳离子 及弱酸酸式酸根离子(如HCO3-、 HSO3- 、HS-等)均不能大量存在;
蓝色
浅绿色
紫色
棕黄色
指离子间通常能发生的三种类型的反应,离子不能大量共存。
①复分解反应,如Ba2+和 CO32- ,NH4+与OH-,H+与CH3COO-等。
②氧化还原反应,如Fe3+与SO32- 、S2-等,NO3- (H+)与Fe2+,MnO4-(H+)与Cl-等。
一色
二性
二反应
任务二、离子的共存
自测题
1、在下列溶液中,各组离子能否能大量共存,不能共存的说明原因
(1)NH4+、H+、NO3-、HCO3-
(2)Ca2+、H+、CO32-、NO3-
(3) H+、 Na+、 SO42- 、OH-
(4)使酚酞试液变红的溶液:
Na+、 Cl- 、SO42-、Cu2+
(5)使紫色石蕊试液变红的溶液:
K+、Na+、NO3-、CH3COO-
2、某无色溶液中,可大量共存的离子组是( )
条件类型 题中的常见表述 难点透析
常见的 限制条件
常见的 易错点
有色离子不能大量存在
溶液显酸性或碱性
只能是氧化性离子和还原性离子不能大量共存,不包括其他类型反应的离子
“透明”也可“有色”
“无色”
“pH=1”或
“pH=13”
“因发生氧化还原反应而不能大量共存”
“透明”
问题2.混有泥沙、Ca2+、Mg2+、SO42-的粗盐,如何进行提纯?依次写出离子方程式。
任务三、离子的除杂
由实验(1) 可能含有SO42-、CO32-
结合实验(2) SO42-、CO32-都有,与之不能大量共存的Ca2+无
溶液电中性 有K+
实验(1)中引入了Cl-,导致无法确定原溶液有Cl-
任务四、离子的推断
加入的试剂引入原溶液中可能存在的离子。
阴、阳离子的总电荷数是守恒的,即溶液呈电中性。
题给条件实验现象
肯定性原则
互斥性原则
进出性原则
电中性原则
判断溶液一定有的离子和不可能有的离子。
利用判断出一定有的离子,将不能与之大
量共存的离子排除。
例1.(2017.4)某固体混合物中可能含有:K+、Na+、Clˉ、CO32-、SO42-等离子,将该固体溶解所得到的溶液进行如下实验:
溶液
黄色
焰色反应
过量Ba(NO3)2
AgNO3/HNO3
溶液
白色沉淀
沉淀溶解
白色沉淀
过量盐酸
下列说法正确的是
A.该混合物一定是K2CO3和NaCl B.该混合物可能是Na2CO3和KCl
C.该混合物可能是Na2SO4和Na2CO3 D.该混合物一定是Na2CO3和NaCl
含有Cl-
含有CO32-无SO42-
含有Na+可能有K+
B
例2.某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀。
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)。
下列说法正确的是
A.该固体中一定含有NH4+、CO32-、SO42-、Na+
B.该固体中一定没有Cu2+、Cl-、Na+
C.该固体中只含有NH4+、CO32-、SO42-、Cl-
D.根据以上实验,无法确定该固体中有Na+
NH4+的物质的量为0.03mol
SO42-的物质的量为0.02mol
CO32-的物质的量为0.01mol
A
03 难点透析
肯定性原则
互斥性原则
进出性原则
电中性原则
注意审题
整合条件
定性与定量相结合
整合四项基本原则
灵活运用
同课章节目录
