2023届高考化学二轮复习:离子反应及与量有关...书写 课件(共30张PPT)
文档属性
| 名称 | 2023届高考化学二轮复习:离子反应及与量有关...书写 课件(共30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 456.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 19:01:24 | ||
图片预览











文档简介
(共30张PPT)
离 子 反 应
①铜 ②NaCl晶体 ③NH3 ④醋酸 ⑤氨水 ⑥酒精 ⑦KOH溶液 ⑧熔融状态的KNO3 ⑨HCl BaSO4
属于电解质的有:
属于非电解质的有 :
能导电的有:
②④⑧⑨
③⑥⑩
⑩葡萄糖
氢碘酸
一、电解质与非电解质
①⑤⑦⑧
必须注意的几点:
①电解质和非电解质是化合物
②电解质必须是本身能够电离的化合物。
③电解质导电的条件:在水溶液或熔化状态下。
练习:下列各组关于强电解质、弱电解质、非电解质的归类,
完全正确的是( )
选项 A B C D
强电解质 Fe NaCl CaCO3 HNO3
弱电解质 CH3COOH NH3 H3PO4 Fe(OH)3
非电解质 蔗糖 BaSO4 乙醇 H2O
二、电离方程式
H2SO3
NaHCO3
KHSO4
NH3.H2O
Al(OH)3
MgCO3
强等号 弱可逆 多元弱酸要分步
NaHCO3 =Na+ +HCO3-
KHSO4 = K+ +H++ SO42-
Al(OH)3 Al3+ +3OH-
H2SO3 HSO3- + H+
HSO3- H++SO32-
NH3.H2O NH4+ + OH-
MgCO3 = Mg2++ CO32-
水溶液中
三、离子反应
用韦恩图表示化合反应、氧化还原反应、离子反应的关系。
化合
氧还
离子
写出符合阴影区域的条件的化学方程式
1. 定义
FeCl3+Fe
FeCl2+Cl2
①发生复分解反应:
2. 离子反应发生的条件
生成难溶、难电离和易挥发的物质
②发生氧化还原反应
③发生络合反应
例1.下列离子在指定溶液中可能大量共存的是
A.c(H+)=0.1 mol·L-1溶液中:K+、Fe2+、MnO4-、SO42-
B.某透明溶液中:Fe3+、NH4+、NO3-、Cl-
C.能使酚酞变红的溶液中:Na+、Cl-、SO42-、NH4+
D.c(OH-)=0.1 mol·L-1溶液中:HS-、K+、Na+、Al3+
3. 某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验:
(1)一份固体溶于水得透明溶液,加入足量BaCl2溶液,得沉淀6.63 g,在沉淀中加入过量稀盐酸,仍有4.66 g沉淀。
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672 L(标准状况)。
下列说法正确的是
A.该固体中一定含有NH4+、CO32-、SO42-、Na+
B.该固体中一定没有Cu2+、Cl-、Na+
C.该固体中只含有NH4+、CO32-、SO42-、Cl-
D.根据以上实验,无法确定该固体中是否有Na+
A
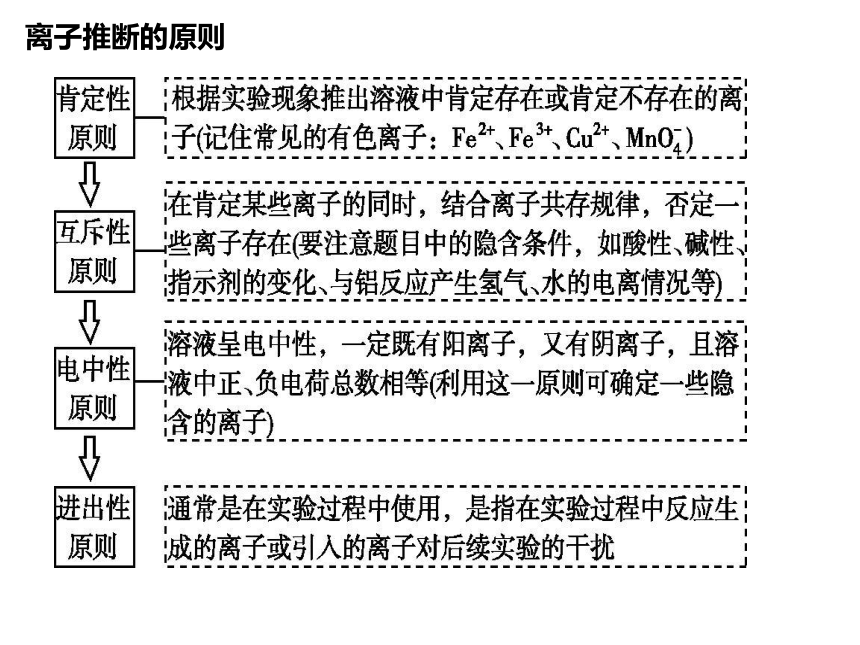
离子推断的原则
4.某绿色溶液 A 含有 H+、Na+、Mg2+、Fe2+、Cu2+、SO42ˉ、Clˉ、CO32ˉ和 HCO3ˉ离子中的若干种。取该溶液进行如下实验(已知 Ag2SO4微溶于水,可溶于酸):
①向溶液中滴加 Ba(OH)2溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液 B;
②取滤液 B,先用 HNO3酸化,再滴加 0.001 mol·Lˉ1 AgNO3 溶液,有白色沉淀生成。
下列说法不正确的是
A.溶液 A 中一定存在 H+、SO42ˉ和 Clˉ
B.溶液 A 中不存在 Mg2+、CO32ˉ和 HCO3ˉ,不能确定 Na+的存在
C.第②步生成的白色沉淀中只有 AgCl,没有 Ag2CO3
D.溶液 A 中存在 Fe2+与 Cu2+中的一种或两种,且可以用 NaOH
溶液判断
B
3. 离子方程式
拆:把可溶性强电解质(即强酸、强碱、可溶性盐)拆成离子形式
写出实验室制氯气的离子方程式
MnO2 + 4H+ +2Cl- Mn2+ + Cl2 + 2H2O
4. 与量有关的离子方程式书写
一. 配比型离子反应
主要指一组反应物中有两种或两种以上离子同时参加反应时,因离子比例不协调(一般为酸式盐和复盐),当一组离子完全反应时,另一组离子不能恰好完全反应。
例1: NaHSO4溶液与Ba(OH)2溶液
“量少定1” “以少定多”
NaHSO4少量:
Ba(OH)2少量:
NaHSO4 : Ba(OH)2 =3:2
若反应物是定量的,则参加反应的离子严格按照给定的量之间的关系进行,按照以少定多方法书写。
1. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性。
2. 向上述中性溶液中继续滴入Ba(OH)2溶液发生的离子反应。
3. 向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀。
4. 向上述4溶液中继续滴入NaHSO4溶液发生的离子反应。
2OH- + Ba2+ +2H+ +SO42- = 2H2O + BaSO4↓
Ba2+ +SO42- = BaSO4
Ba2+ +SO42-+ H++ OH- = H2O + BaSO4↓
H++ OH- = H2O
变式
例2: KAl(SO4)2溶液与Ba(OH)2溶液
KAl(SO4)2溶液少量
Ba(OH)2溶液少量
写出下列反应的离子方程式
练1: NaHCO3溶液中加入足量的Ca(OH)2。
Ca(OH)2溶液中加入足量的NaHCO3溶液。
含有2molCa(OH)2和3molNaHCO3的两溶液混合。
2OH- + Ca2+ +2HCO3- = 2H2O +CaCO3↓
HCO3- + OH- +Ca2+ = H2O +CaCO3↓
3OH- + 2Ca2+ +3HCO3- = 3H2O +2CaCO3↓ + CO32-
练2: NaOH溶液中加入足量的Ca(HCO3)2溶液
Ca(HCO3)2溶液中加入足量的NaOH溶液
二. 连续型离子反应
指反应生成的物质因能与过量的反应物继续反应而与量有关。
例1:酸性氧化物与碱
NaOH溶液中通入少量CO2
NaOH溶液中通入过量CO2
含有5molNaOH的烧碱溶液中通入2mol CO2气体。
2OH- + CO2= CO32- + H2O
OH- + CO2= HCO3-
3
OH- CO32- HCO3-
CO2
CO2
例2:部分多元弱酸盐与强酸
Na2CO3溶液中加入少量盐酸。
Na2CO3溶液中加入足量盐酸。
CO32- + H+ = HCO3-
CO32- + 2H+ = H2O + CO2
CO32- HCO3- CO2
H+
H+
AlCl3溶液中加入少量NaOH溶液。
AlCl3溶液中加入过量NaOH溶液。
AlCl3溶液中加入过量氨水。
例3:铝盐与强碱
Al3+ + 3OH- = Al(OH)3↓
Al3+ + 4OH- = AlO2- + H2O
Al3+ + 3NH3.H2O = Al(OH)3↓ + NH4+
Al3+ Al(OH)3 AlO2-
3OH-
OH-
例4:偏铝酸盐与强酸
NaAlO2溶液中通入少量盐酸。
AlO2- + H+ + H2O = Al(OH)3↓
NaAlO2溶液中通入足量盐酸。
AlO2- + 4H+ = Al3+ + 2H2O
NaAlO2溶液中通入足量CO2
AlO2- + CO2 + H2O = Al(OH)3↓+ HCO3-
那NaAlO2溶液中通入少量CO2?
AlO2- Al(OH)3 Al3+
H+
3H+
没有连续
反应
例5:弱酸盐(NaB)与多元弱酸(H2A)
B- + H2A = HB + HA-
HA-+B- =HB+A2-
当H2A足量时:
多元弱酸H2A的H+是逐个被B-被结合
①若酸性HA- > HB, 则第二步可反应
②若酸性HB>HA- 则第二步不反应
H2A HA- A2-
B-
B-
总:H2A+2B- =2HB + A2-
总: H2A+B- = HB + HA-
酸性:H2A>HB
当H2A少量时:
第一步:
H2A+B-=HA-+HB
酸性H2A>HA- >HB,
酸性H2A>HB >HA- ,
第二步:
例1:酸性:H2CO3 > HCO3- > Al(OH)3
AlO2- + CO2 + H2O = Al(OH)3↓+ HCO3-
2AlO2- + CO2 + 3H2O = 2Al(OH)3↓+ CO32-
NaAlO2溶液中通入足量CO2
NaAlO2溶液中通入少量CO2
H2CO3 HCO3- CO32-
AlO2-
AlO2-
NaClO溶液中通入足量CO2。
NaClO溶液中通入少量CO2。
例2:酸性:H2CO3 > HClO > HCO3-
ClO- + CO2 + H2O = HClO+ HCO3-
ClO- + CO2 + H2O = HClO+ HCO3-
H2CO3 HCO3- CO32-
ClO-
ClO-
小结:
(1)若酸性 H2A > HB > HA-,
足量H2A与NaB反应:NaB + H2A = HB + NaHA
少量H2A与NaB反应: NaB + H2A = HB + NaHA
(2)若酸性 H2A > HA- > HB,
足量H2A与NaB反应: NaB + H2A = HB + NaHA
少量H2A与NaB反应: 2NaB + H2A = 2HB + Na2A
“强”制弱
酸根的“抢氢大战”
练习:Na2CO3溶液中通入少量Cl2。
Na2CO3溶液中通入足量Cl2。
三. 竞争先后型离子反应
主要指一种反应物的两种离子都能跟另一种反应物反应的离子反应,但因反应先后顺序不同而与量不同。
例1: NH4HSO4溶液与NaOH溶液
NH4HSO4溶液少量:
NaOH溶液少量:
“强者先行”
例2: FeBr2溶液中通入氯气
判断氧化性、还原性强弱,并用离子方程式证明。
(1)氧化性强弱顺序? Cl2 、Fe3+、Br2、 I2
Cl2>Br2:
Br2>Fe3+:
Fe3+>I2:
(2)还原性强弱顺序:
Cl2>Br2>Fe3+>I2
l->Fe2+>Br->Cl-
S2->l->Fe2+>Br->Cl-
留 碘 铁 修 路
2Br- + Cl2 = Br2 + 2Cl-
2Fe2+ + Br2 = 2Fe3+ + 2Br-
2Fe3+ +2 I- = 2Fe3+ + I2
例2:FeBr2溶液中通入少量氯气。
FeBr2溶液中通入过量氯气。
含有2molFeBr2的溶液中通入2mol氯气。
2Br- + Cl2 = Br2 + 2Cl-
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
例3:FeI2溶液中通入少量氯气。
FeI2溶液中通入过量氯气。
含有2molFeI2的溶液中通入2mol氯气。
2I- + Cl2 = I2 + 2Cl-
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
4.[2019·浙江金华外国语学校期中] 向含有物质的量均为0.01 mol的NaOH和Na2CO3的
混合溶液中逐滴滴加a L 0.01 mol·L-1的稀盐酸。下列说法不正确的是 ( )
A.当a=1时,发生的离子反应为OH-+H+=H2O
B.当a=2时,发生的离子反应为OH-+C+2H+=HC+H2O
C.当1(a×10-2-0.01)∶(0.02-a×10-2)
D.当a≥3时,发生的离子反应为3H++OH-+C=2H2O+CO2↑
C
离 子 反 应
①铜 ②NaCl晶体 ③NH3 ④醋酸 ⑤氨水 ⑥酒精 ⑦KOH溶液 ⑧熔融状态的KNO3 ⑨HCl BaSO4
属于电解质的有:
属于非电解质的有 :
能导电的有:
②④⑧⑨
③⑥⑩
⑩葡萄糖
氢碘酸
一、电解质与非电解质
①⑤⑦⑧
必须注意的几点:
①电解质和非电解质是化合物
②电解质必须是本身能够电离的化合物。
③电解质导电的条件:在水溶液或熔化状态下。
练习:下列各组关于强电解质、弱电解质、非电解质的归类,
完全正确的是( )
选项 A B C D
强电解质 Fe NaCl CaCO3 HNO3
弱电解质 CH3COOH NH3 H3PO4 Fe(OH)3
非电解质 蔗糖 BaSO4 乙醇 H2O
二、电离方程式
H2SO3
NaHCO3
KHSO4
NH3.H2O
Al(OH)3
MgCO3
强等号 弱可逆 多元弱酸要分步
NaHCO3 =Na+ +HCO3-
KHSO4 = K+ +H++ SO42-
Al(OH)3 Al3+ +3OH-
H2SO3 HSO3- + H+
HSO3- H++SO32-
NH3.H2O NH4+ + OH-
MgCO3 = Mg2++ CO32-
水溶液中
三、离子反应
用韦恩图表示化合反应、氧化还原反应、离子反应的关系。
化合
氧还
离子
写出符合阴影区域的条件的化学方程式
1. 定义
FeCl3+Fe
FeCl2+Cl2
①发生复分解反应:
2. 离子反应发生的条件
生成难溶、难电离和易挥发的物质
②发生氧化还原反应
③发生络合反应
例1.下列离子在指定溶液中可能大量共存的是
A.c(H+)=0.1 mol·L-1溶液中:K+、Fe2+、MnO4-、SO42-
B.某透明溶液中:Fe3+、NH4+、NO3-、Cl-
C.能使酚酞变红的溶液中:Na+、Cl-、SO42-、NH4+
D.c(OH-)=0.1 mol·L-1溶液中:HS-、K+、Na+、Al3+
3. 某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验:
(1)一份固体溶于水得透明溶液,加入足量BaCl2溶液,得沉淀6.63 g,在沉淀中加入过量稀盐酸,仍有4.66 g沉淀。
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672 L(标准状况)。
下列说法正确的是
A.该固体中一定含有NH4+、CO32-、SO42-、Na+
B.该固体中一定没有Cu2+、Cl-、Na+
C.该固体中只含有NH4+、CO32-、SO42-、Cl-
D.根据以上实验,无法确定该固体中是否有Na+
A
离子推断的原则
4.某绿色溶液 A 含有 H+、Na+、Mg2+、Fe2+、Cu2+、SO42ˉ、Clˉ、CO32ˉ和 HCO3ˉ离子中的若干种。取该溶液进行如下实验(已知 Ag2SO4微溶于水,可溶于酸):
①向溶液中滴加 Ba(OH)2溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液 B;
②取滤液 B,先用 HNO3酸化,再滴加 0.001 mol·Lˉ1 AgNO3 溶液,有白色沉淀生成。
下列说法不正确的是
A.溶液 A 中一定存在 H+、SO42ˉ和 Clˉ
B.溶液 A 中不存在 Mg2+、CO32ˉ和 HCO3ˉ,不能确定 Na+的存在
C.第②步生成的白色沉淀中只有 AgCl,没有 Ag2CO3
D.溶液 A 中存在 Fe2+与 Cu2+中的一种或两种,且可以用 NaOH
溶液判断
B
3. 离子方程式
拆:把可溶性强电解质(即强酸、强碱、可溶性盐)拆成离子形式
写出实验室制氯气的离子方程式
MnO2 + 4H+ +2Cl- Mn2+ + Cl2 + 2H2O
4. 与量有关的离子方程式书写
一. 配比型离子反应
主要指一组反应物中有两种或两种以上离子同时参加反应时,因离子比例不协调(一般为酸式盐和复盐),当一组离子完全反应时,另一组离子不能恰好完全反应。
例1: NaHSO4溶液与Ba(OH)2溶液
“量少定1” “以少定多”
NaHSO4少量:
Ba(OH)2少量:
NaHSO4 : Ba(OH)2 =3:2
若反应物是定量的,则参加反应的离子严格按照给定的量之间的关系进行,按照以少定多方法书写。
1. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性。
2. 向上述中性溶液中继续滴入Ba(OH)2溶液发生的离子反应。
3. 向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀。
4. 向上述4溶液中继续滴入NaHSO4溶液发生的离子反应。
2OH- + Ba2+ +2H+ +SO42- = 2H2O + BaSO4↓
Ba2+ +SO42- = BaSO4
Ba2+ +SO42-+ H++ OH- = H2O + BaSO4↓
H++ OH- = H2O
变式
例2: KAl(SO4)2溶液与Ba(OH)2溶液
KAl(SO4)2溶液少量
Ba(OH)2溶液少量
写出下列反应的离子方程式
练1: NaHCO3溶液中加入足量的Ca(OH)2。
Ca(OH)2溶液中加入足量的NaHCO3溶液。
含有2molCa(OH)2和3molNaHCO3的两溶液混合。
2OH- + Ca2+ +2HCO3- = 2H2O +CaCO3↓
HCO3- + OH- +Ca2+ = H2O +CaCO3↓
3OH- + 2Ca2+ +3HCO3- = 3H2O +2CaCO3↓ + CO32-
练2: NaOH溶液中加入足量的Ca(HCO3)2溶液
Ca(HCO3)2溶液中加入足量的NaOH溶液
二. 连续型离子反应
指反应生成的物质因能与过量的反应物继续反应而与量有关。
例1:酸性氧化物与碱
NaOH溶液中通入少量CO2
NaOH溶液中通入过量CO2
含有5molNaOH的烧碱溶液中通入2mol CO2气体。
2OH- + CO2= CO32- + H2O
OH- + CO2= HCO3-
3
OH- CO32- HCO3-
CO2
CO2
例2:部分多元弱酸盐与强酸
Na2CO3溶液中加入少量盐酸。
Na2CO3溶液中加入足量盐酸。
CO32- + H+ = HCO3-
CO32- + 2H+ = H2O + CO2
CO32- HCO3- CO2
H+
H+
AlCl3溶液中加入少量NaOH溶液。
AlCl3溶液中加入过量NaOH溶液。
AlCl3溶液中加入过量氨水。
例3:铝盐与强碱
Al3+ + 3OH- = Al(OH)3↓
Al3+ + 4OH- = AlO2- + H2O
Al3+ + 3NH3.H2O = Al(OH)3↓ + NH4+
Al3+ Al(OH)3 AlO2-
3OH-
OH-
例4:偏铝酸盐与强酸
NaAlO2溶液中通入少量盐酸。
AlO2- + H+ + H2O = Al(OH)3↓
NaAlO2溶液中通入足量盐酸。
AlO2- + 4H+ = Al3+ + 2H2O
NaAlO2溶液中通入足量CO2
AlO2- + CO2 + H2O = Al(OH)3↓+ HCO3-
那NaAlO2溶液中通入少量CO2?
AlO2- Al(OH)3 Al3+
H+
3H+
没有连续
反应
例5:弱酸盐(NaB)与多元弱酸(H2A)
B- + H2A = HB + HA-
HA-+B- =HB+A2-
当H2A足量时:
多元弱酸H2A的H+是逐个被B-被结合
①若酸性HA- > HB, 则第二步可反应
②若酸性HB>HA- 则第二步不反应
H2A HA- A2-
B-
B-
总:H2A+2B- =2HB + A2-
总: H2A+B- = HB + HA-
酸性:H2A>HB
当H2A少量时:
第一步:
H2A+B-=HA-+HB
酸性H2A>HA- >HB,
酸性H2A>HB >HA- ,
第二步:
例1:酸性:H2CO3 > HCO3- > Al(OH)3
AlO2- + CO2 + H2O = Al(OH)3↓+ HCO3-
2AlO2- + CO2 + 3H2O = 2Al(OH)3↓+ CO32-
NaAlO2溶液中通入足量CO2
NaAlO2溶液中通入少量CO2
H2CO3 HCO3- CO32-
AlO2-
AlO2-
NaClO溶液中通入足量CO2。
NaClO溶液中通入少量CO2。
例2:酸性:H2CO3 > HClO > HCO3-
ClO- + CO2 + H2O = HClO+ HCO3-
ClO- + CO2 + H2O = HClO+ HCO3-
H2CO3 HCO3- CO32-
ClO-
ClO-
小结:
(1)若酸性 H2A > HB > HA-,
足量H2A与NaB反应:NaB + H2A = HB + NaHA
少量H2A与NaB反应: NaB + H2A = HB + NaHA
(2)若酸性 H2A > HA- > HB,
足量H2A与NaB反应: NaB + H2A = HB + NaHA
少量H2A与NaB反应: 2NaB + H2A = 2HB + Na2A
“强”制弱
酸根的“抢氢大战”
练习:Na2CO3溶液中通入少量Cl2。
Na2CO3溶液中通入足量Cl2。
三. 竞争先后型离子反应
主要指一种反应物的两种离子都能跟另一种反应物反应的离子反应,但因反应先后顺序不同而与量不同。
例1: NH4HSO4溶液与NaOH溶液
NH4HSO4溶液少量:
NaOH溶液少量:
“强者先行”
例2: FeBr2溶液中通入氯气
判断氧化性、还原性强弱,并用离子方程式证明。
(1)氧化性强弱顺序? Cl2 、Fe3+、Br2、 I2
Cl2>Br2:
Br2>Fe3+:
Fe3+>I2:
(2)还原性强弱顺序:
Cl2>Br2>Fe3+>I2
l->Fe2+>Br->Cl-
S2->l->Fe2+>Br->Cl-
留 碘 铁 修 路
2Br- + Cl2 = Br2 + 2Cl-
2Fe2+ + Br2 = 2Fe3+ + 2Br-
2Fe3+ +2 I- = 2Fe3+ + I2
例2:FeBr2溶液中通入少量氯气。
FeBr2溶液中通入过量氯气。
含有2molFeBr2的溶液中通入2mol氯气。
2Br- + Cl2 = Br2 + 2Cl-
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
例3:FeI2溶液中通入少量氯气。
FeI2溶液中通入过量氯气。
含有2molFeI2的溶液中通入2mol氯气。
2I- + Cl2 = I2 + 2Cl-
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
4.[2019·浙江金华外国语学校期中] 向含有物质的量均为0.01 mol的NaOH和Na2CO3的
混合溶液中逐滴滴加a L 0.01 mol·L-1的稀盐酸。下列说法不正确的是 ( )
A.当a=1时,发生的离子反应为OH-+H+=H2O
B.当a=2时,发生的离子反应为OH-+C+2H+=HC+H2O
C.当1
D.当a≥3时,发生的离子反应为3H++OH-+C=2H2O+CO2↑
C
同课章节目录
