2023届高考化学二轮复习:化学平衡新型图像的突破 课件(共41张PPT)
文档属性
| 名称 | 2023届高考化学二轮复习:化学平衡新型图像的突破 课件(共41张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 19:02:04 | ||
图片预览








文档简介
(共41张PPT)
化学平衡新型图像的突破
2023高考二轮:
[命题分析]
新型图像往往根据实际工业生产,结合图像;分析投料比、转化率、产率的变化。此类题目信息量较大,能充分考查学生读图、提取信息、解决问题的能力,在高考中深受命题者青睐。
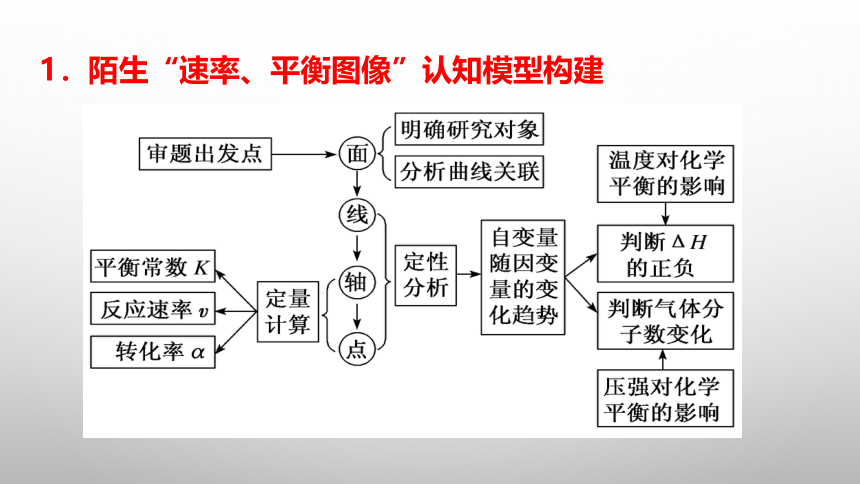
1.陌生“速率、平衡图像”认知模型构建
2.陌生图像题的解题步骤
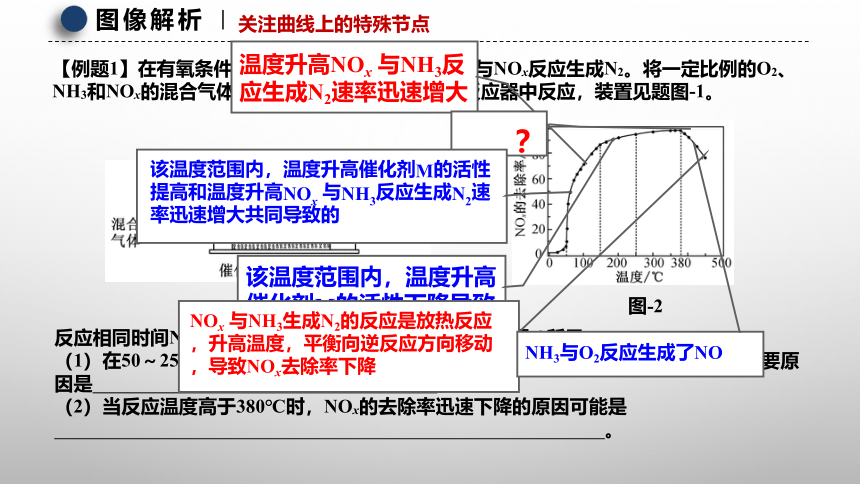
图像解析
关注曲线上的特殊节点
【例题1】在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应,装置见题图-1。
反应相同时间NOx的去除率随反应温度的变化曲线如题图-2所示。
(1)在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是 ;
(2)当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是
。
温度升高NOx 与NH3反应生成N2速率迅速增大
?
该温度范围内,温度升高催化剂M的活性提高和温度升高NOx 与NH3反应生成N2速率迅速增大共同导致的
图-1 图-2
该温度范围内,温度升高催化剂M的活性下降导致的
NOx 与NH3生成N2的反应是放热反应,升高温度,平衡向逆反应方向移动,导致NOx去除率下降
NH3与O2反应生成了NO
图像解析
【例题2】采用“联合脱硫脱氮技术”处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca(NO2)2等副产品,工业流程如题图-1所示。
预处理器中发生的主要反应为NO+O3=NO2+O2,2NO+O2=2NO2。室温下,固定进入预处理器的NO的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)随反应前n(O3)∶n(NO)的变化如题图-2所示。当n(O3)∶n(NO)>1时,反应后NO2的物质的量减少,其原因是__________________________________。
图-1 图-2
NO2分解成NO和O2,导致反应后NO2的物质的量减少
NO被O3氧化成更高价态的氧化物
NO2被O3氧化成更高价态的氧化物
关注曲线的相互关联
图像解析
【例题3】已知水溶液中H2SO3、HSO3-、SO32-随pH的分布如题图-1所示,Na2SO3的溶解度曲线如题图-2所示)。
图-1 图-2
请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: ,用少量无水乙醇洗涤,干燥,密封包装。
NaHSO3溶液――――――→Na2SO3溶液―――――――→无水Na2SO3
NaOH溶液
搅拌
pH=10
结晶
蒸发
过滤
趁热
34℃以上
边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤
关注曲线上的关键数据
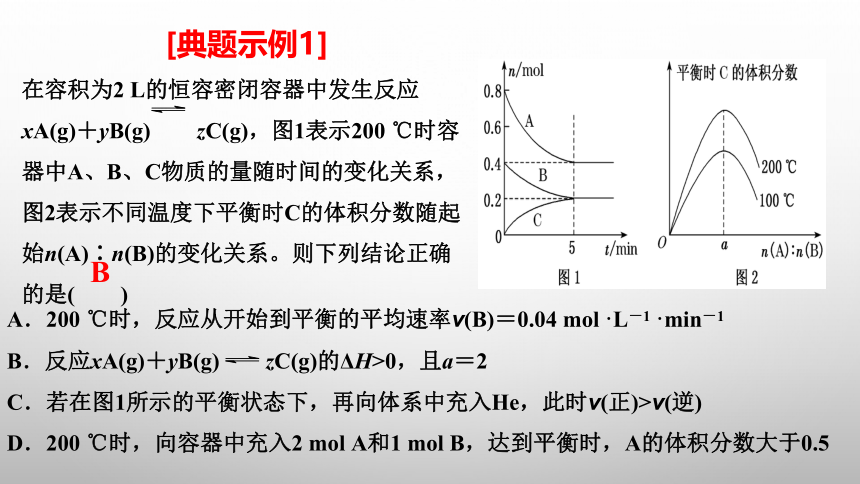
[典题示例1]
在容积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图1表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.反应xA(g)+yB(g) zC(g)的ΔH>0,且a=2
C.若在图1所示的平衡状态下,再向体系中充入He,此时v(正)>v(逆)
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数大于0.5
B
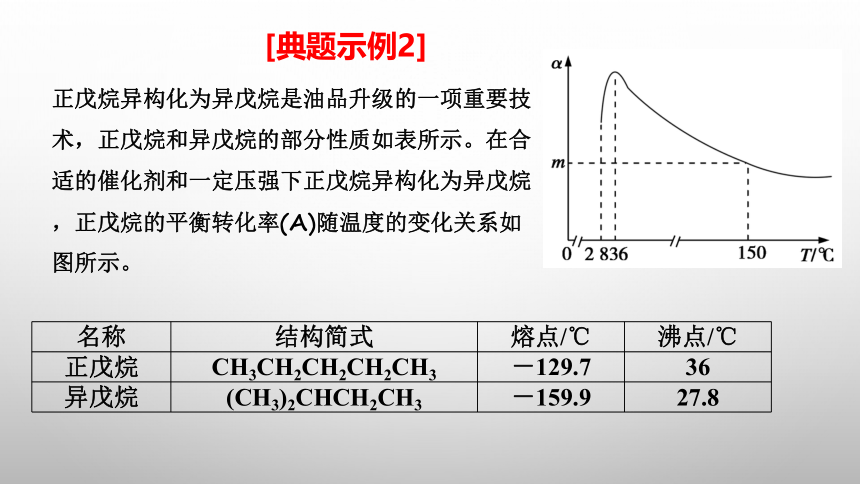
正戊烷异构化为异戊烷是油品升级的一项重要技术,正戊烷和异戊烷的部分性质如表所示。在合适的催化剂和一定压强下正戊烷异构化为异戊烷,正戊烷的平衡转化率(α)随温度的变化关系如图所示。
名称 结构简式 熔点/℃ 沸点/℃
正戊烷 CH3CH2CH2CH2CH3 -129.7 36
异戊烷 (CH3)2CHCH2CH3 -159.9 27.8
[典题示例2]
下列说法正确的是 ( )
a.28~36 ℃时,随温度的升高,正戊烷的平衡转化率增大,原因是异戊烷汽化从平衡体系中分离出去致使平衡正向移动
b.28~36 ℃时,随温度的升高,正戊烷异构化为异戊烷的反应平衡常数减小
c.150 ℃时,若将平衡体系压强从100 kpa升高到500 kpa,正戊烷的平衡转化率增大
d. 150 ℃时,若正戊烷异构化为异戊烷的反应平衡常数为2/3,则正戊烷的平衡转化率为23.8%.
A
【解析】
【练1】用石灰乳与NaClO3混合物吸收SO2和NO可得到CaSO4、Ca(NO3)2,吸收剂的浓度和反应温度对吸收率及吸收产物有影响。
图-1 图-2
(1)NaClO3浓度变化对SO2和NO吸收率影响如题图-1,NaClO3浓度变化对SO2吸收率影响比对NO吸收率影响小的原因是 。。
分析(1)SO2比NO还原性强,更容易被NaClO3氧化,因此NaClO3浓度变化对SO2吸收率影响比对NO吸收率影响小。
(1)SO2可以直接被石灰乳吸收,而NO需要被NaClO3氧化后吸收,因此NaClO3浓度变化对SO2吸收率影响比对NO吸收率影响小。
【练1】用石灰乳与NaClO3混合物吸收SO2和NO可得到CaSO4、Ca(NO3)2,吸收剂的浓度和反应温度对吸收率及吸收产物有影响。
图-1 图-2
(2)温度对SO2和NO吸收率影响如题图-2,当温度高于55℃时,随着温度升高NO吸收率下降,其原因是 。
分析(2)当温度高于55℃时,随着温度升高NO在水中的溶解度减小,因此NO吸收率下降。
(2)当温度高于55℃时,随着温度升高NaClO3分解速率加快,吸收剂中氧化剂浓度减小,因此NO吸收率下降。
【练2】铁炭混合物(铁屑和活性炭的混合物)在水溶液中可形成许多微电池。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如题图所示。
(1)当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是 。
(2)当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加Cu2+和Pb2+的去除率不升反降,其主要原因是 。
分析(1)活性炭具有吸附作用
答案(1)活性炭具有吸附作用,可以吸附少量Cu2+和Pb2+
(2)铁的质量分数增加,活性炭质量分数减少,不利于构成微电池
(2)铁的质量分数增加,铁炭混合物中微电池数目减少
【练3】CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH=41.2 kJ·mol 1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol 1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如题图。其中:
CH3OCH3的选择性= ×100%
(1)温度高于300℃,CO2平衡转化率随温度升高而上升的原因是 。
(2)220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有
。
(1)反应Ⅰ的ΔH>0,温度升高平衡向正反应方向移动,CO2转化为CO的平衡转化率上升;
反应Ⅱ的ΔH<0,温度升高平衡向逆反应方向移动, CO2转化为CH3OCH3的平衡转化率下降。 且上升幅度超过下降幅度
(2)增大压强
使用对反应Ⅱ催化活性更高的催化剂
类型1.根据图像判断投料比
[例1] 一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为
2CO(g)+SO2(g) 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
(1)其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是______________。
催化剂
解析:(1)从图1中可以看出,相比NiO和Cr2O3,用Fe2O3作催化剂时,在较低温度下,SO2的转化率已很高,这样既能去除SO2,又能节省能源。
答案:(1)Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2转化率,从而节约能源
类型1.根据图像判断投料比
[例1] 一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为
2CO(g)+SO2(g) 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
催化剂
a
[剖析] “投料比”曲线的分析方法
“投料比”曲线在最近的高考中经常出现,具有一定的抽象性和综合性。这类试题在同一图中因同时出现几条不同“投料比”曲线,增加了试题难度。处理此类问题的方法:回归影响平衡移动的因素,找出新变量与移动因素本质变化的关系。
[练1] 将燃煤废气中的CO2转化为甲醚的反应原理为
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
已知在压强为a MPa下,该反应在不同温度、
不同投料比时,CO2的转化率见下图:
催化剂
此反应为________(填“放热”或“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将________(填“增大”“减小”或“不变”)。
[答案] 放热 不变
[练2] 采用一种新型的催化剂(主要成分是Cu—Mn合金),利用CO和H2制备二甲醚(DME)。
主反应:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)
副反应:CO(g)+H2O(g) CO2(g)+H2(g)、CO(g)+2H2(g)===CH3OH(g)
测得反应体系中各物质的产率或转化率与催化剂
的关系如图所示。则催化剂中n(Mn)/n(Cu)约
为____时最有利于二甲醚的合成。
[答案] 2.0
[解析] 由图可知当催化剂中n(Mn)/n(Cu)约为2.0时,CO的转化率最大,生成的二甲醚产率最大。
类型2.根据图像判断选择性
[典例3] 丙烯是制造一次性医用口罩的重要原料。丙烷催化脱氢是工业生产丙烯的重要途径,丙烷催脱氢技术主要分为氧化脱氢和直接脱氢两种。回答下列问题:
(1)丙烷催化氧化脱氢法主要反应如下:
2C3H8(g)+O2(g) 2C3H6(g)+2H2O(g) ΔH1=-236 kJ·mol-1(i)
反应过程中消耗的C3H8和 生成的C3H6 的物质的量随温度的变化关系见下表。
n(消耗)或n(生成)/mol反应温度/℃ 535 550 575
C3H8 6 13 33
C3H6 4 8 17
[答案] (1)降低 升高温度,反应 i 的化学平衡逆向移动
(2)丙烷催化直接脱氢反应:
C3H8(g)??C3H6(g)+H2(g) ΔH2=+124.3kJ·mol -1 ( ii )
副反应:C3H8 (g)??C2H4 (g) + CH4(g) ΔH3(iii)
①反应 ii 的平衡常数、产物丙烯选择性、副产物乙烯选择性与温度关系如图所示, 分析工业生产中采用的温度为 650 ℃左右的原因是_____________________________
[解析]
(2)①据图可知,温度控制在 650 ℃ ,丙烯选择性高,且此时温度较高,反应速率快,而且该温度条件下平衡常数较大;
温度控制在 650 ℃ ,丙烯选择性高,反应速率快,平衡常数大
②温度为 670 ℃时,若在 1 l 的容器中投入8 mol c3h8,充分反应后,平衡混合气体中有 2 mol ch4和一定量c3h8、c3h6、h2、c2h4,计算该条件下c3h6 的选择性为________%。
50
③欲使丙烯的产率提高,下列措施可行的是________(填写序号)。
a.恒压条件下向原料气中掺杂水蒸气
b.增大氢气与丙烷的投料比
c.选择对脱氢反应更好选择性的催化剂 d.增大压强
ac
③a.恒压条件下向原料气中掺杂水蒸气,则反应物和生成物的分压减小,该反应正反应为气态物质化学计量数增大的反应,减小压强反应(i)(ii)平衡均正向移动,可以提高丙烯的产率,故a正确;b.氢气为产物,增大氢气的量会使平衡逆向移动,丙烯的产率降低,故b错误;c.选择对脱氢反应更好选择性的催化剂,增大丙烯的选择性,提高产率,故c正确;d.该反应正反应为压强增大的反应,增大压强会使平衡逆向移动,降低产率,故d错误;综上所述选ac。
类型3.废物回收及污染处理图像
[例3] 绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图所示。
①写出总反应化学方程式:________________________________。
②测得该反应的平衡常数与温度的关系为:lg K=5.08+217.5/T,该反应是________反应(填“吸热”或“放热”)。
③该反应的含氮气体浓度随温度变化如图所示,则将NO转化为N2的最佳温度为__________;当温度达到700 K时,发生副反应的化学方程式:___________。
(2)利用氨水吸收工业废气中的SO2,既可解决环境问题,又可制备(NH4)2SO3。可用(NH4)2SO3为原料,以空气氧化法制备(NH4)2SO4,其氧化速率与温度关系如下图:
试解释在温度较高时,(NH4)2SO3 氧化速率下降的原因是_____;相同条件下,等浓度的(NH4)2SO3和(NH4)2SO4溶液中,c(NH)前者______(填“大”或“小”)。
[练1] (1)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为
2CO(g)+SO2(g) 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
某科研小组用Fe2O3作催化剂。在380 ℃时,分别研究了[n(CO)∶n(SO2)]为1∶1、3∶1时SO2转化率的变化情况(图2)。则图2中表示n(CO)∶n(SO2)=3∶1的变化曲线为________。
催化剂
a
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(no)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。
①写出该脱硝原理总反应的化学方程式:________________________。
②为达到最佳脱硝效果,应采取的条件是________________________。
(3)汽车使用乙醇汽油并不能减少nox的排放,这使nox的有效消除成为环保领域的重要课题。某研究小组在实验室以ag—zsm—5为催化剂,测得no转化为n2的转化率随温度变化情况如图所示。
若不使用co,温度超过775 k,发现no的分解率降低,其可能的原因是_________;
在n(no)/n(co)=1的条件下,应控制的最佳温度在________左右。
NO分解反应是放热反应,升高温度不利于反应进行 870 K
[练2](1)向甲、乙、丙三个容积均为2 L的密闭装置中均充入4 mol N2和H2的混合气体,但N2、H2的投料比不同,在400 ℃时反应,测定N2的体积百分含量,得到图1。
①乙装置中N2、H2的投料比为________。
②反应达到平衡后,测得乙装置中H2的体积百分含量为25%,则400 ℃时,合成氨反应的平衡常数为________(不需注明单位)。
(2)向M、N两个装置中分别充入相同投料比的N2、H2,进行合成氨反应,各反应1小时,测定不同温度下N2的转化率,得到图2。
①N2、H2在M、N两装置中反应时,不同的条件可能是___________________________________________________________________。
②在300 ℃时,a、b两点转化率存在差异的原因是___________________
四种典型图像的关键点分析
化学平衡新型图像的突破
2023高考二轮:
[命题分析]
新型图像往往根据实际工业生产,结合图像;分析投料比、转化率、产率的变化。此类题目信息量较大,能充分考查学生读图、提取信息、解决问题的能力,在高考中深受命题者青睐。
1.陌生“速率、平衡图像”认知模型构建
2.陌生图像题的解题步骤
图像解析
关注曲线上的特殊节点
【例题1】在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应,装置见题图-1。
反应相同时间NOx的去除率随反应温度的变化曲线如题图-2所示。
(1)在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是 ;
(2)当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是
。
温度升高NOx 与NH3反应生成N2速率迅速增大
?
该温度范围内,温度升高催化剂M的活性提高和温度升高NOx 与NH3反应生成N2速率迅速增大共同导致的
图-1 图-2
该温度范围内,温度升高催化剂M的活性下降导致的
NOx 与NH3生成N2的反应是放热反应,升高温度,平衡向逆反应方向移动,导致NOx去除率下降
NH3与O2反应生成了NO
图像解析
【例题2】采用“联合脱硫脱氮技术”处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca(NO2)2等副产品,工业流程如题图-1所示。
预处理器中发生的主要反应为NO+O3=NO2+O2,2NO+O2=2NO2。室温下,固定进入预处理器的NO的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)随反应前n(O3)∶n(NO)的变化如题图-2所示。当n(O3)∶n(NO)>1时,反应后NO2的物质的量减少,其原因是__________________________________。
图-1 图-2
NO2分解成NO和O2,导致反应后NO2的物质的量减少
NO被O3氧化成更高价态的氧化物
NO2被O3氧化成更高价态的氧化物
关注曲线的相互关联
图像解析
【例题3】已知水溶液中H2SO3、HSO3-、SO32-随pH的分布如题图-1所示,Na2SO3的溶解度曲线如题图-2所示)。
图-1 图-2
请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: ,用少量无水乙醇洗涤,干燥,密封包装。
NaHSO3溶液――――――→Na2SO3溶液―――――――→无水Na2SO3
NaOH溶液
搅拌
pH=10
结晶
蒸发
过滤
趁热
34℃以上
边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤
关注曲线上的关键数据
[典题示例1]
在容积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图1表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.反应xA(g)+yB(g) zC(g)的ΔH>0,且a=2
C.若在图1所示的平衡状态下,再向体系中充入He,此时v(正)>v(逆)
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数大于0.5
B
正戊烷异构化为异戊烷是油品升级的一项重要技术,正戊烷和异戊烷的部分性质如表所示。在合适的催化剂和一定压强下正戊烷异构化为异戊烷,正戊烷的平衡转化率(α)随温度的变化关系如图所示。
名称 结构简式 熔点/℃ 沸点/℃
正戊烷 CH3CH2CH2CH2CH3 -129.7 36
异戊烷 (CH3)2CHCH2CH3 -159.9 27.8
[典题示例2]
下列说法正确的是 ( )
a.28~36 ℃时,随温度的升高,正戊烷的平衡转化率增大,原因是异戊烷汽化从平衡体系中分离出去致使平衡正向移动
b.28~36 ℃时,随温度的升高,正戊烷异构化为异戊烷的反应平衡常数减小
c.150 ℃时,若将平衡体系压强从100 kpa升高到500 kpa,正戊烷的平衡转化率增大
d. 150 ℃时,若正戊烷异构化为异戊烷的反应平衡常数为2/3,则正戊烷的平衡转化率为23.8%.
A
【解析】
【练1】用石灰乳与NaClO3混合物吸收SO2和NO可得到CaSO4、Ca(NO3)2,吸收剂的浓度和反应温度对吸收率及吸收产物有影响。
图-1 图-2
(1)NaClO3浓度变化对SO2和NO吸收率影响如题图-1,NaClO3浓度变化对SO2吸收率影响比对NO吸收率影响小的原因是 。。
分析(1)SO2比NO还原性强,更容易被NaClO3氧化,因此NaClO3浓度变化对SO2吸收率影响比对NO吸收率影响小。
(1)SO2可以直接被石灰乳吸收,而NO需要被NaClO3氧化后吸收,因此NaClO3浓度变化对SO2吸收率影响比对NO吸收率影响小。
【练1】用石灰乳与NaClO3混合物吸收SO2和NO可得到CaSO4、Ca(NO3)2,吸收剂的浓度和反应温度对吸收率及吸收产物有影响。
图-1 图-2
(2)温度对SO2和NO吸收率影响如题图-2,当温度高于55℃时,随着温度升高NO吸收率下降,其原因是 。
分析(2)当温度高于55℃时,随着温度升高NO在水中的溶解度减小,因此NO吸收率下降。
(2)当温度高于55℃时,随着温度升高NaClO3分解速率加快,吸收剂中氧化剂浓度减小,因此NO吸收率下降。
【练2】铁炭混合物(铁屑和活性炭的混合物)在水溶液中可形成许多微电池。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如题图所示。
(1)当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是 。
(2)当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加Cu2+和Pb2+的去除率不升反降,其主要原因是 。
分析(1)活性炭具有吸附作用
答案(1)活性炭具有吸附作用,可以吸附少量Cu2+和Pb2+
(2)铁的质量分数增加,活性炭质量分数减少,不利于构成微电池
(2)铁的质量分数增加,铁炭混合物中微电池数目减少
【练3】CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH=41.2 kJ·mol 1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol 1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如题图。其中:
CH3OCH3的选择性= ×100%
(1)温度高于300℃,CO2平衡转化率随温度升高而上升的原因是 。
(2)220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有
。
(1)反应Ⅰ的ΔH>0,温度升高平衡向正反应方向移动,CO2转化为CO的平衡转化率上升;
反应Ⅱ的ΔH<0,温度升高平衡向逆反应方向移动, CO2转化为CH3OCH3的平衡转化率下降。 且上升幅度超过下降幅度
(2)增大压强
使用对反应Ⅱ催化活性更高的催化剂
类型1.根据图像判断投料比
[例1] 一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为
2CO(g)+SO2(g) 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
(1)其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是______________。
催化剂
解析:(1)从图1中可以看出,相比NiO和Cr2O3,用Fe2O3作催化剂时,在较低温度下,SO2的转化率已很高,这样既能去除SO2,又能节省能源。
答案:(1)Fe2O3作催化剂时,在相对较低温度下可获得较高的SO2转化率,从而节约能源
类型1.根据图像判断投料比
[例1] 一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为
2CO(g)+SO2(g) 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
催化剂
a
[剖析] “投料比”曲线的分析方法
“投料比”曲线在最近的高考中经常出现,具有一定的抽象性和综合性。这类试题在同一图中因同时出现几条不同“投料比”曲线,增加了试题难度。处理此类问题的方法:回归影响平衡移动的因素,找出新变量与移动因素本质变化的关系。
[练1] 将燃煤废气中的CO2转化为甲醚的反应原理为
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
已知在压强为a MPa下,该反应在不同温度、
不同投料比时,CO2的转化率见下图:
催化剂
此反应为________(填“放热”或“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将________(填“增大”“减小”或“不变”)。
[答案] 放热 不变
[练2] 采用一种新型的催化剂(主要成分是Cu—Mn合金),利用CO和H2制备二甲醚(DME)。
主反应:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)
副反应:CO(g)+H2O(g) CO2(g)+H2(g)、CO(g)+2H2(g)===CH3OH(g)
测得反应体系中各物质的产率或转化率与催化剂
的关系如图所示。则催化剂中n(Mn)/n(Cu)约
为____时最有利于二甲醚的合成。
[答案] 2.0
[解析] 由图可知当催化剂中n(Mn)/n(Cu)约为2.0时,CO的转化率最大,生成的二甲醚产率最大。
类型2.根据图像判断选择性
[典例3] 丙烯是制造一次性医用口罩的重要原料。丙烷催化脱氢是工业生产丙烯的重要途径,丙烷催脱氢技术主要分为氧化脱氢和直接脱氢两种。回答下列问题:
(1)丙烷催化氧化脱氢法主要反应如下:
2C3H8(g)+O2(g) 2C3H6(g)+2H2O(g) ΔH1=-236 kJ·mol-1(i)
反应过程中消耗的C3H8和 生成的C3H6 的物质的量随温度的变化关系见下表。
n(消耗)或n(生成)/mol反应温度/℃ 535 550 575
C3H8 6 13 33
C3H6 4 8 17
[答案] (1)降低 升高温度,反应 i 的化学平衡逆向移动
(2)丙烷催化直接脱氢反应:
C3H8(g)??C3H6(g)+H2(g) ΔH2=+124.3kJ·mol -1 ( ii )
副反应:C3H8 (g)??C2H4 (g) + CH4(g) ΔH3(iii)
①反应 ii 的平衡常数、产物丙烯选择性、副产物乙烯选择性与温度关系如图所示, 分析工业生产中采用的温度为 650 ℃左右的原因是_____________________________
[解析]
(2)①据图可知,温度控制在 650 ℃ ,丙烯选择性高,且此时温度较高,反应速率快,而且该温度条件下平衡常数较大;
温度控制在 650 ℃ ,丙烯选择性高,反应速率快,平衡常数大
②温度为 670 ℃时,若在 1 l 的容器中投入8 mol c3h8,充分反应后,平衡混合气体中有 2 mol ch4和一定量c3h8、c3h6、h2、c2h4,计算该条件下c3h6 的选择性为________%。
50
③欲使丙烯的产率提高,下列措施可行的是________(填写序号)。
a.恒压条件下向原料气中掺杂水蒸气
b.增大氢气与丙烷的投料比
c.选择对脱氢反应更好选择性的催化剂 d.增大压强
ac
③a.恒压条件下向原料气中掺杂水蒸气,则反应物和生成物的分压减小,该反应正反应为气态物质化学计量数增大的反应,减小压强反应(i)(ii)平衡均正向移动,可以提高丙烯的产率,故a正确;b.氢气为产物,增大氢气的量会使平衡逆向移动,丙烯的产率降低,故b错误;c.选择对脱氢反应更好选择性的催化剂,增大丙烯的选择性,提高产率,故c正确;d.该反应正反应为压强增大的反应,增大压强会使平衡逆向移动,降低产率,故d错误;综上所述选ac。
类型3.废物回收及污染处理图像
[例3] 绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图所示。
①写出总反应化学方程式:________________________________。
②测得该反应的平衡常数与温度的关系为:lg K=5.08+217.5/T,该反应是________反应(填“吸热”或“放热”)。
③该反应的含氮气体浓度随温度变化如图所示,则将NO转化为N2的最佳温度为__________;当温度达到700 K时,发生副反应的化学方程式:___________。
(2)利用氨水吸收工业废气中的SO2,既可解决环境问题,又可制备(NH4)2SO3。可用(NH4)2SO3为原料,以空气氧化法制备(NH4)2SO4,其氧化速率与温度关系如下图:
试解释在温度较高时,(NH4)2SO3 氧化速率下降的原因是_____;相同条件下,等浓度的(NH4)2SO3和(NH4)2SO4溶液中,c(NH)前者______(填“大”或“小”)。
[练1] (1)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为
2CO(g)+SO2(g) 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
某科研小组用Fe2O3作催化剂。在380 ℃时,分别研究了[n(CO)∶n(SO2)]为1∶1、3∶1时SO2转化率的变化情况(图2)。则图2中表示n(CO)∶n(SO2)=3∶1的变化曲线为________。
催化剂
a
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(no)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。
①写出该脱硝原理总反应的化学方程式:________________________。
②为达到最佳脱硝效果,应采取的条件是________________________。
(3)汽车使用乙醇汽油并不能减少nox的排放,这使nox的有效消除成为环保领域的重要课题。某研究小组在实验室以ag—zsm—5为催化剂,测得no转化为n2的转化率随温度变化情况如图所示。
若不使用co,温度超过775 k,发现no的分解率降低,其可能的原因是_________;
在n(no)/n(co)=1的条件下,应控制的最佳温度在________左右。
NO分解反应是放热反应,升高温度不利于反应进行 870 K
[练2](1)向甲、乙、丙三个容积均为2 L的密闭装置中均充入4 mol N2和H2的混合气体,但N2、H2的投料比不同,在400 ℃时反应,测定N2的体积百分含量,得到图1。
①乙装置中N2、H2的投料比为________。
②反应达到平衡后,测得乙装置中H2的体积百分含量为25%,则400 ℃时,合成氨反应的平衡常数为________(不需注明单位)。
(2)向M、N两个装置中分别充入相同投料比的N2、H2,进行合成氨反应,各反应1小时,测定不同温度下N2的转化率,得到图2。
①N2、H2在M、N两装置中反应时,不同的条件可能是___________________________________________________________________。
②在300 ℃时,a、b两点转化率存在差异的原因是___________________
四种典型图像的关键点分析
同课章节目录
