2023届高考化学二轮复习晶体结构与性质 课件50张
文档属性
| 名称 | 2023届高考化学二轮复习晶体结构与性质 课件50张 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-26 08:23:01 | ||
图片预览









文档简介
选考专题复习 晶体的结构与性质
1.物质的聚集状态
(1)物质三态间的相互转化 物理变化、分子间距离发生变化
任务一:晶体基本概念
(2)等离子体和离子液体 气态和液体物质不一定都由分子构成
等离子体是由 电子 、阳离子和 电中性 粒子(分子或原子)组成的整体上呈电中性的气态物质。离子液体是熔点不高的仅由 离子 组成的液体物质。?
2.晶体与非晶体
(1)晶体与非晶体的比较
类型
晶体
非晶体
结构特征
结构微粒周期性有序排列
结构微粒 无序 排列?
性质
特征
自范性
有 ?
无 ?
熔点
固定 ?
不固定 ?
各向异
同表现
各向异性 ?
各向同性 ?
二者区
别方法
间接方法
看是否有固定的 熔点 ?
科学方法
对固体进行 X射线衍射 实验?
应用提升 列表比较等离子体、液晶和离子液体
类别
等离子体
液晶
离子液体
构成或存在
状态
电子、阳离子和电中性粒子(分子或原子)
介于液态和晶态之间的物质状态
体积很大的阴离子、阳离子
特性
具有良好的导电性和流动性
具有液体的流动性、黏度、形变性等,具有类似晶体的各向异性
难挥发、良好导电性、可作溶剂和催化剂
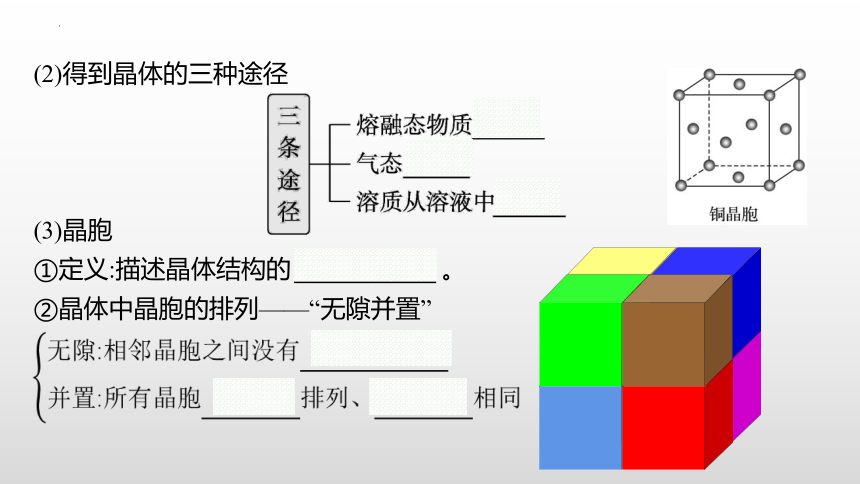
(2)得到晶体的三种途径
(3)晶胞
①定义:描述晶体结构的 基本单元 。?
②晶体中晶胞的排列——“无隙并置”
3.晶格能
(1)定义:气态离子形成1 mol离子晶体释放的能量,通常取正值,单位:kJ·mol-1。
(2)影响因素。
①离子所带电荷数:离子所带电荷数越多,晶格能越大。
②离子的半径:离子的半径越小,晶格能越大。
(3)与离子晶体性质的关系:晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度越大。
4.均摊法
1
2
4
3
7
6
8
5
1
2
2
1
3
4
1
体心:1
面心:1/2
顶点:1/8
棱边:1/4
立方晶胞
体心:
1
面心:
1/2
棱边:
1/4
顶点:
1/8
六棱柱
顶角:1/6
上、下棱:1/4
侧棱:1/3
面上:1/2
内部:1
三棱柱
体心
1
面心
1/2
棱边
水平1/4 竖1/6
顶点
1/12
石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有,每个六边形占1/3
金属钠(C) 金属锌(Zn) 碘(I2) 金刚石(C)
数一数,它们分别平均含有几个原子?
1.金属晶体
任务二:典型晶体结构
金属键
导电性
导热性
延展性
①在金属晶体中,原子间以__________相结合。
②金属晶体的性质:优良的_________、_________和__________。
金属晶体在三维空间的四种堆积模型
空间利用率= ×100%,球体积为晶胞中所含金属原子的总体积。
球体积
晶胞体积
简单立方堆积(Po)
如图所示,设晶胞边长为a,原子半径为 r,则立方体的棱长为 ________,V球 = __________,V晶胞 = ____________,空间利用率为___________________________。
a=2r
8r3
原子的配位数为6
体心立方堆积(Na、K、Cr、Mo(钼)、W等)
如图所示,设原子半径为 r,则体对角线 c 为 __________,面对角线 b 为 __________ (用 a 表示),a = __________ (用 r 表示),空间利用率为 ______________。
原子的配位数为8
六方最密堆积(Mg、Zn、Ti等)
如图所示,设原子半径为 r,则棱长为________(用 r 表示,下同),底面面积 S = ____________,h = __________,V球 = __________,V晶胞 = ________________,空间利用率为__________________。
2r
原子的配位数为12
面心立方最密堆积(Au、Ag、Cu、Al等)
如图所示,设原子半径为 r,则面对角线为 __________ (用 r 表示),a =__________( 用 r 表示 ),V晶胞 =________ (用 r 表示),空间利用率为__________________。
4r
原子的配位数为12
小
多
强
越高
金属键的强弱和对金属熔沸点的影响:
A.金属键的强弱主要取决于金属元素的原子半径和价电子数,原子半径越______,价电子数越______,金属键越______;反之,金属键越______。
B.金属键越强,金属的熔、沸点越______,硬度越______。
弱
大
(1)构成粒子:__________和__________。
(2)作用力:__________。
(3)配位数:一个离子周围__________的__________离子的数目。
(4)离子晶体结构的决定因素。
①几何因素:晶体中正负离子的__________。
②电荷因素:晶体中正负离子的__________。
③键性因素:离子键的____________。
阴离子
阳离子
离子键
最邻近
异电性
半径比
电荷比
纯粹程度
2.离子晶体
常见离子晶体
①NaCl型:在晶体中,每个Na+同时吸引 6 个Cl-,每个Cl-同时吸引 6 个Na+,配位数为 6 。每个晶胞含 4 个Na+和 4 个Cl-。?
②CsCl型:在晶体中,每个Cl-吸引 8 个Cs+,每个Cs+吸引 8 个Cl-,配位数为 8 。?
晶胞中S2-以面心立方堆积,Zn2+占据S2-围成的8个正四面体空隙中的4个互不相邻的正四面体空隙。每个S2-周围距离最近且相等的锌离子有4 个,每个锌离子周围距离最近且相等的硫离子有4 个。1个ZnS晶胞中含有4个Zn2+和4个S2-
S2-
Zn2+
离子晶体的性质
熔、沸点
熔、沸点________,难挥发
硬度
硬度________,难以压缩
溶解性
一般在水中________,在非极性溶剂中________
导电性
固态时__________,熔融状态或在水溶液中__________
较高
较大
易溶
难溶
不导电
能导电
一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如MgO>MgCl2>NaCl>CsCl。衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
3.共价晶体
原子
共价键
①共价晶体中,由于各原子均以强的共价键相结合,因此一般熔点______,硬度______。
②结构相似的共价晶体,原子半径越小,键长________,键能越大,晶体的熔点________,如金刚石>碳化硅>硅。
高
大
越短
越高
常见的共价晶体模型
金刚石晶体中,每个C与另外 4 个C形成共价键,C—C之间的夹角是109°28',最小的环是 六 元环。含有1 mol碳的金刚石中,形成的共价键为 2 mol。?
金刚石
每个C原子被12个最小环共用;每个最小环含有1/2个C原子
SiO2
(1)每个Si与4个O以共价键结合,轨道均为sp3杂化,形成正四面体结构
(2)每个正四面体占有1个Si,4个“O”,n(Si)∶n(O)=1∶2
(3)Si:Si-O=1:4
(4)最小环上有12个原子,即6个O,6个Si
4.分子晶体
(1)概念:只含________的晶体称为分子晶体。
(2)粒子间的相互作用力:分子晶体内相邻分子间以______________相互吸引,分子内原子之间以____ __ ____结合。
分子
分子间作用力
共价键
(3)常见的分子晶体。
①所有________________,如水、硫化氢、氨、甲烷等。
②部分______________,如卤素(X2)、氧(O2)、硫(S8)、氮(N2)、白磷(P4)、C60等。
③部分________________,如CO2、SO2、P4O6、P4O10等。
④几乎所有的______,如H2SO4、HNO3、H3PO4、H2SiO3等。
⑤绝大多数__________的晶体,如苯、乙醇、乙酸、葡萄糖等。
非金属氢化物
非金属单质
非金属氧化物
酸
有机物
常见分子晶体模型
①干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有 12 个。?
②冰的结构模型中,每个水分子与相邻的 4 个水分子以氢键相连接,含1 mol H2O的冰中,最多可形成“氢键”数目为 2NA 个。?
分子晶体的性质
分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得________,如H2O>H2Te>H2Se>H2S;
组成和结构相似的分子晶体,相对分子质量越______,熔、沸点越高,如SnH4>GeH4>SiH4>CH4;
组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如CO>N2、CH3OH>CH3CH3;
同分异构体支链越________,熔、沸点越低,如正丁烷>异丁烷。
高
大
多
5.混合型晶体—石墨晶体
石墨晶体结构
石墨层状晶体中,每个碳原子的配位数为 3 ,有1个未参与杂化的2p轨道,平均每个正六边形拥有的碳原子个数是 2 ;石墨的导电性只能沿着 石墨平面 的方向。?
(1)纯粹的典型晶体是不多的,大多数晶体是它们之间的_________ 。
(2)几种氧化物的化学键中离子键成分的百分数
表中四种氧化物晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的过渡晶体。
过渡晶体
氧化物
Na2O
MgO
Al2O3
SiO2
离子键的百分数/%
62
50
41
33
6.过渡晶体
四种晶体类型的比较
晶体类型
分子晶体
共价晶体
金属晶体
离子晶体
构成粒子
分子 ?
原子 ?
金属阳离子 和?
自由电子?
阴、阳离子?
粒子间的
相互作用力
分子间作用力
共价键?
金属键?
离子键?
硬度
较小
很大?
有的很大,有的很小
较大
熔、沸点
较低
很高?
有的很高,有的很低
较高
溶解性
相似相溶
难溶于一般溶剂
常见溶剂难溶
大多易溶于水等极性溶剂
导电、
传热性
一般不导电,溶于水后有的导电
一般不具有导电性
电和热的 良 导体?
晶体 不导 电,水溶液或熔融态
导 电?
归纳总结
不同晶体熔点高低的比较
(1)看物质所属晶体类型,一般情况下,晶体的熔点:共价晶体>离子晶体>分子晶体。
(2)同类晶体熔点比较思路
任务三:晶胞的计算--均摊法
任务三:晶胞的计算--均摊法
例1 (1)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图1所示。则该化合物的化学式为________________。
(2)图2是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价,则Q的化合价为________。
CuH
+3价
(2021湖南卷,18节选)下图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
(1)已知化合物中Ge和O的原子个数比为1∶4,图中Z表示 原子(填元素符号),该化合物的化学式为 。?
晶体密度的计算公式推导过程
任务三:晶胞的计算--晶体密度
任务三:晶胞的计算--晶体密度
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}晶体
晶体结构
密度计算
金刚石
ρ=
SiO2
ρ=
干冰
ρ=
任务三:晶胞的计算--晶体密度
例1(9)Na和O能够形成化合物,其晶胞结构如图9所示,晶胞参数a=0.566 nm,化合物的化学式为____________;晶胞中Na原子的配位数为________;列式计算该晶体的密度(g·cm-3 )__________________________。
Na2O
8
(2021广东卷,20节选)。
(2)图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg∶Ge∶Sb= 。?
(3)设X的最简式的式量为Mr,则X晶体的密度为? g·cm-3(列出算式)。?
(2)4 1∶1∶2 (3) ×1021
原子分数坐标:以晶胞参数为单位长度(不论晶胞边长大小,都是1)建立的坐标系。
任务三:晶胞的计算--判断原子坐标
任务三:晶胞的计算--判断原子坐标
(????????,0,????????)
?
(????,0,????)
?
(????????,????????,????????)
?
(????????,????????,0)
?
(????,0,????)
?
(????,0,????)
?
(????????,????????,????????)
?
(????????,????????,????????)
?
确定原子的分数坐标
例1.(1)(2021山东卷,16节选)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为 。已知Xe—F键长为r pm,则B点原子的分数坐标为 ;晶胞中A、B间距离d= pm。?
思路指导
(1)
任务三:晶胞的计算--空间利用率
空间利用率= ×100%,球体积为晶胞中所含金属原子的总体积。
球体积
晶胞体积
任务三:晶胞的计算--空间利用率
空间利用率= ×100%,球体积为晶胞中所含金属原子的总体积。
球体积
晶胞体积
例1 (12)金刚石晶胞(如图12)含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=______a,列式表示碳原子在晶胞中的空间占有率__________________________(不要求计算结果)。
8
(2021全国乙卷,35节选)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。
(1)处于顶角位置的是 原子。?
(2)设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为? %(列出计算表达式)。?
谢
谢
观
看
1.物质的聚集状态
(1)物质三态间的相互转化 物理变化、分子间距离发生变化
任务一:晶体基本概念
(2)等离子体和离子液体 气态和液体物质不一定都由分子构成
等离子体是由 电子 、阳离子和 电中性 粒子(分子或原子)组成的整体上呈电中性的气态物质。离子液体是熔点不高的仅由 离子 组成的液体物质。?
2.晶体与非晶体
(1)晶体与非晶体的比较
类型
晶体
非晶体
结构特征
结构微粒周期性有序排列
结构微粒 无序 排列?
性质
特征
自范性
有 ?
无 ?
熔点
固定 ?
不固定 ?
各向异
同表现
各向异性 ?
各向同性 ?
二者区
别方法
间接方法
看是否有固定的 熔点 ?
科学方法
对固体进行 X射线衍射 实验?
应用提升 列表比较等离子体、液晶和离子液体
类别
等离子体
液晶
离子液体
构成或存在
状态
电子、阳离子和电中性粒子(分子或原子)
介于液态和晶态之间的物质状态
体积很大的阴离子、阳离子
特性
具有良好的导电性和流动性
具有液体的流动性、黏度、形变性等,具有类似晶体的各向异性
难挥发、良好导电性、可作溶剂和催化剂
(2)得到晶体的三种途径
(3)晶胞
①定义:描述晶体结构的 基本单元 。?
②晶体中晶胞的排列——“无隙并置”
3.晶格能
(1)定义:气态离子形成1 mol离子晶体释放的能量,通常取正值,单位:kJ·mol-1。
(2)影响因素。
①离子所带电荷数:离子所带电荷数越多,晶格能越大。
②离子的半径:离子的半径越小,晶格能越大。
(3)与离子晶体性质的关系:晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度越大。
4.均摊法
1
2
4
3
7
6
8
5
1
2
2
1
3
4
1
体心:1
面心:1/2
顶点:1/8
棱边:1/4
立方晶胞
体心:
1
面心:
1/2
棱边:
1/4
顶点:
1/8
六棱柱
顶角:1/6
上、下棱:1/4
侧棱:1/3
面上:1/2
内部:1
三棱柱
体心
1
面心
1/2
棱边
水平1/4 竖1/6
顶点
1/12
石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有,每个六边形占1/3
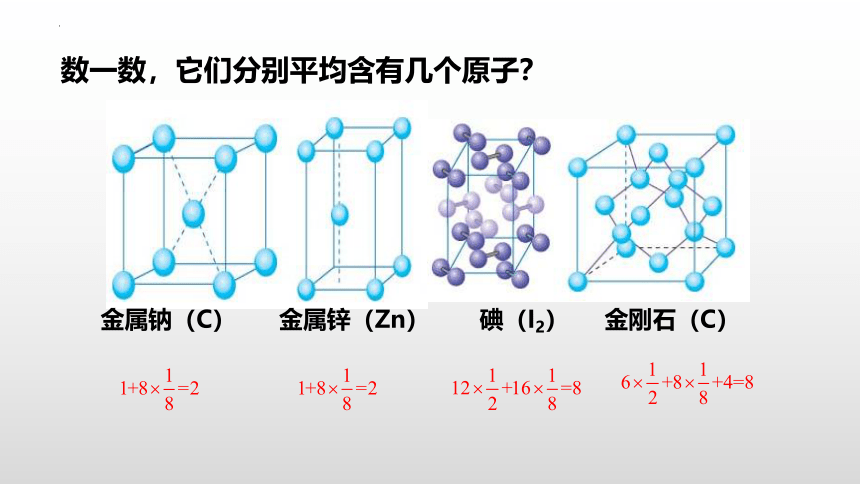
金属钠(C) 金属锌(Zn) 碘(I2) 金刚石(C)
数一数,它们分别平均含有几个原子?
1.金属晶体
任务二:典型晶体结构
金属键
导电性
导热性
延展性
①在金属晶体中,原子间以__________相结合。
②金属晶体的性质:优良的_________、_________和__________。
金属晶体在三维空间的四种堆积模型
空间利用率= ×100%,球体积为晶胞中所含金属原子的总体积。
球体积
晶胞体积
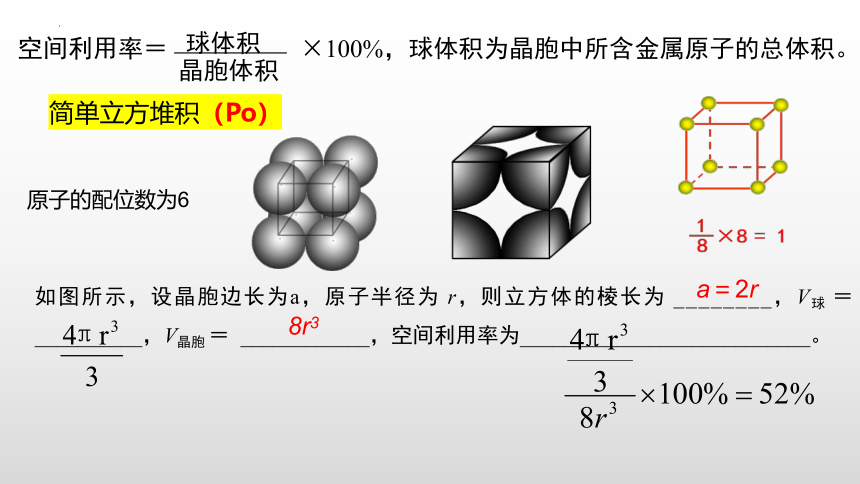
简单立方堆积(Po)
如图所示,设晶胞边长为a,原子半径为 r,则立方体的棱长为 ________,V球 = __________,V晶胞 = ____________,空间利用率为___________________________。
a=2r
8r3
原子的配位数为6
体心立方堆积(Na、K、Cr、Mo(钼)、W等)
如图所示,设原子半径为 r,则体对角线 c 为 __________,面对角线 b 为 __________ (用 a 表示),a = __________ (用 r 表示),空间利用率为 ______________。
原子的配位数为8
六方最密堆积(Mg、Zn、Ti等)
如图所示,设原子半径为 r,则棱长为________(用 r 表示,下同),底面面积 S = ____________,h = __________,V球 = __________,V晶胞 = ________________,空间利用率为__________________。
2r
原子的配位数为12
面心立方最密堆积(Au、Ag、Cu、Al等)
如图所示,设原子半径为 r,则面对角线为 __________ (用 r 表示),a =__________( 用 r 表示 ),V晶胞 =________ (用 r 表示),空间利用率为__________________。
4r
原子的配位数为12
小
多
强
越高
金属键的强弱和对金属熔沸点的影响:
A.金属键的强弱主要取决于金属元素的原子半径和价电子数,原子半径越______,价电子数越______,金属键越______;反之,金属键越______。
B.金属键越强,金属的熔、沸点越______,硬度越______。
弱
大
(1)构成粒子:__________和__________。
(2)作用力:__________。
(3)配位数:一个离子周围__________的__________离子的数目。
(4)离子晶体结构的决定因素。
①几何因素:晶体中正负离子的__________。
②电荷因素:晶体中正负离子的__________。
③键性因素:离子键的____________。
阴离子
阳离子
离子键
最邻近
异电性
半径比
电荷比
纯粹程度
2.离子晶体
常见离子晶体
①NaCl型:在晶体中,每个Na+同时吸引 6 个Cl-,每个Cl-同时吸引 6 个Na+,配位数为 6 。每个晶胞含 4 个Na+和 4 个Cl-。?
②CsCl型:在晶体中,每个Cl-吸引 8 个Cs+,每个Cs+吸引 8 个Cl-,配位数为 8 。?
晶胞中S2-以面心立方堆积,Zn2+占据S2-围成的8个正四面体空隙中的4个互不相邻的正四面体空隙。每个S2-周围距离最近且相等的锌离子有4 个,每个锌离子周围距离最近且相等的硫离子有4 个。1个ZnS晶胞中含有4个Zn2+和4个S2-
S2-
Zn2+
离子晶体的性质
熔、沸点
熔、沸点________,难挥发
硬度
硬度________,难以压缩
溶解性
一般在水中________,在非极性溶剂中________
导电性
固态时__________,熔融状态或在水溶液中__________
较高
较大
易溶
难溶
不导电
能导电
一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如MgO>MgCl2>NaCl>CsCl。衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
3.共价晶体
原子
共价键
①共价晶体中,由于各原子均以强的共价键相结合,因此一般熔点______,硬度______。
②结构相似的共价晶体,原子半径越小,键长________,键能越大,晶体的熔点________,如金刚石>碳化硅>硅。
高
大
越短
越高
常见的共价晶体模型
金刚石晶体中,每个C与另外 4 个C形成共价键,C—C之间的夹角是109°28',最小的环是 六 元环。含有1 mol碳的金刚石中,形成的共价键为 2 mol。?
金刚石
每个C原子被12个最小环共用;每个最小环含有1/2个C原子
SiO2
(1)每个Si与4个O以共价键结合,轨道均为sp3杂化,形成正四面体结构
(2)每个正四面体占有1个Si,4个“O”,n(Si)∶n(O)=1∶2
(3)Si:Si-O=1:4
(4)最小环上有12个原子,即6个O,6个Si
4.分子晶体
(1)概念:只含________的晶体称为分子晶体。
(2)粒子间的相互作用力:分子晶体内相邻分子间以______________相互吸引,分子内原子之间以____ __ ____结合。
分子
分子间作用力
共价键
(3)常见的分子晶体。
①所有________________,如水、硫化氢、氨、甲烷等。
②部分______________,如卤素(X2)、氧(O2)、硫(S8)、氮(N2)、白磷(P4)、C60等。
③部分________________,如CO2、SO2、P4O6、P4O10等。
④几乎所有的______,如H2SO4、HNO3、H3PO4、H2SiO3等。
⑤绝大多数__________的晶体,如苯、乙醇、乙酸、葡萄糖等。
非金属氢化物
非金属单质
非金属氧化物
酸
有机物
常见分子晶体模型
①干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有 12 个。?
②冰的结构模型中,每个水分子与相邻的 4 个水分子以氢键相连接,含1 mol H2O的冰中,最多可形成“氢键”数目为 2NA 个。?
分子晶体的性质
分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得________,如H2O>H2Te>H2Se>H2S;
组成和结构相似的分子晶体,相对分子质量越______,熔、沸点越高,如SnH4>GeH4>SiH4>CH4;
组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如CO>N2、CH3OH>CH3CH3;
同分异构体支链越________,熔、沸点越低,如正丁烷>异丁烷。
高
大
多
5.混合型晶体—石墨晶体
石墨晶体结构
石墨层状晶体中,每个碳原子的配位数为 3 ,有1个未参与杂化的2p轨道,平均每个正六边形拥有的碳原子个数是 2 ;石墨的导电性只能沿着 石墨平面 的方向。?
(1)纯粹的典型晶体是不多的,大多数晶体是它们之间的_________ 。
(2)几种氧化物的化学键中离子键成分的百分数
表中四种氧化物晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的过渡晶体。
过渡晶体
氧化物
Na2O
MgO
Al2O3
SiO2
离子键的百分数/%
62
50
41
33
6.过渡晶体
四种晶体类型的比较
晶体类型
分子晶体
共价晶体
金属晶体
离子晶体
构成粒子
分子 ?
原子 ?
金属阳离子 和?
自由电子?
阴、阳离子?
粒子间的
相互作用力
分子间作用力
共价键?
金属键?
离子键?
硬度
较小
很大?
有的很大,有的很小
较大
熔、沸点
较低
很高?
有的很高,有的很低
较高
溶解性
相似相溶
难溶于一般溶剂
常见溶剂难溶
大多易溶于水等极性溶剂
导电、
传热性
一般不导电,溶于水后有的导电
一般不具有导电性
电和热的 良 导体?
晶体 不导 电,水溶液或熔融态
导 电?
归纳总结
不同晶体熔点高低的比较
(1)看物质所属晶体类型,一般情况下,晶体的熔点:共价晶体>离子晶体>分子晶体。
(2)同类晶体熔点比较思路
任务三:晶胞的计算--均摊法
任务三:晶胞的计算--均摊法
例1 (1)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图1所示。则该化合物的化学式为________________。
(2)图2是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价,则Q的化合价为________。
CuH
+3价
(2021湖南卷,18节选)下图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
(1)已知化合物中Ge和O的原子个数比为1∶4,图中Z表示 原子(填元素符号),该化合物的化学式为 。?
晶体密度的计算公式推导过程
任务三:晶胞的计算--晶体密度
任务三:晶胞的计算--晶体密度
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}晶体
晶体结构
密度计算
金刚石
ρ=
SiO2
ρ=
干冰
ρ=
任务三:晶胞的计算--晶体密度
例1(9)Na和O能够形成化合物,其晶胞结构如图9所示,晶胞参数a=0.566 nm,化合物的化学式为____________;晶胞中Na原子的配位数为________;列式计算该晶体的密度(g·cm-3 )__________________________。
Na2O
8
(2021广东卷,20节选)。
(2)图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg∶Ge∶Sb= 。?
(3)设X的最简式的式量为Mr,则X晶体的密度为? g·cm-3(列出算式)。?
(2)4 1∶1∶2 (3) ×1021
原子分数坐标:以晶胞参数为单位长度(不论晶胞边长大小,都是1)建立的坐标系。
任务三:晶胞的计算--判断原子坐标
任务三:晶胞的计算--判断原子坐标
(????????,0,????????)
?
(????,0,????)
?
(????????,????????,????????)
?
(????????,????????,0)
?
(????,0,????)
?
(????,0,????)
?
(????????,????????,????????)
?
(????????,????????,????????)
?
确定原子的分数坐标
例1.(1)(2021山东卷,16节选)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为 。已知Xe—F键长为r pm,则B点原子的分数坐标为 ;晶胞中A、B间距离d= pm。?
思路指导
(1)
任务三:晶胞的计算--空间利用率
空间利用率= ×100%,球体积为晶胞中所含金属原子的总体积。
球体积
晶胞体积
任务三:晶胞的计算--空间利用率
空间利用率= ×100%,球体积为晶胞中所含金属原子的总体积。
球体积
晶胞体积
例1 (12)金刚石晶胞(如图12)含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=______a,列式表示碳原子在晶胞中的空间占有率__________________________(不要求计算结果)。
8
(2021全国乙卷,35节选)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。
(1)处于顶角位置的是 原子。?
(2)设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为? %(列出计算表达式)。?
谢
谢
观
看
同课章节目录
