2023届高考化学二轮复习基于模型认知的多重平衡分析课件(18张PPT)
文档属性
| 名称 | 2023届高考化学二轮复习基于模型认知的多重平衡分析课件(18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-26 08:25:21 | ||
图片预览



文档简介
(共18张PPT)
——以动力学和热力学为基础
基于模型认知的多重平衡分析
多重平衡概念
一个化学反应体系中,往往存在着多个化学反应。
相互关联的若干平衡同时存在于一个平衡体系中,且至少有一种物质同时参与几种相互关联的平衡,这种现象称作为多重平衡现象,该体系称作为多重平衡体系。
如以下体系:
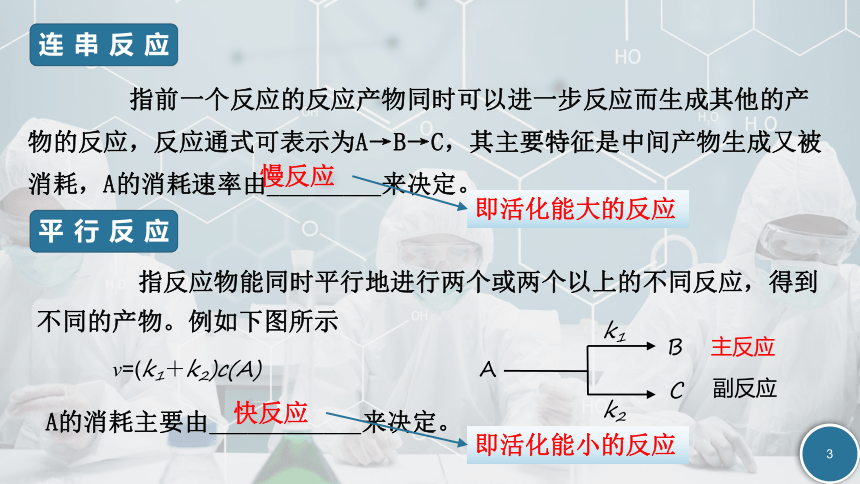
指反应物能同时平行地进行两个或两个以上的不同反应,得到不同的产物。例如下图所示
平行反应
指前一个反应的反应产物同时可以进一步反应而生成其他的产物的反应,反应通式可表示为A→B→C,其主要特征是中间产物生成又被消耗,A的消耗速率由_________来决定。
连串反应
主反应
副反应
A
B
C
k2
k1
v=(k1+k2)c(A)
A的消耗主要由____________来决定。
慢反应
即活化能大的反应
快反应
即活化能小的反应
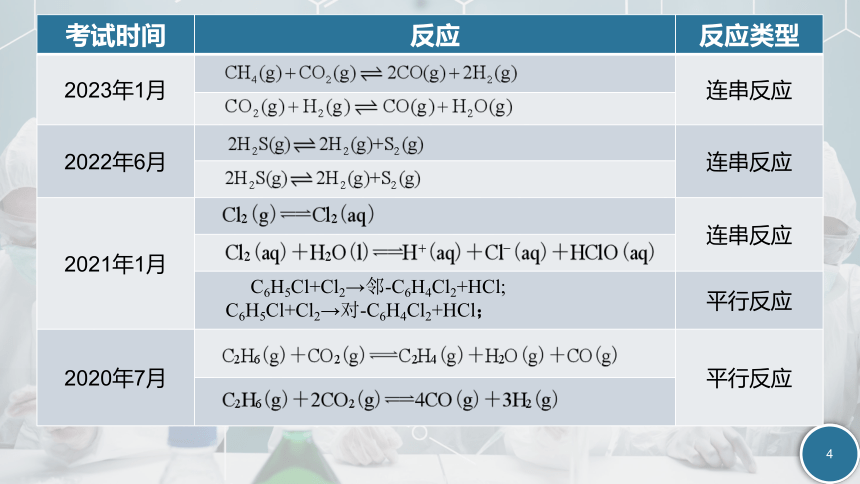
考试时间 反应 反应类型
2023年1月 连串反应
2022年6月 连串反应
2021年1月 连串反应
C6H5Cl+Cl2→邻-C6H4Cl2+HCl; C6H5Cl+Cl2→对-C6H4Cl2+HCl; 平行反应
2020年7月 平行反应
连串反应思维模型构建
A
B
C
v1
v2
若v1>> v2,
若v2>> v1,
则中间产物B的含量会快速上升,后缓慢下降;
则中间产物B的含量始终维持在较低水平。
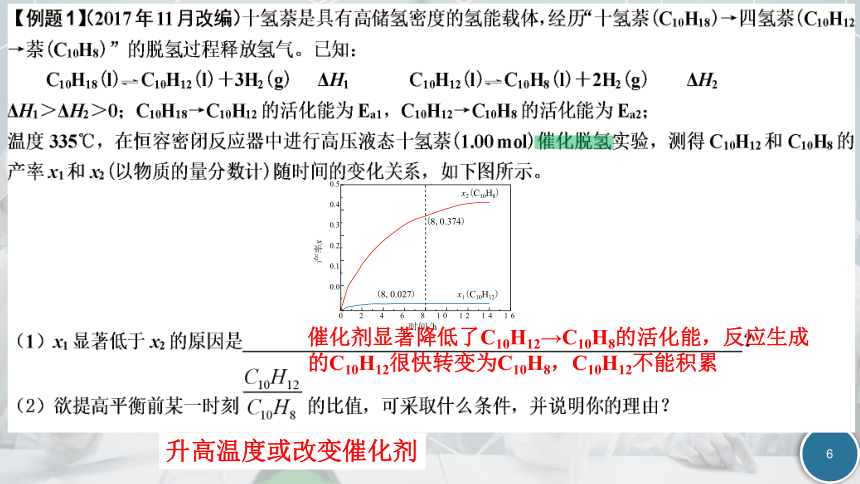
(8,0.374)
0 2 4 6 8 10 12 14 16
0.5
0.4
0.3
0.2
0.1
0.0
产率x
时间/h
x2(C10H8)
(8,0.027)
x1(C10H12)
升高温度或改变催化剂
催化剂显著降低了C10H12→C10H8的活化能,反应生成的C10H12很快转变为C10H8,C10H12不能积累
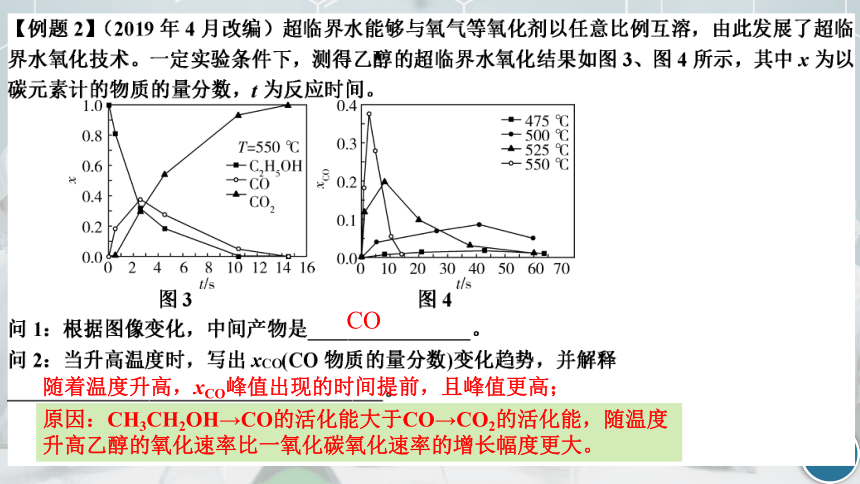
CO
随着温度升高,xCO峰值出现的时间提前,且峰值更高;
原因:CH3CH2OH→CO的活化能大于CO→CO2的活化能,随温度升高乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大。
(8,0.374)
0 2 4 6 8 10 12 14 16
0.5
0.4
0.3
0.2
0.1
0.0
产率x
时间/h
x2(C10H8)
(8,0.027)
x1(C10H12)
适当提高温度
【追问】若想要提高平衡时C10H12的相对含量,可以采取什么措施?
解释:升高温度,活化能大的反应,速率提升程度更大。
阿伦尼乌斯公式
鲁科版教材P-73
解释:改变温度,对│ΔH│大的反应平衡常数的改变百分率大。
1/T
lnk
热力学
调控方法
催化剂
温度
连串反应
改变相同温度时,活化能大的反应,速率改变幅度更大
不同催化剂对活化能降低的幅度不同,可调控某一反应的选择性
改变温度,对│ΔH│大的影响幅度更大
浓度、温度、压强调控平衡移动,改变产物的产率。
动力学
连串反应思维模型构建
浓度
【例题3】(2021年1月改编)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5 mol·L 1,反应30 min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用什么措施,并说明你的理由:
____________________________________________________________。
平行反应思维模型构建
催化剂,可以选择性的降低转化为邻二氯苯的活化能;
适当升高温度,转化为邻二氯苯的速率增幅更大。
速度问题
相对提高指定反应的速率
提高邻二氯苯的比例
温度
催化剂
温度高于800℃时,以反应Ⅱ为主,压强增大,平衡不移动。但压强增大,使反应Ⅰ平衡正移,水蒸气浓度增大,CO2和H2浓度减小,从而导致反应Ⅱ平衡逆移,所以CO2的平衡转化率减小
平衡的影响因素考虑
温度、压强、浓度等
压强
热力学
改变相同温度时,活化能大的反应,速率改变幅度更大
不同催化剂对活化能降低的幅度不同,可调控某一反应的选择性
催化剂
温度
平行反应
调控方法
改变温度、压强、浓度调控平衡的移动
动力学
平行反应思维模型构建
多重平衡思维模型应用
问1:一开始两条曲线相交的原因是什么?
问2:如何解释图1中两条曲线变化趋势?
温度较低时,反应Ⅱ的活化能低,主要发生反应Ⅱ,投料比和反应2的计量系数比相等,因此转化率相同。
温度升高,反应速率加快,故甲烷和二氧化碳的转化率升高;反应Ⅰ的活化能大于反应Ⅱ,升高温度反应Ⅰ速率增幅更大,故转化率差距在增大。
②催化剂X可提高R值,另一时段内转化率、R值随温度变化如下表:
问3:请你简述催化剂可提高R值的原因?
R值提高是由于催化剂X选择性地提高反应Ⅱ的速率
多重平衡思维模型应用
在低温段,以反应Ⅰ为主,随温度升高,S2(g)的体积分数增大;在高温段,随温度升高;反应Ⅱ消耗S2的速率大于反应Ⅰ生成S2的速率,S2(g)的体积分数减小
规律:先升后降;
低温时,1,2-加成反应活化能较小,反应速率较快,所以以1,2-加成产物为主。
温度较高时:
温度升高,活化能更高的1,4-加成反应速率增幅更大;
第二步为可逆反应,1,4-加成反应产物能量更低,有利于平衡向能量更低的1,4-加成反应进行;
谢谢各位专家和同仁
——以动力学和热力学为基础
基于模型认知的多重平衡分析
多重平衡概念
一个化学反应体系中,往往存在着多个化学反应。
相互关联的若干平衡同时存在于一个平衡体系中,且至少有一种物质同时参与几种相互关联的平衡,这种现象称作为多重平衡现象,该体系称作为多重平衡体系。
如以下体系:
指反应物能同时平行地进行两个或两个以上的不同反应,得到不同的产物。例如下图所示
平行反应
指前一个反应的反应产物同时可以进一步反应而生成其他的产物的反应,反应通式可表示为A→B→C,其主要特征是中间产物生成又被消耗,A的消耗速率由_________来决定。
连串反应
主反应
副反应
A
B
C
k2
k1
v=(k1+k2)c(A)
A的消耗主要由____________来决定。
慢反应
即活化能大的反应
快反应
即活化能小的反应
考试时间 反应 反应类型
2023年1月 连串反应
2022年6月 连串反应
2021年1月 连串反应
C6H5Cl+Cl2→邻-C6H4Cl2+HCl; C6H5Cl+Cl2→对-C6H4Cl2+HCl; 平行反应
2020年7月 平行反应
连串反应思维模型构建
A
B
C
v1
v2
若v1>> v2,
若v2>> v1,
则中间产物B的含量会快速上升,后缓慢下降;
则中间产物B的含量始终维持在较低水平。
(8,0.374)
0 2 4 6 8 10 12 14 16
0.5
0.4
0.3
0.2
0.1
0.0
产率x
时间/h
x2(C10H8)
(8,0.027)
x1(C10H12)
升高温度或改变催化剂
催化剂显著降低了C10H12→C10H8的活化能,反应生成的C10H12很快转变为C10H8,C10H12不能积累
CO
随着温度升高,xCO峰值出现的时间提前,且峰值更高;
原因:CH3CH2OH→CO的活化能大于CO→CO2的活化能,随温度升高乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大。
(8,0.374)
0 2 4 6 8 10 12 14 16
0.5
0.4
0.3
0.2
0.1
0.0
产率x
时间/h
x2(C10H8)
(8,0.027)
x1(C10H12)
适当提高温度
【追问】若想要提高平衡时C10H12的相对含量,可以采取什么措施?
解释:升高温度,活化能大的反应,速率提升程度更大。
阿伦尼乌斯公式
鲁科版教材P-73
解释:改变温度,对│ΔH│大的反应平衡常数的改变百分率大。
1/T
lnk
热力学
调控方法
催化剂
温度
连串反应
改变相同温度时,活化能大的反应,速率改变幅度更大
不同催化剂对活化能降低的幅度不同,可调控某一反应的选择性
改变温度,对│ΔH│大的影响幅度更大
浓度、温度、压强调控平衡移动,改变产物的产率。
动力学
连串反应思维模型构建
浓度
【例题3】(2021年1月改编)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5 mol·L 1,反应30 min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用什么措施,并说明你的理由:
____________________________________________________________。
平行反应思维模型构建
催化剂,可以选择性的降低转化为邻二氯苯的活化能;
适当升高温度,转化为邻二氯苯的速率增幅更大。
速度问题
相对提高指定反应的速率
提高邻二氯苯的比例
温度
催化剂
温度高于800℃时,以反应Ⅱ为主,压强增大,平衡不移动。但压强增大,使反应Ⅰ平衡正移,水蒸气浓度增大,CO2和H2浓度减小,从而导致反应Ⅱ平衡逆移,所以CO2的平衡转化率减小
平衡的影响因素考虑
温度、压强、浓度等
压强
热力学
改变相同温度时,活化能大的反应,速率改变幅度更大
不同催化剂对活化能降低的幅度不同,可调控某一反应的选择性
催化剂
温度
平行反应
调控方法
改变温度、压强、浓度调控平衡的移动
动力学
平行反应思维模型构建
多重平衡思维模型应用
问1:一开始两条曲线相交的原因是什么?
问2:如何解释图1中两条曲线变化趋势?
温度较低时,反应Ⅱ的活化能低,主要发生反应Ⅱ,投料比和反应2的计量系数比相等,因此转化率相同。
温度升高,反应速率加快,故甲烷和二氧化碳的转化率升高;反应Ⅰ的活化能大于反应Ⅱ,升高温度反应Ⅰ速率增幅更大,故转化率差距在增大。
②催化剂X可提高R值,另一时段内转化率、R值随温度变化如下表:
问3:请你简述催化剂可提高R值的原因?
R值提高是由于催化剂X选择性地提高反应Ⅱ的速率
多重平衡思维模型应用
在低温段,以反应Ⅰ为主,随温度升高,S2(g)的体积分数增大;在高温段,随温度升高;反应Ⅱ消耗S2的速率大于反应Ⅰ生成S2的速率,S2(g)的体积分数减小
规律:先升后降;
低温时,1,2-加成反应活化能较小,反应速率较快,所以以1,2-加成产物为主。
温度较高时:
温度升高,活化能更高的1,4-加成反应速率增幅更大;
第二步为可逆反应,1,4-加成反应产物能量更低,有利于平衡向能量更低的1,4-加成反应进行;
谢谢各位专家和同仁
同课章节目录
