5.1.3不同价态硫的转化和粗盐提纯 课件(共24张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1.3不同价态硫的转化和粗盐提纯 课件(共24张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-26 09:53:04 | ||
图片预览





文档简介
(共24张PPT)
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第三课时 不同价态硫的转化与粗盐提纯
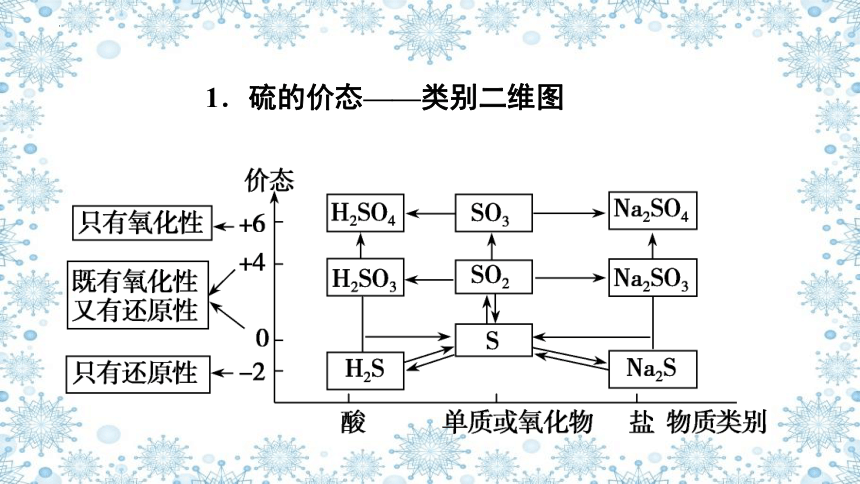
1.硫的价态——类别二维图
2.硫及其化合物之间的转化规律
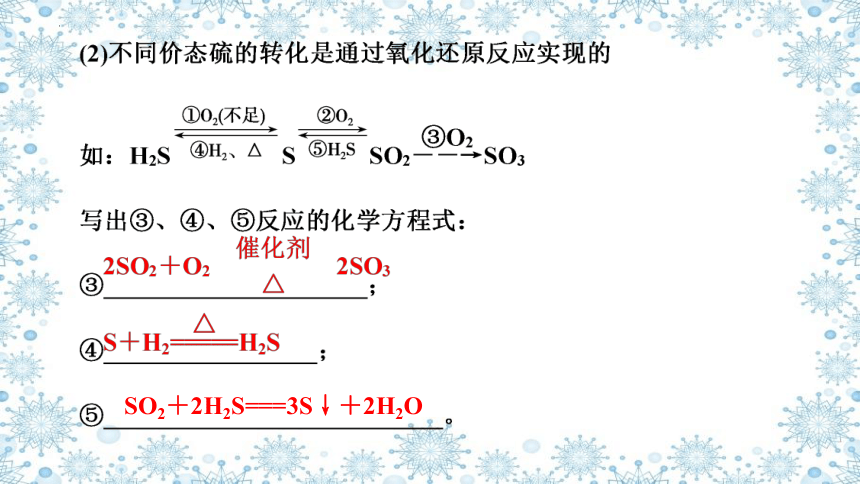
(1)相同价态硫的转化是通过酸、碱反应实现的
如:
反应②、③、④的化学方程式为
②_________________________________;
③______________________________________;
④________________________________。
H2SO3+2NaOH===Na2SO3+2H2O
Na2SO3+H2SO4===Na2SO4+H2O+SO2↑
Na2SO3+H2O+SO2===2NaHSO3
SO2+2H2S===3S↓+2H2O
二、不同价态含硫物质的转化
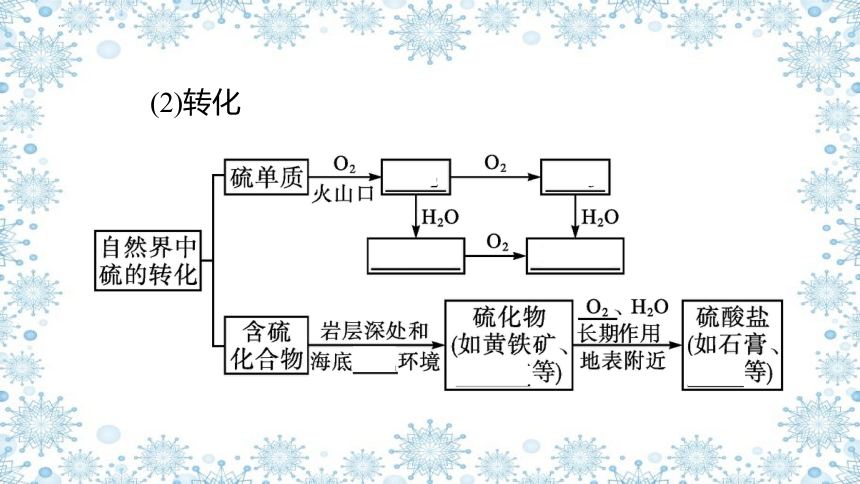
1.自然界中硫的存在与转化
(1)存在
①游离态的硫存在于火山口附近或地壳的岩层中。
②化合态
a.主要以硫化物和硫酸盐的形式存在。
b.重要的化合物:
名称 黄铁矿 黄铜矿 石膏 芒硝
化学式 FeS2 CuFeS2 CaSO4·2H2O Na2SO4·10H2O
(2)转化
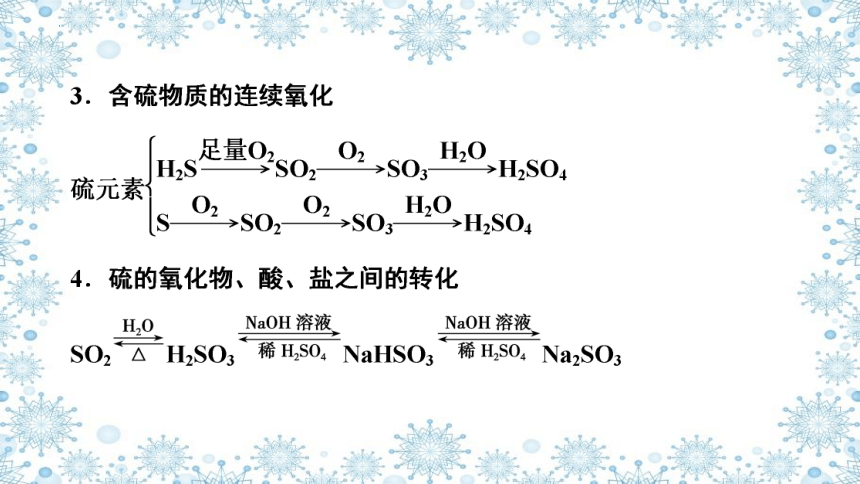
2.工业合成硫酸中硫的转化
现在我们炒菜用的精盐又细又白,粗盐中含有不溶性的泥沙以及一些可溶性的硫酸盐、CaCl2、MgCl2等杂质。你知道精盐是由粗盐经过什么样的程序制得的吗?
实验步骤 实验操作
①溶解 用托盘天平称取5 g粗盐放入烧杯中,然后加入20 mL水,用玻璃棒 ,使粗盐溶解,得到粗盐水。
搅拌
②沉淀 向粗盐水中依次滴加过量的氯化钡溶液、氢氧化钠溶液、饱和碳酸钠溶液,使________________ _完全沉淀析出。
粗盐的提纯
关键点:为保障杂质离子完全除去,只要碳酸钠溶液在氯化钡之后加入即可。
④中和 向滤液中滴加盐酸,用玻璃棒搅拌,直到_____
,并用pH试纸检验,使滤液呈中性或微酸性。
无气
泡冒出
⑤蒸发 将滤液倒入蒸发皿,用酒精灯加热,并用玻璃棒不断 。当蒸发皿中出现 时,停止加热。利用蒸发皿的余热使滤液蒸干。冷却后,得到除去杂质离子的精盐。
搅拌
较多固体
③过滤 将烧杯静置后过滤,除去生成的沉淀和不溶性杂质、过滤中玻璃棒的作用是 ,滤液呈 性
引流
碱
(1) 经溶解、过滤、蒸发操作得到的粗盐中含有一些可溶性硫酸盐及CaCl2、MgCl2等杂质。如果按照下表所示顺序除去它们,应加入什么试剂?
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
NaOH
Mg2++2OH-===Mg(OH)2↓
Na2CO3
Ba2++===BaSO4↓
Ca2++===CaCO4↓
思考与讨论
粗盐的提纯
杂质 加入的试剂 引入新离子 除去方法
硫酸盐 BaCl2溶液
MgCl2 NaOH溶液
CaCl2 Na2CO3溶液
Ba2+
加入Na2CO3溶液
OH-
盐酸
CO32-
盐酸
加入碳酸钠溶液后又引入新的杂质了吗?
(2)加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法除去这些离子?
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
试剂的用量、加试剂的顺序、操作步骤、混合物的分离难易等
粗盐溶液(SO42-、Mg2+、Ca2+)
BaCl2
Na+、Cl-(Ba2+、OH-、Ca2+)沉淀
Na+、Cl-(Ba2+、Mg2+、Ca2+)沉淀
NaOH
Na+、Cl-(CO32-、OH-)沉淀
Na2CO3
过滤
Na+、Cl-(CO32-、OH-)
盐酸
Na+、Cl-(HCl)
为使杂质离子完全除去,要加入过量的试剂。后续试剂要能够将前面所加过量的试剂除去,由此可知碳酸钠溶液要在氯化钡溶液之后加入。
1.粗盐精制过程图示分析
提炼归纳
2.过量试剂的除去
(1)过量BaCl2用Na2CO3溶液除去,故Na2CO3溶液要在BaCl2溶液加入之后再加入。
(2)过量NaOH和Na2CO3溶液用盐酸除去,故盐酸必须在最后加入,即向过滤后的滤液中加入适量盐酸。
3.确定试剂的顺序。
(1)BaCl2→NaOH→Na2CO3→HCl
(2)NaOH→BaCl2→Na2CO3→HCl
(3)BaCl2→Na2CO3→NaOH→HCl
4.分离、提纯的“三必须”“四原则”
(1)“三必须”
①除杂试剂必须稍过量。
②过量试剂必须除尽,且容易除去。
③除杂途径选最佳,有多种杂质时除杂顺序必须合理。
(2)“四原则”
1.(2020·高考全国卷Ⅰ)下列气体去除杂质的方法中,不能实现目的的是( )
气体(杂质) 方法
A SO2(H2S) 通过酸性高锰酸钾溶液
B Cl2(HCl) 通过饱和的食盐水
C N2(O2) 通过灼热的铜丝网
D NO(NO2) 通过氢氧化钠溶液
A
解析:酸性高锰酸钾溶液不仅能与H2S反应,而且也能与SO2反应,A项不能实现目的。
2.判断正误,正确的打“√”,错误的打“×”。
(1)(2019·浙江4月选考,11B)在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色。( )
(2)(2019·浙江4月选考,11C)向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀。( )
(3)(2019·浙江4月选考,8D)硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等。( )
(4)(2018·浙江11月选考,8D)接触法制硫酸的硫元素主要来源于硫黄或含硫矿石。( )
√
√
√
√
√
√
×
×
√
3.(2017·高考全国卷Ⅰ)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是( )
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5 和2.1
D.氢硫酸的还原性强于亚硫酸
D
解析:A能,氢硫酸不能与NaHCO3溶液反应,说明酸性:H2SH2CO3;B能,相同浓度时导电能力越强,说明溶液中离子浓度越大,酸的电离程度越大,故可判断酸性:H2SH2SO3,则c(H+):H2S4.(2018·高考全国卷Ⅰ节选)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:__________________________
_________________________________________。
解析:(1)根据题给信息,将NaHSO3过饱和溶液结晶脱水可得到Na2S2O5,则化学方程式为2NaHSO3===Na2S2O5+H2O。
答案:(1)2NaHSO3===Na2S2O5+H2O
(2)利用烟道气中的SO2生产Na2S2O5的工艺如图所示:
①pH=4.1时,Ⅰ中为________溶液(写化学式)。
②工艺中加入Na2CO3固体并再次充入SO2的目的是________________。
解析:(2)①酸性条件下,SO2与Na2CO3溶液反应生成NaHSO3。②工艺中加入Na2CO3固体并再次通入SO2,其目的是得到NaHSO3过饱和溶液。
答案:(2)①NaHSO3 ②得到NaHSO3过饱和溶液
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第三课时 不同价态硫的转化与粗盐提纯
1.硫的价态——类别二维图
2.硫及其化合物之间的转化规律
(1)相同价态硫的转化是通过酸、碱反应实现的
如:
反应②、③、④的化学方程式为
②_________________________________;
③______________________________________;
④________________________________。
H2SO3+2NaOH===Na2SO3+2H2O
Na2SO3+H2SO4===Na2SO4+H2O+SO2↑
Na2SO3+H2O+SO2===2NaHSO3
SO2+2H2S===3S↓+2H2O
二、不同价态含硫物质的转化
1.自然界中硫的存在与转化
(1)存在
①游离态的硫存在于火山口附近或地壳的岩层中。
②化合态
a.主要以硫化物和硫酸盐的形式存在。
b.重要的化合物:
名称 黄铁矿 黄铜矿 石膏 芒硝
化学式 FeS2 CuFeS2 CaSO4·2H2O Na2SO4·10H2O
(2)转化
2.工业合成硫酸中硫的转化
现在我们炒菜用的精盐又细又白,粗盐中含有不溶性的泥沙以及一些可溶性的硫酸盐、CaCl2、MgCl2等杂质。你知道精盐是由粗盐经过什么样的程序制得的吗?
实验步骤 实验操作
①溶解 用托盘天平称取5 g粗盐放入烧杯中,然后加入20 mL水,用玻璃棒 ,使粗盐溶解,得到粗盐水。
搅拌
②沉淀 向粗盐水中依次滴加过量的氯化钡溶液、氢氧化钠溶液、饱和碳酸钠溶液,使________________ _完全沉淀析出。
粗盐的提纯
关键点:为保障杂质离子完全除去,只要碳酸钠溶液在氯化钡之后加入即可。
④中和 向滤液中滴加盐酸,用玻璃棒搅拌,直到_____
,并用pH试纸检验,使滤液呈中性或微酸性。
无气
泡冒出
⑤蒸发 将滤液倒入蒸发皿,用酒精灯加热,并用玻璃棒不断 。当蒸发皿中出现 时,停止加热。利用蒸发皿的余热使滤液蒸干。冷却后,得到除去杂质离子的精盐。
搅拌
较多固体
③过滤 将烧杯静置后过滤,除去生成的沉淀和不溶性杂质、过滤中玻璃棒的作用是 ,滤液呈 性
引流
碱
(1) 经溶解、过滤、蒸发操作得到的粗盐中含有一些可溶性硫酸盐及CaCl2、MgCl2等杂质。如果按照下表所示顺序除去它们,应加入什么试剂?
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
NaOH
Mg2++2OH-===Mg(OH)2↓
Na2CO3
Ba2++===BaSO4↓
Ca2++===CaCO4↓
思考与讨论
粗盐的提纯
杂质 加入的试剂 引入新离子 除去方法
硫酸盐 BaCl2溶液
MgCl2 NaOH溶液
CaCl2 Na2CO3溶液
Ba2+
加入Na2CO3溶液
OH-
盐酸
CO32-
盐酸
加入碳酸钠溶液后又引入新的杂质了吗?
(2)加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法除去这些离子?
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
试剂的用量、加试剂的顺序、操作步骤、混合物的分离难易等
粗盐溶液(SO42-、Mg2+、Ca2+)
BaCl2
Na+、Cl-(Ba2+、OH-、Ca2+)沉淀
Na+、Cl-(Ba2+、Mg2+、Ca2+)沉淀
NaOH
Na+、Cl-(CO32-、OH-)沉淀
Na2CO3
过滤
Na+、Cl-(CO32-、OH-)
盐酸
Na+、Cl-(HCl)
为使杂质离子完全除去,要加入过量的试剂。后续试剂要能够将前面所加过量的试剂除去,由此可知碳酸钠溶液要在氯化钡溶液之后加入。
1.粗盐精制过程图示分析
提炼归纳
2.过量试剂的除去
(1)过量BaCl2用Na2CO3溶液除去,故Na2CO3溶液要在BaCl2溶液加入之后再加入。
(2)过量NaOH和Na2CO3溶液用盐酸除去,故盐酸必须在最后加入,即向过滤后的滤液中加入适量盐酸。
3.确定试剂的顺序。
(1)BaCl2→NaOH→Na2CO3→HCl
(2)NaOH→BaCl2→Na2CO3→HCl
(3)BaCl2→Na2CO3→NaOH→HCl
4.分离、提纯的“三必须”“四原则”
(1)“三必须”
①除杂试剂必须稍过量。
②过量试剂必须除尽,且容易除去。
③除杂途径选最佳,有多种杂质时除杂顺序必须合理。
(2)“四原则”
1.(2020·高考全国卷Ⅰ)下列气体去除杂质的方法中,不能实现目的的是( )
气体(杂质) 方法
A SO2(H2S) 通过酸性高锰酸钾溶液
B Cl2(HCl) 通过饱和的食盐水
C N2(O2) 通过灼热的铜丝网
D NO(NO2) 通过氢氧化钠溶液
A
解析:酸性高锰酸钾溶液不仅能与H2S反应,而且也能与SO2反应,A项不能实现目的。
2.判断正误,正确的打“√”,错误的打“×”。
(1)(2019·浙江4月选考,11B)在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色。( )
(2)(2019·浙江4月选考,11C)向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀。( )
(3)(2019·浙江4月选考,8D)硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等。( )
(4)(2018·浙江11月选考,8D)接触法制硫酸的硫元素主要来源于硫黄或含硫矿石。( )
√
√
√
√
√
√
×
×
√
3.(2017·高考全国卷Ⅰ)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是( )
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5 和2.1
D.氢硫酸的还原性强于亚硫酸
D
解析:A能,氢硫酸不能与NaHCO3溶液反应,说明酸性:H2S
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:__________________________
_________________________________________。
解析:(1)根据题给信息,将NaHSO3过饱和溶液结晶脱水可得到Na2S2O5,则化学方程式为2NaHSO3===Na2S2O5+H2O。
答案:(1)2NaHSO3===Na2S2O5+H2O
(2)利用烟道气中的SO2生产Na2S2O5的工艺如图所示:
①pH=4.1时,Ⅰ中为________溶液(写化学式)。
②工艺中加入Na2CO3固体并再次充入SO2的目的是________________。
解析:(2)①酸性条件下,SO2与Na2CO3溶液反应生成NaHSO3。②工艺中加入Na2CO3固体并再次通入SO2,其目的是得到NaHSO3过饱和溶液。
答案:(2)①NaHSO3 ②得到NaHSO3过饱和溶液
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
