第1章 原子结构 元素周期律 检测题 (含解析) 2022-2023学年高一下学期化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第1章 原子结构 元素周期律 检测题 (含解析) 2022-2023学年高一下学期化学鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 628.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 22:49:49 | ||
图片预览




文档简介
第1章《原子结构 元素周期律》检测题
一、单选题(共13题)
1.短周期元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,基态时Y原子2p原子轨道上有5个电子,Z的周期序数是族序数的3倍,W与Y属于同一主族。下列说法正确的是
A.原子半径:r(X)B.X的第一电离能比同周期相邻元素的大
C.Y的简单气态氢化物的热稳定性比W的弱
D.Z的最高价氧化物对应水化物的酸性比W的强
2.下列说法不正确的是
A.光导纤维的主要成分为单晶Si
B.常用作油漆、涂料、油墨的红色颜料
C.碳化硅是一种新型陶瓷材料,具有耐高温耐磨的特点
D.可用于制药和焙制糕点
3.核电站遭破坏,会造成放射性物质和向外界泄漏。下列有关说法错误的是
A.每个含有55个质子 B.CsOH的碱性比KOH的强
C.HI的还原性比HF的强 D.是碘的最高价含氧酸的盐
4.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为5∶2,Z原子比X原子的核外电子数多5。下列说法正确的是( )
A.W、Y的最高价氧化物都是气体
B.Y、Z形成的化合物一定为共价化合物
C.四种元素中W元素的非金属性最强
D.W、X、Y、Z的原子半径大小顺序一定是Z>Y>X>W
5.甲~庚等元素在周期表中的相对位置如表所示,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应、
D.丁的单质可用于制造光导纤维
6.主族元素W、X、Y、Z原子序数依次增大。W的某些同位素是核聚变的原料,X的次外层有8个电子,且W与X形成的化合物溶于水显酸性,Y 和Z+的电子层结构都与Ar相同。下列叙述错误的是
A.4种元素中非金属性最强的元素为Y
B.原子半径:Z>X>Y>W
C.Z和其他3种元素均能形成离子化合物
D.Y的含氧酸的酸性比X的含氧酸的酸性强
7.运用元素周期表分析下列判断,其中错误的是
A.铍(Be)的氧化物的水合物可能是两性氧化物
B.硒化氢()是有色、有毒的气体,比稳定
C.的酸性比的酸性弱
D.砹(At)为有色固体,HAt不稳定,AgAt感光性强,不溶于一般的酸
8.按Cl2、Br2、I2的顺序,相关的递变规律正确的是
A.密度依次减小 B.颜色依次变浅
C.分子间距离依次减小 D.熔点依次降低
9.元素及其化合物的知识是“化学1”的重点内容。下列叙述中不正确的是
A.钠呈银白色、质软、熔点相对较低、密度比水小
B.铝及其化合物既能与强酸溶液反应又能与强碱溶液反应
C.二氧化硅是一种熔沸点很高、硬度很大的氧化物
D.工业硝酸因溶有少量NO2而略显黄色
10.短周期元素W、X、Y、Z的原子序数依次增加。W、X、Y简单离子的电子层结构相同,X元素在短周期主族元素中原子半径最大;W是地壳中含量最多的元素,Y的氧化物和氯化物熔融时都能导电,X、Y和Z原子的最外层电子数之和为10。下列说法正确的是( )
A.离子半径:WB.W、X、Z三种元素组成的化合物的水溶液可能显碱性
C.W、X元素组成的化合物一定只含离子键
D.工业上采用电解Y 的氧化物冶炼单质Y
11.周期表中前20号元素W、X、Y、Z的原子序数依次增大,W、X、Y三种元素所在周期序数之和等于7,这四种元素可组成中学常见的离子化合物ZYWX,其常用于检测溶液中的某种金属阳离子;W、X、Y组成一种共价化合物分子(X≡W-Y-Y-W≡X),该分子中每个原子最外层都达到8电子稳定结构。下列推断错误的是
A.简单离子的半径大小:ZC.Y的氧化物对应的水化物一定是强酸 D.Z2Y是只含一种化学键的离子化合物
12.下列有关几种常见的金属和非金属及其化合物的说法正确的是
A.Na、Mg、Al、Fe、Cu都能导电,它们的氧化物都能与酸反应
B.铝热反应是指铝能将所有的金属从其氧化物中置换出来
C.CO2、NO、SO2都是非金属氧化物,都属于酸性氧化物
D.CaCO3+SiO2CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸
13.下列有关物质性质和应用的因果关系正确的是
A.二氧化锰具有强氧化性,能将双氧水氧化为氧气
B.浓硫酸具有较强酸性,能使Cu转化为Cu2+
C.炭具有还原性,一定条件下能将二氧化硅还原为硅
D.二氧化硫具有漂白性,所以与氯水混合使用效果更好
二、非选择题(共10题)
14.按要求完成下列填空:
(1)下列各组微粒,请按要求将序号填空:
①H与D ②O2与O3 ③正戊烷与环戊烷 ④C2H6与CH3CH2CH2CH3 ⑤C2H4与C3H6 ⑥CH2═CHCH═CH2与CHCH ⑦液氯与氯气 ⑧氯化氢与盐酸 ⑨和 ⑩与
属于同素异形体的是_______ ;属于同位素的是_________ ;属于同种物质的是___________;属于同系物的是__________ 。
(2)某有机物分子式为C5H12,该有机物分子中只有一种相同化学环境的氢,有机物的结构简式为___________。
15.填空
(1)写出表示含有8个质子、10个中子的原子的化学符号_______。
(2)元素周期表中,所含元素超过18种的周期是_______。
16.(1)微粒AXn- 核外有18个电子,则它的核电荷数为__________,核内中子数为___________。
(2)由1H216O与2H217O所代表的物质中,共有_________种元素,________种原子。
(3)某实验需要l mol/L的Na2CO3溶液230 mL,配制时需要Na2CO3·10H2O_________g。
17.某元素最高价氧化物的化学式是RO2,已知其气态氢化物中含氢25%。
(1)计算R的相对原子质量_____;
(2)写出R最高价氧化物对应的水化物的化学式_____,并设计一个实验方案证明其酸性比盐酸弱_____。
18.按要求回答问题。
Ⅰ.(1)硅酸盐种类繁多,结构复杂,组成各异,通常用二氧化硅和金属氧化物的组合形式表示其组成,则KAlSi3O8可表示为________________________,Al2Si2O5(OH)4可表示为________________________。
(2)将0.2mol钠和铝的混合物溶于足量的盐酸中,产生3136mL(标准状况下)氢气,则钠和铝的物质的量之比为___________;写出钠与足量盐酸反应的化学方程式__________________________________。
Ⅱ.将3.8 g Na2CO3和NaHCO3的混合物充分加热,混合物质量减少了0.62 g。求:
(1)混合物中NaHCO3的质量___________。
(2)若将等质量的混合物与含有1.46 gHCl的稀盐酸反应,生成气体的的质量为___________。
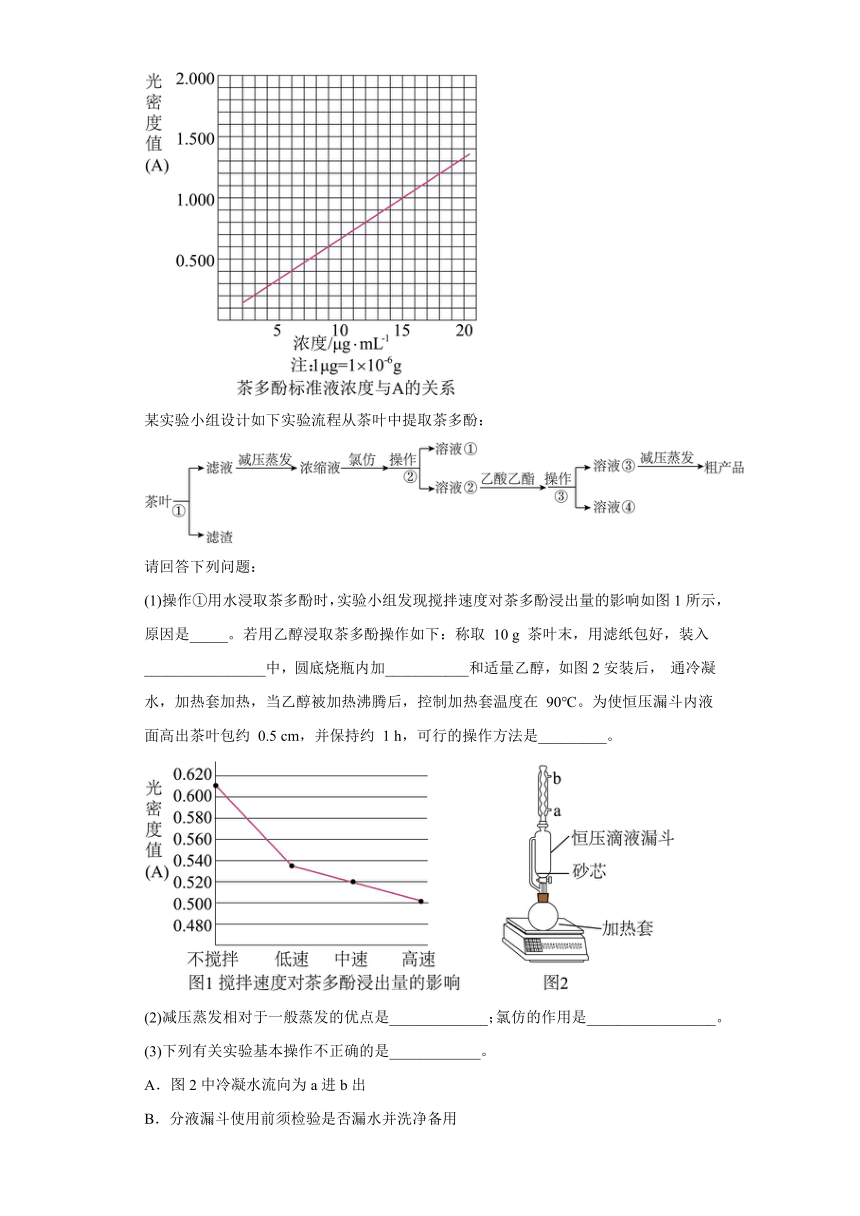
19.茶叶中的茶多酚是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。在酸性介质中,茶多酚能将Fe3+还原为Fe2+,Fe2+与K3Fe(CN)6生成的深蓝色配位化合物KFe[Fe(CN)6]对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
某实验小组设计如下实验流程从茶叶中提取茶多酚:
请回答下列问题:
(1)操作①用水浸取茶多酚时,实验小组发现搅拌速度对茶多酚浸出量的影响如图1所示,原因是_____。若用乙醇浸取茶多酚操作如下:称取 10 g 茶叶末,用滤纸包好,装入________________中,圆底烧瓶内加___________和适量乙醇,如图2安装后, 通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在 90℃。为使恒压漏斗内液面高出茶叶包约 0.5 cm,并保持约 1 h,可行的操作方法是_________。
(2)减压蒸发相对于一般蒸发的优点是_____________;氯仿的作用是_________________。
(3)下列有关实验基本操作不正确的是____________。
A.图2中冷凝水流向为a进b出
B.分液漏斗使用前须检验是否漏水并洗净备用
C.操作①过滤时,可用玻璃棒适当搅拌以加快分离速度
D.萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上立即分液
(4)称取 1.25 g 粗产品,用蒸馏水溶解并定容至 1000 mL,移取该溶液 1.00 mL,加过量 Fe3+和_______酸性溶液,用蒸馏水定容至 100 mL 后,测得溶液光密度值 A=0.800,则产品的纯度是______(以质量分数表示)。
20.某研究性学习小组设计了一组实验验证元素周期律. Ⅰ.甲同学设计了如图装置来一次性完成元素氮、碳、硅非金属性强弱的比较。
(1)甲同学在连接好仪器后,加入药品之前的具体操作是:______________
(2)要证明氮、碳、硅非金属性强弱,在 A 中加________________溶液,B 中加___________溶液,C 中加___________溶液,将观察到C 中________________的现象.但花花认为,该现象不足以证明三者非金属性强弱,请用文字叙述理由_____________。
(3)为避免上述问题,应在 B、C 之间增加一个盛有足量_____的洗气装置.改进后C 中发生反应的离子方程式是________________.
Ⅱ.丙同学设计了如图装置来验证卤族元素性质的递变规律.A、B、C 三处分别是沾有NaBr 溶液的棉花、湿润淀粉 KI 试纸、湿润红纸.
(4)请写出浓盐酸与高锰酸钾反应的离子方程式:______________
(5)A 中棉花颜色变_______,则说明非金属性 Cl>Br;向 NaBr 和 KI 的混合溶液中,通入足量的 Cl2 充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是___________
21.某同学利用某一金属元素不同价态间的相互转化,设计如图转化关系(部分物质未写出)。
已知:①A是生活中应用最广泛的一种金属单质,A、B、C、D、E、F、G中均含有同一种元素;
②常温下,X是一种常见的液体,其分子是10e-分子;
③常温下,Y是一种黄绿色有毒气体,可用于自来水消毒;
④Z为地壳中含量最多的金属元素的单质。
请回答下列问题:
(1)A、B、F、X的化学式分别为A_______ , B_______,F_______,X_______。
(2)铸造工业上,液态A在注入模具前,必须将模具充分干燥,原因是_______。(用文字描述)
(3)上述反应中属于氧化还原反应的有_______个。
(4)由上述转化关系,分析实验室保存B的水溶液时通常加入少量A的目的是_______ ,若 B的水溶液因发生氧化还原反应而变质,加入KSCN溶液后,可观察到的现象为_______。
(5)选用下列装置_______(填标号)能较长时间观察到E的颜色,不选用的装置中可观察到沉淀颜色变化情况为_______。
22.X、Y、Z、M是四种常见的短周期元素,其中Y、Z、M属于同一周期,X和M属于同一主族,Y元素最外层电子数为1,Z元素核内有14个质子。M和X元素可形成共价化合物MX2,它能使品红溶液褪色。请用化学式或化学用语回答下列问题:
(1)写出X、Y、Z的元素符号:X_______;Y_______;Z_________。
(2)M在周期表的位置是__________________________。
(3)用电子式表示Y2M的形成过程_________________。
(4)原子半径由小到大的顺序是____________________。
(5)四种元素中最高价氧化物对应水化物酸性最强的是 __________。把锌片和铜片用导线连接浸入其稀溶液中(如图所示),则_______是正极,该极发生_______反应,电极反应式为________________。
(6)X、Z、M三种元素的简单氢化物稳定性最强的是_________,其电子式是_______。
23.中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。已知:A、B、C、D、E是单质, X、Y、Z、M、N、W、H、K是化合物,其中B是短周期中原子半径最大的元素的单质、D和E为应用广泛的金属单质。请回答下列问题:
(1)组成C的元素的原子结构示意图是_____________。
(2)写出B在氧气中燃烧生成的产物与H2O反应的化学方程式___________;
(3)用惰性电极电解X的水溶液的阴极反应方程式________________________;
(4)写出实验室制备M的化学方程式_____________________________________;
参考答案:
1.B 2.A 3.D 4.B 5.A 6.D 7.B 8.C 9.B 10.B 11.C 12.A 13.C
14. ② ① ⑦⑨⑩ ④
15. 6、7
16. 18-n A-18+n 2 4 71.5
17. 12 H2CO3 实验方案:往石灰石滴加稀盐酸,产生大量气泡,该无色气体能使澄清石灰水变浑浊,则为二氧化碳气体。根据强酸制弱酸的原理可得碳酸的酸性比盐酸弱
18. K2O Al2O3 6SiO2 Al2O3 2SiO2 2H2O 4:1 2Na +2HCl =2NaCl +H2↑ 1.68 g 0.968 g
19. 茶多酚易被氧气氧化,搅拌速度越快,茶多酚氧化速度越快,浸出率越低 恒压滴液漏斗 沸石 关闭活塞,当漏斗内液面高出茶叶包约0.5cm时,调节活塞使乙醇冷凝速度与漏斗放液速度一致 降低蒸发温度防止产物氧化或分解 萃取 CD K3Fe(CN)6 96%
20. 将导管C没于液面下,微热圆底烧瓶 ,有气泡产生,冷却至室温有一段液柱,一段时间后,高度不变,则气密性良好 HNO3 Na2CO3 Na2SiO3 白色浑浊 挥发出的硝酸可能和硅酸钠反应 饱和碳酸氢钠溶液 SiO32-+CO2+H2O═H2SiO3↓+CO32- 2MnO4- +16H+ + 10Cl-=2Mn2++5Cl2↑+8H2O 橙色 NaCl和KCl
21.(1) Fe FeCl2 Fe(OH)3 H2O
(2)Fe与水蒸气在高温下反应生成H2,H2和空气的混合气体遇高温易爆炸
(3)7
(4) 防止氯化亚铁溶液中的亚铁离子被氧化成铁离子 溶液变成红色
(5) ①②④ 白色沉淀变成灰绿色,最终变为红褐色
22. O Na Si 第三周期第VIA族 O23. 2Na2O2+2H2O=4NaOH + O2↑ 2H++2e-=H2↑ AlCl3+3NH3 H2O=Al(OH)3↓+3NH4Cl
一、单选题(共13题)
1.短周期元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,基态时Y原子2p原子轨道上有5个电子,Z的周期序数是族序数的3倍,W与Y属于同一主族。下列说法正确的是
A.原子半径:r(X)
C.Y的简单气态氢化物的热稳定性比W的弱
D.Z的最高价氧化物对应水化物的酸性比W的强
2.下列说法不正确的是
A.光导纤维的主要成分为单晶Si
B.常用作油漆、涂料、油墨的红色颜料
C.碳化硅是一种新型陶瓷材料,具有耐高温耐磨的特点
D.可用于制药和焙制糕点
3.核电站遭破坏,会造成放射性物质和向外界泄漏。下列有关说法错误的是
A.每个含有55个质子 B.CsOH的碱性比KOH的强
C.HI的还原性比HF的强 D.是碘的最高价含氧酸的盐
4.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为5∶2,Z原子比X原子的核外电子数多5。下列说法正确的是( )
A.W、Y的最高价氧化物都是气体
B.Y、Z形成的化合物一定为共价化合物
C.四种元素中W元素的非金属性最强
D.W、X、Y、Z的原子半径大小顺序一定是Z>Y>X>W
5.甲~庚等元素在周期表中的相对位置如表所示,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应、
D.丁的单质可用于制造光导纤维
6.主族元素W、X、Y、Z原子序数依次增大。W的某些同位素是核聚变的原料,X的次外层有8个电子,且W与X形成的化合物溶于水显酸性,Y 和Z+的电子层结构都与Ar相同。下列叙述错误的是
A.4种元素中非金属性最强的元素为Y
B.原子半径:Z>X>Y>W
C.Z和其他3种元素均能形成离子化合物
D.Y的含氧酸的酸性比X的含氧酸的酸性强
7.运用元素周期表分析下列判断,其中错误的是
A.铍(Be)的氧化物的水合物可能是两性氧化物
B.硒化氢()是有色、有毒的气体,比稳定
C.的酸性比的酸性弱
D.砹(At)为有色固体,HAt不稳定,AgAt感光性强,不溶于一般的酸
8.按Cl2、Br2、I2的顺序,相关的递变规律正确的是
A.密度依次减小 B.颜色依次变浅
C.分子间距离依次减小 D.熔点依次降低
9.元素及其化合物的知识是“化学1”的重点内容。下列叙述中不正确的是
A.钠呈银白色、质软、熔点相对较低、密度比水小
B.铝及其化合物既能与强酸溶液反应又能与强碱溶液反应
C.二氧化硅是一种熔沸点很高、硬度很大的氧化物
D.工业硝酸因溶有少量NO2而略显黄色
10.短周期元素W、X、Y、Z的原子序数依次增加。W、X、Y简单离子的电子层结构相同,X元素在短周期主族元素中原子半径最大;W是地壳中含量最多的元素,Y的氧化物和氯化物熔融时都能导电,X、Y和Z原子的最外层电子数之和为10。下列说法正确的是( )
A.离子半径:W
C.W、X元素组成的化合物一定只含离子键
D.工业上采用电解Y 的氧化物冶炼单质Y
11.周期表中前20号元素W、X、Y、Z的原子序数依次增大,W、X、Y三种元素所在周期序数之和等于7,这四种元素可组成中学常见的离子化合物ZYWX,其常用于检测溶液中的某种金属阳离子;W、X、Y组成一种共价化合物分子(X≡W-Y-Y-W≡X),该分子中每个原子最外层都达到8电子稳定结构。下列推断错误的是
A.简单离子的半径大小:Z
12.下列有关几种常见的金属和非金属及其化合物的说法正确的是
A.Na、Mg、Al、Fe、Cu都能导电,它们的氧化物都能与酸反应
B.铝热反应是指铝能将所有的金属从其氧化物中置换出来
C.CO2、NO、SO2都是非金属氧化物,都属于酸性氧化物
D.CaCO3+SiO2CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸
13.下列有关物质性质和应用的因果关系正确的是
A.二氧化锰具有强氧化性,能将双氧水氧化为氧气
B.浓硫酸具有较强酸性,能使Cu转化为Cu2+
C.炭具有还原性,一定条件下能将二氧化硅还原为硅
D.二氧化硫具有漂白性,所以与氯水混合使用效果更好
二、非选择题(共10题)
14.按要求完成下列填空:
(1)下列各组微粒,请按要求将序号填空:
①H与D ②O2与O3 ③正戊烷与环戊烷 ④C2H6与CH3CH2CH2CH3 ⑤C2H4与C3H6 ⑥CH2═CHCH═CH2与CHCH ⑦液氯与氯气 ⑧氯化氢与盐酸 ⑨和 ⑩与
属于同素异形体的是_______ ;属于同位素的是_________ ;属于同种物质的是___________;属于同系物的是__________ 。
(2)某有机物分子式为C5H12,该有机物分子中只有一种相同化学环境的氢,有机物的结构简式为___________。
15.填空
(1)写出表示含有8个质子、10个中子的原子的化学符号_______。
(2)元素周期表中,所含元素超过18种的周期是_______。
16.(1)微粒AXn- 核外有18个电子,则它的核电荷数为__________,核内中子数为___________。
(2)由1H216O与2H217O所代表的物质中,共有_________种元素,________种原子。
(3)某实验需要l mol/L的Na2CO3溶液230 mL,配制时需要Na2CO3·10H2O_________g。
17.某元素最高价氧化物的化学式是RO2,已知其气态氢化物中含氢25%。
(1)计算R的相对原子质量_____;
(2)写出R最高价氧化物对应的水化物的化学式_____,并设计一个实验方案证明其酸性比盐酸弱_____。
18.按要求回答问题。
Ⅰ.(1)硅酸盐种类繁多,结构复杂,组成各异,通常用二氧化硅和金属氧化物的组合形式表示其组成,则KAlSi3O8可表示为________________________,Al2Si2O5(OH)4可表示为________________________。
(2)将0.2mol钠和铝的混合物溶于足量的盐酸中,产生3136mL(标准状况下)氢气,则钠和铝的物质的量之比为___________;写出钠与足量盐酸反应的化学方程式__________________________________。
Ⅱ.将3.8 g Na2CO3和NaHCO3的混合物充分加热,混合物质量减少了0.62 g。求:
(1)混合物中NaHCO3的质量___________。
(2)若将等质量的混合物与含有1.46 gHCl的稀盐酸反应,生成气体的的质量为___________。
19.茶叶中的茶多酚是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。在酸性介质中,茶多酚能将Fe3+还原为Fe2+,Fe2+与K3Fe(CN)6生成的深蓝色配位化合物KFe[Fe(CN)6]对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
某实验小组设计如下实验流程从茶叶中提取茶多酚:
请回答下列问题:
(1)操作①用水浸取茶多酚时,实验小组发现搅拌速度对茶多酚浸出量的影响如图1所示,原因是_____。若用乙醇浸取茶多酚操作如下:称取 10 g 茶叶末,用滤纸包好,装入________________中,圆底烧瓶内加___________和适量乙醇,如图2安装后, 通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在 90℃。为使恒压漏斗内液面高出茶叶包约 0.5 cm,并保持约 1 h,可行的操作方法是_________。
(2)减压蒸发相对于一般蒸发的优点是_____________;氯仿的作用是_________________。
(3)下列有关实验基本操作不正确的是____________。
A.图2中冷凝水流向为a进b出
B.分液漏斗使用前须检验是否漏水并洗净备用
C.操作①过滤时,可用玻璃棒适当搅拌以加快分离速度
D.萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上立即分液
(4)称取 1.25 g 粗产品,用蒸馏水溶解并定容至 1000 mL,移取该溶液 1.00 mL,加过量 Fe3+和_______酸性溶液,用蒸馏水定容至 100 mL 后,测得溶液光密度值 A=0.800,则产品的纯度是______(以质量分数表示)。
20.某研究性学习小组设计了一组实验验证元素周期律. Ⅰ.甲同学设计了如图装置来一次性完成元素氮、碳、硅非金属性强弱的比较。
(1)甲同学在连接好仪器后,加入药品之前的具体操作是:______________
(2)要证明氮、碳、硅非金属性强弱,在 A 中加________________溶液,B 中加___________溶液,C 中加___________溶液,将观察到C 中________________的现象.但花花认为,该现象不足以证明三者非金属性强弱,请用文字叙述理由_____________。
(3)为避免上述问题,应在 B、C 之间增加一个盛有足量_____的洗气装置.改进后C 中发生反应的离子方程式是________________.
Ⅱ.丙同学设计了如图装置来验证卤族元素性质的递变规律.A、B、C 三处分别是沾有NaBr 溶液的棉花、湿润淀粉 KI 试纸、湿润红纸.
(4)请写出浓盐酸与高锰酸钾反应的离子方程式:______________
(5)A 中棉花颜色变_______,则说明非金属性 Cl>Br;向 NaBr 和 KI 的混合溶液中,通入足量的 Cl2 充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是___________
21.某同学利用某一金属元素不同价态间的相互转化,设计如图转化关系(部分物质未写出)。
已知:①A是生活中应用最广泛的一种金属单质,A、B、C、D、E、F、G中均含有同一种元素;
②常温下,X是一种常见的液体,其分子是10e-分子;
③常温下,Y是一种黄绿色有毒气体,可用于自来水消毒;
④Z为地壳中含量最多的金属元素的单质。
请回答下列问题:
(1)A、B、F、X的化学式分别为A_______ , B_______,F_______,X_______。
(2)铸造工业上,液态A在注入模具前,必须将模具充分干燥,原因是_______。(用文字描述)
(3)上述反应中属于氧化还原反应的有_______个。
(4)由上述转化关系,分析实验室保存B的水溶液时通常加入少量A的目的是_______ ,若 B的水溶液因发生氧化还原反应而变质,加入KSCN溶液后,可观察到的现象为_______。
(5)选用下列装置_______(填标号)能较长时间观察到E的颜色,不选用的装置中可观察到沉淀颜色变化情况为_______。
22.X、Y、Z、M是四种常见的短周期元素,其中Y、Z、M属于同一周期,X和M属于同一主族,Y元素最外层电子数为1,Z元素核内有14个质子。M和X元素可形成共价化合物MX2,它能使品红溶液褪色。请用化学式或化学用语回答下列问题:
(1)写出X、Y、Z的元素符号:X_______;Y_______;Z_________。
(2)M在周期表的位置是__________________________。
(3)用电子式表示Y2M的形成过程_________________。
(4)原子半径由小到大的顺序是____________________。
(5)四种元素中最高价氧化物对应水化物酸性最强的是 __________。把锌片和铜片用导线连接浸入其稀溶液中(如图所示),则_______是正极,该极发生_______反应,电极反应式为________________。
(6)X、Z、M三种元素的简单氢化物稳定性最强的是_________,其电子式是_______。
23.中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。已知:A、B、C、D、E是单质, X、Y、Z、M、N、W、H、K是化合物,其中B是短周期中原子半径最大的元素的单质、D和E为应用广泛的金属单质。请回答下列问题:
(1)组成C的元素的原子结构示意图是_____________。
(2)写出B在氧气中燃烧生成的产物与H2O反应的化学方程式___________;
(3)用惰性电极电解X的水溶液的阴极反应方程式________________________;
(4)写出实验室制备M的化学方程式_____________________________________;
参考答案:
1.B 2.A 3.D 4.B 5.A 6.D 7.B 8.C 9.B 10.B 11.C 12.A 13.C
14. ② ① ⑦⑨⑩ ④
15. 6、7
16. 18-n A-18+n 2 4 71.5
17. 12 H2CO3 实验方案:往石灰石滴加稀盐酸,产生大量气泡,该无色气体能使澄清石灰水变浑浊,则为二氧化碳气体。根据强酸制弱酸的原理可得碳酸的酸性比盐酸弱
18. K2O Al2O3 6SiO2 Al2O3 2SiO2 2H2O 4:1 2Na +2HCl =2NaCl +H2↑ 1.68 g 0.968 g
19. 茶多酚易被氧气氧化,搅拌速度越快,茶多酚氧化速度越快,浸出率越低 恒压滴液漏斗 沸石 关闭活塞,当漏斗内液面高出茶叶包约0.5cm时,调节活塞使乙醇冷凝速度与漏斗放液速度一致 降低蒸发温度防止产物氧化或分解 萃取 CD K3Fe(CN)6 96%
20. 将导管C没于液面下,微热圆底烧瓶 ,有气泡产生,冷却至室温有一段液柱,一段时间后,高度不变,则气密性良好 HNO3 Na2CO3 Na2SiO3 白色浑浊 挥发出的硝酸可能和硅酸钠反应 饱和碳酸氢钠溶液 SiO32-+CO2+H2O═H2SiO3↓+CO32- 2MnO4- +16H+ + 10Cl-=2Mn2++5Cl2↑+8H2O 橙色 NaCl和KCl
21.(1) Fe FeCl2 Fe(OH)3 H2O
(2)Fe与水蒸气在高温下反应生成H2,H2和空气的混合气体遇高温易爆炸
(3)7
(4) 防止氯化亚铁溶液中的亚铁离子被氧化成铁离子 溶液变成红色
(5) ①②④ 白色沉淀变成灰绿色,最终变为红褐色
22. O Na Si 第三周期第VIA族 O
