高中化学(2019)必修二 第七章第三节乙醇与乙酸第一课时学案(含答案)
文档属性
| 名称 | 高中化学(2019)必修二 第七章第三节乙醇与乙酸第一课时学案(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 211.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 22:53:00 | ||
图片预览

文档简介
第七章第三节乙醇与乙酸
第一课时学案
【学习目标】
1.通过乙醇的结构及其主要化学性质与应用,认识有机物中羟基与其性质的关系,培养“宏观辨识与微观探析”的能力。
2.理解烃的衍生物、官能团的概念,知道有机物之间在一定条件下是可以转化的,培养变化观念与平衡思想。
3.了解乙醇在日常生活中的应用,培养严谨的“科学态度与社会责任”。
【目标一】有关概念
1.烃的衍生物
概念:从结构上看,烃分子中的_______被__________________所取代而生成的一系列化合物。
实例:CH3Cl、CH2Cl2、CH3CH2OH、CH3COOH等。
2.官能团
⑴ 概念:决定有机化合物____________的原子或原子团。
⑵ 常见的官能团名称和符号
代表物 CH2==CH2乙烯 CH≡CH乙炔 CH3CH2Br溴乙烷 CH3CH2OH乙醇 CH3CHO乙醛 CH3COOH乙酸
官能团结构简式 —C≡C— —OH —CHO —COOH
官能团名称 碳碳双键 碳碳三键 碳溴键 羟基 醛基 羧基
【目标二】乙醇的结构与性质
1.乙醇的物理性质:
乙醇俗称_______,是_______、有__________的液体,密度比水_____,
易_____。乙醇是一种重要的__________,能够溶解多种有机物和无机物,
并能与水以__________互溶。
【导思】能否用分液的方法分离乙醇和水?直接加热蒸馏的方法能得到无水酒精吗?__________
如果不能应如何操作?____________________
2.乙醇的组成与结构:
分子式 结构式 结构简式 官能团 球棍模型
乙醇分子可以看成是由乙基和羟基组成的:CH3CH2—OH。
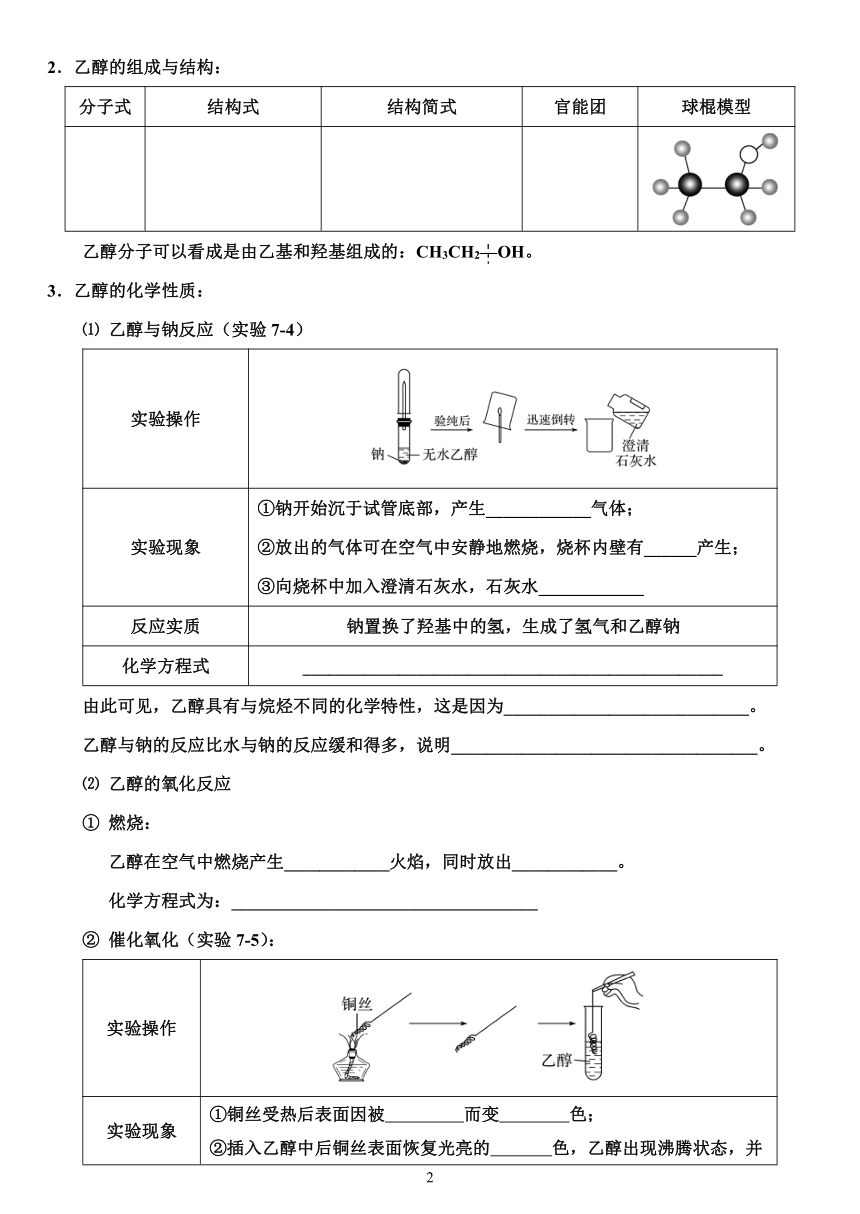
3.乙醇的化学性质:
⑴ 乙醇与钠反应(实验7-4)
实验操作
实验现象 ①钠开始沉于试管底部,产生____________气体;②放出的气体可在空气中安静地燃烧,烧杯内壁有______产生;③向烧杯中加入澄清石灰水,石灰水____________
反应实质 钠置换了羟基中的氢,生成了氢气和乙醇钠
化学方程式 ________________________________________________
由此可见,乙醇具有与烷烃不同的化学特性,这是因为____________________________。
乙醇与钠的反应比水与钠的反应缓和得多,说明___________________________________。
⑵ 乙醇的氧化反应
① 燃烧:
乙醇在空气中燃烧产生____________火焰,同时放出____________。
化学方程式为:___________________________________
② 催化氧化(实验7-5):
实验操作
实验现象 ①铜丝受热后表面因被 而变 色;②插入乙醇中后铜丝表面恢复光亮的 色,乙醇出现沸腾状态,并且持续一段时间,说明反应 ;③同时闻到 气味,与乙醇味道不同。
化学方程式 ________________________________________________
知识扩展 乙醛的官能团为醛基(,或写作—CHO),在适当条件下可被进一步氧化,生成乙酸(CH3COOH)
【导思理解】结合实验现象,在乙醇和氧气催化反应中:
⑴ 实验中铜丝是否参与反应?铜丝作用是什么?写出相关的化学方程式?
。
⑵ 结合乙醇和乙醛的结构,分析在反应中,乙醇分子中断裂的是什么化学键?
。
⑶ 结合乙醇催化氧化时化学键断裂情况分析,什么样的醇才能催化氧化?
。
【归纳总结】醇的催化氧化反应规律
⑴ 凡是含有R—CH2OH(R代表烃基)结构的醇,在一定条件下都能被氧化成醛(R—CHO)。
⑵ 凡是含有R—CH(OH)—R′结构的醇,在一定条件下也能被氧化,但生成物不是醛,而是酮(R—CO—R′)。
⑶ 凡是含有结构的醇通常情况下不能被氧化。
③ 与酸性KMnO4溶液或酸性K2Cr2O7溶液反应:
反应的现象为_________________________,乙醇被_______为_______。
交通警察判断某驾驶员酒后驾车的依据是:
驾驶员呼出的气体使检测仪中的酸性重铬酸钾溶液由橙色变为绿色。
⑶ 乙醇的消去反应
实验室制取乙烯的化学方程式为:
【目标三】乙醇的工业制法
1.发酵法
2.乙烯水化法(写出方程式):K]
【目标四】乙醇的用途
1.用作酒精灯、火锅、内燃机等的燃料。
2.用作生产医药、香料、化妆品、涂料等的化工原料。
3.医疗上常用体积分数为____的乙醇溶液作消毒剂。
【导练1】乙醇分子中有5种化学键,如图所示,根据右图回答乙醇分子结构中的断键情况:
⑴ 与Na的化学反应,断裂的化学键为________(填序号,下同)。
1 mol 乙醇和足量的金属钠反应,生成标准状况下的氢气为________L。
⑵ 在氧气中燃烧生成CO2和H2O,断裂的化学键是为____________。
⑶ ①催化氧化生成乙醛断裂的化学键是为____________。
②如果将乙醇改为,试写出催化氧化的化学反应方程式:_________________。
③如果醇为,在该条件下,醇还能被催化氧化吗?为什么?______________。
【导练2】下列有关乙醇的表述正确的是( )
A.乙醇分子中含有甲基,甲基的电子式为 B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为[OH]- D.乙醇分子的空间填充模型为
【导练3】向装有乙醇的烧杯中投入一小块金属钠,下列对实验现象的描述中正确的是( )
A.钠块沉在乙醇液面之下 B.钠块熔化成小球
C.钠块在乙醇的液面上游动 D.向烧杯中滴入几滴酚酞溶液变红色
C—Br
乙醇
熔点:-117 ℃
沸点:78.5 ℃
密度:0.789 g/cm3
.
.
.
.
PAGE
第一课时学案
【学习目标】
1.通过乙醇的结构及其主要化学性质与应用,认识有机物中羟基与其性质的关系,培养“宏观辨识与微观探析”的能力。
2.理解烃的衍生物、官能团的概念,知道有机物之间在一定条件下是可以转化的,培养变化观念与平衡思想。
3.了解乙醇在日常生活中的应用,培养严谨的“科学态度与社会责任”。
【目标一】有关概念
1.烃的衍生物
概念:从结构上看,烃分子中的_______被__________________所取代而生成的一系列化合物。
实例:CH3Cl、CH2Cl2、CH3CH2OH、CH3COOH等。
2.官能团
⑴ 概念:决定有机化合物____________的原子或原子团。
⑵ 常见的官能团名称和符号
代表物 CH2==CH2乙烯 CH≡CH乙炔 CH3CH2Br溴乙烷 CH3CH2OH乙醇 CH3CHO乙醛 CH3COOH乙酸
官能团结构简式 —C≡C— —OH —CHO —COOH
官能团名称 碳碳双键 碳碳三键 碳溴键 羟基 醛基 羧基
【目标二】乙醇的结构与性质
1.乙醇的物理性质:
乙醇俗称_______,是_______、有__________的液体,密度比水_____,
易_____。乙醇是一种重要的__________,能够溶解多种有机物和无机物,
并能与水以__________互溶。
【导思】能否用分液的方法分离乙醇和水?直接加热蒸馏的方法能得到无水酒精吗?__________
如果不能应如何操作?____________________
2.乙醇的组成与结构:
分子式 结构式 结构简式 官能团 球棍模型
乙醇分子可以看成是由乙基和羟基组成的:CH3CH2—OH。
3.乙醇的化学性质:
⑴ 乙醇与钠反应(实验7-4)
实验操作
实验现象 ①钠开始沉于试管底部,产生____________气体;②放出的气体可在空气中安静地燃烧,烧杯内壁有______产生;③向烧杯中加入澄清石灰水,石灰水____________
反应实质 钠置换了羟基中的氢,生成了氢气和乙醇钠
化学方程式 ________________________________________________
由此可见,乙醇具有与烷烃不同的化学特性,这是因为____________________________。
乙醇与钠的反应比水与钠的反应缓和得多,说明___________________________________。
⑵ 乙醇的氧化反应
① 燃烧:
乙醇在空气中燃烧产生____________火焰,同时放出____________。
化学方程式为:___________________________________
② 催化氧化(实验7-5):
实验操作
实验现象 ①铜丝受热后表面因被 而变 色;②插入乙醇中后铜丝表面恢复光亮的 色,乙醇出现沸腾状态,并且持续一段时间,说明反应 ;③同时闻到 气味,与乙醇味道不同。
化学方程式 ________________________________________________
知识扩展 乙醛的官能团为醛基(,或写作—CHO),在适当条件下可被进一步氧化,生成乙酸(CH3COOH)
【导思理解】结合实验现象,在乙醇和氧气催化反应中:
⑴ 实验中铜丝是否参与反应?铜丝作用是什么?写出相关的化学方程式?
。
⑵ 结合乙醇和乙醛的结构,分析在反应中,乙醇分子中断裂的是什么化学键?
。
⑶ 结合乙醇催化氧化时化学键断裂情况分析,什么样的醇才能催化氧化?
。
【归纳总结】醇的催化氧化反应规律
⑴ 凡是含有R—CH2OH(R代表烃基)结构的醇,在一定条件下都能被氧化成醛(R—CHO)。
⑵ 凡是含有R—CH(OH)—R′结构的醇,在一定条件下也能被氧化,但生成物不是醛,而是酮(R—CO—R′)。
⑶ 凡是含有结构的醇通常情况下不能被氧化。
③ 与酸性KMnO4溶液或酸性K2Cr2O7溶液反应:
反应的现象为_________________________,乙醇被_______为_______。
交通警察判断某驾驶员酒后驾车的依据是:
驾驶员呼出的气体使检测仪中的酸性重铬酸钾溶液由橙色变为绿色。
⑶ 乙醇的消去反应
实验室制取乙烯的化学方程式为:
【目标三】乙醇的工业制法
1.发酵法
2.乙烯水化法(写出方程式):K]
【目标四】乙醇的用途
1.用作酒精灯、火锅、内燃机等的燃料。
2.用作生产医药、香料、化妆品、涂料等的化工原料。
3.医疗上常用体积分数为____的乙醇溶液作消毒剂。
【导练1】乙醇分子中有5种化学键,如图所示,根据右图回答乙醇分子结构中的断键情况:
⑴ 与Na的化学反应,断裂的化学键为________(填序号,下同)。
1 mol 乙醇和足量的金属钠反应,生成标准状况下的氢气为________L。
⑵ 在氧气中燃烧生成CO2和H2O,断裂的化学键是为____________。
⑶ ①催化氧化生成乙醛断裂的化学键是为____________。
②如果将乙醇改为,试写出催化氧化的化学反应方程式:_________________。
③如果醇为,在该条件下,醇还能被催化氧化吗?为什么?______________。
【导练2】下列有关乙醇的表述正确的是( )
A.乙醇分子中含有甲基,甲基的电子式为 B.乙醇的结构简式为C2H6O
C.乙醇分子中羟基的电子式为[OH]- D.乙醇分子的空间填充模型为
【导练3】向装有乙醇的烧杯中投入一小块金属钠,下列对实验现象的描述中正确的是( )
A.钠块沉在乙醇液面之下 B.钠块熔化成小球
C.钠块在乙醇的液面上游动 D.向烧杯中滴入几滴酚酞溶液变红色
C—Br
乙醇
熔点:-117 ℃
沸点:78.5 ℃
密度:0.789 g/cm3
.
.
.
.
PAGE
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
