高中化学人教版(2019)必修二 第八章第一节自然资源的开发利用第一课时课时作业(含解析)
文档属性
| 名称 | 高中化学人教版(2019)必修二 第八章第一节自然资源的开发利用第一课时课时作业(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 441.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-25 22:42:43 | ||
图片预览


文档简介
第八章第一节自然资源的开发利用
第一课时 课时作业
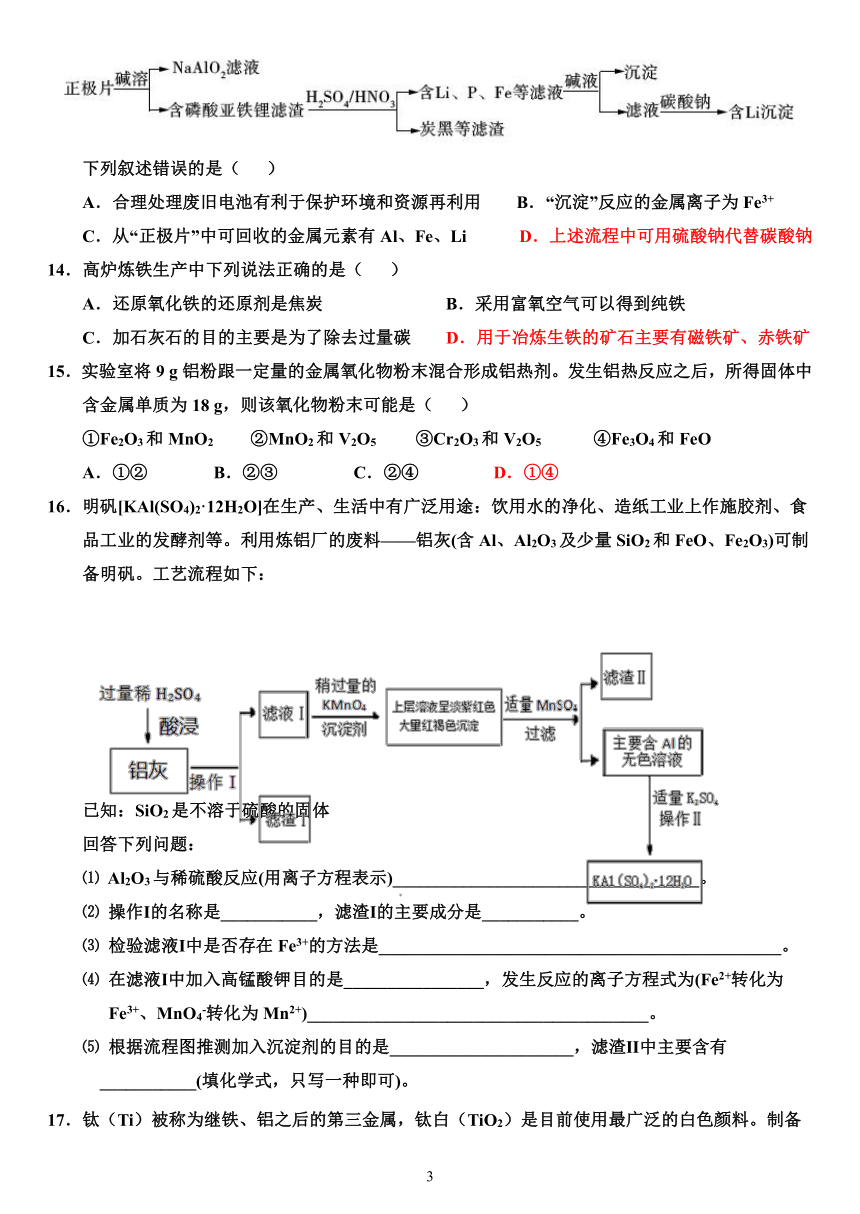
1.下列冶炼方法错误的是( )
A.2HgO2Hg+O2↑ B.3MnO2+4Al 3Mn+2Al2O3
C.2AlCl32Al+3Cl2↑ D.4CO+Fe3O43Fe+4CO2
2.用铝热法还原下列化合物,若得到的金属均为1 mol,则消耗铝最多的是( )
A.MnO2 B.Cr2O3 C.WO3 D.CuO
3.我国古代“药金”的冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A.“药金”实质上是铜锌合金 B.冶炼炉中炉甘石直接被木炭还原为锌
C.用王水可区别黄金和“药金” D.用火焰灼烧不能区别黄金和药金
4.下列有关金属铝的叙述正确的是( )
A.铝在常温下不能与氧气反应 B.铝不能与氯气反应
C.铝能置换出Fe、Cr、Mn等金属,是因为铝的还原性强且铝转化为氧化铝时放出大量的热
D.铝槽车能贮存浓硫酸、浓盐酸,铝合金是制造门窗、汽车、飞机的重要材料
5.下列金属的工业制法正确的是( )
A.制钛:用金属钠置换出氯化钛(TiCl4)溶液中的钛
B.炼铁:炼铁高炉中碳在高温下还原铁矿石中的铁
C.制钠:用海水作原料制得精盐,再电解熔融氯化钠得到金属钠
D.炼硅:用焦炭与二氧化硅在高温下反应生成粗硅和二氧化碳
6.下列说法不正确的是( )
A.钢是用量最大、用途最广的合金,青铜是我国使用最早的合金
B.储氢合金是一类能大量吸收H2,并与H2结合成金属氢化物的材料
C.一般地,合金的硬度大于它的纯金属成分,熔点高于它的成分金属
D.钛合金,形状记忆合金,耐热合金以及储氢合金都属于新型合金
7.下列制备金属单质的方法或原理正确的是( )
A.在高温条件下,用H2还原MgO制备单质Mg
B.加强热,使CuO在高温条件下分解制备单质Cu
C.在通电条件下,电解Al2O3和Na3AlF6的熔融混合物制备单质Al
D.工业上用Al和Fe2O3冶炼大量单质铁
8.下列关于铝热反应2Al + Fe2O3Al2O3 + 2Fe的说法不正确的是( )
A.该反应中Al作还原剂 B.该反应中冶炼1 mol Fe转移2 mol电子
C.氧化产物与还原产物的物质的量比为1∶2 D.该反应可用于焊接钢轨
9.下列说法错误的是( )
A.有些活泼金属(如铝)可用作热还原法的还原剂
B.加强热,使CuO在高温条件下分解可制备单质Cu
C.金属冶炼的实质是金属阳离子得到电子被还原成金属原子
D.回收旧金属可以重新制成金属或它们的化合物
10.以辉铜矿(Cu2S)为原料冶炼铜,其反应原理可表示为Cu2S+O22Cu+SO2。下列说法不正确的是( )
A.化合价发生变化的元素有3种
B.Cu2S在该反应中既是氧化剂又是还原剂
C.1 mol O2参加反应时,上述反应转移电子总物质的量为4 mol
D.SO2被分离、回收后氧化生成SO3,作为制取硫酸的原料
11.工业上用电解熔融氧化铝的方法冶炼铝,而不用还原剂还原氧化铝的方法冶炼铝。下列相关说法正确的是( )
A.氧化铝中的铝元素为+3价,只有还原性,没有氧化性
B.加入冰晶石降低氧化铝的熔点,在熔融状态下易被还原
C.铝单质的还原性强,较难用还原剂还原氧化铝得到铝
D.铝离子的氧化性强,较难用还原剂还原氧化铝得到铝
12.诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上高温冶炼钼的化学反应过程为①2MoS2+7O22MoO3+4SO2;
②MoO3+2NH3·H2O===(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl===H2MoO4↓+2NH4Cl;④H2MoO4MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。下列说法正确的是( )
A.MoS2煅烧产生的尾气可直接排放
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和Al分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
13.(2018全国Ⅰ)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是( )
A.合理处理废旧电池有利于保护环境和资源再利用 B.“沉淀”反应的金属离子为Fe3+
C.从“正极片”中可回收的金属元素有Al、Fe、Li D.上述流程中可用硫酸钠代替碳酸钠
14.高炉炼铁生产中下列说法正确的是( )
A.还原氧化铁的还原剂是焦炭 B.采用富氧空气可以得到纯铁
C.加石灰石的目的主要是为了除去过量碳 D.用于冶炼生铁的矿石主要有磁铁矿、赤铁矿
15.实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18 g,则该氧化物粉末可能是( )
①Fe2O3和MnO2 ②MnO2和V2O5 ③Cr2O3和V2O5 ④Fe3O4和FeO
A.①② B.②③ C.②④ D.①④
16.明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化、造纸工业上作施胶剂、食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO、Fe2O3)可制备明矾。工艺流程如下:
已知:SiO2是不溶于硫酸的固体
回答下列问题:
⑴ Al2O3与稀硫酸反应(用离子方程表示)___________________________________。
⑵ 操作Ⅰ的名称是___________,滤渣Ⅰ的主要成分是___________。
⑶ 检验滤液Ⅰ中是否存在Fe3+的方法是______________________________________________。
⑷ 在滤液Ⅰ中加入高锰酸钾目的是________________,发生反应的离子方程式为(Fe2+转化为Fe3+、MnO4-转化为Mn2+)_______________________________________。
⑸ 根据流程图推测加入沉淀剂的目的是_____________________,滤渣Ⅱ中主要含有___________(填化学式,只写一种即可)。
17.钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前使用最广泛的白色颜料。制备TiO2和Ti的原料是钛铁矿,用含Fe2O3的钛铁矿(主要成分为FeTiO3)制备TiO2的流程如下:
已知:TiO2++2H2O===H2TiO3↓+2H+
⑴ 步骤①加Fe的目的是______________________;步骤②冷却的目的是__________________。
⑵ 考虑成本和废物的综合利用等因素,水浸后的废液中应加入___________处理。
⑶ 由金红石(TiO2)制取单质钛(Ti)的过程为,其中反应在氩气气氛中进行的理由是___________________________。
18.为探索某工厂的废金属屑(主要成分为Fe、Cu、Al、Al2O3、Fe2O3等)的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、胆矾晶体(CuSO4·5H2O)和水处理剂高铁酸钾(K2FeO4)。请回答:
⑴ 试剂X是__________;试剂Y是__________。
⑵ 从CuSO4溶液中获取胆矾晶体的操作是_________、________过滤、洗涤。
⑶ 写出溶液A转化为固体C的离子方程式____________________________________。
⑷ 在步骤II时,小组成员小明用下图装置进行试验,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,你的建议是__________________________________________。
⑸ 由溶液E制取K2FeO4时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。
⑹ 在固体F中加入稀硫酸和H2O2来制备CuSO4溶液是一种环保工艺,该反应的总的离子方程式为__________________________________________。
⑺ 该小组同学取用100.0 g该废金属屑,经过实验,最终得到胆矾晶体25.0g,该废料中铜的质量分数约为_____________。
参考答案
1 2 3 4 5 6 7 8 9 10
C C A C C C C B B C
11 12 13 14 15 16 17 18 19 20
C D D D D
16【答案】
⑴ Al2O3+6H+===2Al3++3H2O ⑵ 过滤 SiO2
⑶ 取少量滤液于试管中,滴加KSCN溶液,若溶液变成红色则证明含有Fe3+或滴加NaOH溶液产生红褐色沉淀
⑷ 把Fe2+氧化成Fe3+ MnO4-+5Fe2++8H+===Mn2++5Fe3++4H2O
⑸ 除去Fe3+ Fe(OH)3或MnO2
17【答案】
⑴ 将Fe3+还原为Fe2+ 析出绿矾(FeSO4·7H2O)
⑵ 生石灰(或碳酸钙、碱) ⑶ 高温下镁或钛与O2、N2等反应
18【答案】
⑴ NaOH或KOH 盐酸或稀硫酸
⑵ 加热浓缩 冷却结晶
⑶ AlO+CO2+ 2H2O===Al (OH) 3↓+HCO
⑷ 将产生的气体通入一个盛有饱和碳酸氢钠溶液的洗气瓶中
⑸ 26°C, 75 g·L-1
⑹ Cu+2H++H2O2===Cu2++2H2O ⑺ 6.4%
PAGE
2
第一课时 课时作业
1.下列冶炼方法错误的是( )
A.2HgO2Hg+O2↑ B.3MnO2+4Al 3Mn+2Al2O3
C.2AlCl32Al+3Cl2↑ D.4CO+Fe3O43Fe+4CO2
2.用铝热法还原下列化合物,若得到的金属均为1 mol,则消耗铝最多的是( )
A.MnO2 B.Cr2O3 C.WO3 D.CuO
3.我国古代“药金”的冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A.“药金”实质上是铜锌合金 B.冶炼炉中炉甘石直接被木炭还原为锌
C.用王水可区别黄金和“药金” D.用火焰灼烧不能区别黄金和药金
4.下列有关金属铝的叙述正确的是( )
A.铝在常温下不能与氧气反应 B.铝不能与氯气反应
C.铝能置换出Fe、Cr、Mn等金属,是因为铝的还原性强且铝转化为氧化铝时放出大量的热
D.铝槽车能贮存浓硫酸、浓盐酸,铝合金是制造门窗、汽车、飞机的重要材料
5.下列金属的工业制法正确的是( )
A.制钛:用金属钠置换出氯化钛(TiCl4)溶液中的钛
B.炼铁:炼铁高炉中碳在高温下还原铁矿石中的铁
C.制钠:用海水作原料制得精盐,再电解熔融氯化钠得到金属钠
D.炼硅:用焦炭与二氧化硅在高温下反应生成粗硅和二氧化碳
6.下列说法不正确的是( )
A.钢是用量最大、用途最广的合金,青铜是我国使用最早的合金
B.储氢合金是一类能大量吸收H2,并与H2结合成金属氢化物的材料
C.一般地,合金的硬度大于它的纯金属成分,熔点高于它的成分金属
D.钛合金,形状记忆合金,耐热合金以及储氢合金都属于新型合金
7.下列制备金属单质的方法或原理正确的是( )
A.在高温条件下,用H2还原MgO制备单质Mg
B.加强热,使CuO在高温条件下分解制备单质Cu
C.在通电条件下,电解Al2O3和Na3AlF6的熔融混合物制备单质Al
D.工业上用Al和Fe2O3冶炼大量单质铁
8.下列关于铝热反应2Al + Fe2O3Al2O3 + 2Fe的说法不正确的是( )
A.该反应中Al作还原剂 B.该反应中冶炼1 mol Fe转移2 mol电子
C.氧化产物与还原产物的物质的量比为1∶2 D.该反应可用于焊接钢轨
9.下列说法错误的是( )
A.有些活泼金属(如铝)可用作热还原法的还原剂
B.加强热,使CuO在高温条件下分解可制备单质Cu
C.金属冶炼的实质是金属阳离子得到电子被还原成金属原子
D.回收旧金属可以重新制成金属或它们的化合物
10.以辉铜矿(Cu2S)为原料冶炼铜,其反应原理可表示为Cu2S+O22Cu+SO2。下列说法不正确的是( )
A.化合价发生变化的元素有3种
B.Cu2S在该反应中既是氧化剂又是还原剂
C.1 mol O2参加反应时,上述反应转移电子总物质的量为4 mol
D.SO2被分离、回收后氧化生成SO3,作为制取硫酸的原料
11.工业上用电解熔融氧化铝的方法冶炼铝,而不用还原剂还原氧化铝的方法冶炼铝。下列相关说法正确的是( )
A.氧化铝中的铝元素为+3价,只有还原性,没有氧化性
B.加入冰晶石降低氧化铝的熔点,在熔融状态下易被还原
C.铝单质的还原性强,较难用还原剂还原氧化铝得到铝
D.铝离子的氧化性强,较难用还原剂还原氧化铝得到铝
12.诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上高温冶炼钼的化学反应过程为①2MoS2+7O22MoO3+4SO2;
②MoO3+2NH3·H2O===(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl===H2MoO4↓+2NH4Cl;④H2MoO4MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。下列说法正确的是( )
A.MoS2煅烧产生的尾气可直接排放
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和Al分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
13.(2018全国Ⅰ)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是( )
A.合理处理废旧电池有利于保护环境和资源再利用 B.“沉淀”反应的金属离子为Fe3+
C.从“正极片”中可回收的金属元素有Al、Fe、Li D.上述流程中可用硫酸钠代替碳酸钠
14.高炉炼铁生产中下列说法正确的是( )
A.还原氧化铁的还原剂是焦炭 B.采用富氧空气可以得到纯铁
C.加石灰石的目的主要是为了除去过量碳 D.用于冶炼生铁的矿石主要有磁铁矿、赤铁矿
15.实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18 g,则该氧化物粉末可能是( )
①Fe2O3和MnO2 ②MnO2和V2O5 ③Cr2O3和V2O5 ④Fe3O4和FeO
A.①② B.②③ C.②④ D.①④
16.明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化、造纸工业上作施胶剂、食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO、Fe2O3)可制备明矾。工艺流程如下:
已知:SiO2是不溶于硫酸的固体
回答下列问题:
⑴ Al2O3与稀硫酸反应(用离子方程表示)___________________________________。
⑵ 操作Ⅰ的名称是___________,滤渣Ⅰ的主要成分是___________。
⑶ 检验滤液Ⅰ中是否存在Fe3+的方法是______________________________________________。
⑷ 在滤液Ⅰ中加入高锰酸钾目的是________________,发生反应的离子方程式为(Fe2+转化为Fe3+、MnO4-转化为Mn2+)_______________________________________。
⑸ 根据流程图推测加入沉淀剂的目的是_____________________,滤渣Ⅱ中主要含有___________(填化学式,只写一种即可)。
17.钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前使用最广泛的白色颜料。制备TiO2和Ti的原料是钛铁矿,用含Fe2O3的钛铁矿(主要成分为FeTiO3)制备TiO2的流程如下:
已知:TiO2++2H2O===H2TiO3↓+2H+
⑴ 步骤①加Fe的目的是______________________;步骤②冷却的目的是__________________。
⑵ 考虑成本和废物的综合利用等因素,水浸后的废液中应加入___________处理。
⑶ 由金红石(TiO2)制取单质钛(Ti)的过程为,其中反应在氩气气氛中进行的理由是___________________________。
18.为探索某工厂的废金属屑(主要成分为Fe、Cu、Al、Al2O3、Fe2O3等)的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、胆矾晶体(CuSO4·5H2O)和水处理剂高铁酸钾(K2FeO4)。请回答:
⑴ 试剂X是__________;试剂Y是__________。
⑵ 从CuSO4溶液中获取胆矾晶体的操作是_________、________过滤、洗涤。
⑶ 写出溶液A转化为固体C的离子方程式____________________________________。
⑷ 在步骤II时,小组成员小明用下图装置进行试验,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,你的建议是__________________________________________。
⑸ 由溶液E制取K2FeO4时,不同的温度下,不同质量浓度的Fe3+对K2FeO4生成率有不同影响,由图可知工业生产中最佳条件(温度和Fe3+的质量浓度)为___________。
⑹ 在固体F中加入稀硫酸和H2O2来制备CuSO4溶液是一种环保工艺,该反应的总的离子方程式为__________________________________________。
⑺ 该小组同学取用100.0 g该废金属屑,经过实验,最终得到胆矾晶体25.0g,该废料中铜的质量分数约为_____________。
参考答案
1 2 3 4 5 6 7 8 9 10
C C A C C C C B B C
11 12 13 14 15 16 17 18 19 20
C D D D D
16【答案】
⑴ Al2O3+6H+===2Al3++3H2O ⑵ 过滤 SiO2
⑶ 取少量滤液于试管中,滴加KSCN溶液,若溶液变成红色则证明含有Fe3+或滴加NaOH溶液产生红褐色沉淀
⑷ 把Fe2+氧化成Fe3+ MnO4-+5Fe2++8H+===Mn2++5Fe3++4H2O
⑸ 除去Fe3+ Fe(OH)3或MnO2
17【答案】
⑴ 将Fe3+还原为Fe2+ 析出绿矾(FeSO4·7H2O)
⑵ 生石灰(或碳酸钙、碱) ⑶ 高温下镁或钛与O2、N2等反应
18【答案】
⑴ NaOH或KOH 盐酸或稀硫酸
⑵ 加热浓缩 冷却结晶
⑶ AlO+CO2+ 2H2O===Al (OH) 3↓+HCO
⑷ 将产生的气体通入一个盛有饱和碳酸氢钠溶液的洗气瓶中
⑸ 26°C, 75 g·L-1
⑹ Cu+2H++H2O2===Cu2++2H2O ⑺ 6.4%
PAGE
2
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
