2.2.1 化学平衡状态 教学设计 2022-2023学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.1 化学平衡状态 教学设计 2022-2023学年高二上学期化学人教版(2019)选择性必修1 |
|
|
| 格式 | docx | ||
| 文件大小 | 73.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-26 00:00:00 | ||
图片预览

文档简介
“化学平衡状态”教学设计
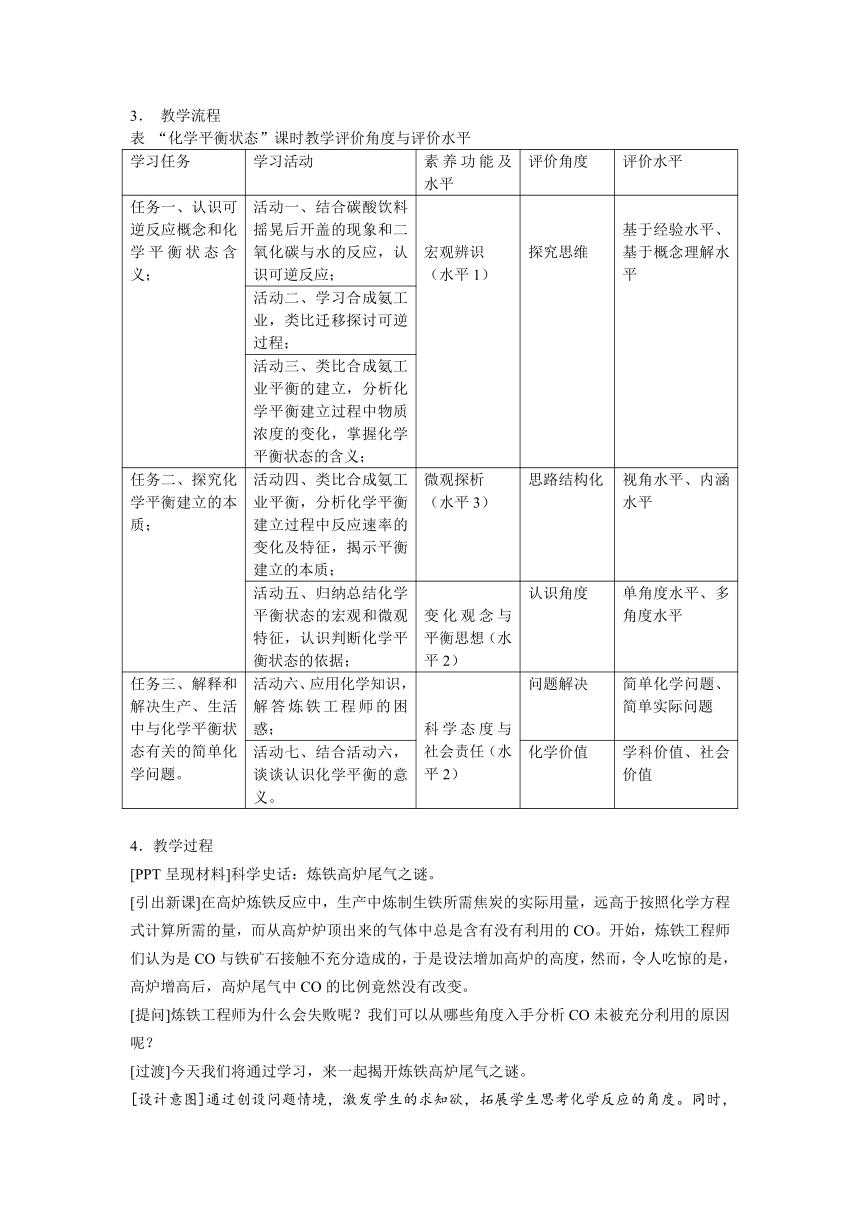
1.教学目标
对三维目标进行融合和升华,得到“化学平衡状态”素养化教学目标,见下图:
2. 评价目标
(1)通过探讨化学反应的可逆过程和化学平衡状态的建立,诊断并发展学生探究化学概念的思维水平;
(2)基于化学反应速率解释化学平衡的建立过程,及探讨化学平衡状态的微观表征,诊断并发展学生对化学平衡建立的认识思路结构化水平和认识对化学反应的认知角度;
(3)由高炉炼铁疑惑的探讨过程,诊断并发展学生问题解决能力及化学价值认识水平。
3. 教学流程
表 “化学平衡状态”课时教学评价角度与评价水平
学习任务 学习活动 素养功能及水平 评价角度 评价水平
任务一、认识可逆反应概念和化学平衡状态含义; 活动一、结合碳酸饮料摇晃后开盖的现象和二氧化碳与水的反应,认识可逆反应; 宏观辨识 (水平1) 探究思维 基于经验水平、基于概念理解水平
活动二、学习合成氨工业,类比迁移探讨可逆过程;
活动三、类比合成氨工业平衡的建立,分析化学平衡建立过程中物质浓度的变化,掌握化学平衡状态的含义;
任务二、探究化学平衡建立的本质; 活动四、类比合成氨工业平衡,分析化学平衡建立过程中反应速率的变化及特征,揭示平衡建立的本质; 微观探析 (水平3) 思路结构化 视角水平、内涵水平
活动五、归纳总结化学平衡状态的宏观和微观特征,认识判断化学平衡状态的依据; 变化观念与平衡思想(水平2) 认识角度 单角度水平、多角度水平
任务三、解释和解决生产、生活中与化学平衡状态有关的简单化学问题。 活动六、应用化学知识,解答炼铁工程师的困惑; 科学态度与社会责任(水平2) 问题解决 简单化学问题、简单实际问题
活动七、结合活动六,谈谈认识化学平衡的意义。 化学价值 学科价值、社会价值
4.教学过程
[PPT呈现材料]科学史话:炼铁高炉尾气之谜。
[引出新课]在高炉炼铁反应中,生产中炼制生铁所需焦炭的实际用量,远高于按照化学方程式计算所需的量,而从高炉炉顶出来的气体中总是含有没有利用的CO。开始,炼铁工程师们认为是CO与铁矿石接触不充分造成的,于是设法增加高炉的高度,然而,令人吃惊的是,高炉增高后,高炉尾气中CO的比例竟然没有改变。
[提问]炼铁工程师为什么会失败呢?我们可以从哪些角度入手分析CO未被充分利用的原因呢?
[过渡]今天我们将通过学习,来一起揭开炼铁高炉尾气之谜。
[设计意图]通过创设问题情境,激发学生的求知欲,拓展学生思考化学反应的角度。同时,将化学知识与生产、生活密切联系起来。
[学习任务一]认识可逆反应概念和化学平衡状态的含义;
[评价任务一]诊断并发展学生探究新知的思维水平;
[引导]在我们初中学习中常见的一个反应,是可逆反应,它是什么?
[展示]多媒体展示图片
[提问]打开碳酸饮料的瞬间会喷出很多细小的泡沫,你能解释这个过程吗?
[学生]打开瓶盖时瓶中压强发生改变,碳酸分解,CO2溶解度减小,从而逸出。
[讲解]由此可知,CO2与水的反应就是一个典型的可逆反应,在同一个条件下,二氧化碳可以与水反应生成碳酸,同时碳酸也能分解生成二氧化碳和水。
[设计意图]引导学生联系生活和已有知识经验进行思考和分析,加深学生的理解。
[提问]所有的化学反应都可逆吗?请举出相应的化学方程式进行说明。
[提问]H2和O2点燃生成H2O和H2O电解生成H2与O2的反应属于可逆反应吗?
[学生]不是,这两个反应的条件不一样,两个化学反应不能同时进行,所以不是可逆反应。
[提问]可逆反应有何特征与条件?请大家归纳一下可逆反应的定义。
[设计意图]通过学生的回答,诊断学生对概念的认识水平,通过进一步提问,引导学生分析、比较、归纳可逆反应的定义、条件和特征,完善可逆反应的概念,发展学生对概念的理解和认识。
[提问]化学反应中是否存在最大限度?你能通过哪些特征进行判断?
[PPT呈现材料]将0.01molCO和0.01molH2O(g)通入容积为1L的密闭容器中,加入催化剂,并加热到800℃,发生反应CO+H2O(g) CO2 + H2,结果发现,不管怎么延长时间,容器中始终存在0.005molCO和0.005molH2O(g)。在教师讲解后,学生产生感悟,形成基本观点。
[基本观点]一定条件下,可逆反应最终会达到一个最大限度。
[过渡]我们的合成氨反应也是可逆反应,如像反应容器中加入N2和H2,随着反应的进行,体系中NH3的浓度增大,而N2和H2的浓度逐渐减小。从某一时刻开始,它们的浓度不再改变,反应达到了最大的限度,体系中各组分的浓度或百分含量也不再改变,这样的状态称之为“化学平衡状态”。
[学习任务二]探究化学平衡的本质。
[评价任务二]诊断并发展学生对化学反应的认识角度,诊断学生对化学平衡建立的认识思路结构化水平。
[提问]你能分析化学平衡建立过程中,正、逆反应速率的变化吗?
[学生]化学平衡的建立过程:起始时,v(正)最大,v(逆)=0;反应过程中,v(正)渐渐减小,v(逆)渐渐增大,但v(正) >v(逆);达到平衡时,v(正) =v(逆) >0。
[设计意图]通过引导学生分析化学反应平衡建立过程中正、逆反应速率的变化,认识平衡建立的微观本质。
[提问]你能用v-t图来表示合成氨平衡建立过程中速率的变化吗?
[提问]当达到化学平衡状态后,化学反应就此停止了吗?
[总结]当化学反应达到平衡状态时,化学反应并没有停止,正反应速率和逆反应速率相等,宏观上表现为各物质组成浓度和百分含量均保持不变。但当改变条件时,化学平衡就会被打破。如日常生活中我们打开碳酸饮料的瓶盖时,压强发生了改变,平衡被破坏,化学反应朝着碳酸分解的方向进行。因此,化学平衡是动态的平衡,一旦条件被改变,平衡就会被破坏。
[设计意图]诊断学生对化学平衡概念的认识,然后师生共同补充完善,发展学生认知思路结构化水平。
[提问]化学平衡状态存在哪些宏观特征和微观体现?请借助化学符号进行说明。
[总结]宏观表现:各物质组成浓度和百分含量不变;
微观实质:v(正) =v(逆) >0
特征:(1)逆,发生可逆反应;
(2)等,v(正) =v(逆) >0
(3)动,动态平衡
(4)定,各物质组分浓度、体积分数一定;
(5)变,条件改变,平衡破坏。
[设计意图]诊断学生对化学平衡宏观和微观理解,加强学生对化学平衡宏观和微观认识的联系,落实学生的变化观念与平衡思想核心素养。
[学习任务三]解释生产生活中与化学平衡状态相关的简单化学问题。
[评价任务三]诊断并发展学生问题解决能力水平和对化学价值的认识水平。
[提问]通过我们刚才的学习,你能解释炼铁高炉尾气之谜了吗,为什么增加高炉的高度仍然不能使CO被充分利用呢?
[学生]应为Fe2O3和CO的反应是可逆反应,可逆反应都存在一定的限度,不能完全转化。炼铁高炉中Fe2O3和CO的反应达到最大限度后,即使再增加高炉的高度,使其充分接触也无法改变反应的平衡状态,不能使CO继续转化。
[畅所欲言]本节课的学习对我们生产、生活的价值。
[设计意图]引导学生应用本节课所学知识解释课堂导入的炼铁高炉尾气之谜,然后进行总结,诊断和发展学生的知识应用能力和对化学知识价值的认识
1.教学目标
对三维目标进行融合和升华,得到“化学平衡状态”素养化教学目标,见下图:
2. 评价目标
(1)通过探讨化学反应的可逆过程和化学平衡状态的建立,诊断并发展学生探究化学概念的思维水平;
(2)基于化学反应速率解释化学平衡的建立过程,及探讨化学平衡状态的微观表征,诊断并发展学生对化学平衡建立的认识思路结构化水平和认识对化学反应的认知角度;
(3)由高炉炼铁疑惑的探讨过程,诊断并发展学生问题解决能力及化学价值认识水平。
3. 教学流程
表 “化学平衡状态”课时教学评价角度与评价水平
学习任务 学习活动 素养功能及水平 评价角度 评价水平
任务一、认识可逆反应概念和化学平衡状态含义; 活动一、结合碳酸饮料摇晃后开盖的现象和二氧化碳与水的反应,认识可逆反应; 宏观辨识 (水平1) 探究思维 基于经验水平、基于概念理解水平
活动二、学习合成氨工业,类比迁移探讨可逆过程;
活动三、类比合成氨工业平衡的建立,分析化学平衡建立过程中物质浓度的变化,掌握化学平衡状态的含义;
任务二、探究化学平衡建立的本质; 活动四、类比合成氨工业平衡,分析化学平衡建立过程中反应速率的变化及特征,揭示平衡建立的本质; 微观探析 (水平3) 思路结构化 视角水平、内涵水平
活动五、归纳总结化学平衡状态的宏观和微观特征,认识判断化学平衡状态的依据; 变化观念与平衡思想(水平2) 认识角度 单角度水平、多角度水平
任务三、解释和解决生产、生活中与化学平衡状态有关的简单化学问题。 活动六、应用化学知识,解答炼铁工程师的困惑; 科学态度与社会责任(水平2) 问题解决 简单化学问题、简单实际问题
活动七、结合活动六,谈谈认识化学平衡的意义。 化学价值 学科价值、社会价值
4.教学过程
[PPT呈现材料]科学史话:炼铁高炉尾气之谜。
[引出新课]在高炉炼铁反应中,生产中炼制生铁所需焦炭的实际用量,远高于按照化学方程式计算所需的量,而从高炉炉顶出来的气体中总是含有没有利用的CO。开始,炼铁工程师们认为是CO与铁矿石接触不充分造成的,于是设法增加高炉的高度,然而,令人吃惊的是,高炉增高后,高炉尾气中CO的比例竟然没有改变。
[提问]炼铁工程师为什么会失败呢?我们可以从哪些角度入手分析CO未被充分利用的原因呢?
[过渡]今天我们将通过学习,来一起揭开炼铁高炉尾气之谜。
[设计意图]通过创设问题情境,激发学生的求知欲,拓展学生思考化学反应的角度。同时,将化学知识与生产、生活密切联系起来。
[学习任务一]认识可逆反应概念和化学平衡状态的含义;
[评价任务一]诊断并发展学生探究新知的思维水平;
[引导]在我们初中学习中常见的一个反应,是可逆反应,它是什么?
[展示]多媒体展示图片
[提问]打开碳酸饮料的瞬间会喷出很多细小的泡沫,你能解释这个过程吗?
[学生]打开瓶盖时瓶中压强发生改变,碳酸分解,CO2溶解度减小,从而逸出。
[讲解]由此可知,CO2与水的反应就是一个典型的可逆反应,在同一个条件下,二氧化碳可以与水反应生成碳酸,同时碳酸也能分解生成二氧化碳和水。
[设计意图]引导学生联系生活和已有知识经验进行思考和分析,加深学生的理解。
[提问]所有的化学反应都可逆吗?请举出相应的化学方程式进行说明。
[提问]H2和O2点燃生成H2O和H2O电解生成H2与O2的反应属于可逆反应吗?
[学生]不是,这两个反应的条件不一样,两个化学反应不能同时进行,所以不是可逆反应。
[提问]可逆反应有何特征与条件?请大家归纳一下可逆反应的定义。
[设计意图]通过学生的回答,诊断学生对概念的认识水平,通过进一步提问,引导学生分析、比较、归纳可逆反应的定义、条件和特征,完善可逆反应的概念,发展学生对概念的理解和认识。
[提问]化学反应中是否存在最大限度?你能通过哪些特征进行判断?
[PPT呈现材料]将0.01molCO和0.01molH2O(g)通入容积为1L的密闭容器中,加入催化剂,并加热到800℃,发生反应CO+H2O(g) CO2 + H2,结果发现,不管怎么延长时间,容器中始终存在0.005molCO和0.005molH2O(g)。在教师讲解后,学生产生感悟,形成基本观点。
[基本观点]一定条件下,可逆反应最终会达到一个最大限度。
[过渡]我们的合成氨反应也是可逆反应,如像反应容器中加入N2和H2,随着反应的进行,体系中NH3的浓度增大,而N2和H2的浓度逐渐减小。从某一时刻开始,它们的浓度不再改变,反应达到了最大的限度,体系中各组分的浓度或百分含量也不再改变,这样的状态称之为“化学平衡状态”。
[学习任务二]探究化学平衡的本质。
[评价任务二]诊断并发展学生对化学反应的认识角度,诊断学生对化学平衡建立的认识思路结构化水平。
[提问]你能分析化学平衡建立过程中,正、逆反应速率的变化吗?
[学生]化学平衡的建立过程:起始时,v(正)最大,v(逆)=0;反应过程中,v(正)渐渐减小,v(逆)渐渐增大,但v(正) >v(逆);达到平衡时,v(正) =v(逆) >0。
[设计意图]通过引导学生分析化学反应平衡建立过程中正、逆反应速率的变化,认识平衡建立的微观本质。
[提问]你能用v-t图来表示合成氨平衡建立过程中速率的变化吗?
[提问]当达到化学平衡状态后,化学反应就此停止了吗?
[总结]当化学反应达到平衡状态时,化学反应并没有停止,正反应速率和逆反应速率相等,宏观上表现为各物质组成浓度和百分含量均保持不变。但当改变条件时,化学平衡就会被打破。如日常生活中我们打开碳酸饮料的瓶盖时,压强发生了改变,平衡被破坏,化学反应朝着碳酸分解的方向进行。因此,化学平衡是动态的平衡,一旦条件被改变,平衡就会被破坏。
[设计意图]诊断学生对化学平衡概念的认识,然后师生共同补充完善,发展学生认知思路结构化水平。
[提问]化学平衡状态存在哪些宏观特征和微观体现?请借助化学符号进行说明。
[总结]宏观表现:各物质组成浓度和百分含量不变;
微观实质:v(正) =v(逆) >0
特征:(1)逆,发生可逆反应;
(2)等,v(正) =v(逆) >0
(3)动,动态平衡
(4)定,各物质组分浓度、体积分数一定;
(5)变,条件改变,平衡破坏。
[设计意图]诊断学生对化学平衡宏观和微观理解,加强学生对化学平衡宏观和微观认识的联系,落实学生的变化观念与平衡思想核心素养。
[学习任务三]解释生产生活中与化学平衡状态相关的简单化学问题。
[评价任务三]诊断并发展学生问题解决能力水平和对化学价值的认识水平。
[提问]通过我们刚才的学习,你能解释炼铁高炉尾气之谜了吗,为什么增加高炉的高度仍然不能使CO被充分利用呢?
[学生]应为Fe2O3和CO的反应是可逆反应,可逆反应都存在一定的限度,不能完全转化。炼铁高炉中Fe2O3和CO的反应达到最大限度后,即使再增加高炉的高度,使其充分接触也无法改变反应的平衡状态,不能使CO继续转化。
[畅所欲言]本节课的学习对我们生产、生活的价值。
[设计意图]引导学生应用本节课所学知识解释课堂导入的炼铁高炉尾气之谜,然后进行总结,诊断和发展学生的知识应用能力和对化学知识价值的认识
