6.2.2 化学反应的限度和化学反应条件的控制 课件(共19张PPT) 2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 6.2.2 化学反应的限度和化学反应条件的控制 课件(共19张PPT) 2022-2023学年下学期高一化学人教版(2019)必修第二册 |  | |
| 格式 | zip | ||
| 文件大小 | 654.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-26 09:58:21 | ||
图片预览






文档简介
(共19张PPT)
化学反应的速率与限度
第二课时 化学反应的限度
学习目标
1、了解可逆反应及其特点。
2、理解化学平衡状态和学会平衡状态的判断。
3、了解控制反应条件在生产生活和科学研究中的作用。
重难点
重点:化学平衡状态的特征和判断
难点:化学平衡状态的特征和判断
化学反应的限度
思考与交流:
一个化学反应在实际进行时,反应物能否完全转变为生成物?阅读:P48 科学史话,从这一材料中,你得到什么启示?
炼铁高炉尾气之谜:
炼制1t生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,且从高炉炉顶出来的气体中含有没有利用的CO气体。
C+O2===CO2
C+CO2====2CO
Fe2O3+3CO==2Fe+3CO2
高温
高温
可逆反应
化学反应的限度
可逆反应
定义:
在相同条件下能向正反应方向进行同时又能向逆反应方向进行的反应称为可逆反应。
注意:书写可逆反应的化学方程式时,不用“===”,用“ ”
同一条件
同时
化学平衡
化学平衡的建立
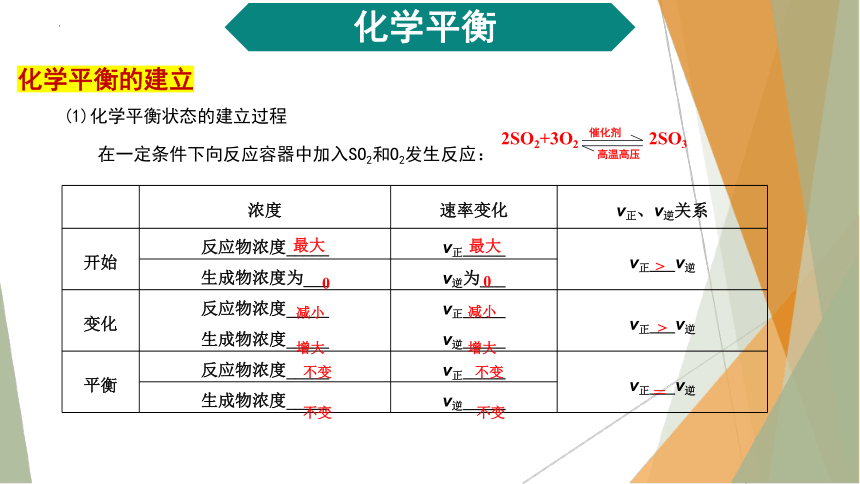
2SO2+3O2 2SO3
催化剂
高温高压
(1)化学平衡状态的建立过程
在一定条件下向反应容器中加入SO2和O2发生反应:
浓度 速率变化 v正、v逆关系
开始 反应物浓度_____ v正_____ v正___v逆
生成物浓度为___ v逆为___
变化 反应物浓度_____ 生成物浓度_____ v正_____ v逆_____ v正___v逆
平衡 反应物浓度_____ v正_____ v正___v逆
生成物浓度_____ v逆_____
最大
最大
>
0
0
减小
减小
增大
增大
>
不变
不变
不变
不变
=
化学平衡
化学平衡的建立
(2)用速率变化图像表示化学平衡状态的建立
化学平衡状态
在一定条件下,当________反应进行到一定程度时,______________与____________相等,反应物的浓度与生成物的浓度都____________,达到一种表面静止的状态,称为化学平衡状态,简称化学平衡。
可逆
正反应速率
逆反应速率
不再改变
化学平衡
化学反应的限度
(1)化学平衡状态是可逆反应在一定条件下所能达到的或完成的____________,即该反应进行的限度。
最大程度
(2)对化学反应限度的理解
①化学反应的限度决定了反应物在一定条件下转化为生成物的最大_________。
②同一可逆反应,在不同条件下,化学反应的限度不同,即改变反应条件可以在一定程度上改变一个化学反应的_________。
转化率
限度
转化率=
n(已被转化的反应物)
n(初始反应物)
正误辨析
(1)1 mol N2和3 mol H2在一定条件下可完全反应生成2 mol NH3。( )
(2)一定条件下,可以通过延长化学反应的时间来改变反应物的最大转化率。( )
(3)可逆反应达到平衡状态时,各反应物、生成物的浓度相等。( )
(4)在一定条件下,一个可逆反应达到的平衡状态就是该反应所能达到的最大限度。( )
(5)化学反应在一定条件下建立平衡状态时,化学反应将会停止。( )
×
×
×
√
×
化学平衡
化学平衡的特征
化学平衡状态的判断依据
逆 化学平衡研究的对象是可逆反应
等 达到化学平衡状态时,正反应速率和逆反应速率相等
动 化学平衡是一种表面静止状态,但反应并未停止,是一种动态平衡
定 达到化学平衡状态后,各组分浓度保持不变,不再随时间变化而变化
变 当外界条件发生改变时,原平衡状态将被打破,再在新条件下建立新的平衡状态
(1)直接依据——根据速率关系
①同一物质:生成速率=消耗速率,即v正(A)=v逆(A)
②不同物质:速率之比=化学计量数之比,但必须是不同方向的速率
(2)间接依据——根据各组分的量
首先分析该量是“变量”还是“恒量”。如为“恒量”,即随着反应的进行永远不变,则不能作为判断平衡状态的依据;如为“变量”,即该量随着反应的进行而改变,当其不变时,则为化学平衡状态。
“异向相等”
“变量不变”
化学反应的限度
以反应mA(g)+nB(g) pC(g)+qD(g) 状态
混合物体系中各组分的含量 各物质的物质的量或各物质的物质的量分数一定 平衡
各物质的质量或各物质的质量分数一定 平衡
各气体的体积或体积分数一定 平衡
正逆反应速率的关系 在单位时间内消耗了m mol A,同时生成m mol A,即v(正)=v(逆) 平衡
在单位时间内消耗了n mol B,同时生成p mol C 不一定平衡
v(A):v(B):v(C):v(D)=m:n:p:q,v(正)不一定等于v(逆) 不一定平衡
在单位时间内生成了n mol B,同时消耗了q mol D 不一定平衡
压强 当m+n ≠p+q时,总压强一定(其他条件一定) 平衡
当m+n=p+q时,总压强一定(其他条件一定) 不一定平衡
混合气体的平均相对分子质量(Mr) 当m+n ≠p+q时,Mr一定(其他条件一定) 平衡
当m+n=p+q时,Mr一定(其他条件一定) 不一定平衡
温度 任何化学反应都伴随着能量的变化,在其他条件不变的情况下,体系温度一定 平衡
密度 密度一定 不一定平衡
颜色 含有有色物质的体系颜色不再变化 平衡
选 择
(双选)可逆反应3H2(g)+N2(g)高温、高压2NH3(g)的正、逆反应速率可用各反应物或生成物的浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是( )A.v正(N2)=v正(H2)B.v正(N2)=v逆(NH3)C.2v正(H2)=3v逆(NH3)D.3v正(N2)=v逆(H2)
CD
选 择
下列说法中能说明2HI(g) H2(g)+I2(g)已达到平衡状态的是____________。(1)单位时间内生成n mol H2的同时生成n mol HI;(2)一个H—H键断裂的同时有两个H—I键断裂;(3)c(HI)=c(I2);(4)反应速率:v(H2)=v(I2)=2(1)v(HI);(5)c(HI)∶c(I2)∶c(H2)=2∶1∶1;(6)温度和体积一定时,某一生成物浓度不再变化;(7)温度和体积一定时,容器内压强不再变化;(8)条件一定,混合气体的平均相对分子质量不再变化;(9)温度和体积一定时,混合气体的颜色不再发生变化;(10)温度和压强一定时,混合气体的密度不再发生变化。
(2)(6)(9)
选 择
分析:(1)生成n mol H2的同时生成n mol HI,说明正反应速率大于逆反应速率。(2)一个H—H键断裂(逆反应方向)的同时有两个H—I键断裂(正反应方向),即v正=v逆。(3)平衡状态时c(HI)、c(I2)浓度不变,但不一定相等。(4)无论是否达到平衡状态都有这样的关系。(5)平衡状态时不一定有这样的浓度关系。(6)生成物浓度不变,说明反应达到平衡状态。(7)无论是否达到平衡,容器内的压强都不变。(8)气体的总质量不变,气体的总物质的量也不变,故无论是否达到平衡状态,混合气体的平均相对分子质量都不变化。(9)反应体系中颜色不变即说明c(I2)不再变化,说明反应达到平衡状态。(10)由于反应前后,气体的体积不变,且混合气体的质量不变,故混合气体的密度始终不发生变化。即(2)(6)(9)能说明反应已达到平衡状态。
化学反应条件的控制
在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性。
化学反应条件的控制
一、化学反应条件的控制
化学反应条件的控制
下列措施可以提高燃料燃烧效率的是( )
①提高燃料的着火点 ②降低燃料的着火点 ③将固体燃料粉碎 ④将液体燃料雾化 ⑤将煤进行气化处理 ⑥通入足量的空气
A.①③④⑤ B.②③⑤⑥
C.③④⑤⑥ D.①②③④
C
当堂检测
如图是可逆反应X2(g)+3Y2(g) 2Z2(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
A.t2~t3时,各物质的浓度不再发生变化B.t2时,反应未达到限度C.t2~t3时,反应已停止进行D.t1时,反应只向正反应方向进行
D
当堂检测
工业制硫酸中的一步重要反应是SO2在400~500 ℃和常压下的催化氧化:2SO2(g)+O2(g) 2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列相关说法中错误的是( )A.反应温度选择400~500 ℃是从该反应催化剂的催化活性、反应速率、反应限度等角度综合考虑的结果B.因为在常压下该反应的速率和SO2的转化率已经很高了,所以选择常压条件主要是从生产成本角度考虑C.为提高SO2的转化率,应适当提高O2的浓度D.使用催化剂是为了加快反应速率,提高SO3的产率
D
当堂检测
(3)下列叙述能说明上述反应达到化学平衡状态的是____________(填字母)。
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3 mol X,同时生成2 mol Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的密度不再发生改变
答案:(1)3X(g)+Y(g)??2Z(g) (2)0.05 mol·L-1·min-1 (3)AB
化学反应的速率与限度
第二课时 化学反应的限度
学习目标
1、了解可逆反应及其特点。
2、理解化学平衡状态和学会平衡状态的判断。
3、了解控制反应条件在生产生活和科学研究中的作用。
重难点
重点:化学平衡状态的特征和判断
难点:化学平衡状态的特征和判断
化学反应的限度
思考与交流:
一个化学反应在实际进行时,反应物能否完全转变为生成物?阅读:P48 科学史话,从这一材料中,你得到什么启示?
炼铁高炉尾气之谜:
炼制1t生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,且从高炉炉顶出来的气体中含有没有利用的CO气体。
C+O2===CO2
C+CO2====2CO
Fe2O3+3CO==2Fe+3CO2
高温
高温
可逆反应
化学反应的限度
可逆反应
定义:
在相同条件下能向正反应方向进行同时又能向逆反应方向进行的反应称为可逆反应。
注意:书写可逆反应的化学方程式时,不用“===”,用“ ”
同一条件
同时
化学平衡
化学平衡的建立
2SO2+3O2 2SO3
催化剂
高温高压
(1)化学平衡状态的建立过程
在一定条件下向反应容器中加入SO2和O2发生反应:
浓度 速率变化 v正、v逆关系
开始 反应物浓度_____ v正_____ v正___v逆
生成物浓度为___ v逆为___
变化 反应物浓度_____ 生成物浓度_____ v正_____ v逆_____ v正___v逆
平衡 反应物浓度_____ v正_____ v正___v逆
生成物浓度_____ v逆_____
最大
最大
>
0
0
减小
减小
增大
增大
>
不变
不变
不变
不变
=
化学平衡
化学平衡的建立
(2)用速率变化图像表示化学平衡状态的建立
化学平衡状态
在一定条件下,当________反应进行到一定程度时,______________与____________相等,反应物的浓度与生成物的浓度都____________,达到一种表面静止的状态,称为化学平衡状态,简称化学平衡。
可逆
正反应速率
逆反应速率
不再改变
化学平衡
化学反应的限度
(1)化学平衡状态是可逆反应在一定条件下所能达到的或完成的____________,即该反应进行的限度。
最大程度
(2)对化学反应限度的理解
①化学反应的限度决定了反应物在一定条件下转化为生成物的最大_________。
②同一可逆反应,在不同条件下,化学反应的限度不同,即改变反应条件可以在一定程度上改变一个化学反应的_________。
转化率
限度
转化率=
n(已被转化的反应物)
n(初始反应物)
正误辨析
(1)1 mol N2和3 mol H2在一定条件下可完全反应生成2 mol NH3。( )
(2)一定条件下,可以通过延长化学反应的时间来改变反应物的最大转化率。( )
(3)可逆反应达到平衡状态时,各反应物、生成物的浓度相等。( )
(4)在一定条件下,一个可逆反应达到的平衡状态就是该反应所能达到的最大限度。( )
(5)化学反应在一定条件下建立平衡状态时,化学反应将会停止。( )
×
×
×
√
×
化学平衡
化学平衡的特征
化学平衡状态的判断依据
逆 化学平衡研究的对象是可逆反应
等 达到化学平衡状态时,正反应速率和逆反应速率相等
动 化学平衡是一种表面静止状态,但反应并未停止,是一种动态平衡
定 达到化学平衡状态后,各组分浓度保持不变,不再随时间变化而变化
变 当外界条件发生改变时,原平衡状态将被打破,再在新条件下建立新的平衡状态
(1)直接依据——根据速率关系
①同一物质:生成速率=消耗速率,即v正(A)=v逆(A)
②不同物质:速率之比=化学计量数之比,但必须是不同方向的速率
(2)间接依据——根据各组分的量
首先分析该量是“变量”还是“恒量”。如为“恒量”,即随着反应的进行永远不变,则不能作为判断平衡状态的依据;如为“变量”,即该量随着反应的进行而改变,当其不变时,则为化学平衡状态。
“异向相等”
“变量不变”
化学反应的限度
以反应mA(g)+nB(g) pC(g)+qD(g) 状态
混合物体系中各组分的含量 各物质的物质的量或各物质的物质的量分数一定 平衡
各物质的质量或各物质的质量分数一定 平衡
各气体的体积或体积分数一定 平衡
正逆反应速率的关系 在单位时间内消耗了m mol A,同时生成m mol A,即v(正)=v(逆) 平衡
在单位时间内消耗了n mol B,同时生成p mol C 不一定平衡
v(A):v(B):v(C):v(D)=m:n:p:q,v(正)不一定等于v(逆) 不一定平衡
在单位时间内生成了n mol B,同时消耗了q mol D 不一定平衡
压强 当m+n ≠p+q时,总压强一定(其他条件一定) 平衡
当m+n=p+q时,总压强一定(其他条件一定) 不一定平衡
混合气体的平均相对分子质量(Mr) 当m+n ≠p+q时,Mr一定(其他条件一定) 平衡
当m+n=p+q时,Mr一定(其他条件一定) 不一定平衡
温度 任何化学反应都伴随着能量的变化,在其他条件不变的情况下,体系温度一定 平衡
密度 密度一定 不一定平衡
颜色 含有有色物质的体系颜色不再变化 平衡
选 择
(双选)可逆反应3H2(g)+N2(g)高温、高压2NH3(g)的正、逆反应速率可用各反应物或生成物的浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是( )A.v正(N2)=v正(H2)B.v正(N2)=v逆(NH3)C.2v正(H2)=3v逆(NH3)D.3v正(N2)=v逆(H2)
CD
选 择
下列说法中能说明2HI(g) H2(g)+I2(g)已达到平衡状态的是____________。(1)单位时间内生成n mol H2的同时生成n mol HI;(2)一个H—H键断裂的同时有两个H—I键断裂;(3)c(HI)=c(I2);(4)反应速率:v(H2)=v(I2)=2(1)v(HI);(5)c(HI)∶c(I2)∶c(H2)=2∶1∶1;(6)温度和体积一定时,某一生成物浓度不再变化;(7)温度和体积一定时,容器内压强不再变化;(8)条件一定,混合气体的平均相对分子质量不再变化;(9)温度和体积一定时,混合气体的颜色不再发生变化;(10)温度和压强一定时,混合气体的密度不再发生变化。
(2)(6)(9)
选 择
分析:(1)生成n mol H2的同时生成n mol HI,说明正反应速率大于逆反应速率。(2)一个H—H键断裂(逆反应方向)的同时有两个H—I键断裂(正反应方向),即v正=v逆。(3)平衡状态时c(HI)、c(I2)浓度不变,但不一定相等。(4)无论是否达到平衡状态都有这样的关系。(5)平衡状态时不一定有这样的浓度关系。(6)生成物浓度不变,说明反应达到平衡状态。(7)无论是否达到平衡,容器内的压强都不变。(8)气体的总质量不变,气体的总物质的量也不变,故无论是否达到平衡状态,混合气体的平均相对分子质量都不变化。(9)反应体系中颜色不变即说明c(I2)不再变化,说明反应达到平衡状态。(10)由于反应前后,气体的体积不变,且混合气体的质量不变,故混合气体的密度始终不发生变化。即(2)(6)(9)能说明反应已达到平衡状态。
化学反应条件的控制
在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性。
化学反应条件的控制
一、化学反应条件的控制
化学反应条件的控制
下列措施可以提高燃料燃烧效率的是( )
①提高燃料的着火点 ②降低燃料的着火点 ③将固体燃料粉碎 ④将液体燃料雾化 ⑤将煤进行气化处理 ⑥通入足量的空气
A.①③④⑤ B.②③⑤⑥
C.③④⑤⑥ D.①②③④
C
当堂检测
如图是可逆反应X2(g)+3Y2(g) 2Z2(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
A.t2~t3时,各物质的浓度不再发生变化B.t2时,反应未达到限度C.t2~t3时,反应已停止进行D.t1时,反应只向正反应方向进行
D
当堂检测
工业制硫酸中的一步重要反应是SO2在400~500 ℃和常压下的催化氧化:2SO2(g)+O2(g) 2SO3(g),这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列相关说法中错误的是( )A.反应温度选择400~500 ℃是从该反应催化剂的催化活性、反应速率、反应限度等角度综合考虑的结果B.因为在常压下该反应的速率和SO2的转化率已经很高了,所以选择常压条件主要是从生产成本角度考虑C.为提高SO2的转化率,应适当提高O2的浓度D.使用催化剂是为了加快反应速率,提高SO3的产率
D
当堂检测
(3)下列叙述能说明上述反应达到化学平衡状态的是____________(填字母)。
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3 mol X,同时生成2 mol Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的密度不再发生改变
答案:(1)3X(g)+Y(g)??2Z(g) (2)0.05 mol·L-1·min-1 (3)AB
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
