高中化学人教版(2019)选择性必修三 第二章 第二节 第2课时 炔烃 学案(含答案)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修三 第二章 第二节 第2课时 炔烃 学案(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 641.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-26 16:30:39 | ||
图片预览




文档简介
第2课时 炔烃
[素养发展目标]
1.从化学键的不饱和性等微观角度理解炔烃的结构特点,能辨析物质类别与反应类型之间的关系。
2.认识加成反应的特点和规律,了解有机反应类型与有机化合物的组成及结构特点的关系。
3.能通过模型假设、证据推理认识常见有机化合物分子的空间结构,会判断有机化合物分子中原子间的位置关系。
知识点一 乙炔的结构与性质
INCLUDEPICTURE "落实必备知识LLL.TIF"
1.结构特点
结构式 官能团 碳原子的杂化方式 三键所含共价键 分子空间结构
H—C≡C—H 碳碳三键 sp 1个σ键,2个π键 直线形,分子中的所有原子都处于同一直线上
2.物理性质
乙炔(俗称电石气)是最简单的炔烃。乙炔是无色、无臭的气体,密度比空气小,微溶于水,易溶于有机溶剂。
3.化学性质
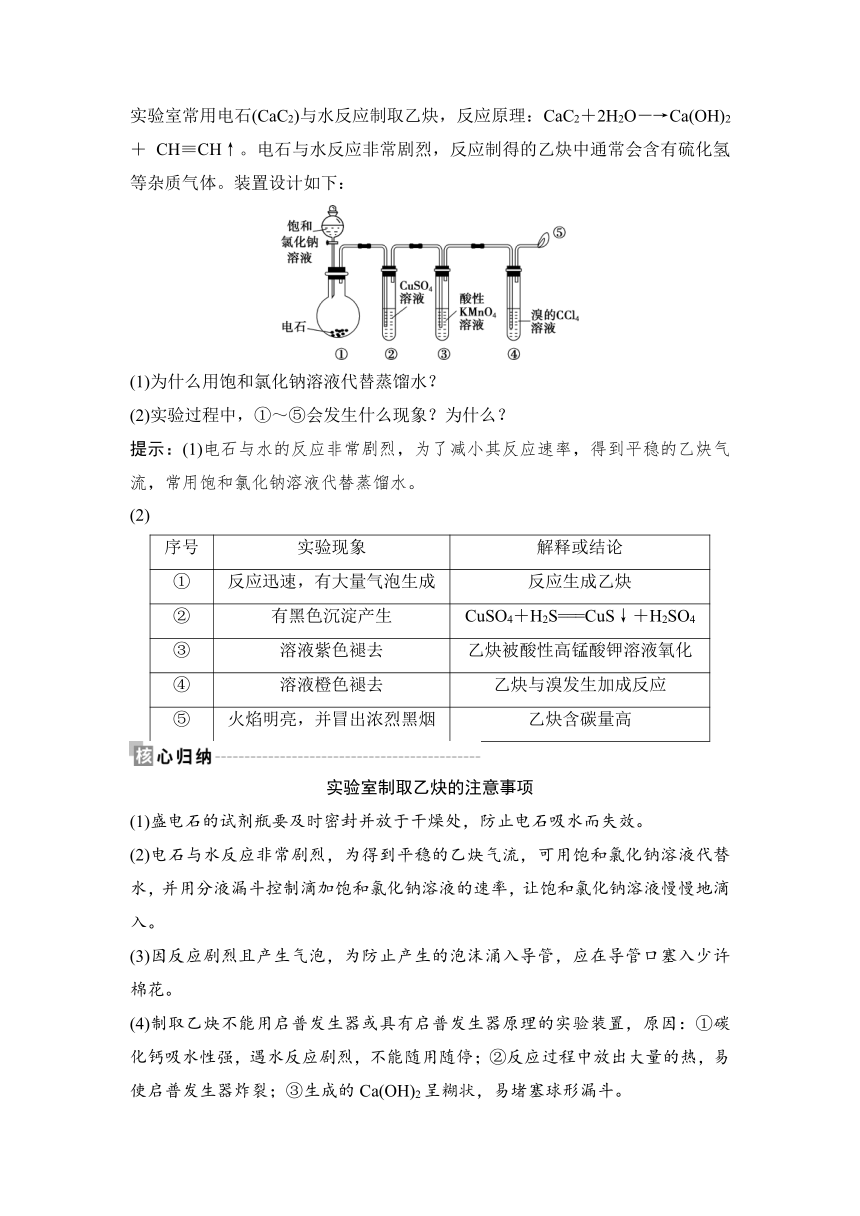
(1)实验探究
实验装置 INCLUDEPICTURE "XF115.TIF"
①中反应 CaC2+2H2O―→Ca(OH)2+C2H2↑(反应生成乙炔)
②中反应 CuSO4+H2S===CuS↓+H2SO4(除去硫化氢等杂质气体)
③中现象 溶液紫红色褪去(乙炔被酸性高锰酸钾溶液氧化)
④中现象 溶液橙色褪去(乙炔与溴发生加成反应)
⑤处现象 火焰明亮,并冒出浓烈黑烟
注意事项 a.电石与水反应非常剧烈,为了减小其反应速率;可用饱和氯化钠溶液代替水作为反应试剂;b.乙炔属于可燃性气体,点燃前要检验纯度,防止爆炸
(2)化学性质
①氧化反应
a.能使酸性KMnO4溶液褪色;
b.能燃烧,火焰明亮并伴有黑烟,化学方程式是2C2H2+5O24CO2+2H2O。
②加成反应
与Br2加成 、
与H2加成生成乙烯 CH≡CH+H2CH2==CH2
与HCl加成生成氯乙烯 CH≡CH+HClCH2==CHCl
与H2O加成生成乙醛 CH≡CH+H2OCH3CHO
[注] 乙炔与水加成后的产物乙烯醇
(CH2==CH—OH)不稳定,很快转化为乙醛。
③加聚反应
聚乙炔可用于制备导电高分子材料,由乙炔合成聚乙炔的化学方程式为nCH≡CH?CH==CH?。
INCLUDEPICTURE "培养关键能力LLL.TIF"
INCLUDEPICTURE "实验探究LLL.TIF"
乙炔在工业生产中有着广泛的应用。可用以照明、焊接及切断金属(氧炔焰),也可以制造乙醛、醋酸、苯、合成橡胶、合成纤维等化工产品。
实验室常用电石(CaC2)与水反应制取乙炔,反应原理:CaC2+2H2O―→Ca(OH)2+ CH≡CH↑。电石与水反应非常剧烈,反应制得的乙炔中通常会含有硫化氢等杂质气体。装置设计如下:
INCLUDEPICTURE "XF115.TIF"
(1)为什么用饱和氯化钠溶液代替蒸馏水?
(2)实验过程中,①~⑤会发生什么现象?为什么?
提示:(1)电石与水的反应非常剧烈,为了减小其反应速率,得到平稳的乙炔气流,常用饱和氯化钠溶液代替蒸馏水。
(2)
序号 实验现象 解释或结论
① 反应迅速,有大量气泡生成 反应生成乙炔
② 有黑色沉淀产生 CuSO4+H2S===CuS↓+H2SO4
③ 溶液紫色褪去 乙炔被酸性高锰酸钾溶液氧化
④ 溶液橙色褪去 乙炔与溴发生加成反应
⑤ 火焰明亮,并冒出浓烈黑烟 乙炔含碳量高
INCLUDEPICTURE "核心归纳LLL.TIF"
实验室制取乙炔的注意事项
(1)盛电石的试剂瓶要及时密封并放于干燥处,防止电石吸水而失效。
(2)电石与水反应非常剧烈,为得到平稳的乙炔气流,可用饱和氯化钠溶液代替水,并用分液漏斗控制滴加饱和氯化钠溶液的速率,让饱和氯化钠溶液慢慢地滴入。
(3)因反应剧烈且产生气泡,为防止产生的泡沫涌入导管,应在导管口塞入少许棉花。
(4)制取乙炔不能用启普发生器或具有启普发生器原理的实验装置,原因:①碳化钙吸水性强,遇水反应剧烈,不能随用随停;②反应过程中放出大量的热,易使启普发生器炸裂;③生成的Ca(OH)2呈糊状,易堵塞球形漏斗。
(5)由于电石中含有可以与水发生反应的杂质(如CaS、Ca3P2等),使制得的乙炔中往往含有H2S、PH3等杂质,将混合气体通过盛有NaOH溶液或CuSO4溶液的洗气瓶可将杂质除去。
INCLUDEPICTURE "实践迁移训练LLL.TIF"
1.下列关于乙炔的物理性质的说法不正确的是( )
A.乙炔和乙烯一样,是无色气体
B.乙炔和乙烯一样,密度和空气接近
C.乙炔和乙烯一样都微溶于水
D.乙炔和乙烯一样,没有强烈的气味
解析:选C。A.乙炔和乙烯均是无色气体,A正确; 乙炔和乙烯的密度均小于空气,且和空气接近,B正确;C.乙炔微溶于水,乙烯难溶于水,C不正确;D.纯净的乙炔是无臭的气体,乙烯稍有气味,D正确。
2.(2022·华东师范大学附中高二期中)不可用来鉴别乙烷和乙炔的方法是( )
A.通入溴水中 B.通入酸性高锰酸钾溶液中
C.点燃观察火焰颜色 D.通入水中
解析:选D。A.乙炔能使溴水褪色,乙烷不能使溴水褪色,能用溴水鉴别乙烷和乙炔,故不选A;B.乙炔能使酸性高锰酸钾溶液褪色,乙烷不能使酸性高锰酸钾溶液褪色,能用酸性高锰酸钾溶液鉴别乙烷和乙炔,故不选B;C.乙炔燃烧产生大量黑烟,乙烷燃烧没有黑烟,点燃观察火焰颜色能鉴别乙烷和乙炔,故不选C;D.乙烷和乙炔都不易溶于水也不与水反应,不能用水鉴别乙烷和乙炔,故选D。
3.(2022·湛江二十一中高二阶段练习)实验室常用如图装置制取并验证乙炔的性质。下列说法错误的是( )
INCLUDEPICTURE "AXH125.TIF"
A.饱和食盐水的作用是减缓化学反应速率,从而得到平稳的气流
B.硫酸铜溶液的作用是除去乙炔中硫化氢等杂质气体,防止干扰实验
C.试管B和C中溶液均褪色,且二者的反应类型是相同的
D.试管C生成的物质的名称为1,1,2,2-四溴乙烷
解析:选C。A.由于电石和水的反应非常剧烈,所以常用饱和食盐水代替水,目的是减缓与水的反应速率,从而得到平稳的气流,故A正确。B.制取的乙炔气体中常混有H2S等杂质气体,H2S能与硫酸铜溶液反应生成CuS沉淀,所以硫酸铜溶液的作用是除去H2S等杂质气体,故B正确。C.B中酸性高锰酸钾溶液有强氧化性,氧化乙炔,发生的是氧化反应;C中溴的四氯化碳溶液与乙炔发生的是加成反应,二者反应类型不同,故C错误。D.C中发生反应:2Br2+CH≡CH―→ INCLUDEPICTURE "AXH126.TIF" ,产物的名称为1,1,2,2 四溴乙烷,故D正确。
知识点二 炔烃的结构与性质
INCLUDEPICTURE "落实必备知识LLL.TIF"
1.结构特点
炔烃的官能团是碳碳三键(—C≡C—)。炔烃分子中只含有一个碳碳三键时,其通式为一般表示CnH2n-2。
2.物理性质
炔烃的物理性质的递变与烷烃和烯烃的相似,沸点也随分子中碳原子数的递增而逐渐升高。
3.化学性质
炔烃的化学性质与乙炔相似,能发生加成反应、加聚反应和氧化反应。
4.系统命名法
与烯烃的命名方法相同,称为“某炔”。
如CH≡C—CH(CH3)—CH(CH3)2的命名为3,4-二甲基-1-戊炔。
INCLUDEPICTURE "培养关键能力LLL.TIF"
INCLUDEPICTURE "问题探究LLL.TIF"
1.戊炔的分子式为C5H8,其属于炔烃的同分异构体可用作溶剂、燃料,有机合成的重要中间体。
(1)戊炔分子中σ键与π键的个数比是多少?
(2)请写出戊炔所有属于炔烃的同分异构体的结构简式并命名。
提示:(1)6∶1。
(2)CH≡C—CH2—CH2—CH3 1-戊炔、
CH3—C≡C—CH2—CH3 2-戊炔、
CH≡C—CH(CH3)—CH3 3-甲基-1戊炔。
2.某单炔烃通过催化加氢反应得到2-甲基戊烷,请推断该炔烃可能的结构。
提示:CH≡C—CH2—CH(CH3)—CH3、
CH3—C≡C—CH(CH3)—CH3。
INCLUDEPICTURE "实践迁移训练LLL.TIF"
1.下列关于炔烃的说法正确的是( )
A.丙炔分子中所有原子可能位于同一平面上
B.乙炔分子中碳碳间的三个共价键性质完全相同
C.分子组成符合CnH2n-2通式的链烃,一定是炔烃
D.乙炔及其同系物中,乙炔的含碳量最大
解析:选D。丙炔分子中含有甲基,所有原子不可能共面,A项错误;碳碳三键中有一个σ键和两个π键,二者性质不同,B项错误;分子组成符合CnH2n-2通式的链烃也可能是二烯烃,C项错误;乙炔及其同系物CnH2n-2中碳的质量分数w(C)=×100%=×100%,n增大时,14-增大,w(C)减小,故n=2时w(C)最大,D项正确。
2.下列物质中,不可能是炔烃的加成产物的是( )
A.乙烷 B.2,3-二甲基戊烷
C.异戊烷 D.异丁烷
解析:选D。A项,乙烷可由乙炔加成得到;B项,2,3-二甲基戊烷可由CH3CH(CH3)CH(CH3)C≡CH与氢气加成得到;C项,异戊烷可由(CH3)2CHC≡CH与氢气加成得到;D项,异丁烷相邻的任意两个碳原子上都不符合有2个氢原子,不能由炔烃经加成反应生成。
3.(2022·泰安高一质检)某烃和溴水反应后的产物为2,2,3,3-四溴丁烷,则该烃的同分异构体为( )
A.1-丁炔 B.2-丁炔
C.1-丁烯 D.2-丁烯
解析:选A。2,2,3,3 四溴丁烷的结构简式为
CH3CBr2CBr2CH3,由某烃与溴加成得到,故该烃为2-丁炔,结构简式为CH3C≡CCH3。A.1-丁炔与2 丁炔互为同分异构体;B.该烃就是2-丁炔,是同一种物质;C.1-丁烯与2 丁炔的分子式不同,二者不互为同分异构体;D.2-丁烯与2-丁炔的分子式不同,二者不互为同分异构体。
INCLUDEPICTURE "随堂练学以致用LLL.TIF"
1.(2022·南昌莲塘三中高二期中)下列有关乙炔性质的叙述中,既不同于乙烯也不同于乙烷的是( )
A.能燃烧生成CO2和H2O
B.能与溴水发生加成反应
C.能与酸性KMnO4溶液发生氧化反应
D.能与HCl反应生成氯乙烯
解析:选D。A.乙烯、乙烷、乙炔完全燃烧都生成CO2和H2O,故A不符合题意;B.乙烯、乙炔都能与溴水发生加成反应,故B不符合题意;C.乙烯、乙炔都能被酸性高锰酸钾溶液氧化而使其褪色,故C不符合题意;D.乙烯能与HCl反应生成氯乙烷,乙炔能与HCl反应生成氯乙烯,乙烷与HCl不反应,即乙炔的该性质既不同于乙烯也不同于乙烷,故D符合题意。
2.某气态烃0.5 mol能与1 mol HCl完全加成,加成后产物分子中的氢原子又可被3 mol Cl2完全取代,则此气态烃可能是( )
A.CH3C≡CCH3 B.CH2==CH2
C.CH≡CCH3 D.CH2==CHCH3
解析:选C。根据题意,该烃与HCl、氯气的物质的量之比是0.5∶1∶3=1∶2∶6,即1 mol该烃与2 mol HCl完全加成,则该烃分子中含有2个碳碳双键或1个碳碳三键;最终被氯气取代后的产物中有8个氯原子,即对应的烷烃分子中有8个氢原子,所以该烃的饱和状态为丙烷,则该烃为丙炔,故选C。
3.下列各选项中能说明分子式为C4H6的某烃是CH≡CCH2CH3,而不是CH2==CHCH==CH2的事实的是( )
A.燃烧有浓烟
B.能使酸性KMnO4溶液褪色
C.能与溴按1∶2的比例发生加成反应
D.与足量溴反应,生成物中只有2个碳原子上有溴原子
解析:选D。无论是CH≡CCH2CH3还是CH2==CHCH==CH2,A、B、C项均能发生,而与足量溴加成后,前者产物为,后者产物为。
4.据报道,近来发现了一种新的星际分子氰基辛炔,其结构简式如下所示:
HC≡C—C≡C—C≡C—C≡C—C≡N
下列对该物质的判断不正确的是( )
A.属于不饱和烃
B.能使酸性KMnO4溶液褪色
C.所有原子一定处于同一直线上
D.可以发生加成反应
解析:选A。A.该有机化合物中除了含有C、H元素外还含有N元素,所以不属于烃,A错误;B.含有碳碳三键,能被酸性高锰酸钾溶液氧化而使其褪色,B正确;C.该分子中一个碳碳三键连接一个碳碳单键,且为直链结构,单键可以旋转,具有乙炔的结构特点,所以该分子中所有原子一定处于同一直线上,C正确;D.碳碳三键和碳氮三键都能发生加成反应,D正确。
5.(1)现有下列有机化合物:
①CH3CH3;②CH2==CH2;③CH3CH2C≡CH;
④CH3C≡CCH3;⑤C2H6;⑥CH3CH==CH2。
其中一定互为同系物的是________,一定互为同分异构体的是________。(填序号)
(2)人造羊毛的主要成分是聚丙烯腈(),试写出以乙炔、HCN为原料,经两步反应合成聚丙烯腈的化学方程式,并注明反应类型。
①________________________________________,反应类型为________;
②_______________________________________,反应类型为________。
解析:(1)同系物指结构相似、分子组成上相差一个或若干个CH2原子团的化合物,②和⑥具有相同的官能团,且分子组成上相差一个CH2原子团,故互为同系物;③和④分子结构中都含有—C≡C—,分子式都是C4H6,但—C≡C—在碳链中的位置不同,故互为同分异构体。
(2)①由CH≡CH和HCN制取CH2CHCN需要通过加成反应:;②由制取需要通过加聚反应:。
答案:(1)②⑥ ③④
(2)①加成反应
②加聚反应
INCLUDEPICTURE "课后测素养评价LLL.TIF"
[基础检测]
1.(2022·青冈一中高二检测)下列关于乙炔的描述中,不正确的是( )
A.乙炔是无色有特殊臭味的气体
B.不能用启普发生器制取乙炔气体
C.乙炔易与溴水发生加成反应
D.乙炔分子中所有原子都在同一直线上
解析:选A。A.纯净的乙炔是无色、无臭的气体,故A错误;B.电石与水的反应大量放热,生成的氢氧化钙是糊状物,反应非常剧烈,不能用启普发生器制取乙炔气体,故B正确;C.乙炔分子中含有碳碳三键,易与溴水发生加成反应,故C正确;D.乙炔是直线形分子,故分子中所有原子都在同一直线上,故D正确。
2.(2022·哈工大附属中学高二期末)下列关于乙炔的说法不正确的是( )
A.在空气中燃烧时有浓厚的黑烟
B.可用溴的四氯化碳溶液来鉴别甲烷和乙炔
C.为了减缓电石和水的反应速率,可用饱和食盐水来代替水
D.工业上常用乙炔制乙烯
解析:选D。A.乙炔分子中含碳量较高,在空气中燃烧时有浓厚的黑烟,故A正确;B.乙炔分子中含有碳碳三键,能与溴发生加成反应而使溴的四氯化碳溶液褪色,甲烷不能使溴的四氯化碳溶液褪色,所以可用溴的四氯化碳溶液来鉴别甲烷和乙炔,故B正确;C.由于电石与水反应非常剧烈,为减缓其反应速率,可用饱和食盐水来代替水,故C正确;D.工业上,乙烯是通过石油裂解得到的,故D错误。
3.汽油中常加入异辛烷来减震,其中异辛烷( INCLUDEPICTURE "AXH128.TIF" )的爆震程度最小,下列各烃与氢气加成能得到异辛烷的是( )
A.2,2,4-三甲基-1-戊烯
B.2,4,4-三甲基-1-戊烯
C.2,4,4-三甲基-2-戊炔
D.3,4,4-三甲基-1-戊炔
解析:选B。根据异辛烷的结构 INCLUDEPICTURE "AXH129.TIF" ,2号位连3个—CH3,不能加成得到,双键位置只能在3号位与4号位之间、4号位与—CH3之间,即 INCLUDEPICTURE "AXH131.TIF" (2,4,4-三甲基-2-戊烯)或 INCLUDEPICTURE "AXH130.TIF" (2,4,4-三甲基-1-戊烯)。
4.标准状况下1 mol某烃完全燃烧时生成89.6 L CO2,又知0.1 mol此烃能与标准状况下4.48 L H2加成,则此烃的结构简式可能是( )
A.CH3CH2CH2CH3
B.CH3—C≡C—CH3
C.CH3CH2CH==CH2
D.CH2==CH—CH==CH—CH3
解析:选B。标准状况下1 mol某烃完全燃烧时,生成CO2的物质的量n(CO2)==4 mol,根据碳元素守恒知,该烃分子中含有4个碳原子;又知0.1 mol此烃能与标准状况下4.48 L H2加成,n(H2)==0.2 mol,故该烃与H2为1∶2加成,可能是二烯烃或炔烃,由于该烃分子中含有4个碳原子,所以CH3—C≡C—CH3符合题意。
5.由乙炔制CHClBr—CH2Br,下列方法最可行的是( )
A.先与HBr加成后再与HCl加成
B.先与H2完全加成后再与Cl2、Br2发生取代反应
C.先与HCl加成后再与Br2加成
D.先与Cl2加成后再与HBr加成
解析:选C。A、D项不可能得到产物CHClBr—CH2Br;B项可能得到产物CHClBr—CH2Br,但生成的是含产物在内的复杂的混合物,无法分离;故应选C。
6.以乙炔为原料在一定条件下可转化为乙烯基乙炔(CH≡C—CH==CH2)。下列关于乙烯基乙炔的说法错误的是( )
A.可用于萃取溴水中的溴单质
B.1 mol乙烯基乙炔最多能与3 mol Br2发生加成反应
C.乙烯基乙炔分子内含有两种官能团
D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同
解析:选A。A.乙烯基乙炔分子中含有碳碳三键和碳碳双键,均能与溴水发生加成反应,不能用于萃取溴水中的溴单质,A错误;B.乙烯基乙炔分子中含有1个碳碳双键和1个碳碳三键,故1 mol乙烯基乙炔最多能与3 mol Br2发生加成反应,B正确;C.乙烯基乙炔分子中含有碳碳双键和碳碳三键两种官能团,C正确;D.乙炔和乙烯基乙炔的最简式均为CH,故等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同,D正确。
7.某烃的结构简式如下,下列说法不正确的是( )
A.1 mol该烃完全燃烧需消耗11 mol O2
B.与氢气完全加成后的产物分子中含2个甲基
C.1 mol该烃完全加成消耗3 mol Br2
D.分子中一定共平面的碳原子有6个
解析:选B。该烃的分子式为C8H12,1 mol该烃完全燃烧消耗O2的物质的量为11 mol,A项正确;该烃与氢气完全加成后的产物为CH3CH2CH2CH(CH2CH3)2,分子中含有3个甲基,B项错误;该烃分子中含有一个和一个—C≡C—,故1 mol该烃完全加成消耗3 mol Br2,C项正确;该烃分子中含有和—C≡C—,结合乙烯和乙炔的结构判断,分子中一定共平面的碳原子有6个,D项正确。
8.相同条件下,乙炔和乙烯的混合气体完全燃烧所需O2的体积是混合气体体积的2.8倍,则混合气体与H2发生加成反应时,所需H2的体积是混合气体体积的( )
A.1.2倍 B.1.4倍
C.1.6倍 D.1.8倍
解析:选B。设原混合气体的总体积为1,乙炔的体积为x,则乙烯的体积为(1-x),根据燃烧的关系式C2H2~O2、C2H4~3O2,可得x+3(1-x)=2.8,解得x=0.4,则加成所需H2的体积为2×0.4+1×(1-0.4)=1.4,即所需H2的体积是混合气体体积的1.4倍。
9.以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,有关合成路线如图所示:
INCLUDEPICTURE "XF118.TIF"
(1)写出下列物质的结构简式:
A______________________,C_______________________________________。
(2)写出下列反应的化学方程式:
反应②_______________________________________________________;
反应③_________________________________________________________;
反应⑥__________________________________________________________。
解析:由合成路线图进行正推(由反应物→产物)和反推(由产物→反应物)。如由A→,可推知A为CH2==CHCl(氯乙烯),由A可推知反应①为CH≡CH+HClCH2==CHCl。根据加成反应的原理,可写出反应③为CH≡CH+HCNCH2==CH—CN。
答案:(1)CH2==CHCl CH≡C—CH==CH2
(2)
CH≡CH+HCNCH2==CH—CN
CH≡C—CH===CH2+HCl
10.某化学兴趣小组选用下列装置和试剂制取纯净的乙炔并进行有关乙炔性质的探究。试回答下列问题:
INCLUDEPICTURE "AXH132.TIF"
(1)A中制取乙炔的化学方程式为_______________________________________。
(2)制乙炔时,为了控制反应速率,分液漏斗中盛装的试剂是______________。
(3)用电石制得的乙炔中常含有H2S、PH3等杂质,除去杂质应选用____________装置,干燥乙炔可以选用__________装置。(填装置字母代号)
(4)为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:
纯净乙炔气有机混合物
该有机混合物可能含有的物质是__________(填结构简式)。
(5)验证电石与水反应生成的乙炔和溴发生加成反应,下列叙述正确的是________________(填字母)。
a.使溴水褪色的反应未必是加成反应
b.使溴水褪色的反应就是加成反应
c.使溴水褪色的物质未必是乙炔
d.使溴水褪色的物质就是乙炔
解析:(1)制取乙炔使用电石(碳化钙)和水,化学方程式为CaC2+2H2O―→C2H2↑+Ca(OH)2。(2)由于CaC2与H2O反应非常剧烈,产生C2H2的速率很快,为了控制反应速率,分液漏斗中盛装的试剂是饱和食盐水。(3)H2S、PH3等杂质均能被CuSO4溶液吸收,选用C装置;碱石灰(NaOH、CaO的混合物)、CaCl2都可以用于干燥C2H2。(4)CH≡CH与HBr发生加成反应时,若CH≡CH中断裂一个π键,则与HBr加成可得CH2==CHBr,CH2==CHBr能继续与HBr加成得到CH3—CHBr2、BrCH2—CH2Br,故该有机混合物可能含有的物质是CH2==CHBr、CH3—CHBr2、CH2Br—CH2Br。(5)生成的乙炔中含有H2S、PH3等杂质,H2S能与溴发生氧化还原反应而使溴水褪色,故使溴水褪色的反应未必是加成反应,使溴水褪色的物质未必是乙炔。
答案:(1)CaC2+2H2O―→C2H2↑+Ca(OH)2
(2)饱和食盐水 (3)C B或D
(4)CH2==CHBr、CH3—CHBr2、CH2Br—CH2Br (5)ac
[素养提升]
11.下列关于烯烃、炔烃的叙述中,正确的是( )
A.某物质的名称为2-乙基-1-丁烯,它的结构简式为CH2==C(C2H5)2
B.CH3—CH==CH—C≡C—CF3分子结构中的6个碳原子可能都在同一条直线上
C.相同物质的量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的量相同
D.β-月桂烯的键线式为 INCLUDEPICTURE "AXH133.TIF" ,该物质与等物质的量的溴发生加成反应的产物(不考虑立体异构)理论上最多有3种
解析:选A。A.2-乙基-1-丁烯的结构简式为CH2==C(C2H5)2,故A正确;B.双键两端的碳原子和与之直接相连的碳原子处于同一平面,键角约是120°,不是直线结构,故B错误;C.1 mol乙炔完全燃烧消耗2.5 mol氧气,而1 mol苯完全燃烧消耗7.5 mol氧气,故等物质的量的乙炔和苯完全燃烧的耗氧量不同,故C错误;D.该分子中存在3个碳碳双键,且与溴按物质的量之比为1∶1反应时可以发生1,2-加成和1,4-加成,共有4种产物,故D错误。
12.乙炔是一种重要的化工原料,可发生如图的转化。下列说法错误的是( )
INCLUDEPICTURE "AXH134.TIF"
A.1个乙烯基乙炔分子中含有7个σ键,3个π键
B.正四面体烷的二氯代物有2种结构
C.苯乙烯()和环辛四烯互为同分异构体
D.等质量的苯和乙炔完全燃烧时消耗氧气的量相同
解析:选B。A.由乙烯基乙炔的结构简式可知,1个乙烯基乙炔分子中含有7个σ键,3个π键,故A正确;B.正四面体烷的结构对称,一氯代物只有1种,二氯代物也只有1种,故B错误;C.苯乙烯()和环辛四烯的分子式都是C8H8,结构不同,二者互为同分异构体,故C正确;D.苯与乙炔的最简式均为CH,所以等质量的苯与乙炔完全燃烧时的耗氧量相同,故D正确。
13.下列关于分子组成为CxHy的烷烃、烯烃、炔烃的说法不正确的是( )
A.当x≤4时,常温常压下均为气体
B.y一定为偶数
C.1 mol CxHy完全燃烧时,消耗氧气 (x+) mol
D.在密闭容器中完全燃烧,150 ℃时测得的压强一定比燃烧前增加
解析:选D。烷烃、烯烃、炔烃的物理性质具有一定的相似性,当x≤4时,常温常压下均为气体,A正确。烃分子中,氢原子数为偶数,B正确。根据CxHy的燃烧通式CxHy+(x+)O2xCO2+H2O(150 ℃时,水为气态),反应前后物质的量变化为x+-(1+x+)=-1,当y=4时,反应前后物质的量不变,压强不变,如CH4、C2H4;当y>4时,反应后物质的量增大,压强增大,如C2H6;当y<4时,反应后物质的量减小,压强减小,如C2H2,C正确、D不正确。
14.化合物 INCLUDEPICTURE "AXH135.TIF" (b)、 INCLUDEPICTURE "AXH136.TIF" (d)、CH≡C—CH==CH2(p)的分子式均为C4H4。下列说法正确的是( )
A.b的同分异构体只有d和p两种
B.只有b的所有原子处于同一平面
C.b、d、p均可与酸性高锰酸钾溶液反应
D.p分子中有3种不同化学环境的氢原子
解析:选D。A.b的同分异构体可为链状烃,也可为环状烃,故b的同分异构体不只有d和p,故A错误;B.p分子中含有碳碳双键和碳碳三键,碳碳双键为平面结构,碳碳三键为直线形结构,所有原子处于同一平面,故B错误;C.d为饱和烃,与酸性高锰酸钾溶液不反应,故C错误。
15.(2022·衡水高二阶段练习)某实验小组设计如图所示实验装置来制取乙炔,并粗略测定电石(含有N、P、S等元素)中碳化钙的质量分数。回答下列问题:
INCLUDEPICTURE "AXH137.TIF"
(1)a的作用是______________________________________________________。
(2)仪器b中发生反应的化学方程式为__________________________________,
实验过程中为了减缓水与电石的反应速率,可采取的措施是__________(写一条即可)。
(3)将生成的气体通入酸性KMnO4溶液中,观察到酸性KMnO4溶液褪色。
①________(填“能”或“不能”)说明生成的气体全部为乙炔,原因是____________________________________________________________。
②实验小组发现该实验不能用启普发生器来制取乙炔,理由是____________(写一条即可)。
(4)装置c中盛放的试剂为________________。
(5)为了安全,点燃乙炔前应____________,乙炔燃烧时的现象是________________________________________________________________。
(6)取m g电石样品,使其与水完全反应,实验结束后测得排入量筒中水的体积为V mL,则电石中碳化钙的质量分数为____________(用含V和m的代数式表示,忽略导管中残留的水和气体中含有的水蒸气,所有气体均已换算成标准状况下)。
解析:(1)a连通烧瓶和分液漏斗上口,维持瓶内气压稳定,使水顺利滴下。(2)仪器b中电石和水反应生成氢氧化钙和乙炔,化学方程式为CaC2+2H2O―→Ca(OH)2+C2H2↑,实验过程中,用饱和食盐水代替水可以减缓水与电石的反应速率。(3)①生成的气体中含有H2S和PH3,这两种气体也能使酸性高锰酸钾溶液褪色,故不能说明生成的气体全部为乙炔;②生成的Ca(OH)2呈糊状,易堵塞启普发生器的球形漏斗,所以不能用启普发生器来制取乙炔。(4)装置c的作用是除去乙炔中的H2S、PH3等气体杂质,盛放的试剂为CuSO4溶液。(5)乙炔是可燃性气体,点燃乙炔前应检验其纯度,乙炔燃烧时的现象是火焰明亮并伴有浓烈的黑烟。(6)设碳化钙的质量为x g。
CaC2+2H2O―→Ca(OH)2+C2H2↑
64 g 1 mol
x g mol
x=×64=;则电石中碳化钙的质量分数为g÷m g×100%=%。
答案:(1)维持瓶内气压稳定,使水顺利滴下
(2)CaC2+2H2O―→Ca(OH)2+C2H2↑ 用饱和食盐水代替水(答案合理即可)
(3)①不能 生成的气体中含有H2S和PH3,这两种气体也能使酸性高锰酸钾溶液褪色 ②生成的Ca(OH)2 呈糊状,易堵塞启普发生器的球形漏斗(合理即可) (4)CuSO4溶液 (5)检验其纯度 火焰明亮并伴有浓烈的黑烟 (6)%
[素养发展目标]
1.从化学键的不饱和性等微观角度理解炔烃的结构特点,能辨析物质类别与反应类型之间的关系。
2.认识加成反应的特点和规律,了解有机反应类型与有机化合物的组成及结构特点的关系。
3.能通过模型假设、证据推理认识常见有机化合物分子的空间结构,会判断有机化合物分子中原子间的位置关系。
知识点一 乙炔的结构与性质
INCLUDEPICTURE "落实必备知识LLL.TIF"
1.结构特点
结构式 官能团 碳原子的杂化方式 三键所含共价键 分子空间结构
H—C≡C—H 碳碳三键 sp 1个σ键,2个π键 直线形,分子中的所有原子都处于同一直线上
2.物理性质
乙炔(俗称电石气)是最简单的炔烃。乙炔是无色、无臭的气体,密度比空气小,微溶于水,易溶于有机溶剂。
3.化学性质
(1)实验探究
实验装置 INCLUDEPICTURE "XF115.TIF"
①中反应 CaC2+2H2O―→Ca(OH)2+C2H2↑(反应生成乙炔)
②中反应 CuSO4+H2S===CuS↓+H2SO4(除去硫化氢等杂质气体)
③中现象 溶液紫红色褪去(乙炔被酸性高锰酸钾溶液氧化)
④中现象 溶液橙色褪去(乙炔与溴发生加成反应)
⑤处现象 火焰明亮,并冒出浓烈黑烟
注意事项 a.电石与水反应非常剧烈,为了减小其反应速率;可用饱和氯化钠溶液代替水作为反应试剂;b.乙炔属于可燃性气体,点燃前要检验纯度,防止爆炸
(2)化学性质
①氧化反应
a.能使酸性KMnO4溶液褪色;
b.能燃烧,火焰明亮并伴有黑烟,化学方程式是2C2H2+5O24CO2+2H2O。
②加成反应
与Br2加成 、
与H2加成生成乙烯 CH≡CH+H2CH2==CH2
与HCl加成生成氯乙烯 CH≡CH+HClCH2==CHCl
与H2O加成生成乙醛 CH≡CH+H2OCH3CHO
[注] 乙炔与水加成后的产物乙烯醇
(CH2==CH—OH)不稳定,很快转化为乙醛。
③加聚反应
聚乙炔可用于制备导电高分子材料,由乙炔合成聚乙炔的化学方程式为nCH≡CH?CH==CH?。
INCLUDEPICTURE "培养关键能力LLL.TIF"
INCLUDEPICTURE "实验探究LLL.TIF"
乙炔在工业生产中有着广泛的应用。可用以照明、焊接及切断金属(氧炔焰),也可以制造乙醛、醋酸、苯、合成橡胶、合成纤维等化工产品。
实验室常用电石(CaC2)与水反应制取乙炔,反应原理:CaC2+2H2O―→Ca(OH)2+ CH≡CH↑。电石与水反应非常剧烈,反应制得的乙炔中通常会含有硫化氢等杂质气体。装置设计如下:
INCLUDEPICTURE "XF115.TIF"
(1)为什么用饱和氯化钠溶液代替蒸馏水?
(2)实验过程中,①~⑤会发生什么现象?为什么?
提示:(1)电石与水的反应非常剧烈,为了减小其反应速率,得到平稳的乙炔气流,常用饱和氯化钠溶液代替蒸馏水。
(2)
序号 实验现象 解释或结论
① 反应迅速,有大量气泡生成 反应生成乙炔
② 有黑色沉淀产生 CuSO4+H2S===CuS↓+H2SO4
③ 溶液紫色褪去 乙炔被酸性高锰酸钾溶液氧化
④ 溶液橙色褪去 乙炔与溴发生加成反应
⑤ 火焰明亮,并冒出浓烈黑烟 乙炔含碳量高
INCLUDEPICTURE "核心归纳LLL.TIF"
实验室制取乙炔的注意事项
(1)盛电石的试剂瓶要及时密封并放于干燥处,防止电石吸水而失效。
(2)电石与水反应非常剧烈,为得到平稳的乙炔气流,可用饱和氯化钠溶液代替水,并用分液漏斗控制滴加饱和氯化钠溶液的速率,让饱和氯化钠溶液慢慢地滴入。
(3)因反应剧烈且产生气泡,为防止产生的泡沫涌入导管,应在导管口塞入少许棉花。
(4)制取乙炔不能用启普发生器或具有启普发生器原理的实验装置,原因:①碳化钙吸水性强,遇水反应剧烈,不能随用随停;②反应过程中放出大量的热,易使启普发生器炸裂;③生成的Ca(OH)2呈糊状,易堵塞球形漏斗。
(5)由于电石中含有可以与水发生反应的杂质(如CaS、Ca3P2等),使制得的乙炔中往往含有H2S、PH3等杂质,将混合气体通过盛有NaOH溶液或CuSO4溶液的洗气瓶可将杂质除去。
INCLUDEPICTURE "实践迁移训练LLL.TIF"
1.下列关于乙炔的物理性质的说法不正确的是( )
A.乙炔和乙烯一样,是无色气体
B.乙炔和乙烯一样,密度和空气接近
C.乙炔和乙烯一样都微溶于水
D.乙炔和乙烯一样,没有强烈的气味
解析:选C。A.乙炔和乙烯均是无色气体,A正确; 乙炔和乙烯的密度均小于空气,且和空气接近,B正确;C.乙炔微溶于水,乙烯难溶于水,C不正确;D.纯净的乙炔是无臭的气体,乙烯稍有气味,D正确。
2.(2022·华东师范大学附中高二期中)不可用来鉴别乙烷和乙炔的方法是( )
A.通入溴水中 B.通入酸性高锰酸钾溶液中
C.点燃观察火焰颜色 D.通入水中
解析:选D。A.乙炔能使溴水褪色,乙烷不能使溴水褪色,能用溴水鉴别乙烷和乙炔,故不选A;B.乙炔能使酸性高锰酸钾溶液褪色,乙烷不能使酸性高锰酸钾溶液褪色,能用酸性高锰酸钾溶液鉴别乙烷和乙炔,故不选B;C.乙炔燃烧产生大量黑烟,乙烷燃烧没有黑烟,点燃观察火焰颜色能鉴别乙烷和乙炔,故不选C;D.乙烷和乙炔都不易溶于水也不与水反应,不能用水鉴别乙烷和乙炔,故选D。
3.(2022·湛江二十一中高二阶段练习)实验室常用如图装置制取并验证乙炔的性质。下列说法错误的是( )
INCLUDEPICTURE "AXH125.TIF"
A.饱和食盐水的作用是减缓化学反应速率,从而得到平稳的气流
B.硫酸铜溶液的作用是除去乙炔中硫化氢等杂质气体,防止干扰实验
C.试管B和C中溶液均褪色,且二者的反应类型是相同的
D.试管C生成的物质的名称为1,1,2,2-四溴乙烷
解析:选C。A.由于电石和水的反应非常剧烈,所以常用饱和食盐水代替水,目的是减缓与水的反应速率,从而得到平稳的气流,故A正确。B.制取的乙炔气体中常混有H2S等杂质气体,H2S能与硫酸铜溶液反应生成CuS沉淀,所以硫酸铜溶液的作用是除去H2S等杂质气体,故B正确。C.B中酸性高锰酸钾溶液有强氧化性,氧化乙炔,发生的是氧化反应;C中溴的四氯化碳溶液与乙炔发生的是加成反应,二者反应类型不同,故C错误。D.C中发生反应:2Br2+CH≡CH―→ INCLUDEPICTURE "AXH126.TIF" ,产物的名称为1,1,2,2 四溴乙烷,故D正确。
知识点二 炔烃的结构与性质
INCLUDEPICTURE "落实必备知识LLL.TIF"
1.结构特点
炔烃的官能团是碳碳三键(—C≡C—)。炔烃分子中只含有一个碳碳三键时,其通式为一般表示CnH2n-2。
2.物理性质
炔烃的物理性质的递变与烷烃和烯烃的相似,沸点也随分子中碳原子数的递增而逐渐升高。
3.化学性质
炔烃的化学性质与乙炔相似,能发生加成反应、加聚反应和氧化反应。
4.系统命名法
与烯烃的命名方法相同,称为“某炔”。
如CH≡C—CH(CH3)—CH(CH3)2的命名为3,4-二甲基-1-戊炔。
INCLUDEPICTURE "培养关键能力LLL.TIF"
INCLUDEPICTURE "问题探究LLL.TIF"
1.戊炔的分子式为C5H8,其属于炔烃的同分异构体可用作溶剂、燃料,有机合成的重要中间体。
(1)戊炔分子中σ键与π键的个数比是多少?
(2)请写出戊炔所有属于炔烃的同分异构体的结构简式并命名。
提示:(1)6∶1。
(2)CH≡C—CH2—CH2—CH3 1-戊炔、
CH3—C≡C—CH2—CH3 2-戊炔、
CH≡C—CH(CH3)—CH3 3-甲基-1戊炔。
2.某单炔烃通过催化加氢反应得到2-甲基戊烷,请推断该炔烃可能的结构。
提示:CH≡C—CH2—CH(CH3)—CH3、
CH3—C≡C—CH(CH3)—CH3。
INCLUDEPICTURE "实践迁移训练LLL.TIF"
1.下列关于炔烃的说法正确的是( )
A.丙炔分子中所有原子可能位于同一平面上
B.乙炔分子中碳碳间的三个共价键性质完全相同
C.分子组成符合CnH2n-2通式的链烃,一定是炔烃
D.乙炔及其同系物中,乙炔的含碳量最大
解析:选D。丙炔分子中含有甲基,所有原子不可能共面,A项错误;碳碳三键中有一个σ键和两个π键,二者性质不同,B项错误;分子组成符合CnH2n-2通式的链烃也可能是二烯烃,C项错误;乙炔及其同系物CnH2n-2中碳的质量分数w(C)=×100%=×100%,n增大时,14-增大,w(C)减小,故n=2时w(C)最大,D项正确。
2.下列物质中,不可能是炔烃的加成产物的是( )
A.乙烷 B.2,3-二甲基戊烷
C.异戊烷 D.异丁烷
解析:选D。A项,乙烷可由乙炔加成得到;B项,2,3-二甲基戊烷可由CH3CH(CH3)CH(CH3)C≡CH与氢气加成得到;C项,异戊烷可由(CH3)2CHC≡CH与氢气加成得到;D项,异丁烷相邻的任意两个碳原子上都不符合有2个氢原子,不能由炔烃经加成反应生成。
3.(2022·泰安高一质检)某烃和溴水反应后的产物为2,2,3,3-四溴丁烷,则该烃的同分异构体为( )
A.1-丁炔 B.2-丁炔
C.1-丁烯 D.2-丁烯
解析:选A。2,2,3,3 四溴丁烷的结构简式为
CH3CBr2CBr2CH3,由某烃与溴加成得到,故该烃为2-丁炔,结构简式为CH3C≡CCH3。A.1-丁炔与2 丁炔互为同分异构体;B.该烃就是2-丁炔,是同一种物质;C.1-丁烯与2 丁炔的分子式不同,二者不互为同分异构体;D.2-丁烯与2-丁炔的分子式不同,二者不互为同分异构体。
INCLUDEPICTURE "随堂练学以致用LLL.TIF"
1.(2022·南昌莲塘三中高二期中)下列有关乙炔性质的叙述中,既不同于乙烯也不同于乙烷的是( )
A.能燃烧生成CO2和H2O
B.能与溴水发生加成反应
C.能与酸性KMnO4溶液发生氧化反应
D.能与HCl反应生成氯乙烯
解析:选D。A.乙烯、乙烷、乙炔完全燃烧都生成CO2和H2O,故A不符合题意;B.乙烯、乙炔都能与溴水发生加成反应,故B不符合题意;C.乙烯、乙炔都能被酸性高锰酸钾溶液氧化而使其褪色,故C不符合题意;D.乙烯能与HCl反应生成氯乙烷,乙炔能与HCl反应生成氯乙烯,乙烷与HCl不反应,即乙炔的该性质既不同于乙烯也不同于乙烷,故D符合题意。
2.某气态烃0.5 mol能与1 mol HCl完全加成,加成后产物分子中的氢原子又可被3 mol Cl2完全取代,则此气态烃可能是( )
A.CH3C≡CCH3 B.CH2==CH2
C.CH≡CCH3 D.CH2==CHCH3
解析:选C。根据题意,该烃与HCl、氯气的物质的量之比是0.5∶1∶3=1∶2∶6,即1 mol该烃与2 mol HCl完全加成,则该烃分子中含有2个碳碳双键或1个碳碳三键;最终被氯气取代后的产物中有8个氯原子,即对应的烷烃分子中有8个氢原子,所以该烃的饱和状态为丙烷,则该烃为丙炔,故选C。
3.下列各选项中能说明分子式为C4H6的某烃是CH≡CCH2CH3,而不是CH2==CHCH==CH2的事实的是( )
A.燃烧有浓烟
B.能使酸性KMnO4溶液褪色
C.能与溴按1∶2的比例发生加成反应
D.与足量溴反应,生成物中只有2个碳原子上有溴原子
解析:选D。无论是CH≡CCH2CH3还是CH2==CHCH==CH2,A、B、C项均能发生,而与足量溴加成后,前者产物为,后者产物为。
4.据报道,近来发现了一种新的星际分子氰基辛炔,其结构简式如下所示:
HC≡C—C≡C—C≡C—C≡C—C≡N
下列对该物质的判断不正确的是( )
A.属于不饱和烃
B.能使酸性KMnO4溶液褪色
C.所有原子一定处于同一直线上
D.可以发生加成反应
解析:选A。A.该有机化合物中除了含有C、H元素外还含有N元素,所以不属于烃,A错误;B.含有碳碳三键,能被酸性高锰酸钾溶液氧化而使其褪色,B正确;C.该分子中一个碳碳三键连接一个碳碳单键,且为直链结构,单键可以旋转,具有乙炔的结构特点,所以该分子中所有原子一定处于同一直线上,C正确;D.碳碳三键和碳氮三键都能发生加成反应,D正确。
5.(1)现有下列有机化合物:
①CH3CH3;②CH2==CH2;③CH3CH2C≡CH;
④CH3C≡CCH3;⑤C2H6;⑥CH3CH==CH2。
其中一定互为同系物的是________,一定互为同分异构体的是________。(填序号)
(2)人造羊毛的主要成分是聚丙烯腈(),试写出以乙炔、HCN为原料,经两步反应合成聚丙烯腈的化学方程式,并注明反应类型。
①________________________________________,反应类型为________;
②_______________________________________,反应类型为________。
解析:(1)同系物指结构相似、分子组成上相差一个或若干个CH2原子团的化合物,②和⑥具有相同的官能团,且分子组成上相差一个CH2原子团,故互为同系物;③和④分子结构中都含有—C≡C—,分子式都是C4H6,但—C≡C—在碳链中的位置不同,故互为同分异构体。
(2)①由CH≡CH和HCN制取CH2CHCN需要通过加成反应:;②由制取需要通过加聚反应:。
答案:(1)②⑥ ③④
(2)①加成反应
②加聚反应
INCLUDEPICTURE "课后测素养评价LLL.TIF"
[基础检测]
1.(2022·青冈一中高二检测)下列关于乙炔的描述中,不正确的是( )
A.乙炔是无色有特殊臭味的气体
B.不能用启普发生器制取乙炔气体
C.乙炔易与溴水发生加成反应
D.乙炔分子中所有原子都在同一直线上
解析:选A。A.纯净的乙炔是无色、无臭的气体,故A错误;B.电石与水的反应大量放热,生成的氢氧化钙是糊状物,反应非常剧烈,不能用启普发生器制取乙炔气体,故B正确;C.乙炔分子中含有碳碳三键,易与溴水发生加成反应,故C正确;D.乙炔是直线形分子,故分子中所有原子都在同一直线上,故D正确。
2.(2022·哈工大附属中学高二期末)下列关于乙炔的说法不正确的是( )
A.在空气中燃烧时有浓厚的黑烟
B.可用溴的四氯化碳溶液来鉴别甲烷和乙炔
C.为了减缓电石和水的反应速率,可用饱和食盐水来代替水
D.工业上常用乙炔制乙烯
解析:选D。A.乙炔分子中含碳量较高,在空气中燃烧时有浓厚的黑烟,故A正确;B.乙炔分子中含有碳碳三键,能与溴发生加成反应而使溴的四氯化碳溶液褪色,甲烷不能使溴的四氯化碳溶液褪色,所以可用溴的四氯化碳溶液来鉴别甲烷和乙炔,故B正确;C.由于电石与水反应非常剧烈,为减缓其反应速率,可用饱和食盐水来代替水,故C正确;D.工业上,乙烯是通过石油裂解得到的,故D错误。
3.汽油中常加入异辛烷来减震,其中异辛烷( INCLUDEPICTURE "AXH128.TIF" )的爆震程度最小,下列各烃与氢气加成能得到异辛烷的是( )
A.2,2,4-三甲基-1-戊烯
B.2,4,4-三甲基-1-戊烯
C.2,4,4-三甲基-2-戊炔
D.3,4,4-三甲基-1-戊炔
解析:选B。根据异辛烷的结构 INCLUDEPICTURE "AXH129.TIF" ,2号位连3个—CH3,不能加成得到,双键位置只能在3号位与4号位之间、4号位与—CH3之间,即 INCLUDEPICTURE "AXH131.TIF" (2,4,4-三甲基-2-戊烯)或 INCLUDEPICTURE "AXH130.TIF" (2,4,4-三甲基-1-戊烯)。
4.标准状况下1 mol某烃完全燃烧时生成89.6 L CO2,又知0.1 mol此烃能与标准状况下4.48 L H2加成,则此烃的结构简式可能是( )
A.CH3CH2CH2CH3
B.CH3—C≡C—CH3
C.CH3CH2CH==CH2
D.CH2==CH—CH==CH—CH3
解析:选B。标准状况下1 mol某烃完全燃烧时,生成CO2的物质的量n(CO2)==4 mol,根据碳元素守恒知,该烃分子中含有4个碳原子;又知0.1 mol此烃能与标准状况下4.48 L H2加成,n(H2)==0.2 mol,故该烃与H2为1∶2加成,可能是二烯烃或炔烃,由于该烃分子中含有4个碳原子,所以CH3—C≡C—CH3符合题意。
5.由乙炔制CHClBr—CH2Br,下列方法最可行的是( )
A.先与HBr加成后再与HCl加成
B.先与H2完全加成后再与Cl2、Br2发生取代反应
C.先与HCl加成后再与Br2加成
D.先与Cl2加成后再与HBr加成
解析:选C。A、D项不可能得到产物CHClBr—CH2Br;B项可能得到产物CHClBr—CH2Br,但生成的是含产物在内的复杂的混合物,无法分离;故应选C。
6.以乙炔为原料在一定条件下可转化为乙烯基乙炔(CH≡C—CH==CH2)。下列关于乙烯基乙炔的说法错误的是( )
A.可用于萃取溴水中的溴单质
B.1 mol乙烯基乙炔最多能与3 mol Br2发生加成反应
C.乙烯基乙炔分子内含有两种官能团
D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同
解析:选A。A.乙烯基乙炔分子中含有碳碳三键和碳碳双键,均能与溴水发生加成反应,不能用于萃取溴水中的溴单质,A错误;B.乙烯基乙炔分子中含有1个碳碳双键和1个碳碳三键,故1 mol乙烯基乙炔最多能与3 mol Br2发生加成反应,B正确;C.乙烯基乙炔分子中含有碳碳双键和碳碳三键两种官能团,C正确;D.乙炔和乙烯基乙炔的最简式均为CH,故等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同,D正确。
7.某烃的结构简式如下,下列说法不正确的是( )
A.1 mol该烃完全燃烧需消耗11 mol O2
B.与氢气完全加成后的产物分子中含2个甲基
C.1 mol该烃完全加成消耗3 mol Br2
D.分子中一定共平面的碳原子有6个
解析:选B。该烃的分子式为C8H12,1 mol该烃完全燃烧消耗O2的物质的量为11 mol,A项正确;该烃与氢气完全加成后的产物为CH3CH2CH2CH(CH2CH3)2,分子中含有3个甲基,B项错误;该烃分子中含有一个和一个—C≡C—,故1 mol该烃完全加成消耗3 mol Br2,C项正确;该烃分子中含有和—C≡C—,结合乙烯和乙炔的结构判断,分子中一定共平面的碳原子有6个,D项正确。
8.相同条件下,乙炔和乙烯的混合气体完全燃烧所需O2的体积是混合气体体积的2.8倍,则混合气体与H2发生加成反应时,所需H2的体积是混合气体体积的( )
A.1.2倍 B.1.4倍
C.1.6倍 D.1.8倍
解析:选B。设原混合气体的总体积为1,乙炔的体积为x,则乙烯的体积为(1-x),根据燃烧的关系式C2H2~O2、C2H4~3O2,可得x+3(1-x)=2.8,解得x=0.4,则加成所需H2的体积为2×0.4+1×(1-0.4)=1.4,即所需H2的体积是混合气体体积的1.4倍。
9.以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,有关合成路线如图所示:
INCLUDEPICTURE "XF118.TIF"
(1)写出下列物质的结构简式:
A______________________,C_______________________________________。
(2)写出下列反应的化学方程式:
反应②_______________________________________________________;
反应③_________________________________________________________;
反应⑥__________________________________________________________。
解析:由合成路线图进行正推(由反应物→产物)和反推(由产物→反应物)。如由A→,可推知A为CH2==CHCl(氯乙烯),由A可推知反应①为CH≡CH+HClCH2==CHCl。根据加成反应的原理,可写出反应③为CH≡CH+HCNCH2==CH—CN。
答案:(1)CH2==CHCl CH≡C—CH==CH2
(2)
CH≡CH+HCNCH2==CH—CN
CH≡C—CH===CH2+HCl
10.某化学兴趣小组选用下列装置和试剂制取纯净的乙炔并进行有关乙炔性质的探究。试回答下列问题:
INCLUDEPICTURE "AXH132.TIF"
(1)A中制取乙炔的化学方程式为_______________________________________。
(2)制乙炔时,为了控制反应速率,分液漏斗中盛装的试剂是______________。
(3)用电石制得的乙炔中常含有H2S、PH3等杂质,除去杂质应选用____________装置,干燥乙炔可以选用__________装置。(填装置字母代号)
(4)为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:
纯净乙炔气有机混合物
该有机混合物可能含有的物质是__________(填结构简式)。
(5)验证电石与水反应生成的乙炔和溴发生加成反应,下列叙述正确的是________________(填字母)。
a.使溴水褪色的反应未必是加成反应
b.使溴水褪色的反应就是加成反应
c.使溴水褪色的物质未必是乙炔
d.使溴水褪色的物质就是乙炔
解析:(1)制取乙炔使用电石(碳化钙)和水,化学方程式为CaC2+2H2O―→C2H2↑+Ca(OH)2。(2)由于CaC2与H2O反应非常剧烈,产生C2H2的速率很快,为了控制反应速率,分液漏斗中盛装的试剂是饱和食盐水。(3)H2S、PH3等杂质均能被CuSO4溶液吸收,选用C装置;碱石灰(NaOH、CaO的混合物)、CaCl2都可以用于干燥C2H2。(4)CH≡CH与HBr发生加成反应时,若CH≡CH中断裂一个π键,则与HBr加成可得CH2==CHBr,CH2==CHBr能继续与HBr加成得到CH3—CHBr2、BrCH2—CH2Br,故该有机混合物可能含有的物质是CH2==CHBr、CH3—CHBr2、CH2Br—CH2Br。(5)生成的乙炔中含有H2S、PH3等杂质,H2S能与溴发生氧化还原反应而使溴水褪色,故使溴水褪色的反应未必是加成反应,使溴水褪色的物质未必是乙炔。
答案:(1)CaC2+2H2O―→C2H2↑+Ca(OH)2
(2)饱和食盐水 (3)C B或D
(4)CH2==CHBr、CH3—CHBr2、CH2Br—CH2Br (5)ac
[素养提升]
11.下列关于烯烃、炔烃的叙述中,正确的是( )
A.某物质的名称为2-乙基-1-丁烯,它的结构简式为CH2==C(C2H5)2
B.CH3—CH==CH—C≡C—CF3分子结构中的6个碳原子可能都在同一条直线上
C.相同物质的量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的量相同
D.β-月桂烯的键线式为 INCLUDEPICTURE "AXH133.TIF" ,该物质与等物质的量的溴发生加成反应的产物(不考虑立体异构)理论上最多有3种
解析:选A。A.2-乙基-1-丁烯的结构简式为CH2==C(C2H5)2,故A正确;B.双键两端的碳原子和与之直接相连的碳原子处于同一平面,键角约是120°,不是直线结构,故B错误;C.1 mol乙炔完全燃烧消耗2.5 mol氧气,而1 mol苯完全燃烧消耗7.5 mol氧气,故等物质的量的乙炔和苯完全燃烧的耗氧量不同,故C错误;D.该分子中存在3个碳碳双键,且与溴按物质的量之比为1∶1反应时可以发生1,2-加成和1,4-加成,共有4种产物,故D错误。
12.乙炔是一种重要的化工原料,可发生如图的转化。下列说法错误的是( )
INCLUDEPICTURE "AXH134.TIF"
A.1个乙烯基乙炔分子中含有7个σ键,3个π键
B.正四面体烷的二氯代物有2种结构
C.苯乙烯()和环辛四烯互为同分异构体
D.等质量的苯和乙炔完全燃烧时消耗氧气的量相同
解析:选B。A.由乙烯基乙炔的结构简式可知,1个乙烯基乙炔分子中含有7个σ键,3个π键,故A正确;B.正四面体烷的结构对称,一氯代物只有1种,二氯代物也只有1种,故B错误;C.苯乙烯()和环辛四烯的分子式都是C8H8,结构不同,二者互为同分异构体,故C正确;D.苯与乙炔的最简式均为CH,所以等质量的苯与乙炔完全燃烧时的耗氧量相同,故D正确。
13.下列关于分子组成为CxHy的烷烃、烯烃、炔烃的说法不正确的是( )
A.当x≤4时,常温常压下均为气体
B.y一定为偶数
C.1 mol CxHy完全燃烧时,消耗氧气 (x+) mol
D.在密闭容器中完全燃烧,150 ℃时测得的压强一定比燃烧前增加
解析:选D。烷烃、烯烃、炔烃的物理性质具有一定的相似性,当x≤4时,常温常压下均为气体,A正确。烃分子中,氢原子数为偶数,B正确。根据CxHy的燃烧通式CxHy+(x+)O2xCO2+H2O(150 ℃时,水为气态),反应前后物质的量变化为x+-(1+x+)=-1,当y=4时,反应前后物质的量不变,压强不变,如CH4、C2H4;当y>4时,反应后物质的量增大,压强增大,如C2H6;当y<4时,反应后物质的量减小,压强减小,如C2H2,C正确、D不正确。
14.化合物 INCLUDEPICTURE "AXH135.TIF" (b)、 INCLUDEPICTURE "AXH136.TIF" (d)、CH≡C—CH==CH2(p)的分子式均为C4H4。下列说法正确的是( )
A.b的同分异构体只有d和p两种
B.只有b的所有原子处于同一平面
C.b、d、p均可与酸性高锰酸钾溶液反应
D.p分子中有3种不同化学环境的氢原子
解析:选D。A.b的同分异构体可为链状烃,也可为环状烃,故b的同分异构体不只有d和p,故A错误;B.p分子中含有碳碳双键和碳碳三键,碳碳双键为平面结构,碳碳三键为直线形结构,所有原子处于同一平面,故B错误;C.d为饱和烃,与酸性高锰酸钾溶液不反应,故C错误。
15.(2022·衡水高二阶段练习)某实验小组设计如图所示实验装置来制取乙炔,并粗略测定电石(含有N、P、S等元素)中碳化钙的质量分数。回答下列问题:
INCLUDEPICTURE "AXH137.TIF"
(1)a的作用是______________________________________________________。
(2)仪器b中发生反应的化学方程式为__________________________________,
实验过程中为了减缓水与电石的反应速率,可采取的措施是__________(写一条即可)。
(3)将生成的气体通入酸性KMnO4溶液中,观察到酸性KMnO4溶液褪色。
①________(填“能”或“不能”)说明生成的气体全部为乙炔,原因是____________________________________________________________。
②实验小组发现该实验不能用启普发生器来制取乙炔,理由是____________(写一条即可)。
(4)装置c中盛放的试剂为________________。
(5)为了安全,点燃乙炔前应____________,乙炔燃烧时的现象是________________________________________________________________。
(6)取m g电石样品,使其与水完全反应,实验结束后测得排入量筒中水的体积为V mL,则电石中碳化钙的质量分数为____________(用含V和m的代数式表示,忽略导管中残留的水和气体中含有的水蒸气,所有气体均已换算成标准状况下)。
解析:(1)a连通烧瓶和分液漏斗上口,维持瓶内气压稳定,使水顺利滴下。(2)仪器b中电石和水反应生成氢氧化钙和乙炔,化学方程式为CaC2+2H2O―→Ca(OH)2+C2H2↑,实验过程中,用饱和食盐水代替水可以减缓水与电石的反应速率。(3)①生成的气体中含有H2S和PH3,这两种气体也能使酸性高锰酸钾溶液褪色,故不能说明生成的气体全部为乙炔;②生成的Ca(OH)2呈糊状,易堵塞启普发生器的球形漏斗,所以不能用启普发生器来制取乙炔。(4)装置c的作用是除去乙炔中的H2S、PH3等气体杂质,盛放的试剂为CuSO4溶液。(5)乙炔是可燃性气体,点燃乙炔前应检验其纯度,乙炔燃烧时的现象是火焰明亮并伴有浓烈的黑烟。(6)设碳化钙的质量为x g。
CaC2+2H2O―→Ca(OH)2+C2H2↑
64 g 1 mol
x g mol
x=×64=;则电石中碳化钙的质量分数为g÷m g×100%=%。
答案:(1)维持瓶内气压稳定,使水顺利滴下
(2)CaC2+2H2O―→Ca(OH)2+C2H2↑ 用饱和食盐水代替水(答案合理即可)
(3)①不能 生成的气体中含有H2S和PH3,这两种气体也能使酸性高锰酸钾溶液褪色 ②生成的Ca(OH)2 呈糊状,易堵塞启普发生器的球形漏斗(合理即可) (4)CuSO4溶液 (5)检验其纯度 火焰明亮并伴有浓烈的黑烟 (6)%
