2.2溶液组成的定量研究同步练习(含答案) 2022-2023学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 2.2溶液组成的定量研究同步练习(含答案) 2022-2023学年上学期高一化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 626.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-27 11:20:30 | ||
图片预览


文档简介
2.2溶液组成的定量研究
(同步练习)
一、单选题
1.物质的量为a的CaCl2溶解在1molH2O中,测得溶液中Cl-与H2O的物质的量之比为1:10,则a为
A.0.05mol B.0.1mol C.0.5mol D.1mol
2.下列说法中,正确的是
A.33.6LCO2的物质的量为1.5 mol
B.34 gNH3物质的量为0.5 mol
C.500 mL 0.1 mol·L 1 MgCl2溶液中含有0.1 mol Cl-
D.1 mol NO2中含有的氧原子数约为6.02×1023
3.在物质的量浓度公式c=中,n是指( )
A.溶液的物质的量 B.溶质的物质的量
C.溶剂的物质的量 D.物质的量
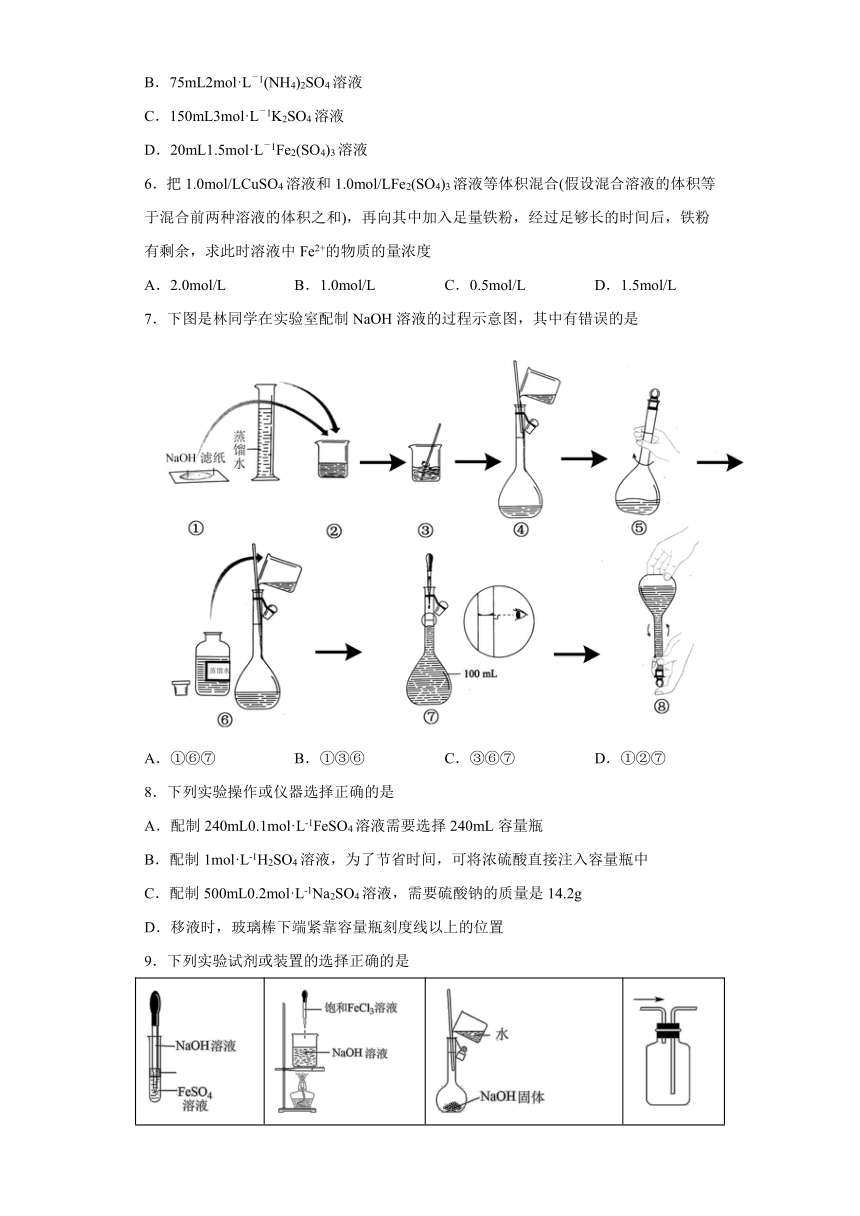
4.某同学欲用Na2CO3固体配制480mL 0.10mol/L Na2CO3溶液,过程如图所示。其中错误的操作有
A.①⑤ B.①⑥ C.②⑦ D.⑤⑥⑦
5.下列溶液中的c(SO42-)与50mL1mol·L-1Al2(SO4)3溶液中的c(SO42-)相等的是
A.150mL1mol·L-1Na2SO4溶液
B.75mL2mol·L-1(NH4)2SO4溶液
C.150mL3mol·L-1K2SO4溶液
D.20mL1.5mol·L-1Fe2(SO4)3溶液
6.把1.0mol/LCuSO4溶液和1.0mol/LFe2(SO4)3溶液等体积混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量铁粉,经过足够长的时间后,铁粉有剩余,求此时溶液中Fe2+的物质的量浓度
A.2.0mol/L B.1.0mol/L C.0.5mol/L D.1.5mol/L
7.下图是林同学在实验室配制NaOH溶液的过程示意图,其中有错误的是
A.①⑥⑦ B.①③⑥ C.③⑥⑦ D.①②⑦
8.下列实验操作或仪器选择正确的是
A.配制240mL0.1mol·L-1FeSO4溶液需要选择240mL容量瓶
B.配制1mol·L-1H2SO4溶液,为了节省时间,可将浓硫酸直接注入容量瓶中
C.配制500mL0.2mol·L-1Na2SO4溶液,需要硫酸钠的质量是14.2g
D.移液时,玻璃棒下端紧靠容量瓶刻度线以上的位置
9.下列实验试剂或装置的选择正确的是
A.制备 B.制备氢氧化铁胶体 C.配制溶液 D.收集氯气
A.A B.B C.C D.D
10.某同学在实验报告中记录下列数据,其中正确的是( )
A.用25 mL量筒量取12.36 mL盐酸
B.用托盘天平称量8.7 g食盐
C.用100 mL的量筒量取18.8 mL NaOH溶液
D.实验室常用的广泛pH试纸测得某溶液的pH为3.5
11.设NA为阿伏加德罗常数,下列说法正确的是
A.8g氦气含有分子数为NA
B.0.1mol/L的硫酸铝溶液中含数目为0.3NA
C.在标准状况下,22.4LH2SO4所含的氧原子数为4NA
D.1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
12.在一定物质的量浓度溶液的配制实验中,下列说法正确的是
A.溶解过程中需要准确计算水的用量
B.该实验中玻璃棒只有一个作用
C.已配制好的溶液应在容量瓶中久贮
D.定容时,加水超过刻度线会导致所配制溶液浓度偏低
13.下列有关实验原理或实验操作正确的是
A.用pH试纸测量新制氯水的pH
B.实验室用如图所示装置制饱和氯水
C.利用丁达尔效应鉴别淀粉胶体和NaCl溶液
D.用量筒量取20 mL 0.5000 mol·L-1H2SO4溶液于烧杯中,加水80 mL,配制成0.1000 mol·L-1H2SO4溶液
14.设为阿伏加德罗常数的值。下列说法正确的是。
A.和混合气体中,所含氧原子数目为0.1
B.溶液中,所含数目为3
C.标准状况下,乙醇中所含氢原子数目为3
D.与足量溶液反应,转移电子数目为2
15.设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22gCO2与11.2 L H2O含有相同的原子数
B.1.8 g D2O含有的电子数为0.1NA
C.常温常压下,3.2 g氧气所含的分子数是0.1NA
D.0.5 mol·L-1 K2SO4溶液中含有的钾离子数是NA
二、填空题
16.在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为_________,___________,_____________。
17.配制0.25mol·L-1的NaOH溶液100mL,某学生操作如下:
①用托盘天平称出1.00g氢氧化钠:将天平调好零点,再在两盘上各取一张同样质量的纸,把游码调到1.00g的位置上,于左盘放粒状氢氧化钠至天平平衡,取下称好的氢氧化钠,并撤掉两盘上的纸。
②把称好的氢氧化钠放入一只100mL的烧杯中,加入约10mL水,搅拌使之溶解,溶解后立即用玻璃棒引流将溶液移至一只100mL的容量瓶内,加水至离刻度线约2cm处,用滴管加水至刻度线。
③写出一个标有配制日期的“0.25mol·L-1NaOH溶液”的标签,贴在容量瓶上密闭保存。指出上述操作中的7处错误:
(1)__________________________;(2)_________________________
(3)__________________________;(4)_________________________
(5)__________________________;(6)_________________________
(7)__________________________
18.新冠肺炎疫情期间,“84消毒液被广泛应用于物体表面杀菌消毒。嘉兴某学校高一化学兴趣小组的同学参阅84消毒液”的配方,欲用次氯酸钠固体配制500mL 0.2mol/L的次氯酸钠消毒液。
(1)配制上述溶液需要的玻璃仪器有量筒、烧杯、玻璃棒、500mL容量瓶、_______;
(2)需要用托盘天平称量NaClO固体的质量为_______g。
(3)该小组的同学查阅资料得知“洁厕灵”(主要成分是稀盐酸)与“84消毒液”(主要成分是NaClO)混合可以得到氯气,请用离子方程式解释原因_______。
(4)该小组的同学查阅资料又得知:“84消毒液”与稀硫酸混合使用可增强消毒能力,于是他们准备用浓硫酸配制稀硫酸用于增强“84消毒液”的消毒能力。
①在配制过程中,将烧杯中的溶液注入容量瓶后,要用少量蒸馏水_______2-3次。
②若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是_______。
A.配制前,容量瓶中有少量蒸馏水 B.往容量瓶转移时,有少量液体溅出
C.未冷却,立即转移至容量瓶定容 D.定容时,仰视溶液的凹液面
19.如图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是_____(填操作序号)。
①→②→③→④→⑤→⑥
20.你参加了化学社团,老师让用密度为,质量分数为的浓盐酸配制的盐酸,第二天做实验要用。请回答下列问题。
(1)应量取浓盐酸的体积_______mL。
(2)需要用到的仪器有:量筒、烧杯、玻璃棒、_______。
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次) ___。
A.用水洗涤烧杯内壁和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约)稀释,用玻璃棒慢慢搅拌,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀。
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线处
(4)若你在实验中遇到下列情况,会使所配制盐酸的物质的量浓度偏高的有______________。
①用于稀释盐酸的烧杯未洗涤;
②容量瓶中原有少量蒸馏水;
③定容时俯视观察液面;
④定容后经振荡、摇匀,发现液面下降,再加水重新定容;
⑤量取浓盐酸时俯视液面;
⑥浓盐酸稀释后未冷却就直接转移至容量瓶中;
⑦量取浓盐酸后,用蒸馏水洗涤量筒并转移至容量瓶中。
(5)取任意体积的该盐酸时,下列物理量中不随所取体积多少而变化的是:______(填字母)。
A.溶液的浓度 B.溶液中HCl的物质的量
C.溶液中的数目 D.溶液的密度
三、实验题
21.实验室用2.0 mol/L NaCl溶液配制100mL 0.10 mol/L NaCl溶液。
(1)计算:配制上述溶液,需要2.0 mol/L NaCl溶液_____________mL;
(2)称量:用量筒正确量取所需溶液;
(3)溶解:所需仪器是_____________、_____________;
(4)转移:将烧杯中的溶液沿着玻璃棒小心引流到___________________中;
(5)洗涤:将烧杯和玻璃棒洗涤2~3次并将洗涤液也都注入容量瓶中;
(6)定容:往容量瓶中加蒸馏水至距刻度线_________cm处,改用__________________加蒸馏水至液面与刻度线相切。盖好瓶塞摇匀;
(7)配制过程中出现以下情况,对所配溶液浓度有何影响(填偏高、偏低、不变):
①没有洗涤烧杯和玻璃棒_____________;
②量取2.0 mol/L NaCl溶液时俯视量筒的刻度线_____________。
参考答案:
1.A2.C3.B4.B5.C6.A7.A8.C9.A10.B11.D12.D13.C14.A15.C
16. 0.64mol 0.02mol 0.24mol
17. NaOH应放在干燥的烧杯中称量 用过的游码未拨回原处 托盘天平只能称出0.1~0.2g,称不出1.00g 烧杯和玻璃棒未洗涤,洗涤液亦应转入容量瓶 溶解NaOH应冷却后再转移至容量瓶中 容量瓶中的溶液未摇匀 配好的溶液应及时转移到有胶塞的试剂瓶内
18.(1)胶头滴管
(2)7.5
(3)
(4) 洗涤烧杯和玻璃棒 BD
19.①③⑤
20.(1)2mL
(2)250mL容量瓶、胶头滴管
(3)BCAFED
(4)③⑥⑦
(5)AD
21. 5.0 烧杯 玻璃棒 100mL容量瓶 1~2 胶头滴管 偏低 偏低
(同步练习)
一、单选题
1.物质的量为a的CaCl2溶解在1molH2O中,测得溶液中Cl-与H2O的物质的量之比为1:10,则a为
A.0.05mol B.0.1mol C.0.5mol D.1mol
2.下列说法中,正确的是
A.33.6LCO2的物质的量为1.5 mol
B.34 gNH3物质的量为0.5 mol
C.500 mL 0.1 mol·L 1 MgCl2溶液中含有0.1 mol Cl-
D.1 mol NO2中含有的氧原子数约为6.02×1023
3.在物质的量浓度公式c=中,n是指( )
A.溶液的物质的量 B.溶质的物质的量
C.溶剂的物质的量 D.物质的量
4.某同学欲用Na2CO3固体配制480mL 0.10mol/L Na2CO3溶液,过程如图所示。其中错误的操作有
A.①⑤ B.①⑥ C.②⑦ D.⑤⑥⑦
5.下列溶液中的c(SO42-)与50mL1mol·L-1Al2(SO4)3溶液中的c(SO42-)相等的是
A.150mL1mol·L-1Na2SO4溶液
B.75mL2mol·L-1(NH4)2SO4溶液
C.150mL3mol·L-1K2SO4溶液
D.20mL1.5mol·L-1Fe2(SO4)3溶液
6.把1.0mol/LCuSO4溶液和1.0mol/LFe2(SO4)3溶液等体积混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量铁粉,经过足够长的时间后,铁粉有剩余,求此时溶液中Fe2+的物质的量浓度
A.2.0mol/L B.1.0mol/L C.0.5mol/L D.1.5mol/L
7.下图是林同学在实验室配制NaOH溶液的过程示意图,其中有错误的是
A.①⑥⑦ B.①③⑥ C.③⑥⑦ D.①②⑦
8.下列实验操作或仪器选择正确的是
A.配制240mL0.1mol·L-1FeSO4溶液需要选择240mL容量瓶
B.配制1mol·L-1H2SO4溶液,为了节省时间,可将浓硫酸直接注入容量瓶中
C.配制500mL0.2mol·L-1Na2SO4溶液,需要硫酸钠的质量是14.2g
D.移液时,玻璃棒下端紧靠容量瓶刻度线以上的位置
9.下列实验试剂或装置的选择正确的是
A.制备 B.制备氢氧化铁胶体 C.配制溶液 D.收集氯气
A.A B.B C.C D.D
10.某同学在实验报告中记录下列数据,其中正确的是( )
A.用25 mL量筒量取12.36 mL盐酸
B.用托盘天平称量8.7 g食盐
C.用100 mL的量筒量取18.8 mL NaOH溶液
D.实验室常用的广泛pH试纸测得某溶液的pH为3.5
11.设NA为阿伏加德罗常数,下列说法正确的是
A.8g氦气含有分子数为NA
B.0.1mol/L的硫酸铝溶液中含数目为0.3NA
C.在标准状况下,22.4LH2SO4所含的氧原子数为4NA
D.1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
12.在一定物质的量浓度溶液的配制实验中,下列说法正确的是
A.溶解过程中需要准确计算水的用量
B.该实验中玻璃棒只有一个作用
C.已配制好的溶液应在容量瓶中久贮
D.定容时,加水超过刻度线会导致所配制溶液浓度偏低
13.下列有关实验原理或实验操作正确的是
A.用pH试纸测量新制氯水的pH
B.实验室用如图所示装置制饱和氯水
C.利用丁达尔效应鉴别淀粉胶体和NaCl溶液
D.用量筒量取20 mL 0.5000 mol·L-1H2SO4溶液于烧杯中,加水80 mL,配制成0.1000 mol·L-1H2SO4溶液
14.设为阿伏加德罗常数的值。下列说法正确的是。
A.和混合气体中,所含氧原子数目为0.1
B.溶液中,所含数目为3
C.标准状况下,乙醇中所含氢原子数目为3
D.与足量溶液反应,转移电子数目为2
15.设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22gCO2与11.2 L H2O含有相同的原子数
B.1.8 g D2O含有的电子数为0.1NA
C.常温常压下,3.2 g氧气所含的分子数是0.1NA
D.0.5 mol·L-1 K2SO4溶液中含有的钾离子数是NA
二、填空题
16.在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为_________,___________,_____________。
17.配制0.25mol·L-1的NaOH溶液100mL,某学生操作如下:
①用托盘天平称出1.00g氢氧化钠:将天平调好零点,再在两盘上各取一张同样质量的纸,把游码调到1.00g的位置上,于左盘放粒状氢氧化钠至天平平衡,取下称好的氢氧化钠,并撤掉两盘上的纸。
②把称好的氢氧化钠放入一只100mL的烧杯中,加入约10mL水,搅拌使之溶解,溶解后立即用玻璃棒引流将溶液移至一只100mL的容量瓶内,加水至离刻度线约2cm处,用滴管加水至刻度线。
③写出一个标有配制日期的“0.25mol·L-1NaOH溶液”的标签,贴在容量瓶上密闭保存。指出上述操作中的7处错误:
(1)__________________________;(2)_________________________
(3)__________________________;(4)_________________________
(5)__________________________;(6)_________________________
(7)__________________________
18.新冠肺炎疫情期间,“84消毒液被广泛应用于物体表面杀菌消毒。嘉兴某学校高一化学兴趣小组的同学参阅84消毒液”的配方,欲用次氯酸钠固体配制500mL 0.2mol/L的次氯酸钠消毒液。
(1)配制上述溶液需要的玻璃仪器有量筒、烧杯、玻璃棒、500mL容量瓶、_______;
(2)需要用托盘天平称量NaClO固体的质量为_______g。
(3)该小组的同学查阅资料得知“洁厕灵”(主要成分是稀盐酸)与“84消毒液”(主要成分是NaClO)混合可以得到氯气,请用离子方程式解释原因_______。
(4)该小组的同学查阅资料又得知:“84消毒液”与稀硫酸混合使用可增强消毒能力,于是他们准备用浓硫酸配制稀硫酸用于增强“84消毒液”的消毒能力。
①在配制过程中,将烧杯中的溶液注入容量瓶后,要用少量蒸馏水_______2-3次。
②若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是_______。
A.配制前,容量瓶中有少量蒸馏水 B.往容量瓶转移时,有少量液体溅出
C.未冷却,立即转移至容量瓶定容 D.定容时,仰视溶液的凹液面
19.如图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是_____(填操作序号)。
①→②→③→④→⑤→⑥
20.你参加了化学社团,老师让用密度为,质量分数为的浓盐酸配制的盐酸,第二天做实验要用。请回答下列问题。
(1)应量取浓盐酸的体积_______mL。
(2)需要用到的仪器有:量筒、烧杯、玻璃棒、_______。
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次) ___。
A.用水洗涤烧杯内壁和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约)稀释,用玻璃棒慢慢搅拌,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀。
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线处
(4)若你在实验中遇到下列情况,会使所配制盐酸的物质的量浓度偏高的有______________。
①用于稀释盐酸的烧杯未洗涤;
②容量瓶中原有少量蒸馏水;
③定容时俯视观察液面;
④定容后经振荡、摇匀,发现液面下降,再加水重新定容;
⑤量取浓盐酸时俯视液面;
⑥浓盐酸稀释后未冷却就直接转移至容量瓶中;
⑦量取浓盐酸后,用蒸馏水洗涤量筒并转移至容量瓶中。
(5)取任意体积的该盐酸时,下列物理量中不随所取体积多少而变化的是:______(填字母)。
A.溶液的浓度 B.溶液中HCl的物质的量
C.溶液中的数目 D.溶液的密度
三、实验题
21.实验室用2.0 mol/L NaCl溶液配制100mL 0.10 mol/L NaCl溶液。
(1)计算:配制上述溶液,需要2.0 mol/L NaCl溶液_____________mL;
(2)称量:用量筒正确量取所需溶液;
(3)溶解:所需仪器是_____________、_____________;
(4)转移:将烧杯中的溶液沿着玻璃棒小心引流到___________________中;
(5)洗涤:将烧杯和玻璃棒洗涤2~3次并将洗涤液也都注入容量瓶中;
(6)定容:往容量瓶中加蒸馏水至距刻度线_________cm处,改用__________________加蒸馏水至液面与刻度线相切。盖好瓶塞摇匀;
(7)配制过程中出现以下情况,对所配溶液浓度有何影响(填偏高、偏低、不变):
①没有洗涤烧杯和玻璃棒_____________;
②量取2.0 mol/L NaCl溶液时俯视量筒的刻度线_____________。
参考答案:
1.A2.C3.B4.B5.C6.A7.A8.C9.A10.B11.D12.D13.C14.A15.C
16. 0.64mol 0.02mol 0.24mol
17. NaOH应放在干燥的烧杯中称量 用过的游码未拨回原处 托盘天平只能称出0.1~0.2g,称不出1.00g 烧杯和玻璃棒未洗涤,洗涤液亦应转入容量瓶 溶解NaOH应冷却后再转移至容量瓶中 容量瓶中的溶液未摇匀 配好的溶液应及时转移到有胶塞的试剂瓶内
18.(1)胶头滴管
(2)7.5
(3)
(4) 洗涤烧杯和玻璃棒 BD
19.①③⑤
20.(1)2mL
(2)250mL容量瓶、胶头滴管
(3)BCAFED
(4)③⑥⑦
(5)AD
21. 5.0 烧杯 玻璃棒 100mL容量瓶 1~2 胶头滴管 偏低 偏低
