3.3.2乙酸(教学课件)(共19张PPT)—2022-2023学年高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 3.3.2乙酸(教学课件)(共19张PPT)—2022-2023学年高一化学鲁科版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-27 11:10:23 | ||
图片预览






文档简介
(共19张PPT)
第3章 简单的有机化合物
第3节 饮食中有机化合物
第2课时 乙酸
【核心素养目标】
【重难点】
1. 了解乙酸的物理性质,体会乙酸与日常生活的紧密联系以及研究有机化合物的价值
2.认识乙酸的分子结构,能正确书写乙酸的结构式、结构简式及其官能团
3.掌握乙酸的化学性质 ,能理解酯化反应的原理和实验操作
乙酸的化学性质
人类食用醋的历史非常悠久,有人认为有 10 000 多年。有关醋的文字记载的历史,至少也有 3 000年。醋和食盐一样,属于最古老的调味品。
我国在数千年前已经掌握了谷物酿醋的技术。公元 1058 年周公所著《周礼》一书就有关于酿醋的记载,春秋战国时代已出现专门的酿醋作坊。《齐民要术·作酢法》:“酢,今醋也。”我国古代称醋为酢、酐、苦酒或醯,《齐民要术》中有详细酿醋过程的记载
自主学习 阅读课本P106页内容,观察所给的乙酸试剂和模型,总结归纳乙酸的物理性质和结构特点
颜色:
气味:
状态:
熔沸点:
溶解性:
密度:
无色
强烈刺激性气味
液体
20 ℃ 时1.05 g·cm-3
117.9 ℃, 16.6 ℃
易溶于水
挥发性:
易挥发
普通食醋中含乙酸 3% ~ 5%(质量分数)
归纳总结
一、乙酸的物理性质
当温度低于16.6℃时,乙酸就凝结成像冰一样的晶体,所以无水乙酸又称冰醋酸。
归纳总结
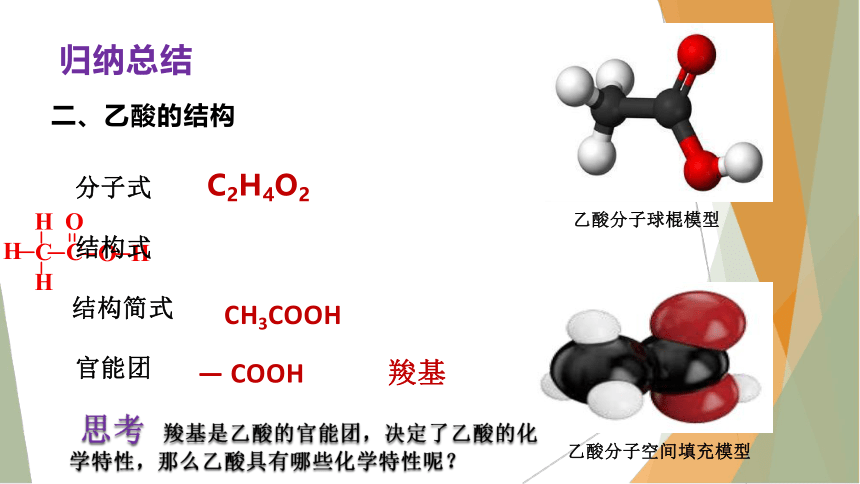
二、乙酸的结构
乙酸分子空间填充模型
乙酸分子球棍模型
分子式
结构式
结构简式
官能团
C2H4O2
CH3COOH
— COOH
羧基
思考 羧基是乙酸的官能团,决定了乙酸的化学特性,那么乙酸具有哪些化学特性呢?
三、乙酸的化学性质 活动 探究(课本P106页)
【活动1】 乙酸的酸性
乙酸在溶于水时能够电离出 CH3COO - 和 H+ ,因而乙酸具有一定的酸性。请小组内合作设计几个实验证明乙酸具有酸性。完成下面表格
实验内容 实验现象 反应的化学方程式
结合所学物质性质,思考总结酸一般具有哪些性质?
酸的性质
使指示剂变色
与活泼金属反应生成氢气
与金属氧化物反应
与碱发生中和反应
与某些盐反应
联想质疑
实现内容 实验现象 反应的化学方程式
实验方案的设计与实施
向试管中加入约 2 mL 乙酸溶液,然后滴入数滴紫色石蕊试液,观察颜色变化
向试管中加入适量锌粒,然后加入约 2 mL冰醋酸溶液
向试管中加入适量碳酸钙,然后加入约 2 mL冰醋酸溶液
向试管中加入约 2 mL NaOH溶液,滴入数滴酚酞溶液,然后逐滴滴加乙酸溶液,观察颜色变化
溶液变红
溶液中有气泡生成
碳酸钙溶解,有大量气泡生成
溶液由红色逐渐变为无色
Zn+2CH3COOH Zn(CH3COO)2+H2↑
CaCO3+2CH3COOH Ca(CH3COO)2+CO2↑+H2O
NaOH+CH3COOH
CH3COONa+H2O
归纳总结
乙酸是一种有机酸,具有酸的一般性质:
(1)与指示剂发生显色反应,使紫色的石蕊溶液变红
(2)与活泼金属反应,生成氢气
(3)和碳酸盐反应生成二氧化碳,酸性比碳酸强
(4)和碱反应生成盐和水
(5)和碱性氧化物反应生成盐和水
CaCO3+2CH3COOH Ca(CH3COO)2+CO2↑+H2O
Zn+2CH3COOH Zn(CH3COO)2+H2↑
Na2O+2CH3COOH 2CH3COONa+H2O
NaOH+CH3COOH CH3COONa+H2O
联想质疑
厨师在烧鱼时,常加入适量的醋和酒,这样做出来鱼的味道就变得无腥、香醇,味道鲜美。你知道原因是什么吗?乙醇和乙酸能否发生反应?产物是什么?
【活动2】 乙酸与乙醇的反应
在试管中加入无水乙醇、浓硫酸、冰醋酸的混合物,再加入2~3块碎瓷片。按下图所示连接装置,用酒精灯小心均匀地加热试管,将产生的气体经导管通到饱和Na2CO3 溶液的液面上。观察发生的现象,闻一闻生成物的气味。
归纳总结
实验现象:
实验结论:
反应方程式:
饱和Na2CO3溶液的液面上有透明的油状液体生成,
且能闻到香味
CH3COOH+CH3CH2OH CH3COOC2H5+H2O
乙醇和乙酸在浓硫酸的作用下生成了一种不易溶于水的,具有香味的物质
乙酸乙酯,是一种无色透明、有香味的油状液体
交流研讨
1.反应中浓硫酸的作用是什么?碎瓷片的作用是什么?
2.为什么反应物都必须是无水液体?
3.为什么要用饱和 Na2 CO 3 溶液吸收产物?
4.为什么导气管不能伸入饱和 Na 2 CO3 溶液中?
催化剂、吸水剂
防止倒吸
中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度,利于分层
有利于乙酸乙酯的生成,提高产率
防止暴沸
导气
冷凝回流
定义:
酯化反应
特点:
反应原理:
酸和醇反应,生成酯和水的反应
可逆反应,且比较缓慢
酸脱羟基,醇脱氢(羟基上的)
ch3—c—o—h + h—o—ch2ch3 ch3coch2ch3 + h2o
o
||
o
||
取代反应
试一试:请试着写出乙酸和甲醇反应的化学方程式
CH3COOCH3 + H2O
CH3COOH + HOCH3
浓H2SO4
迁移 应用
1. 向结有水垢[主要成分是 CaCO3 和 Mg(OH)2 ]的壶里或暖瓶里加入少量食醋(最好是醋酸),浸泡一段时间后,再用水清洗,水垢便可除去。请写出相关反应的化学方程式。
2. 用粮食酿制的酒中,除了含有乙醇,通常还含有少量乙酸等物质。由粮食酿造的酒会随着储藏时间的延长而变得更醇香,请分析其中可能的原因。
CaCO3 + 2CH3 COOH→(CH3 COO) 2 Ca + CO2↑ +H2O
Mg(OH) 2 + 2CH3 COOH→(CH3 COO)2 Mg + 2H2O
长时间的储藏乙醇和少量的乙酸反应,生成具有香味的乙酸乙酯
四、乙酸的用途 课本P106页
乙酸是一种重要的化学试剂,也是制药、染料、农药工业的重要原料,还可用于制造电影胶片所需要的醋酸纤维素和木材用胶黏剂中的聚乙酸乙烯酯以及很多合成纤维。
例 “酒是陈的香”是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室和工业上常采用如图所示装置来制取乙酸乙酯。
(1)写出装置中制取乙酸乙酯的化学方程式
。
(2)装置中通蒸气的导管要置于饱和碳酸钠溶液液面上,
而不能插入液面以下,目的是防止 。
(3)实验制取的乙酸乙酯,可用 方法分离乙酸乙酯
与饱和碳酸钠溶液,请用文字说明使用这种方法的理由: 。
(4)实验时,试管Ⅱ观察到的现象是界面处呈浅红色,下层为蓝色,振荡后产生气泡,界面处浅红色消失,原因是(用化学方程式表示) 。
CH3COOH + HOC2H5 CH3COOC2H5+H2O
浓H2SO4
△
倒吸
分液
乙酸乙酯不溶于饱和碳酸钠溶液,溶液分层
Na2CO3+2CH3COOH
2CH3COONa+CO2↑+H2O
滴有石蕊的饱和Na2CO3溶液
课堂小结
乙酸
结构
性质
用途
物
理
性
质
化
学
性
质
(1)酸性(比碳酸强)
(2)酯化反应
羧基—COOH
与指示剂发生反应,与碱反应、与活泼金属反应、与金属氧化物反应、与某些盐反应
CH3COOH+CH3CH2OH CH3COOC2H5+H2O
第3章 简单的有机化合物
第3节 饮食中有机化合物
第2课时 乙酸
【核心素养目标】
【重难点】
1. 了解乙酸的物理性质,体会乙酸与日常生活的紧密联系以及研究有机化合物的价值
2.认识乙酸的分子结构,能正确书写乙酸的结构式、结构简式及其官能团
3.掌握乙酸的化学性质 ,能理解酯化反应的原理和实验操作
乙酸的化学性质
人类食用醋的历史非常悠久,有人认为有 10 000 多年。有关醋的文字记载的历史,至少也有 3 000年。醋和食盐一样,属于最古老的调味品。
我国在数千年前已经掌握了谷物酿醋的技术。公元 1058 年周公所著《周礼》一书就有关于酿醋的记载,春秋战国时代已出现专门的酿醋作坊。《齐民要术·作酢法》:“酢,今醋也。”我国古代称醋为酢、酐、苦酒或醯,《齐民要术》中有详细酿醋过程的记载
自主学习 阅读课本P106页内容,观察所给的乙酸试剂和模型,总结归纳乙酸的物理性质和结构特点
颜色:
气味:
状态:
熔沸点:
溶解性:
密度:
无色
强烈刺激性气味
液体
20 ℃ 时1.05 g·cm-3
117.9 ℃, 16.6 ℃
易溶于水
挥发性:
易挥发
普通食醋中含乙酸 3% ~ 5%(质量分数)
归纳总结
一、乙酸的物理性质
当温度低于16.6℃时,乙酸就凝结成像冰一样的晶体,所以无水乙酸又称冰醋酸。
归纳总结
二、乙酸的结构
乙酸分子空间填充模型
乙酸分子球棍模型
分子式
结构式
结构简式
官能团
C2H4O2
CH3COOH
— COOH
羧基
思考 羧基是乙酸的官能团,决定了乙酸的化学特性,那么乙酸具有哪些化学特性呢?
三、乙酸的化学性质 活动 探究(课本P106页)
【活动1】 乙酸的酸性
乙酸在溶于水时能够电离出 CH3COO - 和 H+ ,因而乙酸具有一定的酸性。请小组内合作设计几个实验证明乙酸具有酸性。完成下面表格
实验内容 实验现象 反应的化学方程式
结合所学物质性质,思考总结酸一般具有哪些性质?
酸的性质
使指示剂变色
与活泼金属反应生成氢气
与金属氧化物反应
与碱发生中和反应
与某些盐反应
联想质疑
实现内容 实验现象 反应的化学方程式
实验方案的设计与实施
向试管中加入约 2 mL 乙酸溶液,然后滴入数滴紫色石蕊试液,观察颜色变化
向试管中加入适量锌粒,然后加入约 2 mL冰醋酸溶液
向试管中加入适量碳酸钙,然后加入约 2 mL冰醋酸溶液
向试管中加入约 2 mL NaOH溶液,滴入数滴酚酞溶液,然后逐滴滴加乙酸溶液,观察颜色变化
溶液变红
溶液中有气泡生成
碳酸钙溶解,有大量气泡生成
溶液由红色逐渐变为无色
Zn+2CH3COOH Zn(CH3COO)2+H2↑
CaCO3+2CH3COOH Ca(CH3COO)2+CO2↑+H2O
NaOH+CH3COOH
CH3COONa+H2O
归纳总结
乙酸是一种有机酸,具有酸的一般性质:
(1)与指示剂发生显色反应,使紫色的石蕊溶液变红
(2)与活泼金属反应,生成氢气
(3)和碳酸盐反应生成二氧化碳,酸性比碳酸强
(4)和碱反应生成盐和水
(5)和碱性氧化物反应生成盐和水
CaCO3+2CH3COOH Ca(CH3COO)2+CO2↑+H2O
Zn+2CH3COOH Zn(CH3COO)2+H2↑
Na2O+2CH3COOH 2CH3COONa+H2O
NaOH+CH3COOH CH3COONa+H2O
联想质疑
厨师在烧鱼时,常加入适量的醋和酒,这样做出来鱼的味道就变得无腥、香醇,味道鲜美。你知道原因是什么吗?乙醇和乙酸能否发生反应?产物是什么?
【活动2】 乙酸与乙醇的反应
在试管中加入无水乙醇、浓硫酸、冰醋酸的混合物,再加入2~3块碎瓷片。按下图所示连接装置,用酒精灯小心均匀地加热试管,将产生的气体经导管通到饱和Na2CO3 溶液的液面上。观察发生的现象,闻一闻生成物的气味。
归纳总结
实验现象:
实验结论:
反应方程式:
饱和Na2CO3溶液的液面上有透明的油状液体生成,
且能闻到香味
CH3COOH+CH3CH2OH CH3COOC2H5+H2O
乙醇和乙酸在浓硫酸的作用下生成了一种不易溶于水的,具有香味的物质
乙酸乙酯,是一种无色透明、有香味的油状液体
交流研讨
1.反应中浓硫酸的作用是什么?碎瓷片的作用是什么?
2.为什么反应物都必须是无水液体?
3.为什么要用饱和 Na2 CO 3 溶液吸收产物?
4.为什么导气管不能伸入饱和 Na 2 CO3 溶液中?
催化剂、吸水剂
防止倒吸
中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度,利于分层
有利于乙酸乙酯的生成,提高产率
防止暴沸
导气
冷凝回流
定义:
酯化反应
特点:
反应原理:
酸和醇反应,生成酯和水的反应
可逆反应,且比较缓慢
酸脱羟基,醇脱氢(羟基上的)
ch3—c—o—h + h—o—ch2ch3 ch3coch2ch3 + h2o
o
||
o
||
取代反应
试一试:请试着写出乙酸和甲醇反应的化学方程式
CH3COOCH3 + H2O
CH3COOH + HOCH3
浓H2SO4
迁移 应用
1. 向结有水垢[主要成分是 CaCO3 和 Mg(OH)2 ]的壶里或暖瓶里加入少量食醋(最好是醋酸),浸泡一段时间后,再用水清洗,水垢便可除去。请写出相关反应的化学方程式。
2. 用粮食酿制的酒中,除了含有乙醇,通常还含有少量乙酸等物质。由粮食酿造的酒会随着储藏时间的延长而变得更醇香,请分析其中可能的原因。
CaCO3 + 2CH3 COOH→(CH3 COO) 2 Ca + CO2↑ +H2O
Mg(OH) 2 + 2CH3 COOH→(CH3 COO)2 Mg + 2H2O
长时间的储藏乙醇和少量的乙酸反应,生成具有香味的乙酸乙酯
四、乙酸的用途 课本P106页
乙酸是一种重要的化学试剂,也是制药、染料、农药工业的重要原料,还可用于制造电影胶片所需要的醋酸纤维素和木材用胶黏剂中的聚乙酸乙烯酯以及很多合成纤维。
例 “酒是陈的香”是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室和工业上常采用如图所示装置来制取乙酸乙酯。
(1)写出装置中制取乙酸乙酯的化学方程式
。
(2)装置中通蒸气的导管要置于饱和碳酸钠溶液液面上,
而不能插入液面以下,目的是防止 。
(3)实验制取的乙酸乙酯,可用 方法分离乙酸乙酯
与饱和碳酸钠溶液,请用文字说明使用这种方法的理由: 。
(4)实验时,试管Ⅱ观察到的现象是界面处呈浅红色,下层为蓝色,振荡后产生气泡,界面处浅红色消失,原因是(用化学方程式表示) 。
CH3COOH + HOC2H5 CH3COOC2H5+H2O
浓H2SO4
△
倒吸
分液
乙酸乙酯不溶于饱和碳酸钠溶液,溶液分层
Na2CO3+2CH3COOH
2CH3COONa+CO2↑+H2O
滴有石蕊的饱和Na2CO3溶液
课堂小结
乙酸
结构
性质
用途
物
理
性
质
化
学
性
质
(1)酸性(比碳酸强)
(2)酯化反应
羧基—COOH
与指示剂发生反应,与碱反应、与活泼金属反应、与金属氧化物反应、与某些盐反应
CH3COOH+CH3CH2OH CH3COOC2H5+H2O
