3.3.1乙醇(教学课件)(共21张PPT)—2022-2023学年高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 3.3.1乙醇(教学课件)(共21张PPT)—2022-2023学年高一化学鲁科版(2019)必修第二册 |  | |
| 格式 | ppt | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-27 11:11:07 | ||
图片预览






文档简介
(共21张PPT)
第3章 简单的有机化合物
第3节 饮食中的有机化合物
第1课时 乙醇
【核心素养目标】
1.了解乙醇的结构和物理性质
2.能描述乙醇的主要化学性质及相应性质实验的现象,能书写相关的反应式,能利用这些物质的主要性质进行鉴别
3.了解乙醇的用途以及在人体内的转化过程
【重难点】
乙醇的结构和化学性质
颜色状态:
气味:
密度:
溶解性:
挥发性:
熔沸点:
一、 乙醇的物理性质
有特殊香味
无色液体
比水小
熔沸点较低(沸点:78.5℃,
熔点:-117.3℃)
能跟水以任意比例互溶,能溶解多种有机物和无机物
易挥发
(需密封保存!)
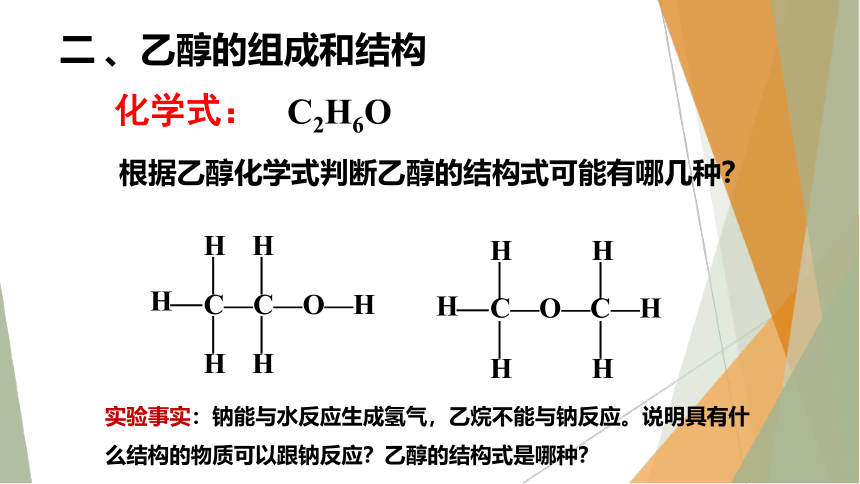
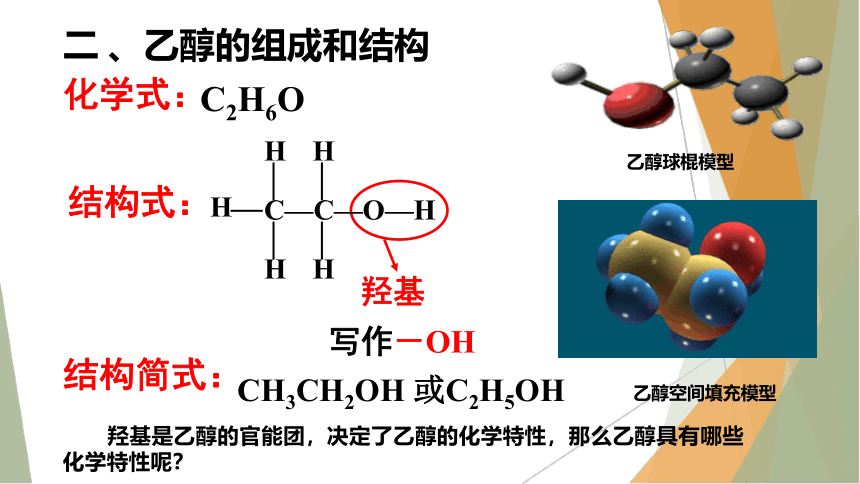
二 、乙醇的组成和结构
化学式:
C2H6O
根据乙醇化学式判断乙醇的结构式可能有哪几种?
C—C—O—H
H
H
H
H
H
C—O—C—H
H
H
H
H
H
实验事实:钠能与水反应生成氢气,乙烷不能与钠反应。说明具有什么结构的物质可以跟钠反应?乙醇的结构式是哪种?
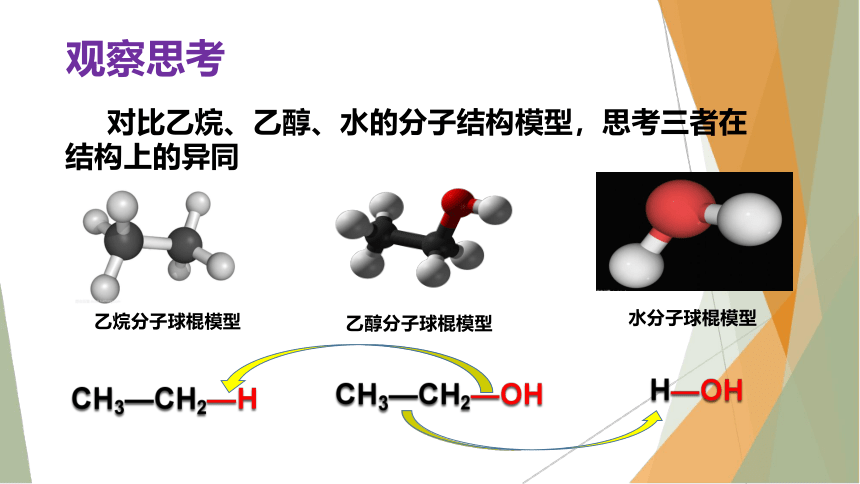
对比乙烷、乙醇、水的分子结构模型,思考三者在结构上的异同
乙烷分子球棍模型
乙醇分子球棍模型
水分子球棍模型
CH3—CH2—H
CH3—CH2—OH
H—OH
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH 或C2H5OH
羟基
写作-OH
结构简式:
化学式:
C2H6O
二 、乙醇的组成和结构
羟基是乙醇的官能团,决定了乙醇的化学特性,那么乙醇具有哪些化学特性呢?
乙醇空间填充模型
乙醇球棍模型
实验1:向烧杯中加入约2mL的无水乙醇,点燃,观察现象
铜丝在空气中加热由红变黑,插入乙醇溶液中,溶液沸腾,铜丝表面有黑变红,试管中的液体有刺激性气味
2CH3CH2OH+O2 2CH3CHO+2H2O
铜做催化剂,乙醇可以被氧化为有刺激性气味的液体
整个反应过程中铜的作用是什么?
实验2:向试管中加入约2mL的无水乙醇,取一根光亮的铜丝绕成螺旋状,置于酒精灯外焰上加热,然后伸入无水乙醇中,反复几次。
黑色→红色
2Cu + O2 === 2CuO
H O-H
│ │
H-C-C-H
│ │
H H
CuO
+
Cu
+
H2O
△
+
H O
│
H-C-C-H
│
H
乙醛 刺激性气味
红色→黑色
2Cu +O2 ==== 2CuO
△
(1)
(1) + (2) ×2 并整理:
2CH3CH2OH + O2
2CH3CHO + 2 H2O
Cu
△
(2)
+ CuO
+ Cu
+ H2O
△
CH3CH2OH
CH3CHO
实验3:向试管中加入约2mL的酸性高锰酸钾溶液,滴入数滴无水乙醇,震荡,观察现象。
紫色酸性高锰酸钾溶液褪色
乙醇能被酸性高锰酸钾强氧化剂氧化
结论:
CH3CH2OH→CH3COOH
实验4:向试管中加入约2mL的无水乙醇,再放入一小块金属钠,观察现象,检验生成的气体。
钠沉到乙醇底部,缓慢反应,有无色气泡冒出,最终消失
乙醇能和活泼金属反应,生成氢气
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
联想质疑:
联想钠和水反应的现象,对比乙醇和钠反应的现象,分析二者有何异同,从中你能得出什么结论?
与水反应 与乙醇反应
反应方程式 2Na+2H2O==2NaOH+H2↑ 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
反应实质 水中氢原子被置换出来 羟基氢原子被置换出来
现
象 声现象 有“嘶嘶”声响 无声响
钠变化 浮、熔、游、响 沉于底部、不熔化
结
论
羟基氢的活泼性 H2O>CH3CH2OH
密度大小 ρ(Na)<ρ(H2O) ρ(Na)>ρ(CH3CH2OH)
归纳总结
三、乙醇的化学性质
2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
CH3CH2OH→CH3COOH
造酒原料
杀菌、消毒
有机溶剂和化工原料
燃料
身边的化学
酒的度数:
乙醇的体积分数
乙醇在人体内的代谢过程
酒精(乙醇)
乙醛
乙酸
CO2+H2O
乙醇脱氢酶
乙醛脱氢酶
未成年人不应饮酒
利 弊
1.提供能量 1.伤肝害脑
2.帮助消化 2.致癌
3.舒筋活血 3.心血管病
4.消除疲劳
思考 为什么不能用工业酒精配制饮用酒?
工业酒精含甲醇,会导致中毒
K 2 Cr2O7
Cr2(SO4 )3
CH3 CH2OH
身边的化学
橙红色
绿色
课堂练习:
C—C—O—H
H
H
H
H
H
①
②
④
③
1、与钠反应时在何处断键
A: ①
2、发生催化氧化反应时在何处断键
A: ① ④
B: ②
B: ① ③
C: ③
C: ② ④
D: ④
D: ② ④
A
B
课堂小结
用途
第3章 简单的有机化合物
第3节 饮食中的有机化合物
第1课时 乙醇
【核心素养目标】
1.了解乙醇的结构和物理性质
2.能描述乙醇的主要化学性质及相应性质实验的现象,能书写相关的反应式,能利用这些物质的主要性质进行鉴别
3.了解乙醇的用途以及在人体内的转化过程
【重难点】
乙醇的结构和化学性质
颜色状态:
气味:
密度:
溶解性:
挥发性:
熔沸点:
一、 乙醇的物理性质
有特殊香味
无色液体
比水小
熔沸点较低(沸点:78.5℃,
熔点:-117.3℃)
能跟水以任意比例互溶,能溶解多种有机物和无机物
易挥发
(需密封保存!)
二 、乙醇的组成和结构
化学式:
C2H6O
根据乙醇化学式判断乙醇的结构式可能有哪几种?
C—C—O—H
H
H
H
H
H
C—O—C—H
H
H
H
H
H
实验事实:钠能与水反应生成氢气,乙烷不能与钠反应。说明具有什么结构的物质可以跟钠反应?乙醇的结构式是哪种?
对比乙烷、乙醇、水的分子结构模型,思考三者在结构上的异同
乙烷分子球棍模型
乙醇分子球棍模型
水分子球棍模型
CH3—CH2—H
CH3—CH2—OH
H—OH
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH 或C2H5OH
羟基
写作-OH
结构简式:
化学式:
C2H6O
二 、乙醇的组成和结构
羟基是乙醇的官能团,决定了乙醇的化学特性,那么乙醇具有哪些化学特性呢?
乙醇空间填充模型
乙醇球棍模型
实验1:向烧杯中加入约2mL的无水乙醇,点燃,观察现象
铜丝在空气中加热由红变黑,插入乙醇溶液中,溶液沸腾,铜丝表面有黑变红,试管中的液体有刺激性气味
2CH3CH2OH+O2 2CH3CHO+2H2O
铜做催化剂,乙醇可以被氧化为有刺激性气味的液体
整个反应过程中铜的作用是什么?
实验2:向试管中加入约2mL的无水乙醇,取一根光亮的铜丝绕成螺旋状,置于酒精灯外焰上加热,然后伸入无水乙醇中,反复几次。
黑色→红色
2Cu + O2 === 2CuO
H O-H
│ │
H-C-C-H
│ │
H H
CuO
+
Cu
+
H2O
△
+
H O
│
H-C-C-H
│
H
乙醛 刺激性气味
红色→黑色
2Cu +O2 ==== 2CuO
△
(1)
(1) + (2) ×2 并整理:
2CH3CH2OH + O2
2CH3CHO + 2 H2O
Cu
△
(2)
+ CuO
+ Cu
+ H2O
△
CH3CH2OH
CH3CHO
实验3:向试管中加入约2mL的酸性高锰酸钾溶液,滴入数滴无水乙醇,震荡,观察现象。
紫色酸性高锰酸钾溶液褪色
乙醇能被酸性高锰酸钾强氧化剂氧化
结论:
CH3CH2OH→CH3COOH
实验4:向试管中加入约2mL的无水乙醇,再放入一小块金属钠,观察现象,检验生成的气体。
钠沉到乙醇底部,缓慢反应,有无色气泡冒出,最终消失
乙醇能和活泼金属反应,生成氢气
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
联想质疑:
联想钠和水反应的现象,对比乙醇和钠反应的现象,分析二者有何异同,从中你能得出什么结论?
与水反应 与乙醇反应
反应方程式 2Na+2H2O==2NaOH+H2↑ 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
反应实质 水中氢原子被置换出来 羟基氢原子被置换出来
现
象 声现象 有“嘶嘶”声响 无声响
钠变化 浮、熔、游、响 沉于底部、不熔化
结
论
羟基氢的活泼性 H2O>CH3CH2OH
密度大小 ρ(Na)<ρ(H2O) ρ(Na)>ρ(CH3CH2OH)
归纳总结
三、乙醇的化学性质
2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
CH3CH2OH→CH3COOH
造酒原料
杀菌、消毒
有机溶剂和化工原料
燃料
身边的化学
酒的度数:
乙醇的体积分数
乙醇在人体内的代谢过程
酒精(乙醇)
乙醛
乙酸
CO2+H2O
乙醇脱氢酶
乙醛脱氢酶
未成年人不应饮酒
利 弊
1.提供能量 1.伤肝害脑
2.帮助消化 2.致癌
3.舒筋活血 3.心血管病
4.消除疲劳
思考 为什么不能用工业酒精配制饮用酒?
工业酒精含甲醇,会导致中毒
K 2 Cr2O7
Cr2(SO4 )3
CH3 CH2OH
身边的化学
橙红色
绿色
课堂练习:
C—C—O—H
H
H
H
H
H
①
②
④
③
1、与钠反应时在何处断键
A: ①
2、发生催化氧化反应时在何处断键
A: ① ④
B: ②
B: ① ③
C: ③
C: ② ④
D: ④
D: ② ④
A
B
课堂小结
用途
