7.3.2乙醇与乙酸(2)【教学课件】(共33张PPT)【优课堂】2022-2023学年高一化学同步备课系列(人教版2019必修第二册)
文档属性
| 名称 | 7.3.2乙醇与乙酸(2)【教学课件】(共33张PPT)【优课堂】2022-2023学年高一化学同步备课系列(人教版2019必修第二册) |  | |
| 格式 | zip | ||
| 文件大小 | 22.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-27 11:13:49 | ||
图片预览





文档简介
(共33张PPT)
第三节 乙醇与乙酸
第2课时
第七章 有机化合物
2
1
本节重点
本节难点
乙醇与乙酸的结构、性质比较及应用
乙酸
食醋是中国古代劳动人民发明传统调味品,流传至今的是中国四大名醋,食醋中含有3% ~ 5%的乙酸,故乙酸又被称为醋酸。
那么,乙酸有哪些性质呢?
乙酸
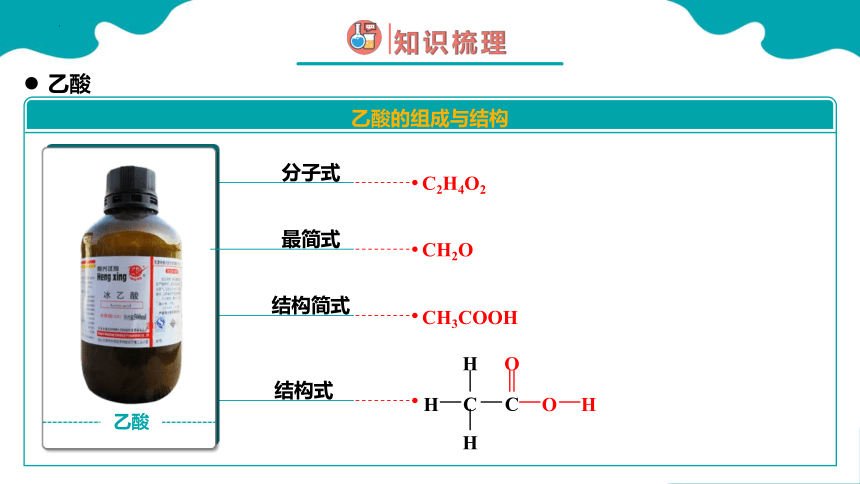
存放乙酸的试剂瓶
纯净的乙酸又叫冰醋酸
C2H4O2
H
H
O
H
C
H
O
C
乙酸
乙酸的组成与结构
CH3COOH
分子式
结构简式
结构式
乙酸
最简式
CH2O
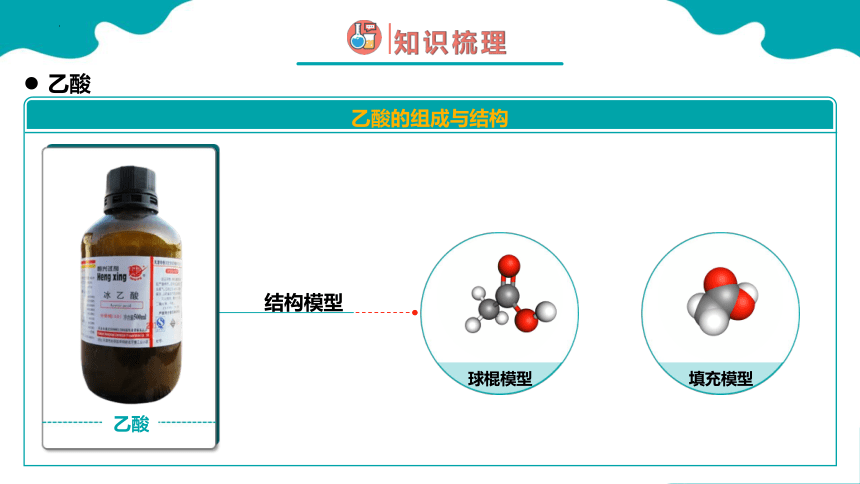
结构模型
乙酸
乙酸的组成与结构
球棍模型
填充模型
乙酸
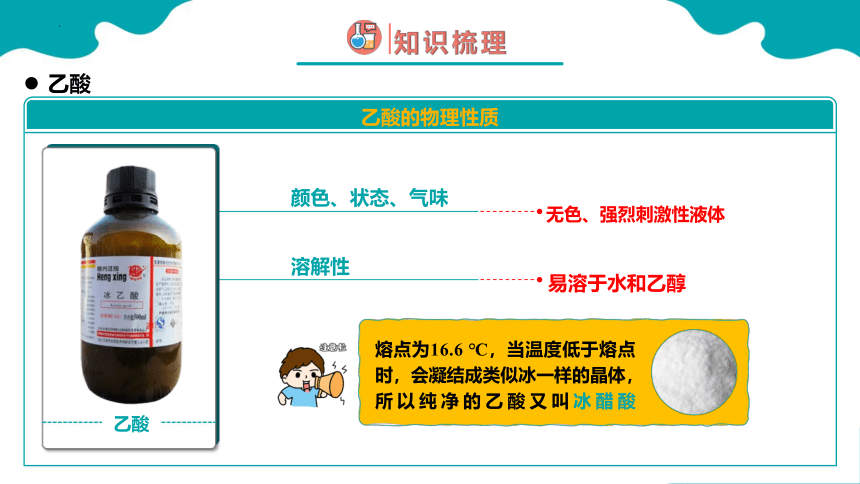
易溶于水和乙醇
颜色、状态、气味
溶解性
乙酸的物理性质
乙酸
无色、强烈刺激性液体
熔点为16.6 ℃,当温度低于熔点时,会凝结成类似冰一样的晶体,所以纯净的乙酸又叫冰醋酸
乙酸
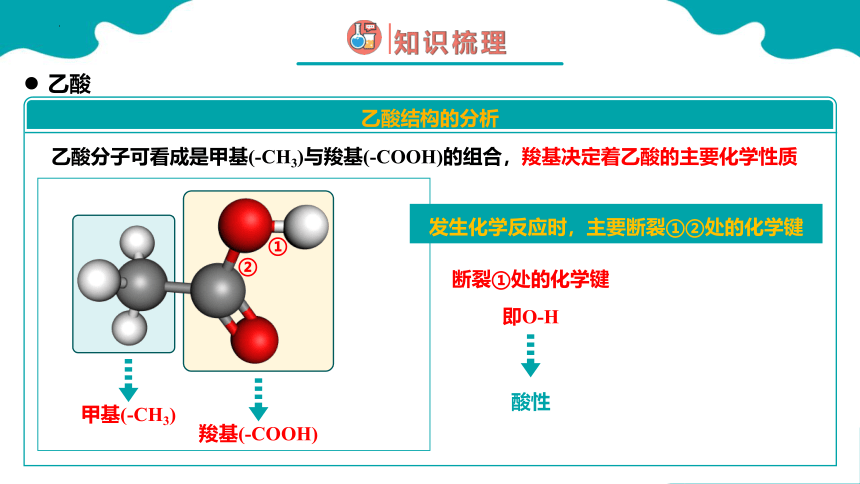
乙酸分子可看成是甲基(-CH3)与羧基(-COOH)的组合,羧基决定着乙酸的主要化学性质
乙酸
乙酸结构的分析
甲基(-CH3)
羧基(-COOH)
①
②
断裂①处的化学键
即O-H
酸性
发生化学反应时,主要断裂①②处的化学键
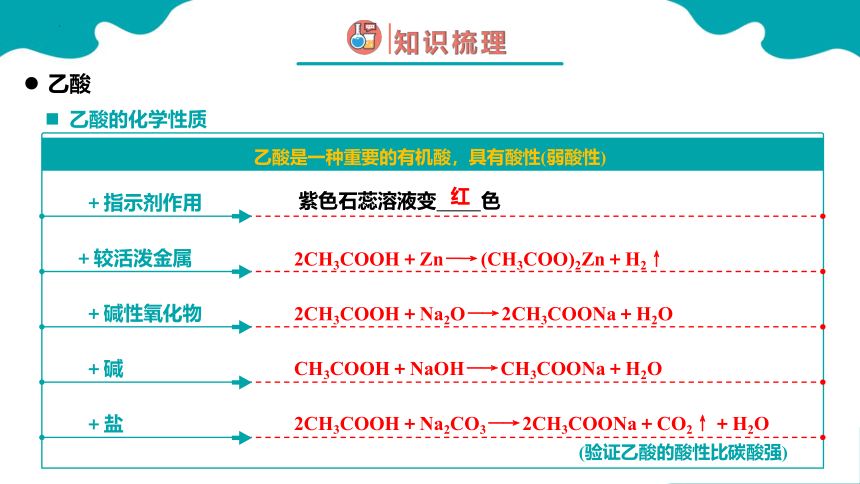
乙酸的化学性质
乙酸是一种重要的有机酸,具有酸性(弱酸性)
乙酸
紫色石蕊溶液变 色
2CH3COOH+Zn―→ (CH3COO)2Zn+H2↑
红
CH3COOH+NaOH―→ CH3COONa+H2O
2CH3COOH+Na2O―→ 2CH3COONa+H2O
2CH3COOH+Na2CO3―→ 2CH3COONa+CO2↑+H2O
+指示剂作用
+较活泼金属
+碱性氧化物
+碱
+盐
(验证乙酸的酸性比碳酸强)
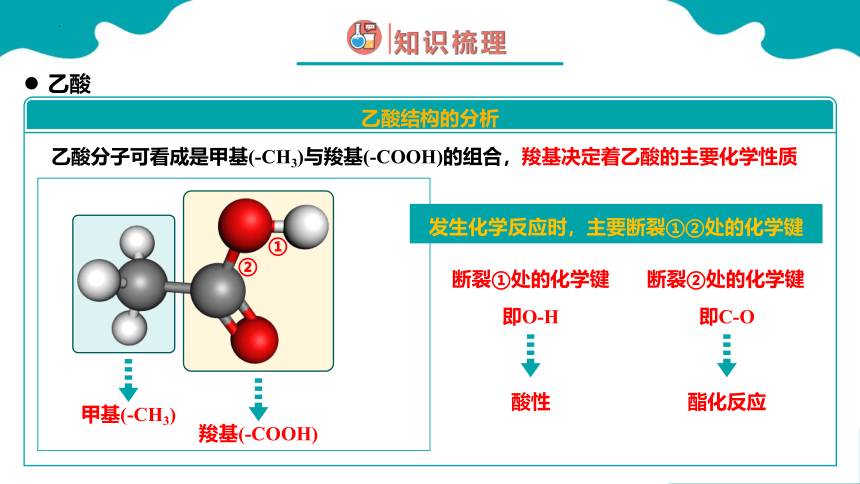
乙酸分子可看成是甲基(-CH3)与羧基(-COOH)的组合,羧基决定着乙酸的主要化学性质
乙酸
乙酸结构的分析
甲基(-CH3)
羧基(-COOH)
①
②
断裂①处的化学键
断裂②处的化学键
即O-H
酸性
即C-O
酯化反应
发生化学反应时,主要断裂①②处的化学键
乙醇+乙酸+浓硫酸
饱和Na2CO3溶液
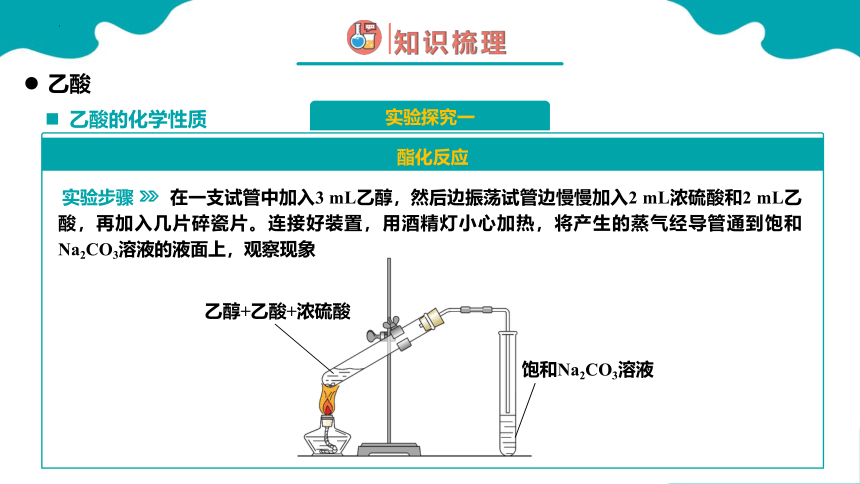
乙酸的化学性质
乙酸
实验探究一
酯化反应
实验步骤
在一支试管中加入3 mL乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL乙酸,再加入几片碎瓷片。连接好装置,用酒精灯小心加热,将产生的蒸气经导管通到饱和Na2CO3溶液的液面上,观察现象
乙酸的化学性质
乙酸
实验探究一
酯化反应
实验现象
饱和Na2CO3溶液的液面上有 生成,且能闻到_____
无色透明油状液体
香味
乙酸的化学性质
乙酸
实验探究一
酯化反应
化学方程式
H
H
O
H
C
H
O
C
H
H
O
H
C
H
H
C
H
+
+H2O
浓硫酸
H
H
C
H
O
C
H
O
H
C
H
H
C
H
乙酸乙酯
实验原理
发生酯化反应时,羧酸分子断开C-O键,醇分子断开O-H键,即“酸脱羟基,醇脱氢”
同位素示踪法验证断键位置
乙酸的化学性质
酯化反应实验中的注意事项
乙酸
试剂的加入顺序:先加入乙醇,然后沿器壁慢慢加入浓硫酸,冷却后再加入乙酸
浓H2SO4的密度大于乙醇和乙酸的密度,而且混合时会放出大量的热,为了防止暴沸,实验中先加入乙醇,然后边振荡试管边缓慢的加入浓H2SO4和乙酸
浓硫酸的作用:加快反应速率(作催化剂),提高CH3COOC2H5产率、CH3CH2OH的转化率(作吸水剂)
酒精灯加热的目的:加快反应速率,使生成的乙酸乙酯及时蒸出,从而提高反应物的转化率
导气管末端不能插入液面以下,目的是防倒吸
乙酸的化学性质
酯化反应实验中的注意事项
乙酸
饱和碳酸钠溶液的作用
采用分液法分离试管中的液体混合物
二是溶解挥发出来的乙醇
一是与挥发出来的乙酸发生反应
三是降低乙酸乙酯在水中的溶解度,使溶液分层,便于得到酯
乙酸乙酯
乙酸
H
H
O
H
C
H
O
C
H
H
O
H
C
H
H
C
H
+
+H2O
浓硫酸
H
H
C
H
O
C
H
O
H
C
H
H
C
H
酯化反应
酸
醇
酯
水
(可逆反应)
酯化反应
乙酸
酯的理解
乙酸乙酯是酯类物质中的一种
CH3
O
C
O
CH3
CH2
乙酸乙酯
—COOR
O
C
O
官能团
酯基
酯化反应
乙酸
酯的理解
很多鲜花和水果的香味都来自酯
乙酸异戊酯
戊酸戊酯
酯化反应
乙酸
酯的理解
酯分子中碳原子数较少、相对分子质量较小的低级酯具有一定的挥发性,有芳香气味,可用作饮料、糖果、化妆品中的香料和有机溶剂。
请同学们回顾所学内容,判断正误:
问题1
可以用水鉴别乙醇和乙酸( )
乙酸分子中含有4个H原子,故为四元酸( )
酯化反应中,只要乙醇过量,可以把乙酸完全反应生成乙酸乙酯( )
酯化反应实验中,加入的碎瓷片为反应的催化剂( )
问题2
问题3
问题4
乙醇与乙酸的结构、性质比较及应用
乙醇在化学变化中的断键规律
①键和③键同时断裂:发生 反应。
Na
酯化
催化氧化
①键断裂:和 反应,和乙酸发生 反应。
乙醇与乙酸的结构、性质比较及应用
乙酸在化学变化中的断键规律
酸性
酯化
①键断裂:显示____________。
②键断裂:发生________反应。
【例1】某有机物的结构简式为 。下列关于该有机物的叙述中,不正确的是( )
A.能与NaHCO3发生反应并放出二氧化碳
B.能在催化剂作用下与HCl发生加成反应
C.不能使酸性KMnO4溶液和溴水褪色
D.在浓硫酸作催化剂条件下能和乙醇发生酯化反应生成酯
C
蚁酸一般指甲酸。 甲酸是一种有机物,化学式为HCOOH,俗名蚁酸,是最简单的羧酸。为无色而有刺激性气味的液体。甲酸属于弱电解质,但其水溶液中弱酸性且腐蚀性强,能刺激皮肤起泡。
蚁酸
1.下列关于乙酸性质的叙述中,错误的是( )
A.乙酸的酸性比碳酸的强,所以它可以与碳酸盐溶液反应,产生CO2气体
B.乙酸具有酸性,所以能与钠反应放出H2
C.乙酸分子中含有碳氧双键,所以它能使溴水褪色
D.乙酸在温度低于16.6 ℃时,就凝结成冰状晶体
C
A.CH2==CH—CH2—OH
B.
C.CH2==CH—COOH
D.CH3COOH
2.下表为某有机物与各种试剂的反应现象,则这种有机物可能是( )
试剂 钠 溴水 NaHCO3溶液
现象 放出气体 褪色 放出气体
C
3.实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入3 mL乙醇、2 mL浓硫酸和2 mL乙酸的混合溶液。
②按图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙,并用力振荡,然后静置待分层。
④分离出乙酸乙酯层,洗涤、干燥。
(1)反应中浓硫酸的作用是__________________。
作催化剂和吸水剂
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
BC
(3)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有___________;分离时,乙酸乙酯应该从仪器__________(填“下口放出”或“上口倒出”)。
分液漏斗
上口倒出
第三节
乙醇与乙酸
第2课时
乙酸
乙醇与乙酸的结构和性质的比较及应用
乙醇在化学变化中的断键规律
乙酸在化学变化中的断键规律
组成与结构
化学性质
物理性质
THANKS
谢谢聆听
第三节 乙醇与乙酸
第2课时
第七章 有机化合物
2
1
本节重点
本节难点
乙醇与乙酸的结构、性质比较及应用
乙酸
食醋是中国古代劳动人民发明传统调味品,流传至今的是中国四大名醋,食醋中含有3% ~ 5%的乙酸,故乙酸又被称为醋酸。
那么,乙酸有哪些性质呢?
乙酸
存放乙酸的试剂瓶
纯净的乙酸又叫冰醋酸
C2H4O2
H
H
O
H
C
H
O
C
乙酸
乙酸的组成与结构
CH3COOH
分子式
结构简式
结构式
乙酸
最简式
CH2O
结构模型
乙酸
乙酸的组成与结构
球棍模型
填充模型
乙酸
易溶于水和乙醇
颜色、状态、气味
溶解性
乙酸的物理性质
乙酸
无色、强烈刺激性液体
熔点为16.6 ℃,当温度低于熔点时,会凝结成类似冰一样的晶体,所以纯净的乙酸又叫冰醋酸
乙酸
乙酸分子可看成是甲基(-CH3)与羧基(-COOH)的组合,羧基决定着乙酸的主要化学性质
乙酸
乙酸结构的分析
甲基(-CH3)
羧基(-COOH)
①
②
断裂①处的化学键
即O-H
酸性
发生化学反应时,主要断裂①②处的化学键
乙酸的化学性质
乙酸是一种重要的有机酸,具有酸性(弱酸性)
乙酸
紫色石蕊溶液变 色
2CH3COOH+Zn―→ (CH3COO)2Zn+H2↑
红
CH3COOH+NaOH―→ CH3COONa+H2O
2CH3COOH+Na2O―→ 2CH3COONa+H2O
2CH3COOH+Na2CO3―→ 2CH3COONa+CO2↑+H2O
+指示剂作用
+较活泼金属
+碱性氧化物
+碱
+盐
(验证乙酸的酸性比碳酸强)
乙酸分子可看成是甲基(-CH3)与羧基(-COOH)的组合,羧基决定着乙酸的主要化学性质
乙酸
乙酸结构的分析
甲基(-CH3)
羧基(-COOH)
①
②
断裂①处的化学键
断裂②处的化学键
即O-H
酸性
即C-O
酯化反应
发生化学反应时,主要断裂①②处的化学键
乙醇+乙酸+浓硫酸
饱和Na2CO3溶液
乙酸的化学性质
乙酸
实验探究一
酯化反应
实验步骤
在一支试管中加入3 mL乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL乙酸,再加入几片碎瓷片。连接好装置,用酒精灯小心加热,将产生的蒸气经导管通到饱和Na2CO3溶液的液面上,观察现象
乙酸的化学性质
乙酸
实验探究一
酯化反应
实验现象
饱和Na2CO3溶液的液面上有 生成,且能闻到_____
无色透明油状液体
香味
乙酸的化学性质
乙酸
实验探究一
酯化反应
化学方程式
H
H
O
H
C
H
O
C
H
H
O
H
C
H
H
C
H
+
+H2O
浓硫酸
H
H
C
H
O
C
H
O
H
C
H
H
C
H
乙酸乙酯
实验原理
发生酯化反应时,羧酸分子断开C-O键,醇分子断开O-H键,即“酸脱羟基,醇脱氢”
同位素示踪法验证断键位置
乙酸的化学性质
酯化反应实验中的注意事项
乙酸
试剂的加入顺序:先加入乙醇,然后沿器壁慢慢加入浓硫酸,冷却后再加入乙酸
浓H2SO4的密度大于乙醇和乙酸的密度,而且混合时会放出大量的热,为了防止暴沸,实验中先加入乙醇,然后边振荡试管边缓慢的加入浓H2SO4和乙酸
浓硫酸的作用:加快反应速率(作催化剂),提高CH3COOC2H5产率、CH3CH2OH的转化率(作吸水剂)
酒精灯加热的目的:加快反应速率,使生成的乙酸乙酯及时蒸出,从而提高反应物的转化率
导气管末端不能插入液面以下,目的是防倒吸
乙酸的化学性质
酯化反应实验中的注意事项
乙酸
饱和碳酸钠溶液的作用
采用分液法分离试管中的液体混合物
二是溶解挥发出来的乙醇
一是与挥发出来的乙酸发生反应
三是降低乙酸乙酯在水中的溶解度,使溶液分层,便于得到酯
乙酸乙酯
乙酸
H
H
O
H
C
H
O
C
H
H
O
H
C
H
H
C
H
+
+H2O
浓硫酸
H
H
C
H
O
C
H
O
H
C
H
H
C
H
酯化反应
酸
醇
酯
水
(可逆反应)
酯化反应
乙酸
酯的理解
乙酸乙酯是酯类物质中的一种
CH3
O
C
O
CH3
CH2
乙酸乙酯
—COOR
O
C
O
官能团
酯基
酯化反应
乙酸
酯的理解
很多鲜花和水果的香味都来自酯
乙酸异戊酯
戊酸戊酯
酯化反应
乙酸
酯的理解
酯分子中碳原子数较少、相对分子质量较小的低级酯具有一定的挥发性,有芳香气味,可用作饮料、糖果、化妆品中的香料和有机溶剂。
请同学们回顾所学内容,判断正误:
问题1
可以用水鉴别乙醇和乙酸( )
乙酸分子中含有4个H原子,故为四元酸( )
酯化反应中,只要乙醇过量,可以把乙酸完全反应生成乙酸乙酯( )
酯化反应实验中,加入的碎瓷片为反应的催化剂( )
问题2
问题3
问题4
乙醇与乙酸的结构、性质比较及应用
乙醇在化学变化中的断键规律
①键和③键同时断裂:发生 反应。
Na
酯化
催化氧化
①键断裂:和 反应,和乙酸发生 反应。
乙醇与乙酸的结构、性质比较及应用
乙酸在化学变化中的断键规律
酸性
酯化
①键断裂:显示____________。
②键断裂:发生________反应。
【例1】某有机物的结构简式为 。下列关于该有机物的叙述中,不正确的是( )
A.能与NaHCO3发生反应并放出二氧化碳
B.能在催化剂作用下与HCl发生加成反应
C.不能使酸性KMnO4溶液和溴水褪色
D.在浓硫酸作催化剂条件下能和乙醇发生酯化反应生成酯
C
蚁酸一般指甲酸。 甲酸是一种有机物,化学式为HCOOH,俗名蚁酸,是最简单的羧酸。为无色而有刺激性气味的液体。甲酸属于弱电解质,但其水溶液中弱酸性且腐蚀性强,能刺激皮肤起泡。
蚁酸
1.下列关于乙酸性质的叙述中,错误的是( )
A.乙酸的酸性比碳酸的强,所以它可以与碳酸盐溶液反应,产生CO2气体
B.乙酸具有酸性,所以能与钠反应放出H2
C.乙酸分子中含有碳氧双键,所以它能使溴水褪色
D.乙酸在温度低于16.6 ℃时,就凝结成冰状晶体
C
A.CH2==CH—CH2—OH
B.
C.CH2==CH—COOH
D.CH3COOH
2.下表为某有机物与各种试剂的反应现象,则这种有机物可能是( )
试剂 钠 溴水 NaHCO3溶液
现象 放出气体 褪色 放出气体
C
3.实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入3 mL乙醇、2 mL浓硫酸和2 mL乙酸的混合溶液。
②按图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙,并用力振荡,然后静置待分层。
④分离出乙酸乙酯层,洗涤、干燥。
(1)反应中浓硫酸的作用是__________________。
作催化剂和吸水剂
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
BC
(3)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有___________;分离时,乙酸乙酯应该从仪器__________(填“下口放出”或“上口倒出”)。
分液漏斗
上口倒出
第三节
乙醇与乙酸
第2课时
乙酸
乙醇与乙酸的结构和性质的比较及应用
乙醇在化学变化中的断键规律
乙酸在化学变化中的断键规律
组成与结构
化学性质
物理性质
THANKS
谢谢聆听
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
