5.1元素周期律和元素周期表 同步练习 (含答案) 2022-2023学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 5.1元素周期律和元素周期表 同步练习 (含答案) 2022-2023学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 469.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-28 15:57:50 | ||
图片预览


文档简介
5.1元素周期律和元素周期表
一、单选题
1.以下各组表示卤素及其化合物的性质变化规律中,错误的是
A.得电子能力 F2>Cl2>Br2>I2 B.还原能力 F-<Cl-<Br-<I-
C.稳定性 HF>HCl>HBr>HI D.酸性 HF>HCl>HBr>HI
2.下列含氧酸中,酸性最强的是
A. B. C. D.
3.金属元素铊的相关信息如下图所示。下列有关卡片信息解读错误的是
A.Tl是铊的元素符号
B.铊元素的中子数=204-81=123
C.铊位于第六周期IIIA族
D.铊的金属性比铝的金属性强
4.元素周期表,所含元素种类最多的族是
A.第Ⅲ族 B.第IA族
C.0族 D.第ⅢB族
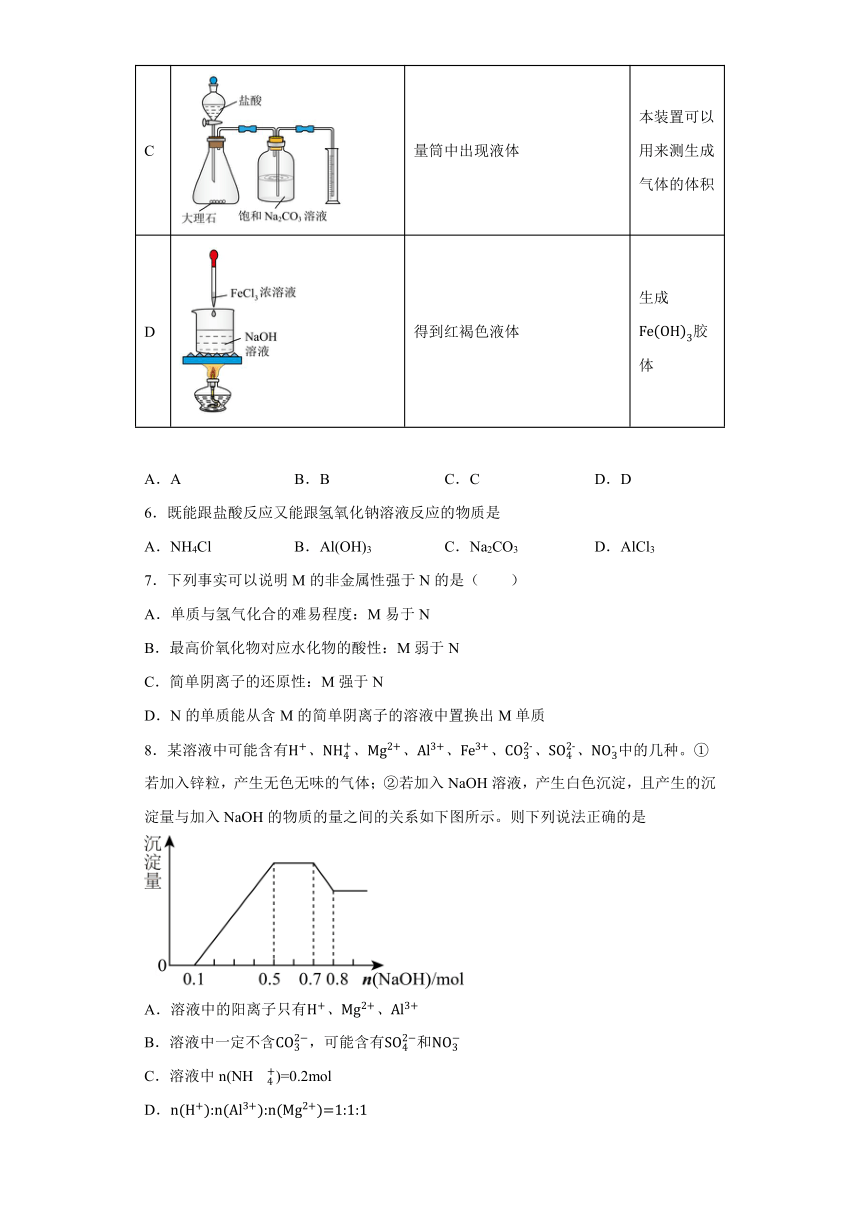
5.下列有关实验操作、现象和结论均正确的是
选项 操作 现象或数据 结论
A 碳酸钠溶于水放热,碳酸氢钠溶于水吸热
B 钾与水反应更剧烈 金属性:Na>K
C 量筒中出现液体 本装置可以用来测生成气体的体积
D 得到红褐色液体 生成胶体
A.A B.B C.C D.D
6.既能跟盐酸反应又能跟氢氧化钠溶液反应的物质是
A.NH4Cl B.Al(OH)3 C.Na2CO3 D.AlCl3
7.下列事实可以说明M的非金属性强于N的是( )
A.单质与氢气化合的难易程度:M易于N
B.最高价氧化物对应水化物的酸性:M弱于N
C.简单阴离子的还原性:M强于N
D.N的单质能从含M的简单阴离子的溶液中置换出M单质
8.某溶液中可能含有中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是
A.溶液中的阳离子只有
B.溶液中一定不含,可能含有和
C.溶液中n(NH)=0.2mol
D.
9.2molX2和2molY2正好化合生成4molZ,则Z的化学式为
A.XY B.X3Y2 C.X2Y3 D.XY3
10.下列各组递变性的规律排序中,正确的是
A.酸性:H2SiO3C.稳定性:HF11.设NA为阿伏加德罗常数的值。下列说法正确的是
A.将0.1 mol FeCl3溶于沸水制成胶体,其中含有的胶体粒子数目等于0.1NA
B.常温常压下,0.78 g Na2O2含有的离子数目为0.04NA
C.2.0 g D216O和14ND3的混合物中含有的电子数为NA
D.1 mol/L AlCl3溶液中,Cl-数目为3NA
12.X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素,X元素的一种核素的中子数为0,X和Z处于同一主族,Y的一种同位素在考古时用来测定文物的年代,W、Z的最外层电子数之和与Q的最外层电子数相等,W的最内层电子数和最外层电子数之和等于次外层电子数。下列说法中错误的是( )
A.原子半径:Q>W>Z>Y>X
B.Y与X形成的化合物在一定条件下可与Q的单质发生反应
C.化合物XQ和ZQ中化学键的类型不同
D.W的一种氧化物是形成酸雨的主要成分
13.X、Y、Z、W为原子序数依次增大的四种短周期元素。甲、乙、丙是由这些元素组成的二元化合物,A、B、C、D是四种元素形成的非金属单质,甲是10电子微粒,丙是18电子微粒,B是密度最小的气体,C为淡黄色固体。上述物质的转化关系如图所示。下列说法正确的是( )
A.W的原子半径是这些元素中最大的
B.甲、乙、丙溶于水后溶液呈酸性
C.Z、W的氧化物对应水化物的酸性:
D.稳定性:丙>乙
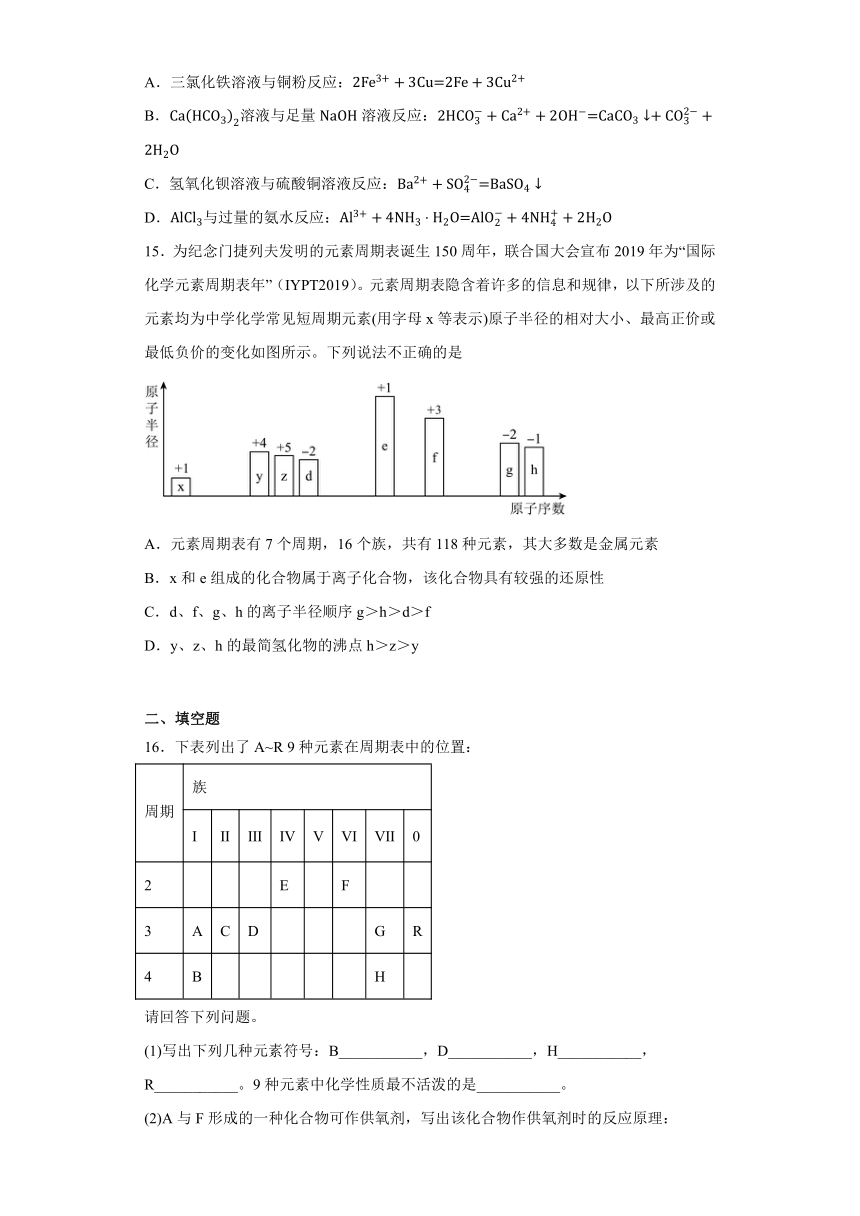
14.下列反应的离子方程式书写正确的是
A.三氯化铁溶液与铜粉反应:
B.溶液与足量溶液反应:
C.氢氧化钡溶液与硫酸铜溶液反应:
D.与过量的氨水反应:
15.为纪念门捷列夫发明的元素周期表诞生150周年,联合国大会宣布2019年为“国际化学元素周期表年”(IYPT2019)。元素周期表隐含着许多的信息和规律,以下所涉及的元素均为中学化学常见短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列说法不正确的是
A.元素周期表有7个周期,16个族,共有118种元素,其大多数是金属元素
B.x和e组成的化合物属于离子化合物,该化合物具有较强的还原性
C.d、f、g、h的离子半径顺序g>h>d>f
D.y、z、h的最简氢化物的沸点h>z>y
二、填空题
16.下表列出了A~R 9种元素在周期表中的位置:
周期 族
Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅶ 0
2 E F
3 A C D G R
4 B H
请回答下列问题。
(1)写出下列几种元素符号:B___________,D___________,H___________,R___________。9种元素中化学性质最不活泼的是___________。
(2)A与F形成的一种化合物可作供氧剂,写出该化合物作供氧剂时的反应原理:___________。
(3)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是___________。
(4)A、B、C三种元素按原子半径由大到小的顺序排列为___________。
(5)H元素与A元素形成化合物的化学式是___________,高温灼烧该化合物时,火焰呈___________色。
17.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。试回答下列问题:
(1)写出反应过程中的离子反应方程式:
DE段_____________________________________,
EF段__________________________________。
(2)合金中,铝的质量为_________g,铁的质量为_______g 。
(3)硝酸溶液的物质的量浓度为________________mol·L-1
(4)C的值为___________mL。
18.表为元素周期表中短周期元素的一部分,表中所列的字母分别代表一种元素。
a
b c
d e f
(1)a、b、c、d、e、f六种元素的原子半径最大的是_______(填元素符号)。
(2)d、e两种元素的最高价氧化物对应水化物的碱性较强的物质俗称为_______,、的沸点较高的是_______(填化学式)。
(3)过量的与溶液能发生反应,写出反应的离子方程式:_______。
(4)化学式为的化合物属于_______(填“离子化合物”或“共价化合物”),其中含有的化学键的类型为_______。
19.填空题
(1)已知某非金属元素R的简单气态氧化物的分子式为HmR,则R的化合价为_______,若它的最高价氧化物对应的水化物分子中有b个氧原子,则这种酸的分子式为_______。
(2)已知FeS2与Fe2O3,在高温下反应生成Fe3O4,和SO2,则FeS2与Fe2O3恰好反应时的物质的量之比是_______。
(3)某温度下22%NaNO3,溶液150毫升加100克水稀释后浓度变为14%,原溶液的物质的量浓度为_______。
(4)与Na2O2反应的化学方程式_______。
20.元素周期表是进行化学研究的重要工具,如图是元素周期表的一部分,其中①~⑨代表9种元素。请回答下列问题:
(1)上述元素中最高价氧化物对应的水化物的酸性最强的是___(填物质的化学式)。
(2)上述元素中最稳定的简单氢化物是___(填物质的化学式),请用电子式表示其形成过程:___;②④⑥形成的1:1:1型化合物的电子式为___。
(3)下列推断正确的是___(填选项字母)。
A.⑨的单质可能为白色固体
B.⑧的单质能与水剧烈反应生成氢气
C.①、⑥的简单氢化物之间反应的产物中既含离子键又含极性键
三、实验题
21.某同学想通过比较硫和碳的最高价氧化物对应的水化物的酸性强弱来验证硫与碳的得电子能力的强弱,他采用了如图所示的装置。
请回答下列问题:
(1)仪器a的名称是________________,应盛放下列药品中的________(填标号)。
A 稀硫酸 B 亚硫酸 C 氢硫酸 D 盐酸
(2)仪器b的名称是________________,应盛放下列药品中的________(填标号)。
A 硫酸钙 B 硫酸钠 C 氯化钠 D 碳酸钠
(3)仪器c中应盛放的药品是_________,如果看到的现象是_________,即可证明________比________酸性强,得电子能力____比________强,b中发生反应的化学方程式为________。
参考答案:
1.D2.C3.B4.D5.A6.B7.A8.C9.A10.A11.C12.A13.D14.B15.D
16. K Al Br Ar Ar 2Na2O2+2CO2=2Na2CO3 +O2 2Na2O2+2H2O=4NaOH +O2 Al(OH)3+OH-=AlO+2H2O K>Na>Mg NaBr 黄
17. NH4++OH-→NH3·H2O Al(OH)3+ OHˉ→AlO2ˉ+2H2O 0.216 1.344 1.48 7
18.(1)
(2) 烧碱
(3)
(4) 共价化合物 非极性共价键、极性共价键
19.(1) -m H2b+m-8ROb
(2)1:16
(3)3mol/L
(4)2Na2O2+2H218O=2Na18OH+2NaOH+O2↑
20. HClO4 HF BC
21. 分液漏斗 A 圆底烧瓶 D 澄清石灰水 石灰水变浑浊 硫 碳
一、单选题
1.以下各组表示卤素及其化合物的性质变化规律中,错误的是
A.得电子能力 F2>Cl2>Br2>I2 B.还原能力 F-<Cl-<Br-<I-
C.稳定性 HF>HCl>HBr>HI D.酸性 HF>HCl>HBr>HI
2.下列含氧酸中,酸性最强的是
A. B. C. D.
3.金属元素铊的相关信息如下图所示。下列有关卡片信息解读错误的是
A.Tl是铊的元素符号
B.铊元素的中子数=204-81=123
C.铊位于第六周期IIIA族
D.铊的金属性比铝的金属性强
4.元素周期表,所含元素种类最多的族是
A.第Ⅲ族 B.第IA族
C.0族 D.第ⅢB族
5.下列有关实验操作、现象和结论均正确的是
选项 操作 现象或数据 结论
A 碳酸钠溶于水放热,碳酸氢钠溶于水吸热
B 钾与水反应更剧烈 金属性:Na>K
C 量筒中出现液体 本装置可以用来测生成气体的体积
D 得到红褐色液体 生成胶体
A.A B.B C.C D.D
6.既能跟盐酸反应又能跟氢氧化钠溶液反应的物质是
A.NH4Cl B.Al(OH)3 C.Na2CO3 D.AlCl3
7.下列事实可以说明M的非金属性强于N的是( )
A.单质与氢气化合的难易程度:M易于N
B.最高价氧化物对应水化物的酸性:M弱于N
C.简单阴离子的还原性:M强于N
D.N的单质能从含M的简单阴离子的溶液中置换出M单质
8.某溶液中可能含有中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是
A.溶液中的阳离子只有
B.溶液中一定不含,可能含有和
C.溶液中n(NH)=0.2mol
D.
9.2molX2和2molY2正好化合生成4molZ,则Z的化学式为
A.XY B.X3Y2 C.X2Y3 D.XY3
10.下列各组递变性的规律排序中,正确的是
A.酸性:H2SiO3
A.将0.1 mol FeCl3溶于沸水制成胶体,其中含有的胶体粒子数目等于0.1NA
B.常温常压下,0.78 g Na2O2含有的离子数目为0.04NA
C.2.0 g D216O和14ND3的混合物中含有的电子数为NA
D.1 mol/L AlCl3溶液中,Cl-数目为3NA
12.X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素,X元素的一种核素的中子数为0,X和Z处于同一主族,Y的一种同位素在考古时用来测定文物的年代,W、Z的最外层电子数之和与Q的最外层电子数相等,W的最内层电子数和最外层电子数之和等于次外层电子数。下列说法中错误的是( )
A.原子半径:Q>W>Z>Y>X
B.Y与X形成的化合物在一定条件下可与Q的单质发生反应
C.化合物XQ和ZQ中化学键的类型不同
D.W的一种氧化物是形成酸雨的主要成分
13.X、Y、Z、W为原子序数依次增大的四种短周期元素。甲、乙、丙是由这些元素组成的二元化合物,A、B、C、D是四种元素形成的非金属单质,甲是10电子微粒,丙是18电子微粒,B是密度最小的气体,C为淡黄色固体。上述物质的转化关系如图所示。下列说法正确的是( )
A.W的原子半径是这些元素中最大的
B.甲、乙、丙溶于水后溶液呈酸性
C.Z、W的氧化物对应水化物的酸性:
D.稳定性:丙>乙
14.下列反应的离子方程式书写正确的是
A.三氯化铁溶液与铜粉反应:
B.溶液与足量溶液反应:
C.氢氧化钡溶液与硫酸铜溶液反应:
D.与过量的氨水反应:
15.为纪念门捷列夫发明的元素周期表诞生150周年,联合国大会宣布2019年为“国际化学元素周期表年”(IYPT2019)。元素周期表隐含着许多的信息和规律,以下所涉及的元素均为中学化学常见短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列说法不正确的是
A.元素周期表有7个周期,16个族,共有118种元素,其大多数是金属元素
B.x和e组成的化合物属于离子化合物,该化合物具有较强的还原性
C.d、f、g、h的离子半径顺序g>h>d>f
D.y、z、h的最简氢化物的沸点h>z>y
二、填空题
16.下表列出了A~R 9种元素在周期表中的位置:
周期 族
Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅶ 0
2 E F
3 A C D G R
4 B H
请回答下列问题。
(1)写出下列几种元素符号:B___________,D___________,H___________,R___________。9种元素中化学性质最不活泼的是___________。
(2)A与F形成的一种化合物可作供氧剂,写出该化合物作供氧剂时的反应原理:___________。
(3)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是___________。
(4)A、B、C三种元素按原子半径由大到小的顺序排列为___________。
(5)H元素与A元素形成化合物的化学式是___________,高温灼烧该化合物时,火焰呈___________色。
17.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。试回答下列问题:
(1)写出反应过程中的离子反应方程式:
DE段_____________________________________,
EF段__________________________________。
(2)合金中,铝的质量为_________g,铁的质量为_______g 。
(3)硝酸溶液的物质的量浓度为________________mol·L-1
(4)C的值为___________mL。
18.表为元素周期表中短周期元素的一部分,表中所列的字母分别代表一种元素。
a
b c
d e f
(1)a、b、c、d、e、f六种元素的原子半径最大的是_______(填元素符号)。
(2)d、e两种元素的最高价氧化物对应水化物的碱性较强的物质俗称为_______,、的沸点较高的是_______(填化学式)。
(3)过量的与溶液能发生反应,写出反应的离子方程式:_______。
(4)化学式为的化合物属于_______(填“离子化合物”或“共价化合物”),其中含有的化学键的类型为_______。
19.填空题
(1)已知某非金属元素R的简单气态氧化物的分子式为HmR,则R的化合价为_______,若它的最高价氧化物对应的水化物分子中有b个氧原子,则这种酸的分子式为_______。
(2)已知FeS2与Fe2O3,在高温下反应生成Fe3O4,和SO2,则FeS2与Fe2O3恰好反应时的物质的量之比是_______。
(3)某温度下22%NaNO3,溶液150毫升加100克水稀释后浓度变为14%,原溶液的物质的量浓度为_______。
(4)与Na2O2反应的化学方程式_______。
20.元素周期表是进行化学研究的重要工具,如图是元素周期表的一部分,其中①~⑨代表9种元素。请回答下列问题:
(1)上述元素中最高价氧化物对应的水化物的酸性最强的是___(填物质的化学式)。
(2)上述元素中最稳定的简单氢化物是___(填物质的化学式),请用电子式表示其形成过程:___;②④⑥形成的1:1:1型化合物的电子式为___。
(3)下列推断正确的是___(填选项字母)。
A.⑨的单质可能为白色固体
B.⑧的单质能与水剧烈反应生成氢气
C.①、⑥的简单氢化物之间反应的产物中既含离子键又含极性键
三、实验题
21.某同学想通过比较硫和碳的最高价氧化物对应的水化物的酸性强弱来验证硫与碳的得电子能力的强弱,他采用了如图所示的装置。
请回答下列问题:
(1)仪器a的名称是________________,应盛放下列药品中的________(填标号)。
A 稀硫酸 B 亚硫酸 C 氢硫酸 D 盐酸
(2)仪器b的名称是________________,应盛放下列药品中的________(填标号)。
A 硫酸钙 B 硫酸钠 C 氯化钠 D 碳酸钠
(3)仪器c中应盛放的药品是_________,如果看到的现象是_________,即可证明________比________酸性强,得电子能力____比________强,b中发生反应的化学方程式为________。
参考答案:
1.D2.C3.B4.D5.A6.B7.A8.C9.A10.A11.C12.A13.D14.B15.D
16. K Al Br Ar Ar 2Na2O2+2CO2=2Na2CO3 +O2 2Na2O2+2H2O=4NaOH +O2 Al(OH)3+OH-=AlO+2H2O K>Na>Mg NaBr 黄
17. NH4++OH-→NH3·H2O Al(OH)3+ OHˉ→AlO2ˉ+2H2O 0.216 1.344 1.48 7
18.(1)
(2) 烧碱
(3)
(4) 共价化合物 非极性共价键、极性共价键
19.(1) -m H2b+m-8ROb
(2)1:16
(3)3mol/L
(4)2Na2O2+2H218O=2Na18OH+2NaOH+O2↑
20. HClO4 HF BC
21. 分液漏斗 A 圆底烧瓶 D 澄清石灰水 石灰水变浑浊 硫 碳
