第九单元溶液检测题(含答案) --2022-2023学年九年级化学人教版下册
文档属性
| 名称 | 第九单元溶液检测题(含答案) --2022-2023学年九年级化学人教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 165.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-27 09:03:20 | ||
图片预览


文档简介
第九单元《溶液》检测题
一、单选题
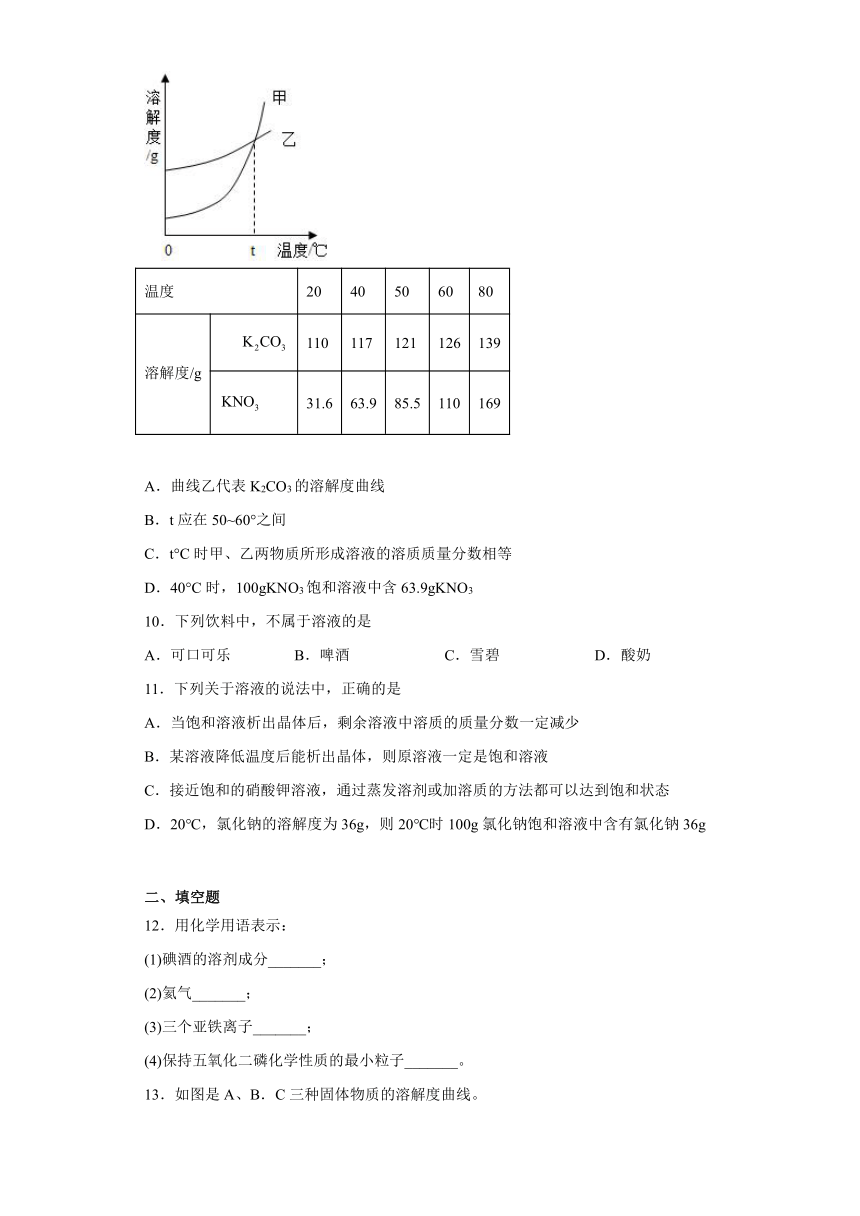
1.下列实验现象描述正确的是
A.铁丝伸入盛氧气的集气瓶中剧烈燃烧
B.红磷在空气中燃烧产生大量白雾
C.硫燃烧时生成有刺激性气味的气体
D.氢氧化钠溶于水时溶液温度降低
2.在一定温度下,将少量生石灰放入一定量的饱和石灰水中,投拌并冷却至原来温度,下列说法正确的是
A.溶剂质量不变 B.溶质质量增加
C.溶解度变小 D.溶液中溶质的质量分数不变
3.下列实验方案不能达到实验目的是
A.探究影响溶解性的因素 B.证明可燃物燃烧需要氧气
C.证明二氧化碳能溶于水 D.比较Fe、Ag、Zn的金属活动性
4.某同学梳理归纳了以下知识: ①硬水通过活性炭吸附后可变为软水②两瓶气体元素组成相同,则它们的化学性质一定相同③离子是带电的粒子,所以带电的粒子一定是离子④配制6%的氯化钠溶液,量取水时,俯视量筒刻度会使所配氯化钠溶液质量分数偏高⑤元素的种类由原子的最外层电子数决定⑥除去铜粉中混有的少量炭粉,可采用在空气中灼烧混合物的方法。其中正确的个数有
A.1个 B.2个 C.3个 D.4个
5.将少量的下列物质分别放入水中并充分搅拌,其中不能形成溶液的是
A.白砂糖 B.食盐 C.高锰酸钾 D.植物油
6.下列有关溶液的说法中,正确的是
A.溶液一定是均一的、无色的
B.食用油和水的混合物是一种溶液
C.溶液一定是一种混合物
D.溶液一定是固体溶于水形成的
7.a、b两种物质的溶解度曲线如图所示。下列说法不正确的是
A.15 ℃时,a、b的溶解度均为20 g
B.加水或升温均可使b的饱和溶液变为不饱和溶液
C.将15 ℃时a的饱和溶液升温至30 ℃,有晶体析出
D.将30 ℃时a、b的饱和溶液降温至15 ℃,此时a、b两种溶液中溶质的质量分数相等
8.如图是甲、乙、丙三种固体物质的溶解度曲线。下列说法不正确的是
A.a3℃时三种物质的溶解度由大到小的顺是:甲>乙=丙
B.乙中含有少量甲时,可用冷却热饱和溶液的方法提纯乙
C.a1℃时将30g乙加入5g水中充分溶解,所得溶液中溶质与溶剂的质量比为2:5
D.将a3℃甲、乙、丙三种物质的饱和溶液分别降温至a2℃,所得溶液的溶质质量分数由大到小的顺序是:甲>丙>乙
9.K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如图。下列说法正确的是( )
温度 20 40 50 60 80
溶解度/g 110 117 121 126 139
31.6 63.9 85.5 110 169
A.曲线乙代表K2CO3的溶解度曲线
B.t应在50~60°之间
C.t°C时甲、乙两物质所形成溶液的溶质质量分数相等
D.40°C时,100gKNO3饱和溶液中含63.9gKNO3
10.下列饮料中,不属于溶液的是
A.可口可乐 B.啤酒 C.雪碧 D.酸奶
11.下列关于溶液的说法中,正确的是
A.当饱和溶液析出晶体后,剩余溶液中溶质的质量分数一定减少
B.某溶液降低温度后能析出晶体,则原溶液一定是饱和溶液
C.接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态
D.20℃,氯化钠的溶解度为36g,则20℃时100g氯化钠饱和溶液中含有氯化钠36g
二、填空题
12.用化学用语表示:
(1)碘酒的溶剂成分_______;
(2)氦气_______;
(3)三个亚铁离子_______;
(4)保持五氧化二磷化学性质的最小粒子_______。
13.如图是A、B.C三种固体物质的溶解度曲线。
(1)在t1°C时,A物质饱和溶液中溶质和溶剂的质量比为___________________。
(2)20°C时,A、B、C三种物质的饱和溶液各100g 中,溶剂质量最大的是________________。
(3) t2°C时,准确称取A物质40g,加入50g水中,在不改变溶剂质量的前提下,若想把A物质完全溶解,你设计的操作是__________________。
14.人类的日常生活和工农业生产离不开水。请回答:
(1) 含有较多可溶性钙、镁化合物的水叫做__________(填“软水”或“硬水”);
(2) 下列净化水的单一操作中,相对净化程度较高的是___________(填字母);
A.静置沉淀 B.吸附沉淀 C. 蒸馏
(3) 水在通电的条件下可以分解,写出该反应的化学方程式__________;
(4) 甲和乙两种固体物质的溶解度曲线如右图所示,回答下列问题:
①在_________℃时,甲和乙两种物质的溶解度相等;
②将t1℃时等质量的甲和乙两种物质的饱和溶液分别降温到0℃,析出固体质量较少的是________(填“甲”或“乙”);
③t2℃时,将60 g甲物质放入100 g 水中,充分搅拌,所得溶液的溶质质量分数ω(甲)与同温下乙物质的饱和溶液的溶质质量分数ω(乙)大小关系为_________(填字母)
A.ω(甲)< ω(乙) B.ω(甲)> ω(乙)
C. ω(甲)= ω (乙) D.无法确定
三、推断题
15.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
16.A、B、C、D、E、F均是初中化学中的常见物质,其中A、D为单质,其余均为化合物,B、C由两种相同元素组成。
(1)A在D中完全燃烧和不完全燃烧时,生成不同的气体。B溶液在一定条件下可反应生成C和无色气体D,C和D都与生命活动息息相关。B溶液中的溶质是_____(用化学式表示)
(2)如图所示将固体E放入大烧杯中的水里,小烧杯中F的饱和溶液变浑浊。则E的化学式可能为_____,产生此现象的原因是_____________。
四、实验题
17.化学是以实验为基础的学科,根据实验一、二、三回答下列问题。
实验一 实验二 实验三
(1)实验一:待红磷熄灭冷却后,打开弹簧夹,观察到集气瓶内水面上升_____,该现象说明氮气的化学性质稳定。
(2)实验二:实验室制取O2和CO2能共用的发生装置是_____,仪器a的名称是_____。若用C装置收集二氧化碳气体,请把导管图补充完整,并在b、c处标明气体流动的方向_____。
(3)实验三:将试管②和④的现象相比较得到的结论是_____。
18.如图是实验室制取气体的有关装置图,据图回答下列问题:
(1)CO2的制取方法有多种,若用加热碳酸氢钠固体制取CO2,应选用的发生和收集装置为_______(填装置序号)。
(2)小海同学在装置B中加入15%的过氧化氢溶液和二氧化锰制取氧气。
①若用F装置收集氧气,氧气应从_______(填“a”或“b”)端通入。
②实验中发现不能得到平稳的氧气流,小涛同学提出可以从两个方面加以改进:
一是将制取的装置B换为上图中的装置_______(填装置序号);
二是将过氧化氢溶液加水稀释。如果把50g溶质质量分数为15%的过氧化氢溶液稀释成溶质质量分数为10%的溶液需加水的质量为_______克。
五、计算题
19.实验室配制500g溶质质量分数为20%氢氧化钠溶液。
(1)用氢氧化钠固体和水配制溶液,需氢氧化钠固体的质量为____ g。
(2)按要求配制好溶液后,取其中100g溶液稀释成溶质质量分数为5%的氢氧化钠溶液,需加水的质量为____ g。
(3)过氧化钠是一种淡黄色固体,能与水发生化学反应,其反应的化学方程式为:2Na2O2+2H2O==4NaOH+O2↑。现将7.8g过氧化钠投入到100g 溶质质量分数为10%的氢氧化钠溶液中,完全反应。求反应后所得溶液的溶质质量分数。_________(写出计算过程,最后结果精确到0.1% 。)
参考答案:
1.C 2.D 3.A 4.A 5.D 6.C 7.D 8.B 9.A 10.D 11.C
12. C2H5OH He 3Fe2+ P2O5
13. 1:5 C 升高温度到t3℃
14. 硬水 C 2H2O2H2↑+O2↑ 20 乙 B
15. 75 a>b>c
16. H2O2 NaOH或CaO E溶于水放热
17. 集气瓶内空气部分体积的五分之一 B 锥形瓶 不同的溶质在同种溶剂中的溶解能力不同
18. AD a C 25
19.(1)100(2)300(3)16.9%
一、单选题
1.下列实验现象描述正确的是
A.铁丝伸入盛氧气的集气瓶中剧烈燃烧
B.红磷在空气中燃烧产生大量白雾
C.硫燃烧时生成有刺激性气味的气体
D.氢氧化钠溶于水时溶液温度降低
2.在一定温度下,将少量生石灰放入一定量的饱和石灰水中,投拌并冷却至原来温度,下列说法正确的是
A.溶剂质量不变 B.溶质质量增加
C.溶解度变小 D.溶液中溶质的质量分数不变
3.下列实验方案不能达到实验目的是
A.探究影响溶解性的因素 B.证明可燃物燃烧需要氧气
C.证明二氧化碳能溶于水 D.比较Fe、Ag、Zn的金属活动性
4.某同学梳理归纳了以下知识: ①硬水通过活性炭吸附后可变为软水②两瓶气体元素组成相同,则它们的化学性质一定相同③离子是带电的粒子,所以带电的粒子一定是离子④配制6%的氯化钠溶液,量取水时,俯视量筒刻度会使所配氯化钠溶液质量分数偏高⑤元素的种类由原子的最外层电子数决定⑥除去铜粉中混有的少量炭粉,可采用在空气中灼烧混合物的方法。其中正确的个数有
A.1个 B.2个 C.3个 D.4个
5.将少量的下列物质分别放入水中并充分搅拌,其中不能形成溶液的是
A.白砂糖 B.食盐 C.高锰酸钾 D.植物油
6.下列有关溶液的说法中,正确的是
A.溶液一定是均一的、无色的
B.食用油和水的混合物是一种溶液
C.溶液一定是一种混合物
D.溶液一定是固体溶于水形成的
7.a、b两种物质的溶解度曲线如图所示。下列说法不正确的是
A.15 ℃时,a、b的溶解度均为20 g
B.加水或升温均可使b的饱和溶液变为不饱和溶液
C.将15 ℃时a的饱和溶液升温至30 ℃,有晶体析出
D.将30 ℃时a、b的饱和溶液降温至15 ℃,此时a、b两种溶液中溶质的质量分数相等
8.如图是甲、乙、丙三种固体物质的溶解度曲线。下列说法不正确的是
A.a3℃时三种物质的溶解度由大到小的顺是:甲>乙=丙
B.乙中含有少量甲时,可用冷却热饱和溶液的方法提纯乙
C.a1℃时将30g乙加入5g水中充分溶解,所得溶液中溶质与溶剂的质量比为2:5
D.将a3℃甲、乙、丙三种物质的饱和溶液分别降温至a2℃,所得溶液的溶质质量分数由大到小的顺序是:甲>丙>乙
9.K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如图。下列说法正确的是( )
温度 20 40 50 60 80
溶解度/g 110 117 121 126 139
31.6 63.9 85.5 110 169
A.曲线乙代表K2CO3的溶解度曲线
B.t应在50~60°之间
C.t°C时甲、乙两物质所形成溶液的溶质质量分数相等
D.40°C时,100gKNO3饱和溶液中含63.9gKNO3
10.下列饮料中,不属于溶液的是
A.可口可乐 B.啤酒 C.雪碧 D.酸奶
11.下列关于溶液的说法中,正确的是
A.当饱和溶液析出晶体后,剩余溶液中溶质的质量分数一定减少
B.某溶液降低温度后能析出晶体,则原溶液一定是饱和溶液
C.接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态
D.20℃,氯化钠的溶解度为36g,则20℃时100g氯化钠饱和溶液中含有氯化钠36g
二、填空题
12.用化学用语表示:
(1)碘酒的溶剂成分_______;
(2)氦气_______;
(3)三个亚铁离子_______;
(4)保持五氧化二磷化学性质的最小粒子_______。
13.如图是A、B.C三种固体物质的溶解度曲线。
(1)在t1°C时,A物质饱和溶液中溶质和溶剂的质量比为___________________。
(2)20°C时,A、B、C三种物质的饱和溶液各100g 中,溶剂质量最大的是________________。
(3) t2°C时,准确称取A物质40g,加入50g水中,在不改变溶剂质量的前提下,若想把A物质完全溶解,你设计的操作是__________________。
14.人类的日常生活和工农业生产离不开水。请回答:
(1) 含有较多可溶性钙、镁化合物的水叫做__________(填“软水”或“硬水”);
(2) 下列净化水的单一操作中,相对净化程度较高的是___________(填字母);
A.静置沉淀 B.吸附沉淀 C. 蒸馏
(3) 水在通电的条件下可以分解,写出该反应的化学方程式__________;
(4) 甲和乙两种固体物质的溶解度曲线如右图所示,回答下列问题:
①在_________℃时,甲和乙两种物质的溶解度相等;
②将t1℃时等质量的甲和乙两种物质的饱和溶液分别降温到0℃,析出固体质量较少的是________(填“甲”或“乙”);
③t2℃时,将60 g甲物质放入100 g 水中,充分搅拌,所得溶液的溶质质量分数ω(甲)与同温下乙物质的饱和溶液的溶质质量分数ω(乙)大小关系为_________(填字母)
A.ω(甲)< ω(乙) B.ω(甲)> ω(乙)
C. ω(甲)= ω (乙) D.无法确定
三、推断题
15.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
16.A、B、C、D、E、F均是初中化学中的常见物质,其中A、D为单质,其余均为化合物,B、C由两种相同元素组成。
(1)A在D中完全燃烧和不完全燃烧时,生成不同的气体。B溶液在一定条件下可反应生成C和无色气体D,C和D都与生命活动息息相关。B溶液中的溶质是_____(用化学式表示)
(2)如图所示将固体E放入大烧杯中的水里,小烧杯中F的饱和溶液变浑浊。则E的化学式可能为_____,产生此现象的原因是_____________。
四、实验题
17.化学是以实验为基础的学科,根据实验一、二、三回答下列问题。
实验一 实验二 实验三
(1)实验一:待红磷熄灭冷却后,打开弹簧夹,观察到集气瓶内水面上升_____,该现象说明氮气的化学性质稳定。
(2)实验二:实验室制取O2和CO2能共用的发生装置是_____,仪器a的名称是_____。若用C装置收集二氧化碳气体,请把导管图补充完整,并在b、c处标明气体流动的方向_____。
(3)实验三:将试管②和④的现象相比较得到的结论是_____。
18.如图是实验室制取气体的有关装置图,据图回答下列问题:
(1)CO2的制取方法有多种,若用加热碳酸氢钠固体制取CO2,应选用的发生和收集装置为_______(填装置序号)。
(2)小海同学在装置B中加入15%的过氧化氢溶液和二氧化锰制取氧气。
①若用F装置收集氧气,氧气应从_______(填“a”或“b”)端通入。
②实验中发现不能得到平稳的氧气流,小涛同学提出可以从两个方面加以改进:
一是将制取的装置B换为上图中的装置_______(填装置序号);
二是将过氧化氢溶液加水稀释。如果把50g溶质质量分数为15%的过氧化氢溶液稀释成溶质质量分数为10%的溶液需加水的质量为_______克。
五、计算题
19.实验室配制500g溶质质量分数为20%氢氧化钠溶液。
(1)用氢氧化钠固体和水配制溶液,需氢氧化钠固体的质量为____ g。
(2)按要求配制好溶液后,取其中100g溶液稀释成溶质质量分数为5%的氢氧化钠溶液,需加水的质量为____ g。
(3)过氧化钠是一种淡黄色固体,能与水发生化学反应,其反应的化学方程式为:2Na2O2+2H2O==4NaOH+O2↑。现将7.8g过氧化钠投入到100g 溶质质量分数为10%的氢氧化钠溶液中,完全反应。求反应后所得溶液的溶质质量分数。_________(写出计算过程,最后结果精确到0.1% 。)
参考答案:
1.C 2.D 3.A 4.A 5.D 6.C 7.D 8.B 9.A 10.D 11.C
12. C2H5OH He 3Fe2+ P2O5
13. 1:5 C 升高温度到t3℃
14. 硬水 C 2H2O2H2↑+O2↑ 20 乙 B
15. 75 a>b>c
16. H2O2 NaOH或CaO E溶于水放热
17. 集气瓶内空气部分体积的五分之一 B 锥形瓶 不同的溶质在同种溶剂中的溶解能力不同
18. AD a C 25
19.(1)100(2)300(3)16.9%
同课章节目录
