2023年高三化学二轮专题复习 化学反应原理备考策略暨原创题赏析(共84张PPT)
文档属性
| 名称 | 2023年高三化学二轮专题复习 化学反应原理备考策略暨原创题赏析(共84张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-28 15:20:35 | ||
图片预览








文档简介
(共84张PPT)
《2023年化学反应原理综合题复习备考
策略暨原创题赏析》
01
新高考的理解
02
命题特点和规律
03
高考试题典例分析
04
备考策略
目 录
05
原创题赏析
01
对新高考的理解
01
对新高考的理解
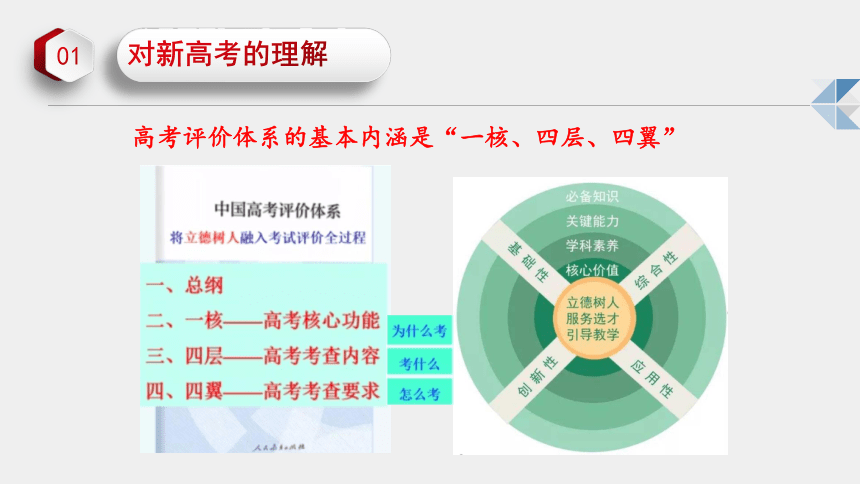
高考评价体系的基本内涵是“一核、四层、四翼”
01
对新高考的理解
高考评价体系将“必备知识、关键能力 、学科素养、核心价值”作为考查内容,将高校人才选拔要求和国家课程标准有机结合在一起,使选人和育人目标统一于落实立德树人根本任务,系统地回答了高考“考什么”的问题。
01
对新高考的理解
情境:高考评价体系中的考查载体
01
对新高考的理解
情境:高考评价体系中的考查载体
01
对新高考的理解
化学科考查载体五类试题情境
1.日常生活情境。(食物营养、合成药物、常见材料和能量转化设备)
2.生产环保情境。(自然资源利用、生产条件优化、废物回收利用和毒害物质处理)
3.学术探究情境。(最新合成方法、新颖功能物质和新型催化技术)
4.实验探究情境。(基本操作实验、研究性实验)
5.化学史料情境。
01
对新高考的理解
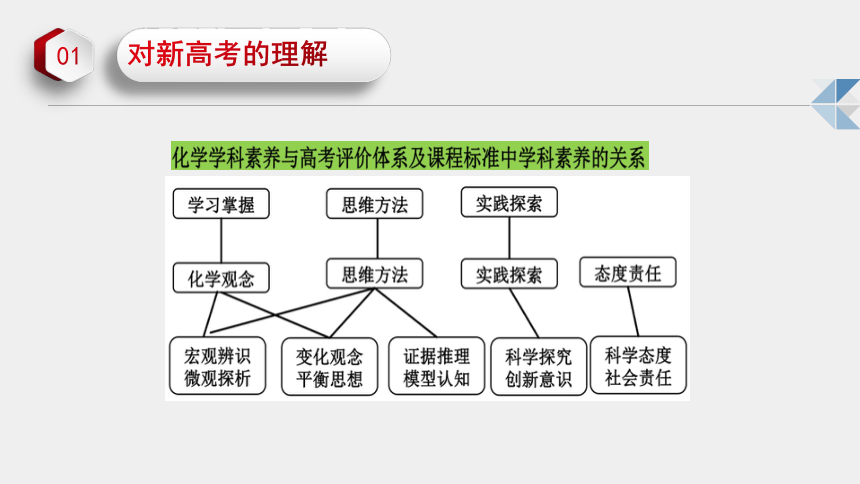
化学学科核心素养构成要素之间具有内在的本质联系。“宏观辨识与微观探析”“变化观念与平衡思想”和“证据推理与模型认知”,分别是从学科观念和思维方式视角对化学科学思维的描述,要求学生形成化学学科的思想和方法;“科学探究与创新意识”是对化学科学实践的表征,从实践层面激励学生勇于创新;“科学态度与社会责任”是对化学科学价值取向的刻画,是化学学科整体育人功能和价值的具体表现,揭示了化学学习更高层次的价值追求。
01
对新高考的理解
01
对新高考的理解
01
对新高考的理解
核心能力
获取处理
信息能力
分析解决问题能力
化学实验与探究能力
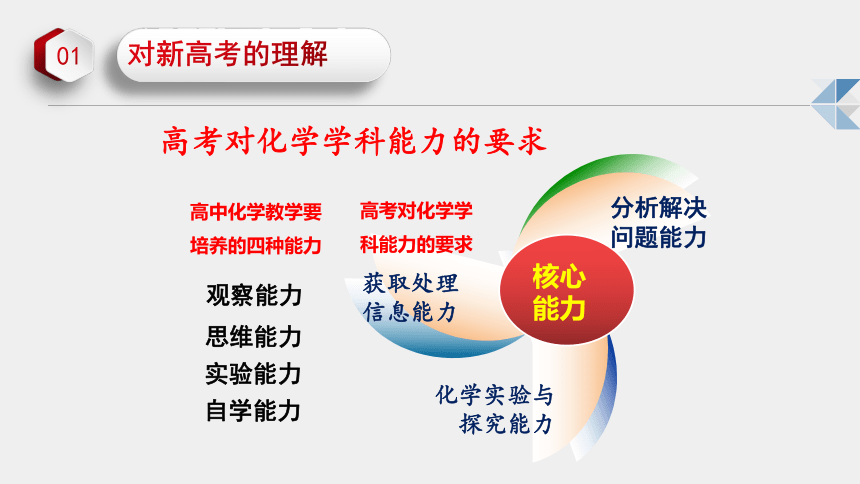
高中化学教学要培养的四种能力
观察能力
思维能力
实验能力
自学能力
高考对化学学科能力的要求
高考对化学学科能力的要求
01
对新高考的理解
与其大量做题,不如抽出时间认真研究往年的试题,往年的试题是精雕细磨的产物,它反映了对考试内容的深思熟虑、对设问和答案的准确拿捏、对学生水平的客观判断。研究这些试题,就如同和试题的制作者对话。
——教育部考试中心 刘芃《考试文集》
研究高考题,才能预测高考题,高考题就是最好的复习资料,认真研究历年高考试题不难找出命题轨迹,从而把握试题难度。
——高考化学命题组长、南京大学段康宁教授
最重要、最直接、最有效的高考信息就是历年来,尤其是近年来的高考试题。这是因为高考命题组的成员是“稳定的”,在“稳中求进”的要求下,命题组在把握课程的基本要求及如何有效考查这方面的意图,已经体现在历年高考试题中。
——北大教授严宣申
01
对新高考的理解
【近年高考试题总体评价】
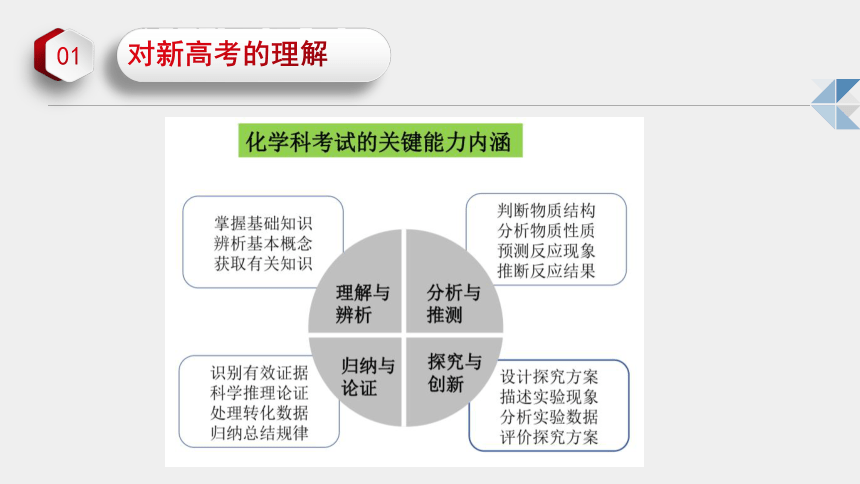
从教育部考试中心命制的高考化学试题来看,以“价值引领、素养导向、能力为重、知识为基”为命题基本理念,以普通高中化学课程标准(2017年版)(以下简称(课程标准)和中国高考评价体系为命题依据,以考查化学观念、思维方法、实践探索、态度责任等化学学科核心素养为命题立意,体现基础性、综合性、应用性和创新性的考试要求,发挥化学学科独特的育人功能。试题选取具有鮮明时代特色和科技前沿的素材,呈现真实情境,通过精心设计的问题,在检测必备知识掌情况的基础上,突出考查理解与辩析能力、分析与推测能力、归纳与论证能力、探究与创新能力等化学学科关键能力。高考化学试题在落实党的教育方针、对接高中课程改革、深化高考内容改革方面等均有新的突破,在彰显教育改革鲜明方向的同时,也为今后高中化学教学及高考备考给出了明确的导向。
01
对新高考的理解
一、把握育人导向,精选试题情境素材
除了少量考查基础知识和基本概念的试题外,大部分试题围绕某一特定主题情境,以文字、数据、图表等形式呈现,这些情境主要包括日常生活情境、生产环保情境、学术探索情境、实验探索情境、化学史料情境五个方面。
1.以我国古代文化和典籍中的化学知识为情境,增强考生民族自豪感。
2.以我国科学家最新研究成果为情境,增强考生国家成就感。
01
对新高考的理解
二、凸显学科素养,把握主干知识精心设问
在试题命制和考点设置上,体现了对化学观念、思维方法、实践探索、态度责任的考查,体现了对高考评价中的基础性、应用性、综合性、创新性的考查,突出了对必备知识、关键能力、化学学科素养的考查,体现了高考在服务选才和引导教学上的重要功能。
1.考查必备知识,体现基础性和综合性,引领关注学科重点。
01
对新高考的理解
2.考查关键能力,体现应用性和创新性,引领关注学科素养。
在试题命制和设问上,着眼学生未来的长远发展,重点考查理解与辨析能力、分析与推测能力、归纳与论证能力、探究与创新能力等化学学科关键能力。
02
命题特点和规律
化学反应原理综合题高考呈现
——怎么考?
02
命题特点和规律
年份 2022年甲卷 2022年乙卷 2021年甲卷 2021年乙卷 2020年1卷 2019年1卷 2018年1卷
载体 TiCl4的工业制备 H2S的回收处理 CO2制甲醇 ICl的制备及性质探究 SO2的催化氧化 水煤气变换 N2O5的分解
作 答 量 8个空(填空3个、选择2个、计算3个) 9个空(填空3个、选择2个、计算4个) 8个空(填空2个、选择2个、计算4个) 8个空(填空2个、选择3个、计算3个) 7个空(写方程1个、简答3个、、计算3个) 10个空(填空4个、写方程1个、选择3个、计算2个) 8个空(填空3个、选择1个、计算4个)
涉及知识点 (1)压强平衡常数的计算; (2) 平衡移动、转化率的判断(3)盖斯定律(4)反应条件的选择 (1)反应热的计算(2)转化率的计算(3)压强平衡常数的计算(4)图像分析。(5)转化率的影响因素(6)热分解法的优缺点 (1)压强平衡常数的计算(2)转化率的计算(3)焓变的判断及推理(4)图像分析。 (1)压强平衡常数的计算(2)转化率的计算(3)焓变的判断及推理(4)图像分析。(5)反应条件的选择(6)读图计算 (1)盖斯定律(写热方程) ; (2) 曲线分析:计算平衡转化率并说明理由、影响平衡转化率的因素;(3)分压计算(4)平衡常数计算(5)速率方程的应用、 (1)物质的量分数判断反应倾向(2)物质的量分数判断(3)焓变(4)活化能(5)写化学反应方程式(6)平均反应速率的计算(7)识图计算、化学平衡 (1)氧化还原(2)盖斯定律(3)速率方程的应用、(4)分压计算、(5)平衡常数计算、(6)反应历程判断(7)平衡移动原理的应用。
02
命题特点和规律
【2022·全国甲卷】:金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化TiCl4为有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:TiO2 (s)+ 2Cl2 (g) ==TiCl4(g) +O2 (g) △H=+172kJ·mol-1 KP1=1.0×10-2Pa
(ⅱ)碳氯化:TiO2 (s)+ 2Cl2 (g)+ 2C (s) ==TiCl4(g) +2CO (g) △H=-51kJ·mol-1 KP1=1.2×1012Pa
①反应 2C (s) + O2 (g) ==2CO (g)的△H为_______2kJ·mol-1,KP=_________Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是________________________________
___________________________________________________________________________
___________________________________________________________________________。
③对于碳氯化反应:增大压强,平衡_______移动(填“向左”“向右”或“不”);温度升高,平衡转化率_______(填“变大”“变小”或“不变”)。
-223
1.2×1014
碳氯化反应气体分子数增加,
H小于0,是熵增、放热过程,熵判据与焓判据均是自发过程,
而直接氯化的体系气体分子数不变、且是吸热过程
向左
变小
02
命题特点和规律
(2)在1.0×105Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①反应 C (s) + CO2 (g) ==2CO (g)的平衡常数 KP(400℃)=___________Pa。
②图中显示,在200℃平衡时TiO2 几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是_________________________________________________________________________。
(3)TiO2碳氯化是一个“气—固—固”反应,有利于TiO2--C “固—固”接触的措施是_____________________________________________________________。
7.2×105
为了提高反应速率,在相同时间内得到更多的TiCl4产品,提高效益
将两固体粉碎后混合,同时鼓入Cl2,使固体粉末“沸腾”
02
命题特点和规律
【2022·全国乙卷】: 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
① 2H2S(g) + 3O2 (g) == 2SO2(g) +2H2O (g) △H1=-1036kJ·mol-1
② 4H2S(g) +2SO2(g) == 3S2(g) +4H2O (g) △H2=94kJ·mol-1
③ 2H2(g) +O2(g) ==2H2O (g) △H3= -484kJ·mol-1
计算H2S热分解反应④2H2S(g) == S2(g) +2H2 (g) 的△H4=________kJ·mol-1。
170
02
命题特点和规律
(2)较普遍采用的H2S处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解H2S。相比克劳斯工艺,高温热分解方法的优点是_______________________,
缺点是________。
(3)在1470K、100kPa反应条件下,将n(H2S) :n(Ar)的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为________,平衡常数KP=________kPa。
副产物氢气可作燃料
耗能高
50%
4.76
02
命题特点和规律
(4)在1373K、100kPa反应条件下,对于n(H2S) :n(Ar)分别为4:1、1:1、1:4、1: 9、1:19的H2S -Ar混合气,热分解反应过程中H2S转化率随时间的变化如下图所示。
①n(H2S) :n(Ar)越小,H2S平衡转化率________,理由是____________________________
________________________________________________________________________。
②n(H2S) :n(Ar)=1: 9对应图中曲线________,计算其在0-0.1之间,H2S分压的平均变化率为________kPa·s-1。
24.9
越高
n(H2S):n(Ar)越小,H2S的分压越小,
n(H2S):n(Ar)越小,H2S的分压越小,平衡向正反应方向进行,H2S平衡转化率越高
d
02
命题特点和规律
【2021·全国甲卷】:二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g) + 3H2 (g) == 2CH3OH(g) +H2O (g)
该反应一般认为通过如下步骤来实现:
①CO2(g) + H2 (g) == CO(g) +H2O (g) △H1=+41kJ·mol-1
②CO(g) +2 H2 (g) == CH3OH (g) △H2=-90kJ·mol-1
总反应的 △H=_______kJ·mol-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是_______(填标号),判断的理由是___________________________________________________________。
A.
A B C D
ΔH1为正值,ΔH2为和ΔH为负值,反应①的活化能大于反应②的
49
A
02
命题特点和规律
(2)合成总反应在起始物n(H2)/n(CO2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为X(CH3OH),在t=250℃下的X(CH3OH)~P、在 P=5×105Pa
下的X(CH3OH)~t如图所示。
①用各物质的平衡分压表示总反应的平衡常数,表达式KP=________________;
②图中对应等压过程的曲线是_______,判断的理由是_____________________________________________________________________________________;
③当时X(CH3OH)=0.10,CO2的平衡转化α=_______,反应条件可能为____________________或____________________。
总反应ΔH<0,升高温度时平衡向逆反应方向移动,甲醇的物质的量分数变小
b
33.3%
9×105Pa,250℃
5×105Pa,210℃
02
命题特点和规律
【2021·全国乙卷】:一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1)历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig误认为是ICl,从而错过了一种新元素的发现,该元素是_______。
(2)氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt和Cl2,376.8℃时平衡常数KP=1.0×104kPa2,在一硬质玻璃烧瓶中加入过量BaPtCl6,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0 kPa。376.8℃平衡时,测得烧瓶中压强为32.5 kPa,则
P(ICl)=_______ kPa,反应2ICl(g)== Cl2(g) +2I2O(g) 的平衡常数K=_________________(列出计算式即可)。
溴
24.8
02
命题特点和规律
(3)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数KP。
2NO(g) +2ICl(g) 2NOCl(g) +2I2(g) KP1
2NOCl(g) +2ICl(g) 2NOCl(g) +2I2(g) KP1
得到 和 均为线性关系,如下图所示:
①由图可知,NOCl分解为NO和Cl2反应的
△H_______0(填“大于”或“小于”)
②反应2ICl(g)Cl2(g) +2I2(g)的K=___________(用KP1、K12表示):
该反应的△H_______0(填“大于”或“小于”),写出推理过程_______。
大于
大于
02
命题特点和规律
4)Kistiakowsky曾研究了NOCl光化学分解反应,在一定频率(v)光的照射下机理为:
NOCl + hv → NOCl*
NOCl +NOCl* → NO + Cl2
其中hv表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收_______mol光子。
0.5
02
命题特点和规律
【2020·全国Ⅰ卷】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g) + O2(g) SO3(g) ΔH= 98 kJ·mol 1。回答下列问题:
⑴钒催化剂参与反应的能量变化如图(a)所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为: 。
2V2O5(s)+ 2SO2(g)=2VOSO4(s)+V2O4(s) ΔH = 351 kJ·mol 1
考查运用盖斯定律书写热化学方程式
02
命题特点和规律
⑵当SO2(g)、O2(g)和N2(g)起始的物质的量
分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温 度的变化如图(b)所示。反应在5.0MPa、550℃时的α=_____,判断的依据
是 。
影响α的因素有 。
0.975
该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa = p2,所以p1= 5.0Mpa
温度、压强和反应物的起始浓度(组成)
⑶将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为___________________,平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)。
考查平衡转化率的计算及影响因素
考查分压及平衡常数Kp的计算
02
命题特点和规律
⑷研究表明,SO2催化氧化的反应速率方程为:
式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α‘为某时刻SO2转化率,n为常数。在α’=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图(c)所示。曲线上v最大值所对应温度称为该α‘下反应的最适宜温度tm。ttm后,v逐渐下降。原因是_______________________
__________________________________
________________________________________________。
α引起的降低; t>tm后,k增大对v的提高小于α引起的降低。
考查化学反应速率、化学平衡的影响因素
升高温度,k增大使v逐渐提高,
但α降低使v逐渐下降。t02
命题特点和规律
【2019·全国Ⅰ卷】 水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是
重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_______H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为___(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
大于
C
02
命题特点和规律
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂
表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。可知水煤气变换的ΔH______0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_______eV,写出该步骤的化学方程式____________________________________________________。
小于
2.02
COOH*+H*+H2O*=COOH*+2H*+OH*或H2O*=H*+OH*
02
命题特点和规律
(4)Shoichi研究了467 ℃、489 ℃时水煤气
变换中CO和H2分压随时间变化关系(如下图
所示),催化剂为氧化铁,实验初始时体系
中的 pH2O和pCO相等、pCO2和pH2 相等。计算
曲线a的反应在30~90 min内的平均速率
(a)=_______ kPa·min 1。467 ℃时 和 随时间
变化关系的曲线分别是_______、_______。
489 ℃时 和 随时间变化关系的曲线分别是
_____、_____。
d
0.0047
b
c
a
02
命题特点和规律
【关键能力】本题考查的关键能力侧重于理解与辩析、分析与推测、归纳与论证:一是从提供的新信息中,准确地提取实质性内容,并与已有知识整合、重组为新知识块的能力;二是通过对图形、图表的阅读,获取有关的感性知识和印象,并进行加工、吸收有序存储的能力;三是将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题的能力;四是将分析和解决问题的过程及成果,能正确地运用化学术语进行表达的能力。本题具体要求是根据题给信息,特别是图像、图示中隐含的信息,结合所学知识对平衡常数计算和应用、反应类型、活化能、反应速率的计算和曲线的含义等进行综合分析判断。
【学科素养】本题考查的学科素养侧重于化学观念、思维方法、实践探索和态度责任。化学观念:能根据题给反应历程的图示,分析反应热、活化能和书写化学方程式。思维方法:通过分析反应历程,认识化学变化过程中的能量变化;能根据物质的量分数的大小关系判断反应限度;能够判断平衡体系中生成物的物质的量分数的大小范围;能够根据图像中数据判断各平衡状态时物质的压强。实践探索:根据真实情境,通过国内外科学成果的展示,体现科学探究和创新意识。态度责任:能够赞赏化学对人类发展所做出的突出贡献。
02
命题特点和规律
【2020·全国Ⅰ卷】28.采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。
回答下列问题:
(1)1840年Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为 。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t = 时,N2O5(g)完全分解):
t / min 0 40 80 160 260 1300 1700
p / kPa 35.8 40.3 42.5 45.9 49.2 61.2 62.3 63.1
O2
多反应体系,真实情境研究
试题背景:N2O5作为新型的硝化剂,其热力学和动力学研究具有一定价值
02
命题特点和规律
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1= 4.4 kJ·mol 1
2NO2(g) =N2O4(g) ΔH 2= 55.3 kJ·mol 1
则反应N2O5(g)=2NO2(g)+1/2 O2(g)的ΔH =_______ kJ·mol 1。
②研究表明,N2O5(g)分解的反应速率v=2×10 3× (kPa·min 1)。t=62 min时,测得体系中 =2.9kPa,则此时的 =___ kPa,v=_______ kPa·min 1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是____________________
________________________________________________________________ 。
④25℃时N2O4(g)= 2NO2(g)反应的平衡常数Kp=_______kPa(计算结果保留1位小数)。
+53.1
30.0
6.0×10-2
大于
温度提高,体积不变,
13.4
总压强提高; NO2二聚为放热反应,温度提高,平衡左移,总压强提高
反应热的常规计算
“三段式”的运用
考查分析、解决问题的能力
02
命题特点和规律
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提
出如下反应历程:
第一步 N2O5 NO3+NO2 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是__________(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
AC
以反应历程为研究对象,考查有效碰撞、活化能等相关概念
03
高考试题典例分析
化学反应原理综合题高考呈现
——考什么?
03
高考试题典例分析
近年全国卷化学反应原理综合题主要知识点
常以实际工业生产、化合物性质与转化、化合物制备等为素材,常考查考生盖斯定律的应用、化学平衡移动原理、转化率、化学平衡常数、化学反应速率、陌生化学反应方程式书写或判断化学式、溶度积常数、电化学等方面的知识。能较好地检测学生在已有知识的前提下,从定性和定量视角分析问题和解决问题能力、化学基本计算能力以及运用化学用语正确表达的能力。
03
高考试题典例分析
1.盖期定律、△H
2.平衡常数
3.化学平衡及移动、转化率
4.化学反应速率与化学平衡图像分析
6.速率方程
7.活化能
原理综合题考点:
5.化学反应速率及影响因素
8.陌生方程式的书写
03
高考试题典例分析
热点
盖斯定律
平衡常数计算
化学平衡
转化率
化学反应速率
陌生方程式书写
溶度积常数
电化学
化学反应原理综合题
情境新
反应新
设问新
图表多
描述多
计算多
特点
03
高考试题典例分析
1.盖期定律、△H
【2022·全国甲卷】:金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化TiCl4为有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:TiO2 (s)+ 2Cl2 (g) ==TiCl4(g) +O2 (g) △H=+172kJ·mol-1 KP1=1.0×10-2Pa
(ⅱ)碳氯化:TiO2 (s)+ 2Cl2 (g)+ 2C (s) ==TiCl4(g) +2CO (g) △H=-51kJ·mol-1 KP1=1.2×1012Pa
①反应 2C (s) + O2 (g) ==2CO (g)的△H为_______2kJ·mol-1。
-223
03
高考试题典例分析
1.盖期定律、△H
【2022·全国乙卷】: 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
① 2H2S(g) + 3O2 (g) == 2SO2(g) +2H2O (g) △H1=-1036kJ·mol-1
② 4H2S(g) +2SO2(g) == 3S2(g) +4H2O (g) △H2=94kJ·mol-1
③ 2H2(g) +O2(g) ==2H2O (g) △H3= -484kJ·mol-1
计算H2S热分解反应④2H2S(g) == S2(g) +2H2 (g) 的△H4=________kJ·mol-1。
170
03
高考试题典例分析
1.盖期定律、△H
【2021·全国甲卷】:二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g) + 3H2 (g) == 2CH3OH(g) +H2O (g)
该反应一般认为通过如下步骤来实现:
①CO2(g) + H2 (g) == CO(g) +H2O (g) △H1=+41kJ·mol-1
②CO(g) +2 H2 (g) == CH3OH (g) △H2=-90kJ·mol-1
总反应的 △H=_______kJ·mol-1;
49
03
高考试题典例分析
1.盖期定律、△H
【2020·全国Ⅰ卷】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g) + O2(g) SO3(g) ΔH= 98 kJ·mol 1。回答下列问题:
⑴钒催化剂参与反应的能量变化如图(a)所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为: 。
2V2O5(s)+ 2SO2(g)=2VOSO4(s)+V2O4(s) ΔH = 351 kJ·mol 1
03
高考试题典例分析
1.盖期定律、△H
【2019·全国Ⅰ卷】
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。可知水煤气变换的ΔH______0(填“大于”“等于”或“小于”),。
小于
(1)从图中分判断ΔH
03
高考试题典例分析
1.盖期定律、△H
【2018·全国Ⅰ卷】
(2) ①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1= 4.4 kJ·mol 1
2NO2(g) =N2O4(g) ΔH 2= 55.3 kJ·mol 1
则反应N2O5(g)=2NO2(g)+ O2(g)的ΔH =_______ kJ·mol 1。
+53.1
【2018·全国Ⅱ卷】
(1)CH4-CO2催化重整反应为:CH4(g)+ CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)= CH4 (g) ΔH=-75 kJ·mol 1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol 1
C(s)+ O2(g)=CO(g) ΔH=-111 kJ·mol 1
该催化重整反应的ΔH=______ kJ·mol 1
+247
03
高考试题典例分析
化学平衡与化学反应速率
主要从化学热力学和化学动力学两个方面去考查,以气相研究居多。
化学平衡常数
化学平衡及移动、转化率
化学反应速率与化学平衡图像分析
化学反应速率及影响因素
化学速率方程
活化能与催化剂
高频考点:
03
高考试题典例分析
2.平衡常数
【2022·全国甲卷】:金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化TiCl4为有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:TiO2 (s)+ 2Cl2 (g) ==TiCl4(g) +O2 (g) △H=+172kJ·mol-1 KP1=1.0×10-2Pa
(ⅱ)碳氯化:TiO2 (s)+ 2Cl2 (g)+ 2C (s) ==TiCl4(g) +2CO (g) △H=-51kJ·mol-1 KP1=1.2×1012Pa
①反应 2C (s) + O2 (g) ==2CO (g)的KP=_________Pa。
1.2×1014
03
高考试题典例分析
2.平衡常数
【2022·全国甲卷】(2)在1.0×105Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①反应 C (s) + CO2 (g) ==2CO (g)的平衡常数
KP(400℃)=___________Pa。
7.2×105
03
高考试题典例分析
2.平衡常数
【2021·全国甲卷】(2)合成总反应在起始物n(H2)/n(CO2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为X(CH3OH),在t=250℃下的X(CH3OH)~P、在 P=5×105Pa
下的X(CH3OH)~t如图所示。
①用各物质的平衡分压表示总反应的平衡常数,
表达式KP=________________;
03
高考试题典例分析
2.平衡常数
【2021·全国乙卷】:(2)氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt和Cl2,376.8℃时平衡常数KP=1.0×104kPa2,在一硬质玻璃烧瓶中加入过量BaPtCl6,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0 kPa。376.8℃平衡时,测得烧瓶中压强为32.5 kPa,则
P(ICl)=_______ kPa,反应2ICl(g)== Cl2(g) +2I2O(g) 的平衡常数K=_________________(列出计算式即可)。
24.8
(3)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数KP。
2NO(g) +2ICl(g) 2NOCl(g) +2I2(g) KP1
2NOCl(g) +2ICl(g) 2NOCl(g) +2I2(g) KP1
②反应2ICl(g)Cl2(g) +2I2(g)的K=___________(用KP1、KP2表示):
03
高考试题典例分析
【2020·全国Ⅰ卷】⑶将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为___________________,平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)。
2.平衡常数
03
高考试题典例分析
3.化学平衡及移动、转化率
【2022·全国甲卷】:金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化TiCl4为有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:TiO2 (s)+ 2Cl2 (g) ==TiCl4(g) +O2 (g) △H=+172kJ·mol-1 KP1=1.0×10-2Pa
(ⅱ)碳氯化:TiO2 (s)+ 2Cl2 (g)+ 2C (s) ==TiCl4(g) +2CO (g) △H=-51kJ·mol-1 KP1=1.2×1012Pa
③对于碳氯化反应:增大压强,平衡_______移动(填“向左”“向右”或“不”);温度升高,平衡转化率_______(填“变大”“变小”或“不变”)。
向左
变小
【2022·全国乙卷】(3)在1470K、100kPa反应条件下,将n(H2S) :n(Ar)的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为________,平衡常数KP=________kPa。
50%
4.76
03
高考试题典例分析
3.化学平衡及移动、转化率
【2020·全国Ⅰ卷】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g) + O2(g) SO3(g) ΔH= 98 kJ·mol 1。回答下列问题:
⑵当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温 度的变化如图(b)所示。反应在5.0MPa、550℃时的α=_____,判断的依据 。影响α的因素有 。
0.975
该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa = p2,所以p1= 5.0Mpa
温度、压强和反应物的起始浓度(组成)
03
高考试题典例分析
【2020·全国Ⅰ卷】(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_______H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_____(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
大于
C
估算K值,判断转化率的大小
估算K值大于1,判断物质的量分数区间
3.化学平衡及移动、转化率
03
高考试题典例分析
4.化学反应速率与化学平衡图像分析
【2019·全国Ⅰ卷】(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的pH2O和pCO相等、pCO2和pH2 相等。
计算曲线a的反应在30~90 min内的平均速率(a)=__________ kPa·min 1。
0.0047
03
高考试题典例分析
5.化学反应速率及影响因素
02
命题特点和规律
【2022·全国甲卷】(2)在1.0×105Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
②图中显示,在200℃平衡时TiO2 几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是_________________________________________________________________________。
(3)TiO2碳氯化是一个“气—固—固”反应,有利于TiO2--C “固—固”接触的措施是_____________________________________________________________。
为了提高反应速率,在相同时间内得到更多的TiCl4产品,提高效益
将两固体粉碎后混合,同时鼓入Cl2,使固体粉末“沸腾”
03
高考试题典例分析
【2020·全国Ⅰ卷】⑷研究表明,SO2催化氧化的反应速率方程为:
式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α‘为某时刻SO2转化率,n为常数。在α’=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图(c)所示。曲线上v最大值所对应温度称为该α‘下反应的最适宜温度tm。ttm后,v逐渐下降。原因是_______________________
__________________________________
________________________________________________。
α引起的降低; t>tm后,k增大对v的提高小于α引起的降低。
升高温度,k增大使v逐渐提高,
但α降低使v逐渐下降。t6.速率方程
03
高考试题典例分析
6.速率方程
【2018·全国Ⅰ卷】(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
②研究表明,N2O5(g)分解的反应速率v=2×10 3× (kPa·min 1)。t=62 min时,测得体系中 =2.9kPa,则此时的 =____ kPa,v =_________ kPa·min 1。
t/min 0 40 80 160 260 1300 1700 ∞
p/kPa 35.8 40.3 42.5 45.9 49.2 61.2 62.3 63.1
30.0
6.0×10-2
03
高考试题典例分析
【2018·全国Ⅱ卷】
(2)②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)· (k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________________________。
pc(CO2)、pb(CO2)、pa(CO2)
【2018·全国Ⅲ卷】
(3)③比较a、b处反应速率大小:υa________υb(填“大于”“小于”或“等于”)。反应速率υ=υ正 υ逆= ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的 =_____(保留1位小数)。
大于
1.3
6.速率方程
03
高考试题典例分析
——催化剂降低反应的活化能,加快化学反应的速率
——催化剂改变反应的途径
——催化剂的活性
——催化剂的专一性、选择性
——催化剂参加化学反应,反应前后质量和化学性质不变
7.催化剂、活化能
03
高考试题典例分析
7.催化剂、活化能
【2021·全国甲卷】:二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g) + 3H2 (g) == 2CH3OH(g) +H2O (g)
该反应一般认为通过如下步骤来实现:
①CO2(g) + H2 (g) == CO(g) +H2O (g) △H1=+41kJ·mol-1
②CO(g) +2 H2 (g) == CH3OH (g) △H2=-90kJ·mol-1
总反应的 △H=_______kJ·mol-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是_______(填标号),判断的理由是___________________________________________________________。
A.
A B C D
ΔH1为正值,ΔH2为和ΔH为负值,反应①的活化能大于反应②的
49
A
03
高考试题典例分析
7.催化剂、活化能
【2020·全国Ⅰ卷】(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提
出如下反应历程:
第一步 N2O5 NO3+NO2 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是__________(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
AC
03
高考试题典例分析
【2019·全国Ⅰ卷】⑷研究表明,SO2催化氧化的反应速率方程为:
式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α‘为某时刻SO2转化率,n为常数。在α’=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图(c)所示。曲线上v最大值所对应温度称为该α‘下反应的最适宜温度tm。ttm后,v逐渐下降。原因是_______________________
__________________________________
________________________________________________。
α引起的降低; t>tm后,k增大对v的提高小于α引起的降低。
升高温度,k增大使v逐渐提高,
但α降低使v逐渐下降。t7.催化剂、活化能
03
高考试题典例分析
氧化还原反应:
主要考查运用氧化还原反应原理分析参与反应的物质及进行方程式的配平,同时利用其原理进行相关的计算。
非氧化还原反应:
结合物质性质和反应酸碱环境判断产物形式
电极反应:
结合原电池和电解池的电极特点、环境等因素正确书写电极方程式或总反应式
8.陌生方程式的书写
03
高考试题典例分析
【2019·全国Ⅰ卷】(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂
表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。可知水煤气变换的ΔH______0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_______eV,写出该步骤的化学方程式____________________________________________________。
小于
2.02
COOH*+H*+H2O*=COOH*+2H*+OH*或H2O*=H*+OH*
8.陌生方程式的书写
04
备考策略
化学反应原理综合题
——教什么?
04
备考策略
一、教学要点:
化学反应与能量(掌握常见氧化还原反应的配平、能正确书写热化学方程式、理解盖斯定律)。
化学反应速率和化学平衡(了解化学反应速率的概念和定量表示方法、掌握化学平衡的特征、理解化学平衡常数(K)的含义、理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律)。
电解质溶液(理解弱电解质在水中的电离平衡,盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用、掌握常见离子的检验方法、理解溶度积(Ksp)的含义)
电化学原理:主要考查新型电池及燃料电池的工作原理、电极反应式的书写及相关计算。
教学建议:
04
备考策略
化学反应原理网络构建
04
备考策略
反应物
生成物
能量变化
反应热(△H )
物质变化
图示
常见类型
吸热反应
(△H>0)
放热反应
(△H<0)
常见类型
测定
书写
图示
盖斯定律
燃烧热
中和热
热化学方程式
活化能
反应热:
04
备考策略
化学反应
方向性
速率
应用
限度
熵判据
焓判据
速率平衡理论的综合应用
表示
影响因素
速率方程
活化能与有效碰撞理论
图像分析
影响因素
平衡特征
平衡移动
平衡常数
速率和平衡:
04
备考策略
二、化学反应原理综合题的复习应对
1.注重化学观的构建:
速率观、平衡观、守恒观、微粒观、控制变量。
2.注重知识点建模:热化学方程式的书写模型,盖斯定律应用模型;速率与平衡、平衡状态的判断模型,三段式模型,平衡移动模型,Q与K比较;原电池和电解池的工作原理模型;水溶液中平衡常数计算模型,pH的计算模型,水溶液中的平衡移动模型等
3.熟练使用化学用语:化学方程式、离子方程式、热化学方程式、电离方程式、水解方程式、电极反应、平衡常数表达式、电子式、结构式等
4.注重化学平衡教学中定量思想:提高定量分析问题的能力,掌握守恒法、定义表达式法等各种计算方法。
5.加强“图像”分析:提高图表的识别能力,能够根据各种图表分析物质的变化过程和反应原理
6.强化化学计算,计算要过心理关:
(1)掌握常见氧化还原反应的相关计算。
(2)能运用盖斯定律进行有关反应焓变的计算。
(3)化学速率计算,并能正确计算化学反应的转化率(α)。
04
备考策略
(4)能利用化学平衡常数进行相关计算。
(5)能进行溶液pH的简单计算。
(6)能利用电离平衡常数进行相关计算。
(7)能进行溶度积(Ksp)相关的计算。
(8)滴定计算
7.答题技巧:
(1)读题:通过对试题所有信息的通读,搞清楚已知什么,问什么,求什么,阅读时最好用笔点着逐字读,这样不会遗漏有用信息。
(2)审题:找“题眼”和“关键词”,要稳扎稳打,力争一次成功。
(3)答案可以“从题干和教材原话”中去寻找。
(4)注意解题规范:解题不规范的失分,不是“不会做”,而是“做不好”。
(5)要有“会做的先做”的得分意识。
(6)做题要预留弹性时间,避免因超时带来的紧张。
甲烷在化学工业中应用广泛。回答下列问题:
(1)H2捕集CO2合成CH4涉及下列反应:
I. 4H2(g)+CO2(g) CH4(g)+2H2O(g) △H1平衡常数K1
II. H2(g)+CO2(g) CO(g)+H2O(g) △H2平衡常数K2
①相关物质相对能量大小如图所示,则△H1=_______kJ·mol-1,
升高温度, _______(填“增大”或“减小”)。
②起始物 =3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)_______vB(逆)(填“大于”、“小于”或“等于”);若C点CH4与CO的分压相同,则p(H2O)=_______Pa,反应I以物质的量分数表示的平衡常数KxI=_______。
05
原创题赏析
(2)CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。
其中过程II主要发生如下反应:
i. CaO(s)+CO2(g) CaCO3(s) ii. 2Fe3O4(s)+8H2(g) 6Fe(s)+8H2O(g)
iii. Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将_____(填“正向移动”“逆向移动”或“不移动”),重新平衡时,n(CO2)_______(填“增大”、“减小”或“不变”),p(CO)_____(填“增大”、“减小”或“不变”)。
05
原创题赏析
05
原创题赏析
【答案】
(1)-165 减小 大于 1.5×105
(2)逆向移动 增大 不变
研究CO、CO2在一定条件下与H2催化合成CH4等有机化工产品,对实现“碳中和”目标具有重要的意义。在一定条件下CO(g)与H2(g)可发生如下反应:
反应Ⅰ:CO(g)+3H2(g) CH4(g)+H2O(g) △H1=-206.4kJ mol-1
反应Ⅱ:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H2
反应Ⅲ:CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41.2kJ mol-1
(1)部分物质的标准生成焓数据如表所示:
物质 CO(g) H2(g) CH4(g) H2O(g)
标准生成焓/(kJ mol-1) -110 0 -74.6 x
则x=______;△H2=______kJ mol-1。
05
原创题赏析
(2)一定温度范围内反应I和反应Ⅱ的lgKp- 的线性关系如图1所示
①依据图像,可知T1℃时,反应Ⅲ的平衡常数Kp3=________________。
②图中v正(A)__________(填“>”、“<”或“=”)v逆(B)。
(3)①恒温(323K)恒压(p)条件下,在密闭容器中起始时按n(H2):n(CO2)=1:1投料进行反应(仅发生反应Ⅱ和反应Ⅲ),CO2初始分压分别为p0-(a)MPa、p0-(b)MPa、p0-(c)MPa,测得CO2的压强转化率α(CO2)[已知:气体A的压强转化率表示为α(A)=(1- )×100%,p0MPa为A的初始分压,p1MPa为某时刻A的分压]与时间(t)的关系如图2,则p0-(a)、p0-(b)、p0-(c)由大到小的顺序为____________________。
05
原创题赏析
②在密闭容器中起始时按n(H2):n(CO2)=3:1投料,分别在压强为1MPa和5MPa的恒压下进行反应(两压强下均只发生反应Ⅱ和反应Ⅲ)。恒压条件下反应温度对平衡体积分数δ(x)[x为CO或CH4,δ(x)= ×100%]的影响如图3所示。
则在1MPa时,表示CH4和CO的平衡体积分数随温度变化关系的曲线依次是_____(填“a”、“b”、“c”或“d”,下同)和______;在T℃、一定压强下,反应在M点达到化学平衡,平衡时CH4的分压p(CH4)=__________MPa,反应Ⅲ的平衡常数Kp=__________。
05
原创题赏析
04
备考策略
【答案】
(1)-241.8 -165.2
(2)1 >
(3)p0-(a)>p0-(c)>p0-(b) b c 0.125 2.4
祝2023高考大捷
感谢您的指导
《2023年化学反应原理综合题复习备考
策略暨原创题赏析》
01
新高考的理解
02
命题特点和规律
03
高考试题典例分析
04
备考策略
目 录
05
原创题赏析
01
对新高考的理解
01
对新高考的理解
高考评价体系的基本内涵是“一核、四层、四翼”
01
对新高考的理解
高考评价体系将“必备知识、关键能力 、学科素养、核心价值”作为考查内容,将高校人才选拔要求和国家课程标准有机结合在一起,使选人和育人目标统一于落实立德树人根本任务,系统地回答了高考“考什么”的问题。
01
对新高考的理解
情境:高考评价体系中的考查载体
01
对新高考的理解
情境:高考评价体系中的考查载体
01
对新高考的理解
化学科考查载体五类试题情境
1.日常生活情境。(食物营养、合成药物、常见材料和能量转化设备)
2.生产环保情境。(自然资源利用、生产条件优化、废物回收利用和毒害物质处理)
3.学术探究情境。(最新合成方法、新颖功能物质和新型催化技术)
4.实验探究情境。(基本操作实验、研究性实验)
5.化学史料情境。
01
对新高考的理解
化学学科核心素养构成要素之间具有内在的本质联系。“宏观辨识与微观探析”“变化观念与平衡思想”和“证据推理与模型认知”,分别是从学科观念和思维方式视角对化学科学思维的描述,要求学生形成化学学科的思想和方法;“科学探究与创新意识”是对化学科学实践的表征,从实践层面激励学生勇于创新;“科学态度与社会责任”是对化学科学价值取向的刻画,是化学学科整体育人功能和价值的具体表现,揭示了化学学习更高层次的价值追求。
01
对新高考的理解
01
对新高考的理解
01
对新高考的理解
核心能力
获取处理
信息能力
分析解决问题能力
化学实验与探究能力
高中化学教学要培养的四种能力
观察能力
思维能力
实验能力
自学能力
高考对化学学科能力的要求
高考对化学学科能力的要求
01
对新高考的理解
与其大量做题,不如抽出时间认真研究往年的试题,往年的试题是精雕细磨的产物,它反映了对考试内容的深思熟虑、对设问和答案的准确拿捏、对学生水平的客观判断。研究这些试题,就如同和试题的制作者对话。
——教育部考试中心 刘芃《考试文集》
研究高考题,才能预测高考题,高考题就是最好的复习资料,认真研究历年高考试题不难找出命题轨迹,从而把握试题难度。
——高考化学命题组长、南京大学段康宁教授
最重要、最直接、最有效的高考信息就是历年来,尤其是近年来的高考试题。这是因为高考命题组的成员是“稳定的”,在“稳中求进”的要求下,命题组在把握课程的基本要求及如何有效考查这方面的意图,已经体现在历年高考试题中。
——北大教授严宣申
01
对新高考的理解
【近年高考试题总体评价】
从教育部考试中心命制的高考化学试题来看,以“价值引领、素养导向、能力为重、知识为基”为命题基本理念,以普通高中化学课程标准(2017年版)(以下简称(课程标准)和中国高考评价体系为命题依据,以考查化学观念、思维方法、实践探索、态度责任等化学学科核心素养为命题立意,体现基础性、综合性、应用性和创新性的考试要求,发挥化学学科独特的育人功能。试题选取具有鮮明时代特色和科技前沿的素材,呈现真实情境,通过精心设计的问题,在检测必备知识掌情况的基础上,突出考查理解与辩析能力、分析与推测能力、归纳与论证能力、探究与创新能力等化学学科关键能力。高考化学试题在落实党的教育方针、对接高中课程改革、深化高考内容改革方面等均有新的突破,在彰显教育改革鲜明方向的同时,也为今后高中化学教学及高考备考给出了明确的导向。
01
对新高考的理解
一、把握育人导向,精选试题情境素材
除了少量考查基础知识和基本概念的试题外,大部分试题围绕某一特定主题情境,以文字、数据、图表等形式呈现,这些情境主要包括日常生活情境、生产环保情境、学术探索情境、实验探索情境、化学史料情境五个方面。
1.以我国古代文化和典籍中的化学知识为情境,增强考生民族自豪感。
2.以我国科学家最新研究成果为情境,增强考生国家成就感。
01
对新高考的理解
二、凸显学科素养,把握主干知识精心设问
在试题命制和考点设置上,体现了对化学观念、思维方法、实践探索、态度责任的考查,体现了对高考评价中的基础性、应用性、综合性、创新性的考查,突出了对必备知识、关键能力、化学学科素养的考查,体现了高考在服务选才和引导教学上的重要功能。
1.考查必备知识,体现基础性和综合性,引领关注学科重点。
01
对新高考的理解
2.考查关键能力,体现应用性和创新性,引领关注学科素养。
在试题命制和设问上,着眼学生未来的长远发展,重点考查理解与辨析能力、分析与推测能力、归纳与论证能力、探究与创新能力等化学学科关键能力。
02
命题特点和规律
化学反应原理综合题高考呈现
——怎么考?
02
命题特点和规律
年份 2022年甲卷 2022年乙卷 2021年甲卷 2021年乙卷 2020年1卷 2019年1卷 2018年1卷
载体 TiCl4的工业制备 H2S的回收处理 CO2制甲醇 ICl的制备及性质探究 SO2的催化氧化 水煤气变换 N2O5的分解
作 答 量 8个空(填空3个、选择2个、计算3个) 9个空(填空3个、选择2个、计算4个) 8个空(填空2个、选择2个、计算4个) 8个空(填空2个、选择3个、计算3个) 7个空(写方程1个、简答3个、、计算3个) 10个空(填空4个、写方程1个、选择3个、计算2个) 8个空(填空3个、选择1个、计算4个)
涉及知识点 (1)压强平衡常数的计算; (2) 平衡移动、转化率的判断(3)盖斯定律(4)反应条件的选择 (1)反应热的计算(2)转化率的计算(3)压强平衡常数的计算(4)图像分析。(5)转化率的影响因素(6)热分解法的优缺点 (1)压强平衡常数的计算(2)转化率的计算(3)焓变的判断及推理(4)图像分析。 (1)压强平衡常数的计算(2)转化率的计算(3)焓变的判断及推理(4)图像分析。(5)反应条件的选择(6)读图计算 (1)盖斯定律(写热方程) ; (2) 曲线分析:计算平衡转化率并说明理由、影响平衡转化率的因素;(3)分压计算(4)平衡常数计算(5)速率方程的应用、 (1)物质的量分数判断反应倾向(2)物质的量分数判断(3)焓变(4)活化能(5)写化学反应方程式(6)平均反应速率的计算(7)识图计算、化学平衡 (1)氧化还原(2)盖斯定律(3)速率方程的应用、(4)分压计算、(5)平衡常数计算、(6)反应历程判断(7)平衡移动原理的应用。
02
命题特点和规律
【2022·全国甲卷】:金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化TiCl4为有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:TiO2 (s)+ 2Cl2 (g) ==TiCl4(g) +O2 (g) △H=+172kJ·mol-1 KP1=1.0×10-2Pa
(ⅱ)碳氯化:TiO2 (s)+ 2Cl2 (g)+ 2C (s) ==TiCl4(g) +2CO (g) △H=-51kJ·mol-1 KP1=1.2×1012Pa
①反应 2C (s) + O2 (g) ==2CO (g)的△H为_______2kJ·mol-1,KP=_________Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是________________________________
___________________________________________________________________________
___________________________________________________________________________。
③对于碳氯化反应:增大压强,平衡_______移动(填“向左”“向右”或“不”);温度升高,平衡转化率_______(填“变大”“变小”或“不变”)。
-223
1.2×1014
碳氯化反应气体分子数增加,
H小于0,是熵增、放热过程,熵判据与焓判据均是自发过程,
而直接氯化的体系气体分子数不变、且是吸热过程
向左
变小
02
命题特点和规律
(2)在1.0×105Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①反应 C (s) + CO2 (g) ==2CO (g)的平衡常数 KP(400℃)=___________Pa。
②图中显示,在200℃平衡时TiO2 几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是_________________________________________________________________________。
(3)TiO2碳氯化是一个“气—固—固”反应,有利于TiO2--C “固—固”接触的措施是_____________________________________________________________。
7.2×105
为了提高反应速率,在相同时间内得到更多的TiCl4产品,提高效益
将两固体粉碎后混合,同时鼓入Cl2,使固体粉末“沸腾”
02
命题特点和规律
【2022·全国乙卷】: 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
① 2H2S(g) + 3O2 (g) == 2SO2(g) +2H2O (g) △H1=-1036kJ·mol-1
② 4H2S(g) +2SO2(g) == 3S2(g) +4H2O (g) △H2=94kJ·mol-1
③ 2H2(g) +O2(g) ==2H2O (g) △H3= -484kJ·mol-1
计算H2S热分解反应④2H2S(g) == S2(g) +2H2 (g) 的△H4=________kJ·mol-1。
170
02
命题特点和规律
(2)较普遍采用的H2S处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解H2S。相比克劳斯工艺,高温热分解方法的优点是_______________________,
缺点是________。
(3)在1470K、100kPa反应条件下,将n(H2S) :n(Ar)的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为________,平衡常数KP=________kPa。
副产物氢气可作燃料
耗能高
50%
4.76
02
命题特点和规律
(4)在1373K、100kPa反应条件下,对于n(H2S) :n(Ar)分别为4:1、1:1、1:4、1: 9、1:19的H2S -Ar混合气,热分解反应过程中H2S转化率随时间的变化如下图所示。
①n(H2S) :n(Ar)越小,H2S平衡转化率________,理由是____________________________
________________________________________________________________________。
②n(H2S) :n(Ar)=1: 9对应图中曲线________,计算其在0-0.1之间,H2S分压的平均变化率为________kPa·s-1。
24.9
越高
n(H2S):n(Ar)越小,H2S的分压越小,
n(H2S):n(Ar)越小,H2S的分压越小,平衡向正反应方向进行,H2S平衡转化率越高
d
02
命题特点和规律
【2021·全国甲卷】:二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g) + 3H2 (g) == 2CH3OH(g) +H2O (g)
该反应一般认为通过如下步骤来实现:
①CO2(g) + H2 (g) == CO(g) +H2O (g) △H1=+41kJ·mol-1
②CO(g) +2 H2 (g) == CH3OH (g) △H2=-90kJ·mol-1
总反应的 △H=_______kJ·mol-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是_______(填标号),判断的理由是___________________________________________________________。
A.
A B C D
ΔH1为正值,ΔH2为和ΔH为负值,反应①的活化能大于反应②的
49
A
02
命题特点和规律
(2)合成总反应在起始物n(H2)/n(CO2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为X(CH3OH),在t=250℃下的X(CH3OH)~P、在 P=5×105Pa
下的X(CH3OH)~t如图所示。
①用各物质的平衡分压表示总反应的平衡常数,表达式KP=________________;
②图中对应等压过程的曲线是_______,判断的理由是_____________________________________________________________________________________;
③当时X(CH3OH)=0.10,CO2的平衡转化α=_______,反应条件可能为____________________或____________________。
总反应ΔH<0,升高温度时平衡向逆反应方向移动,甲醇的物质的量分数变小
b
33.3%
9×105Pa,250℃
5×105Pa,210℃
02
命题特点和规律
【2021·全国乙卷】:一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1)历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig误认为是ICl,从而错过了一种新元素的发现,该元素是_______。
(2)氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt和Cl2,376.8℃时平衡常数KP=1.0×104kPa2,在一硬质玻璃烧瓶中加入过量BaPtCl6,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0 kPa。376.8℃平衡时,测得烧瓶中压强为32.5 kPa,则
P(ICl)=_______ kPa,反应2ICl(g)== Cl2(g) +2I2O(g) 的平衡常数K=_________________(列出计算式即可)。
溴
24.8
02
命题特点和规律
(3)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数KP。
2NO(g) +2ICl(g) 2NOCl(g) +2I2(g) KP1
2NOCl(g) +2ICl(g) 2NOCl(g) +2I2(g) KP1
得到 和 均为线性关系,如下图所示:
①由图可知,NOCl分解为NO和Cl2反应的
△H_______0(填“大于”或“小于”)
②反应2ICl(g)Cl2(g) +2I2(g)的K=___________(用KP1、K12表示):
该反应的△H_______0(填“大于”或“小于”),写出推理过程_______。
大于
大于
02
命题特点和规律
4)Kistiakowsky曾研究了NOCl光化学分解反应,在一定频率(v)光的照射下机理为:
NOCl + hv → NOCl*
NOCl +NOCl* → NO + Cl2
其中hv表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收_______mol光子。
0.5
02
命题特点和规律
【2020·全国Ⅰ卷】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g) + O2(g) SO3(g) ΔH= 98 kJ·mol 1。回答下列问题:
⑴钒催化剂参与反应的能量变化如图(a)所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为: 。
2V2O5(s)+ 2SO2(g)=2VOSO4(s)+V2O4(s) ΔH = 351 kJ·mol 1
考查运用盖斯定律书写热化学方程式
02
命题特点和规律
⑵当SO2(g)、O2(g)和N2(g)起始的物质的量
分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温 度的变化如图(b)所示。反应在5.0MPa、550℃时的α=_____,判断的依据
是 。
影响α的因素有 。
0.975
该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa = p2,所以p1= 5.0Mpa
温度、压强和反应物的起始浓度(组成)
⑶将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为___________________,平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)。
考查平衡转化率的计算及影响因素
考查分压及平衡常数Kp的计算
02
命题特点和规律
⑷研究表明,SO2催化氧化的反应速率方程为:
式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α‘为某时刻SO2转化率,n为常数。在α’=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图(c)所示。曲线上v最大值所对应温度称为该α‘下反应的最适宜温度tm。t
__________________________________
________________________________________________。
α引起的降低; t>tm后,k增大对v的提高小于α引起的降低。
考查化学反应速率、化学平衡的影响因素
升高温度,k增大使v逐渐提高,
但α降低使v逐渐下降。t
命题特点和规律
【2019·全国Ⅰ卷】 水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是
重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_______H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为___(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
大于
C
02
命题特点和规律
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂
表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。可知水煤气变换的ΔH______0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_______eV,写出该步骤的化学方程式____________________________________________________。
小于
2.02
COOH*+H*+H2O*=COOH*+2H*+OH*或H2O*=H*+OH*
02
命题特点和规律
(4)Shoichi研究了467 ℃、489 ℃时水煤气
变换中CO和H2分压随时间变化关系(如下图
所示),催化剂为氧化铁,实验初始时体系
中的 pH2O和pCO相等、pCO2和pH2 相等。计算
曲线a的反应在30~90 min内的平均速率
(a)=_______ kPa·min 1。467 ℃时 和 随时间
变化关系的曲线分别是_______、_______。
489 ℃时 和 随时间变化关系的曲线分别是
_____、_____。
d
0.0047
b
c
a
02
命题特点和规律
【关键能力】本题考查的关键能力侧重于理解与辩析、分析与推测、归纳与论证:一是从提供的新信息中,准确地提取实质性内容,并与已有知识整合、重组为新知识块的能力;二是通过对图形、图表的阅读,获取有关的感性知识和印象,并进行加工、吸收有序存储的能力;三是将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题的能力;四是将分析和解决问题的过程及成果,能正确地运用化学术语进行表达的能力。本题具体要求是根据题给信息,特别是图像、图示中隐含的信息,结合所学知识对平衡常数计算和应用、反应类型、活化能、反应速率的计算和曲线的含义等进行综合分析判断。
【学科素养】本题考查的学科素养侧重于化学观念、思维方法、实践探索和态度责任。化学观念:能根据题给反应历程的图示,分析反应热、活化能和书写化学方程式。思维方法:通过分析反应历程,认识化学变化过程中的能量变化;能根据物质的量分数的大小关系判断反应限度;能够判断平衡体系中生成物的物质的量分数的大小范围;能够根据图像中数据判断各平衡状态时物质的压强。实践探索:根据真实情境,通过国内外科学成果的展示,体现科学探究和创新意识。态度责任:能够赞赏化学对人类发展所做出的突出贡献。
02
命题特点和规律
【2020·全国Ⅰ卷】28.采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。
回答下列问题:
(1)1840年Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为 。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t = 时,N2O5(g)完全分解):
t / min 0 40 80 160 260 1300 1700
p / kPa 35.8 40.3 42.5 45.9 49.2 61.2 62.3 63.1
O2
多反应体系,真实情境研究
试题背景:N2O5作为新型的硝化剂,其热力学和动力学研究具有一定价值
02
命题特点和规律
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1= 4.4 kJ·mol 1
2NO2(g) =N2O4(g) ΔH 2= 55.3 kJ·mol 1
则反应N2O5(g)=2NO2(g)+1/2 O2(g)的ΔH =_______ kJ·mol 1。
②研究表明,N2O5(g)分解的反应速率v=2×10 3× (kPa·min 1)。t=62 min时,测得体系中 =2.9kPa,则此时的 =___ kPa,v=_______ kPa·min 1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是____________________
________________________________________________________________ 。
④25℃时N2O4(g)= 2NO2(g)反应的平衡常数Kp=_______kPa(计算结果保留1位小数)。
+53.1
30.0
6.0×10-2
大于
温度提高,体积不变,
13.4
总压强提高; NO2二聚为放热反应,温度提高,平衡左移,总压强提高
反应热的常规计算
“三段式”的运用
考查分析、解决问题的能力
02
命题特点和规律
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提
出如下反应历程:
第一步 N2O5 NO3+NO2 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是__________(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
AC
以反应历程为研究对象,考查有效碰撞、活化能等相关概念
03
高考试题典例分析
化学反应原理综合题高考呈现
——考什么?
03
高考试题典例分析
近年全国卷化学反应原理综合题主要知识点
常以实际工业生产、化合物性质与转化、化合物制备等为素材,常考查考生盖斯定律的应用、化学平衡移动原理、转化率、化学平衡常数、化学反应速率、陌生化学反应方程式书写或判断化学式、溶度积常数、电化学等方面的知识。能较好地检测学生在已有知识的前提下,从定性和定量视角分析问题和解决问题能力、化学基本计算能力以及运用化学用语正确表达的能力。
03
高考试题典例分析
1.盖期定律、△H
2.平衡常数
3.化学平衡及移动、转化率
4.化学反应速率与化学平衡图像分析
6.速率方程
7.活化能
原理综合题考点:
5.化学反应速率及影响因素
8.陌生方程式的书写
03
高考试题典例分析
热点
盖斯定律
平衡常数计算
化学平衡
转化率
化学反应速率
陌生方程式书写
溶度积常数
电化学
化学反应原理综合题
情境新
反应新
设问新
图表多
描述多
计算多
特点
03
高考试题典例分析
1.盖期定律、△H
【2022·全国甲卷】:金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化TiCl4为有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:TiO2 (s)+ 2Cl2 (g) ==TiCl4(g) +O2 (g) △H=+172kJ·mol-1 KP1=1.0×10-2Pa
(ⅱ)碳氯化:TiO2 (s)+ 2Cl2 (g)+ 2C (s) ==TiCl4(g) +2CO (g) △H=-51kJ·mol-1 KP1=1.2×1012Pa
①反应 2C (s) + O2 (g) ==2CO (g)的△H为_______2kJ·mol-1。
-223
03
高考试题典例分析
1.盖期定律、△H
【2022·全国乙卷】: 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
① 2H2S(g) + 3O2 (g) == 2SO2(g) +2H2O (g) △H1=-1036kJ·mol-1
② 4H2S(g) +2SO2(g) == 3S2(g) +4H2O (g) △H2=94kJ·mol-1
③ 2H2(g) +O2(g) ==2H2O (g) △H3= -484kJ·mol-1
计算H2S热分解反应④2H2S(g) == S2(g) +2H2 (g) 的△H4=________kJ·mol-1。
170
03
高考试题典例分析
1.盖期定律、△H
【2021·全国甲卷】:二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g) + 3H2 (g) == 2CH3OH(g) +H2O (g)
该反应一般认为通过如下步骤来实现:
①CO2(g) + H2 (g) == CO(g) +H2O (g) △H1=+41kJ·mol-1
②CO(g) +2 H2 (g) == CH3OH (g) △H2=-90kJ·mol-1
总反应的 △H=_______kJ·mol-1;
49
03
高考试题典例分析
1.盖期定律、△H
【2020·全国Ⅰ卷】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g) + O2(g) SO3(g) ΔH= 98 kJ·mol 1。回答下列问题:
⑴钒催化剂参与反应的能量变化如图(a)所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为: 。
2V2O5(s)+ 2SO2(g)=2VOSO4(s)+V2O4(s) ΔH = 351 kJ·mol 1
03
高考试题典例分析
1.盖期定律、△H
【2019·全国Ⅰ卷】
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。可知水煤气变换的ΔH______0(填“大于”“等于”或“小于”),。
小于
(1)从图中分判断ΔH
03
高考试题典例分析
1.盖期定律、△H
【2018·全国Ⅰ卷】
(2) ①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1= 4.4 kJ·mol 1
2NO2(g) =N2O4(g) ΔH 2= 55.3 kJ·mol 1
则反应N2O5(g)=2NO2(g)+ O2(g)的ΔH =_______ kJ·mol 1。
+53.1
【2018·全国Ⅱ卷】
(1)CH4-CO2催化重整反应为:CH4(g)+ CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)= CH4 (g) ΔH=-75 kJ·mol 1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol 1
C(s)+ O2(g)=CO(g) ΔH=-111 kJ·mol 1
该催化重整反应的ΔH=______ kJ·mol 1
+247
03
高考试题典例分析
化学平衡与化学反应速率
主要从化学热力学和化学动力学两个方面去考查,以气相研究居多。
化学平衡常数
化学平衡及移动、转化率
化学反应速率与化学平衡图像分析
化学反应速率及影响因素
化学速率方程
活化能与催化剂
高频考点:
03
高考试题典例分析
2.平衡常数
【2022·全国甲卷】:金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化TiCl4为有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:TiO2 (s)+ 2Cl2 (g) ==TiCl4(g) +O2 (g) △H=+172kJ·mol-1 KP1=1.0×10-2Pa
(ⅱ)碳氯化:TiO2 (s)+ 2Cl2 (g)+ 2C (s) ==TiCl4(g) +2CO (g) △H=-51kJ·mol-1 KP1=1.2×1012Pa
①反应 2C (s) + O2 (g) ==2CO (g)的KP=_________Pa。
1.2×1014
03
高考试题典例分析
2.平衡常数
【2022·全国甲卷】(2)在1.0×105Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①反应 C (s) + CO2 (g) ==2CO (g)的平衡常数
KP(400℃)=___________Pa。
7.2×105
03
高考试题典例分析
2.平衡常数
【2021·全国甲卷】(2)合成总反应在起始物n(H2)/n(CO2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为X(CH3OH),在t=250℃下的X(CH3OH)~P、在 P=5×105Pa
下的X(CH3OH)~t如图所示。
①用各物质的平衡分压表示总反应的平衡常数,
表达式KP=________________;
03
高考试题典例分析
2.平衡常数
【2021·全国乙卷】:(2)氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt和Cl2,376.8℃时平衡常数KP=1.0×104kPa2,在一硬质玻璃烧瓶中加入过量BaPtCl6,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0 kPa。376.8℃平衡时,测得烧瓶中压强为32.5 kPa,则
P(ICl)=_______ kPa,反应2ICl(g)== Cl2(g) +2I2O(g) 的平衡常数K=_________________(列出计算式即可)。
24.8
(3)McMorris测定和计算了在136~180℃范围内下列反应的平衡常数KP。
2NO(g) +2ICl(g) 2NOCl(g) +2I2(g) KP1
2NOCl(g) +2ICl(g) 2NOCl(g) +2I2(g) KP1
②反应2ICl(g)Cl2(g) +2I2(g)的K=___________(用KP1、KP2表示):
03
高考试题典例分析
【2020·全国Ⅰ卷】⑶将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为___________________,平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)。
2.平衡常数
03
高考试题典例分析
3.化学平衡及移动、转化率
【2022·全国甲卷】:金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化TiCl4为有直接氯化法和碳氯化法。在1000℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:TiO2 (s)+ 2Cl2 (g) ==TiCl4(g) +O2 (g) △H=+172kJ·mol-1 KP1=1.0×10-2Pa
(ⅱ)碳氯化:TiO2 (s)+ 2Cl2 (g)+ 2C (s) ==TiCl4(g) +2CO (g) △H=-51kJ·mol-1 KP1=1.2×1012Pa
③对于碳氯化反应:增大压强,平衡_______移动(填“向左”“向右”或“不”);温度升高,平衡转化率_______(填“变大”“变小”或“不变”)。
向左
变小
【2022·全国乙卷】(3)在1470K、100kPa反应条件下,将n(H2S) :n(Ar)的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为________,平衡常数KP=________kPa。
50%
4.76
03
高考试题典例分析
3.化学平衡及移动、转化率
【2020·全国Ⅰ卷】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g) + O2(g) SO3(g) ΔH= 98 kJ·mol 1。回答下列问题:
⑵当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温 度的变化如图(b)所示。反应在5.0MPa、550℃时的α=_____,判断的依据 。影响α的因素有 。
0.975
该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa = p2,所以p1= 5.0Mpa
温度、压强和反应物的起始浓度(组成)
03
高考试题典例分析
【2020·全国Ⅰ卷】(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_______H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_____(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
大于
C
估算K值,判断转化率的大小
估算K值大于1,判断物质的量分数区间
3.化学平衡及移动、转化率
03
高考试题典例分析
4.化学反应速率与化学平衡图像分析
【2019·全国Ⅰ卷】(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的pH2O和pCO相等、pCO2和pH2 相等。
计算曲线a的反应在30~90 min内的平均速率(a)=__________ kPa·min 1。
0.0047
03
高考试题典例分析
5.化学反应速率及影响因素
02
命题特点和规律
【2022·全国甲卷】(2)在1.0×105Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
②图中显示,在200℃平衡时TiO2 几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是_________________________________________________________________________。
(3)TiO2碳氯化是一个“气—固—固”反应,有利于TiO2--C “固—固”接触的措施是_____________________________________________________________。
为了提高反应速率,在相同时间内得到更多的TiCl4产品,提高效益
将两固体粉碎后混合,同时鼓入Cl2,使固体粉末“沸腾”
03
高考试题典例分析
【2020·全国Ⅰ卷】⑷研究表明,SO2催化氧化的反应速率方程为:
式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α‘为某时刻SO2转化率,n为常数。在α’=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图(c)所示。曲线上v最大值所对应温度称为该α‘下反应的最适宜温度tm。t
__________________________________
________________________________________________。
α引起的降低; t>tm后,k增大对v的提高小于α引起的降低。
升高温度,k增大使v逐渐提高,
但α降低使v逐渐下降。t
03
高考试题典例分析
6.速率方程
【2018·全国Ⅰ卷】(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
②研究表明,N2O5(g)分解的反应速率v=2×10 3× (kPa·min 1)。t=62 min时,测得体系中 =2.9kPa,则此时的 =____ kPa,v =_________ kPa·min 1。
t/min 0 40 80 160 260 1300 1700 ∞
p/kPa 35.8 40.3 42.5 45.9 49.2 61.2 62.3 63.1
30.0
6.0×10-2
03
高考试题典例分析
【2018·全国Ⅱ卷】
(2)②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)· (k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________________________。
pc(CO2)、pb(CO2)、pa(CO2)
【2018·全国Ⅲ卷】
(3)③比较a、b处反应速率大小:υa________υb(填“大于”“小于”或“等于”)。反应速率υ=υ正 υ逆= ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的 =_____(保留1位小数)。
大于
1.3
6.速率方程
03
高考试题典例分析
——催化剂降低反应的活化能,加快化学反应的速率
——催化剂改变反应的途径
——催化剂的活性
——催化剂的专一性、选择性
——催化剂参加化学反应,反应前后质量和化学性质不变
7.催化剂、活化能
03
高考试题典例分析
7.催化剂、活化能
【2021·全国甲卷】:二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g) + 3H2 (g) == 2CH3OH(g) +H2O (g)
该反应一般认为通过如下步骤来实现:
①CO2(g) + H2 (g) == CO(g) +H2O (g) △H1=+41kJ·mol-1
②CO(g) +2 H2 (g) == CH3OH (g) △H2=-90kJ·mol-1
总反应的 △H=_______kJ·mol-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是_______(填标号),判断的理由是___________________________________________________________。
A.
A B C D
ΔH1为正值,ΔH2为和ΔH为负值,反应①的活化能大于反应②的
49
A
03
高考试题典例分析
7.催化剂、活化能
【2020·全国Ⅰ卷】(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提
出如下反应历程:
第一步 N2O5 NO3+NO2 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是__________(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
AC
03
高考试题典例分析
【2019·全国Ⅰ卷】⑷研究表明,SO2催化氧化的反应速率方程为:
式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α‘为某时刻SO2转化率,n为常数。在α’=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图(c)所示。曲线上v最大值所对应温度称为该α‘下反应的最适宜温度tm。t
__________________________________
________________________________________________。
α引起的降低; t>tm后,k增大对v的提高小于α引起的降低。
升高温度,k增大使v逐渐提高,
但α降低使v逐渐下降。t
03
高考试题典例分析
氧化还原反应:
主要考查运用氧化还原反应原理分析参与反应的物质及进行方程式的配平,同时利用其原理进行相关的计算。
非氧化还原反应:
结合物质性质和反应酸碱环境判断产物形式
电极反应:
结合原电池和电解池的电极特点、环境等因素正确书写电极方程式或总反应式
8.陌生方程式的书写
03
高考试题典例分析
【2019·全国Ⅰ卷】(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂
表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。可知水煤气变换的ΔH______0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_______eV,写出该步骤的化学方程式____________________________________________________。
小于
2.02
COOH*+H*+H2O*=COOH*+2H*+OH*或H2O*=H*+OH*
8.陌生方程式的书写
04
备考策略
化学反应原理综合题
——教什么?
04
备考策略
一、教学要点:
化学反应与能量(掌握常见氧化还原反应的配平、能正确书写热化学方程式、理解盖斯定律)。
化学反应速率和化学平衡(了解化学反应速率的概念和定量表示方法、掌握化学平衡的特征、理解化学平衡常数(K)的含义、理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律)。
电解质溶液(理解弱电解质在水中的电离平衡,盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用、掌握常见离子的检验方法、理解溶度积(Ksp)的含义)
电化学原理:主要考查新型电池及燃料电池的工作原理、电极反应式的书写及相关计算。
教学建议:
04
备考策略
化学反应原理网络构建
04
备考策略
反应物
生成物
能量变化
反应热(△H )
物质变化
图示
常见类型
吸热反应
(△H>0)
放热反应
(△H<0)
常见类型
测定
书写
图示
盖斯定律
燃烧热
中和热
热化学方程式
活化能
反应热:
04
备考策略
化学反应
方向性
速率
应用
限度
熵判据
焓判据
速率平衡理论的综合应用
表示
影响因素
速率方程
活化能与有效碰撞理论
图像分析
影响因素
平衡特征
平衡移动
平衡常数
速率和平衡:
04
备考策略
二、化学反应原理综合题的复习应对
1.注重化学观的构建:
速率观、平衡观、守恒观、微粒观、控制变量。
2.注重知识点建模:热化学方程式的书写模型,盖斯定律应用模型;速率与平衡、平衡状态的判断模型,三段式模型,平衡移动模型,Q与K比较;原电池和电解池的工作原理模型;水溶液中平衡常数计算模型,pH的计算模型,水溶液中的平衡移动模型等
3.熟练使用化学用语:化学方程式、离子方程式、热化学方程式、电离方程式、水解方程式、电极反应、平衡常数表达式、电子式、结构式等
4.注重化学平衡教学中定量思想:提高定量分析问题的能力,掌握守恒法、定义表达式法等各种计算方法。
5.加强“图像”分析:提高图表的识别能力,能够根据各种图表分析物质的变化过程和反应原理
6.强化化学计算,计算要过心理关:
(1)掌握常见氧化还原反应的相关计算。
(2)能运用盖斯定律进行有关反应焓变的计算。
(3)化学速率计算,并能正确计算化学反应的转化率(α)。
04
备考策略
(4)能利用化学平衡常数进行相关计算。
(5)能进行溶液pH的简单计算。
(6)能利用电离平衡常数进行相关计算。
(7)能进行溶度积(Ksp)相关的计算。
(8)滴定计算
7.答题技巧:
(1)读题:通过对试题所有信息的通读,搞清楚已知什么,问什么,求什么,阅读时最好用笔点着逐字读,这样不会遗漏有用信息。
(2)审题:找“题眼”和“关键词”,要稳扎稳打,力争一次成功。
(3)答案可以“从题干和教材原话”中去寻找。
(4)注意解题规范:解题不规范的失分,不是“不会做”,而是“做不好”。
(5)要有“会做的先做”的得分意识。
(6)做题要预留弹性时间,避免因超时带来的紧张。
甲烷在化学工业中应用广泛。回答下列问题:
(1)H2捕集CO2合成CH4涉及下列反应:
I. 4H2(g)+CO2(g) CH4(g)+2H2O(g) △H1平衡常数K1
II. H2(g)+CO2(g) CO(g)+H2O(g) △H2平衡常数K2
①相关物质相对能量大小如图所示,则△H1=_______kJ·mol-1,
升高温度, _______(填“增大”或“减小”)。
②起始物 =3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)_______vB(逆)(填“大于”、“小于”或“等于”);若C点CH4与CO的分压相同,则p(H2O)=_______Pa,反应I以物质的量分数表示的平衡常数KxI=_______。
05
原创题赏析
(2)CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。
其中过程II主要发生如下反应:
i. CaO(s)+CO2(g) CaCO3(s) ii. 2Fe3O4(s)+8H2(g) 6Fe(s)+8H2O(g)
iii. Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将_____(填“正向移动”“逆向移动”或“不移动”),重新平衡时,n(CO2)_______(填“增大”、“减小”或“不变”),p(CO)_____(填“增大”、“减小”或“不变”)。
05
原创题赏析
05
原创题赏析
【答案】
(1)-165 减小 大于 1.5×105
(2)逆向移动 增大 不变
研究CO、CO2在一定条件下与H2催化合成CH4等有机化工产品,对实现“碳中和”目标具有重要的意义。在一定条件下CO(g)与H2(g)可发生如下反应:
反应Ⅰ:CO(g)+3H2(g) CH4(g)+H2O(g) △H1=-206.4kJ mol-1
反应Ⅱ:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H2
反应Ⅲ:CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41.2kJ mol-1
(1)部分物质的标准生成焓数据如表所示:
物质 CO(g) H2(g) CH4(g) H2O(g)
标准生成焓/(kJ mol-1) -110 0 -74.6 x
则x=______;△H2=______kJ mol-1。
05
原创题赏析
(2)一定温度范围内反应I和反应Ⅱ的lgKp- 的线性关系如图1所示
①依据图像,可知T1℃时,反应Ⅲ的平衡常数Kp3=________________。
②图中v正(A)__________(填“>”、“<”或“=”)v逆(B)。
(3)①恒温(323K)恒压(p)条件下,在密闭容器中起始时按n(H2):n(CO2)=1:1投料进行反应(仅发生反应Ⅱ和反应Ⅲ),CO2初始分压分别为p0-(a)MPa、p0-(b)MPa、p0-(c)MPa,测得CO2的压强转化率α(CO2)[已知:气体A的压强转化率表示为α(A)=(1- )×100%,p0MPa为A的初始分压,p1MPa为某时刻A的分压]与时间(t)的关系如图2,则p0-(a)、p0-(b)、p0-(c)由大到小的顺序为____________________。
05
原创题赏析
②在密闭容器中起始时按n(H2):n(CO2)=3:1投料,分别在压强为1MPa和5MPa的恒压下进行反应(两压强下均只发生反应Ⅱ和反应Ⅲ)。恒压条件下反应温度对平衡体积分数δ(x)[x为CO或CH4,δ(x)= ×100%]的影响如图3所示。
则在1MPa时,表示CH4和CO的平衡体积分数随温度变化关系的曲线依次是_____(填“a”、“b”、“c”或“d”,下同)和______;在T℃、一定压强下,反应在M点达到化学平衡,平衡时CH4的分压p(CH4)=__________MPa,反应Ⅲ的平衡常数Kp=__________。
05
原创题赏析
04
备考策略
【答案】
(1)-241.8 -165.2
(2)1 >
(3)p0-(a)>p0-(c)>p0-(b) b c 0.125 2.4
祝2023高考大捷
感谢您的指导
同课章节目录
