第一章原子结构与性质课件(共30张PPT)2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第一章原子结构与性质课件(共30张PPT)2022-2023学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | zip | ||
| 文件大小 | 4.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-28 08:15:06 | ||
图片预览









文档简介
(共30张PPT)
第一章 原子结构与性质
——事实驱动与问题驱动
广东广雅中学 王焯强
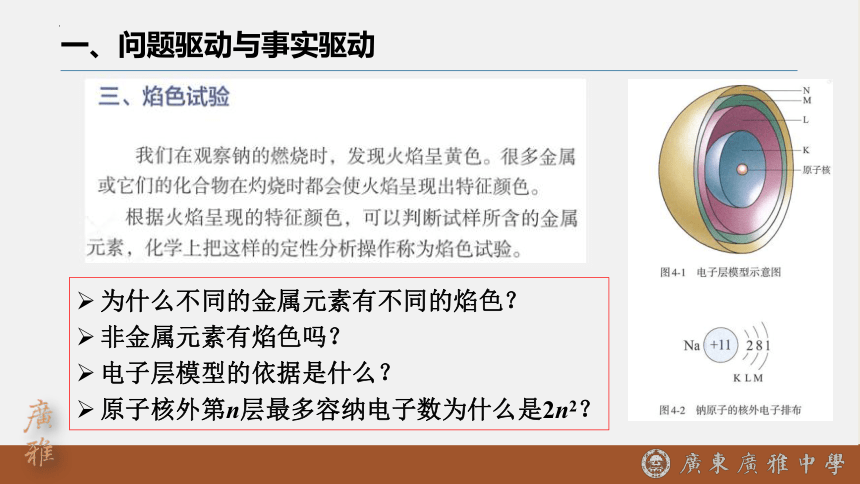
一、问题驱动与事实驱动
为什么不同的金属元素有不同的焰色?
非金属元素有焰色吗?
电子层模型的依据是什么?
原子核外第n层最多容纳电子数为什么是2n2?
一、问题驱动与事实驱动
为什么不同的金属元素有不同的焰色?
核外电子吸收能量后发生跃迁,从能量较低的能级跃迁到能量较高的能级,即原子从基态变为激发态;激发态能量高,不稳定,核外电子从较高能级返回较低能级,以光的形式释放能量。所释放能量的大小对应一定波长的光。在焰色试验中,不同金属或它们的化合物在灼烧时会放出多种不同波长的光 ,在肉眼能感知的可见光范围内 ,因不同光的波长不同,呈现的颜色也就存在差异 。
这里可以给学生强调一点,不同能层上电子的能量是不一样的,相同能层上电子的能量也不完全相同,因为能层还有亚层,即能级,不同能级上电子的能量也不相同。
一、问题驱动与事实驱动
非金属元素有焰色吗?
非金属元素没有焰色,因为当电子从较高能级返回较低能级时,所放出的光的波长在可见光区,我们才能用肉眼感知到,在紫外光区或红外光区我们是看不到的。
须要给学生指出,虽然非金属元素没有焰色,但它们有不同的原子光谱,其实这个也在强调一个问题,就是原子中不同能级上电子的能量状态是不一样的。
一、问题驱动与事实驱动
电子层模型的依据是什么?
必修一中的电子层模型其实就是玻尔原子模型,玻尔原子模型是指电子在原子核外空间的一定轨道上绕核做高速圆周运动。该原子模型是玻尔为了解释氢原子光谱是由具有特定波长、彼此分立的谱线组成的线状光谱这一实验事实而提出的。
玻尔原子模型的其中一个主要观点是在不同轨道上运动的电子具有不同的能量。这里面提到的轨道即原子轨道,不同能层上的电子的能量是不同的,相同能层上不同能级中的电子的能量也是不同的,不同的能级具有不同的原子轨道。
一、问题驱动与事实驱动
原子核外第n层最多容纳电子数为什么是2n2?
根据上面能层、能级及不同能级上可填充的电子数,可以得到答案。在给学生讲解这个问题时,可以结合不同能层具有什么能级,不同能级上可以填充多少个电子的角度来分析。
二、几点建议
熟悉新课标中的内容要求与学业要求
电子云与原子轨道:学业要求(×)、内容要求(√)、教学目标(√)、教学重难点(√)、高考题(√)
准确把握教材变化
轨道表示式、元素周期系、构造原理与元素周期表
充分利用教材与教参
教材:思考与讨论、探究、资料卡片等;
教参:内容分析、教学建议、教学案例等
准确把握概念
能层、能级、核外电子排布式、价层电子排布式、原子轨道等
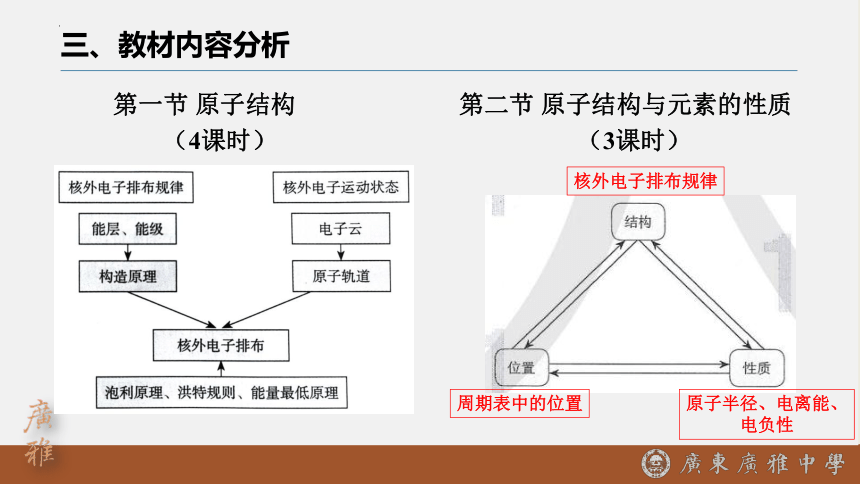
三、教材内容分析
第一节 原子结构 第二节 原子结构与元素的性质
(4课时) (3课时)
核外电子排布规律
周期表中的位置
原子半径、电离能、
电负性
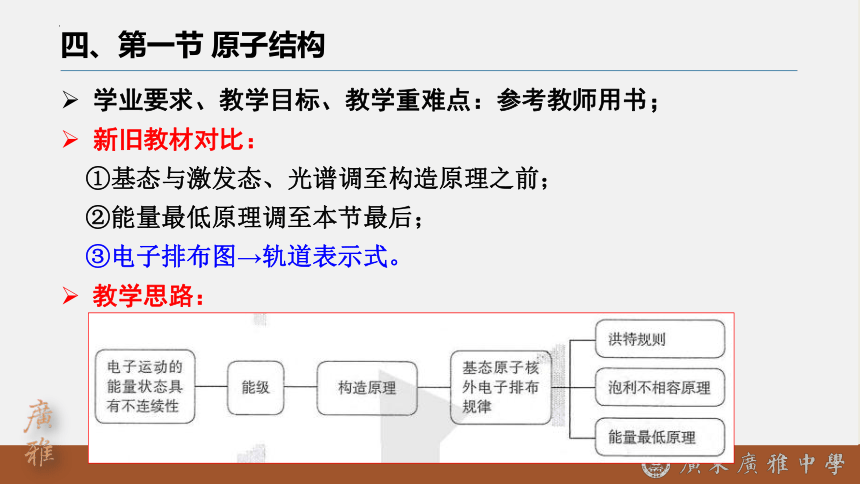
四、第一节 原子结构
学业要求、教学目标、教学重难点:参考教师用书;
新旧教材对比:
①基态与激发态、光谱调至构造原理之前;
②能量最低原理调至本节最后;
③电子排布图→轨道表示式。
教学思路:
四、第一节 原子结构
1. 能层与能级
能层与能级的关系;
能级的表示方法;
每个能级所能容纳的电子数;
能级间的能量关系
四、第一节 原子结构
2. 基态与激发态 原子光谱
基态原子:处于最低能量状态的原子;
激发态原子:基态原子吸收能量,电子跃迁到较高能级;
原子光谱:不同元素原子的电子发生跃迁时会吸收或释放不同的光,用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
思考:
原子光谱是否只有一条谱线?
不同原子的原子光谱是否相同?
原子光谱具有差异的原因是什么?
四、第一节 原子结构
原子光谱是否只有一条谱线?
核外电子吸收能量后跃迁到不同的能级,处于高能级的电子返回不同能级时释放的能量大小是不同的,所以原子吸收光谱或原子发射光谱的谱线都是复杂的,不止一条(右图是氢原子的能级图)。
不同原子的原子光谱是否相同?
不同原子的能层及能级都是有差别的,所以核外电子吸收能量会发生不同的跃迁行为(主要体现在能量差异),所得原子光谱的谱线自然存在差别。
原子光谱具有差异的原因是什么?
主要原因同样是不同能层及能级的能量有差异,电子跃迁到较高能级所需能量或电子返回较低能级所释放能量是不同的。
这几个题目主要是想让学生进一步理解能层与能级的概念及相互关系。
四、第一节 原子结构
3. 构造原理
构造原理:
以光谱事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序。
能级交错:3p→4s→3d。
基态原子的电子排布式:
1-36号元素;
Cr:3d54s1 Cu:3d104s1
四、第一节 原子结构
3. 构造原理
思考:电子在原子核外是怎么运动的呢?
四、第一节 原子结构
4. 电子云与原子轨道
用于描述核外电子的运动状态;
电子云:电子出现的概率;
电子云轮廓图:电子空间运动状态的形象化描述;
原子轨道:电子在原子核外的一个空间运动状态称为一个原子轨道。
思考:N原子的核外电子怎样填充到原子轨道上?
四、第一节 原子结构
四、第一节 原子结构
5. 泡利原理、洪特规则、能量最低原理
泡利原理:
①概念: 在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反。
②自旋:电子的运动方向,用“↑”和“↓”表示(证据?)
③轨道表示式(电子排布图):
洪特规则:
①概念:基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行;
②特例:简并轨道全充满、半充满或全空状态是能量较低的稳定状态,
如 Cr:3d54s1 Cu:3d104s1
四、第一节 原子结构
5. 泡利原理、洪特规则、能量最低原理
能量最低原理:
①概念:在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低;
②同时满足构造原理、泡利原理、洪特规则;
③区分构造原理和能量最低原理:填或没填电子的区别(个人观点);
④根据电子排布式、轨道表示式区分基态和激发态:
五、第二节 原子结构与元素的性质
新旧教材对比:
①明确元素周期律与元素周期系的区别;
②突出构造原理与元素周期表的关系;
③对角线规则提前(位-构-性)。
教学思路:
①从价层电子排布的角度
分析元素周期表;
②注意电离能与电负性的
变化趋势异同。
核外电子排布规律
周期表中的位置
原子半径、电离能、
电负性
五、第二节 原子结构与元素的性质
1. 原子结构与元素周期表
元素周期律
元素性质随元素原子的核电荷数递增发生周期性递变的规律。
元素周期系
元素性质随元素原子的核电荷数递增排列的序列。
元素周期表是呈现元素周期系的表格。
原子结构与元素周期表
周期数
族序数
结构-位置
五、第二节 原子结构与元素的性质
2. 构造原理与元素周期表
除第一周期外,以ns能级开始,以np能级结束,递增的电子数等于每个周期的元素数;
除第一周期外,每周期均以ns2np6结束;
最后填入电子的能级即为该元素在周期表所在的分区(ds区除外)
。。。
结构-位置
五、第二节 原子结构与元素的性质
位置-性质
Be、BeO、Be(OH)2 均能跟酸或碱反应;
Si3N4、BN均具有高熔点,高硬度;
。。。
五、第二节 原子结构与元素的性质
3. 元素周期律
(1) 原子半径
① 能层数越大,原子半径越大
(核外电子相互排斥);
② 核电荷数越大,原子半径越小
(原子核对电子的吸引);
③ 离子半径的比较及解析。
五、第二节 原子结构与元素的性质
3. 元素周期律
(2) 电离能
① 概念:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。
② 趋势分析
特殊情况分析:
结构-性质
第一电离能与金属性
特殊情况分析
五、第二节 原子结构与元素的性质
Na与Li同主族,Na的电子层数更多,原子半径更大,故第一电离能更小;
Li,Be和B为同周期元素,同周期元素从左至右,第一电离能呈现增大的趋势;但由于基态Be原子的s能级轨道处于全充满状态,能量更低更稳定,故其第一电离能大于B的。
五、第二节 原子结构与元素的性质
3. 元素周期律
(2) 电离能
③ 电离能与元素
的性质:
结构-性质
五、第二节 原子结构与元素的性质
3. 元素周期律
(3) 电负性
①概念:用来描述不同元素的原子
对键合电子吸引力的大小;
②键合电子:用于形成化学键的电子;
③氟:4.0;锂:1.0;
④金属元素一般小于1.8,非金属元素
一般大于1.8。
电负性与(非)金属性
五、第二节 原子结构与元素的性质
3. 元素周期律
(4) 电离能与电负性的异同
同:
①得、失电子的能力;
② 衡量金属性或非金属性的强弱;
③ 变化趋势基本一致;
异:
电离能有例外情况(原子结构)
六、熟悉高考题,准确把握重点
谢谢
第一章 原子结构与性质
——事实驱动与问题驱动
广东广雅中学 王焯强
一、问题驱动与事实驱动
为什么不同的金属元素有不同的焰色?
非金属元素有焰色吗?
电子层模型的依据是什么?
原子核外第n层最多容纳电子数为什么是2n2?
一、问题驱动与事实驱动
为什么不同的金属元素有不同的焰色?
核外电子吸收能量后发生跃迁,从能量较低的能级跃迁到能量较高的能级,即原子从基态变为激发态;激发态能量高,不稳定,核外电子从较高能级返回较低能级,以光的形式释放能量。所释放能量的大小对应一定波长的光。在焰色试验中,不同金属或它们的化合物在灼烧时会放出多种不同波长的光 ,在肉眼能感知的可见光范围内 ,因不同光的波长不同,呈现的颜色也就存在差异 。
这里可以给学生强调一点,不同能层上电子的能量是不一样的,相同能层上电子的能量也不完全相同,因为能层还有亚层,即能级,不同能级上电子的能量也不相同。
一、问题驱动与事实驱动
非金属元素有焰色吗?
非金属元素没有焰色,因为当电子从较高能级返回较低能级时,所放出的光的波长在可见光区,我们才能用肉眼感知到,在紫外光区或红外光区我们是看不到的。
须要给学生指出,虽然非金属元素没有焰色,但它们有不同的原子光谱,其实这个也在强调一个问题,就是原子中不同能级上电子的能量状态是不一样的。
一、问题驱动与事实驱动
电子层模型的依据是什么?
必修一中的电子层模型其实就是玻尔原子模型,玻尔原子模型是指电子在原子核外空间的一定轨道上绕核做高速圆周运动。该原子模型是玻尔为了解释氢原子光谱是由具有特定波长、彼此分立的谱线组成的线状光谱这一实验事实而提出的。
玻尔原子模型的其中一个主要观点是在不同轨道上运动的电子具有不同的能量。这里面提到的轨道即原子轨道,不同能层上的电子的能量是不同的,相同能层上不同能级中的电子的能量也是不同的,不同的能级具有不同的原子轨道。
一、问题驱动与事实驱动
原子核外第n层最多容纳电子数为什么是2n2?
根据上面能层、能级及不同能级上可填充的电子数,可以得到答案。在给学生讲解这个问题时,可以结合不同能层具有什么能级,不同能级上可以填充多少个电子的角度来分析。
二、几点建议
熟悉新课标中的内容要求与学业要求
电子云与原子轨道:学业要求(×)、内容要求(√)、教学目标(√)、教学重难点(√)、高考题(√)
准确把握教材变化
轨道表示式、元素周期系、构造原理与元素周期表
充分利用教材与教参
教材:思考与讨论、探究、资料卡片等;
教参:内容分析、教学建议、教学案例等
准确把握概念
能层、能级、核外电子排布式、价层电子排布式、原子轨道等
三、教材内容分析
第一节 原子结构 第二节 原子结构与元素的性质
(4课时) (3课时)
核外电子排布规律
周期表中的位置
原子半径、电离能、
电负性
四、第一节 原子结构
学业要求、教学目标、教学重难点:参考教师用书;
新旧教材对比:
①基态与激发态、光谱调至构造原理之前;
②能量最低原理调至本节最后;
③电子排布图→轨道表示式。
教学思路:
四、第一节 原子结构
1. 能层与能级
能层与能级的关系;
能级的表示方法;
每个能级所能容纳的电子数;
能级间的能量关系
四、第一节 原子结构
2. 基态与激发态 原子光谱
基态原子:处于最低能量状态的原子;
激发态原子:基态原子吸收能量,电子跃迁到较高能级;
原子光谱:不同元素原子的电子发生跃迁时会吸收或释放不同的光,用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
思考:
原子光谱是否只有一条谱线?
不同原子的原子光谱是否相同?
原子光谱具有差异的原因是什么?
四、第一节 原子结构
原子光谱是否只有一条谱线?
核外电子吸收能量后跃迁到不同的能级,处于高能级的电子返回不同能级时释放的能量大小是不同的,所以原子吸收光谱或原子发射光谱的谱线都是复杂的,不止一条(右图是氢原子的能级图)。
不同原子的原子光谱是否相同?
不同原子的能层及能级都是有差别的,所以核外电子吸收能量会发生不同的跃迁行为(主要体现在能量差异),所得原子光谱的谱线自然存在差别。
原子光谱具有差异的原因是什么?
主要原因同样是不同能层及能级的能量有差异,电子跃迁到较高能级所需能量或电子返回较低能级所释放能量是不同的。
这几个题目主要是想让学生进一步理解能层与能级的概念及相互关系。
四、第一节 原子结构
3. 构造原理
构造原理:
以光谱事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序。
能级交错:3p→4s→3d。
基态原子的电子排布式:
1-36号元素;
Cr:3d54s1 Cu:3d104s1
四、第一节 原子结构
3. 构造原理
思考:电子在原子核外是怎么运动的呢?
四、第一节 原子结构
4. 电子云与原子轨道
用于描述核外电子的运动状态;
电子云:电子出现的概率;
电子云轮廓图:电子空间运动状态的形象化描述;
原子轨道:电子在原子核外的一个空间运动状态称为一个原子轨道。
思考:N原子的核外电子怎样填充到原子轨道上?
四、第一节 原子结构
四、第一节 原子结构
5. 泡利原理、洪特规则、能量最低原理
泡利原理:
①概念: 在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反。
②自旋:电子的运动方向,用“↑”和“↓”表示(证据?)
③轨道表示式(电子排布图):
洪特规则:
①概念:基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行;
②特例:简并轨道全充满、半充满或全空状态是能量较低的稳定状态,
如 Cr:3d54s1 Cu:3d104s1
四、第一节 原子结构
5. 泡利原理、洪特规则、能量最低原理
能量最低原理:
①概念:在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低;
②同时满足构造原理、泡利原理、洪特规则;
③区分构造原理和能量最低原理:填或没填电子的区别(个人观点);
④根据电子排布式、轨道表示式区分基态和激发态:
五、第二节 原子结构与元素的性质
新旧教材对比:
①明确元素周期律与元素周期系的区别;
②突出构造原理与元素周期表的关系;
③对角线规则提前(位-构-性)。
教学思路:
①从价层电子排布的角度
分析元素周期表;
②注意电离能与电负性的
变化趋势异同。
核外电子排布规律
周期表中的位置
原子半径、电离能、
电负性
五、第二节 原子结构与元素的性质
1. 原子结构与元素周期表
元素周期律
元素性质随元素原子的核电荷数递增发生周期性递变的规律。
元素周期系
元素性质随元素原子的核电荷数递增排列的序列。
元素周期表是呈现元素周期系的表格。
原子结构与元素周期表
周期数
族序数
结构-位置
五、第二节 原子结构与元素的性质
2. 构造原理与元素周期表
除第一周期外,以ns能级开始,以np能级结束,递增的电子数等于每个周期的元素数;
除第一周期外,每周期均以ns2np6结束;
最后填入电子的能级即为该元素在周期表所在的分区(ds区除外)
。。。
结构-位置
五、第二节 原子结构与元素的性质
位置-性质
Be、BeO、Be(OH)2 均能跟酸或碱反应;
Si3N4、BN均具有高熔点,高硬度;
。。。
五、第二节 原子结构与元素的性质
3. 元素周期律
(1) 原子半径
① 能层数越大,原子半径越大
(核外电子相互排斥);
② 核电荷数越大,原子半径越小
(原子核对电子的吸引);
③ 离子半径的比较及解析。
五、第二节 原子结构与元素的性质
3. 元素周期律
(2) 电离能
① 概念:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。
② 趋势分析
特殊情况分析:
结构-性质
第一电离能与金属性
特殊情况分析
五、第二节 原子结构与元素的性质
Na与Li同主族,Na的电子层数更多,原子半径更大,故第一电离能更小;
Li,Be和B为同周期元素,同周期元素从左至右,第一电离能呈现增大的趋势;但由于基态Be原子的s能级轨道处于全充满状态,能量更低更稳定,故其第一电离能大于B的。
五、第二节 原子结构与元素的性质
3. 元素周期律
(2) 电离能
③ 电离能与元素
的性质:
结构-性质
五、第二节 原子结构与元素的性质
3. 元素周期律
(3) 电负性
①概念:用来描述不同元素的原子
对键合电子吸引力的大小;
②键合电子:用于形成化学键的电子;
③氟:4.0;锂:1.0;
④金属元素一般小于1.8,非金属元素
一般大于1.8。
电负性与(非)金属性
五、第二节 原子结构与元素的性质
3. 元素周期律
(4) 电离能与电负性的异同
同:
①得、失电子的能力;
② 衡量金属性或非金属性的强弱;
③ 变化趋势基本一致;
异:
电离能有例外情况(原子结构)
六、熟悉高考题,准确把握重点
谢谢
