1.2.2有机化合物的分离提纯方法与苯甲酸的提纯课件(共20张PPT)2022-2023学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 1.2.2有机化合物的分离提纯方法与苯甲酸的提纯课件(共20张PPT)2022-2023学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | zip | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-28 08:59:00 | ||
图片预览






文档简介
(共20张PPT)
有机化合物的分离提纯方法和苯甲酸的提纯
——人教版选择性必修3 第一章
教学实施过程分享
广东广雅中学
一、教学实施的背景和意义
1、普通高中化学课程标准(2017版)的要求
围绕物质性质和反应规律的研究、物质的制备、物质的分离与提纯、物质的检测等方面选取实验活动,认识解决这些类型的实验任务的一般思路和常用方法,掌握必须的实验操作技能。
2、化学科学与实验探究必修的主要内容。
初步学会物质检验、分离、提纯和溶液配制的化学实验基本知识和实验技能。
3、体现学生学科素养的高考考查要求
无机实验题和工业流程题、化工生产过程中分离提纯、除杂等环节,与高中化学基本的实验原理紧密联系。
二、教学目标和重难点
教学目标
1、能根据混合物的组成与状态特点选择合适的分离提纯方法
2、能够辨识蒸馏装置中各仪器的名称、结构和操作要点
3、能运用重结晶的原理设计实验方案,分离不同组成特点的固体
混合物
4、通过苯甲酸的提纯实验掌握重结晶的操作方法
教学重难点
运用重结晶的原理设计实验方案,分离不同组成特点的固体混合物
通过苯甲酸的提纯实验掌握重结晶的操作方法
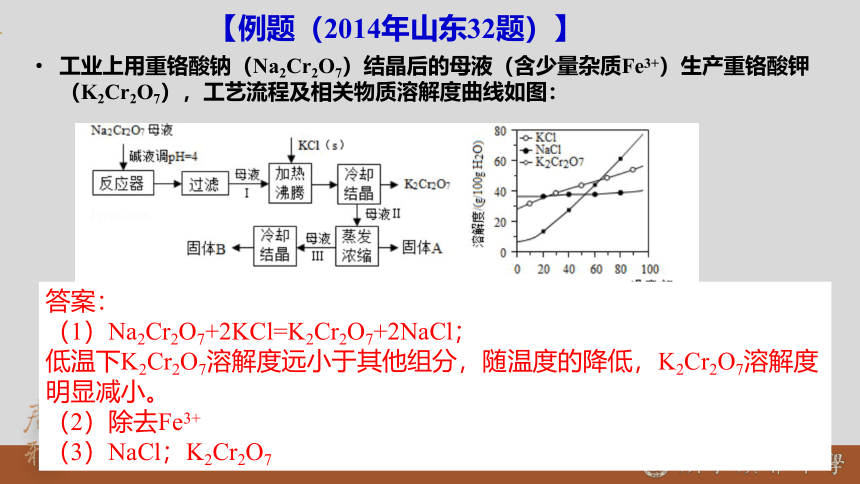
【例题(2014年山东32题)】
工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),工艺流程及相关物质溶解度曲线如图:
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为 ,
通过冷却结晶析出大量K2Cr2O7的原因是 。
(2)向Na2Cr2O7母液中加碱液调pH的目的是 。
(3)固体A主要为 (填化学式),固体B 主要为 (填化学式)
答案:
(1)Na2Cr2O7+2KCl=K2Cr2O7+2NaCl;
低温下K2Cr2O7溶解度远小于其他组分,随温度的降低,K2Cr2O7溶解度明显减小。
(2)除去Fe3+
(3)NaCl;K2Cr2O7
三、教学实施过程
(1)如何提取溴水中的溴?
(2)实验原理是什么?举例说明?
原理:利用混合物中一种溶质在互不相溶的两种溶剂中溶解性的不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来。
(3)用到的实验仪器(玻璃仪器)有哪些?
(4)如何选取萃取剂?
(5)归纳萃取的步骤。
(6)实验过程要注意哪些问题?
(7)萃取后的颜色特征?
分液漏斗
二、萃取
萃取剂条件:
与原溶剂互不相溶;
溶质在萃取剂中溶解度比在原溶剂中大;
与溶质不反应。
三、重结晶
1、基本概念:
辨析“结晶” 和“重结晶” :实验原理、操作方法、仪器相同,样品的起始状态不同,重结晶的目的多为除杂或使混合物分离。
2、实验原理:混合物中各组分在不同温度下溶解度不同来达到分离提纯的目的
3、实验操作:
结晶方法:蒸发结晶和冷却结晶
具体操作:“蒸发结晶,趁热过滤”或“蒸发浓缩、冷却结晶、过滤”
选择依据:溶解度大小及受其温度影响情况——可由“溶解度曲线” 获知
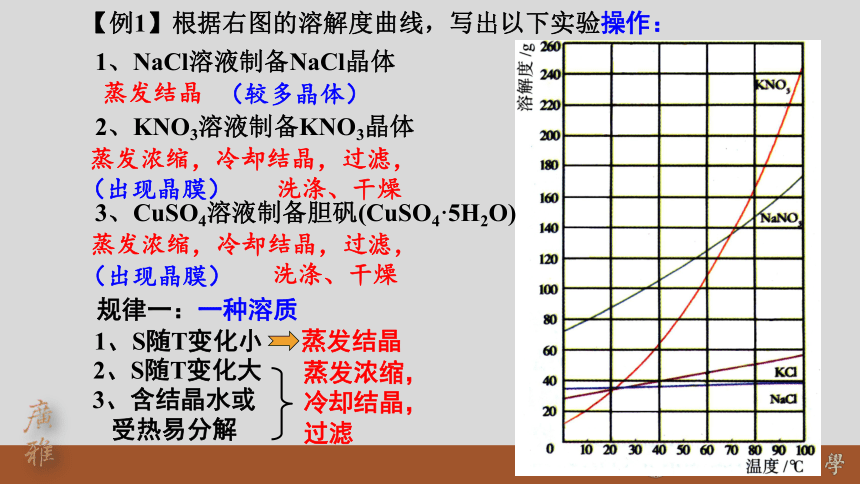
1、NaCl溶液制备NaCl晶体
【例1】根据右图的溶解度曲线,写出以下实验操作:
2、KNO3溶液制备KNO3晶体
蒸发结晶
蒸发浓缩,冷却结晶,过滤,
洗涤、干燥
规律一:一种溶质
3、CuSO4溶液制备胆矾(CuSO4·5H2O)
蒸发浓缩,冷却结晶,过滤,
洗涤、干燥
3、含结晶水或
受热易分解
蒸发浓缩,
冷却结晶,
过滤
(较多晶体)
(出现晶膜)
蒸发结晶
1、S随T变化小
2、S随T变化大
(出现晶膜)
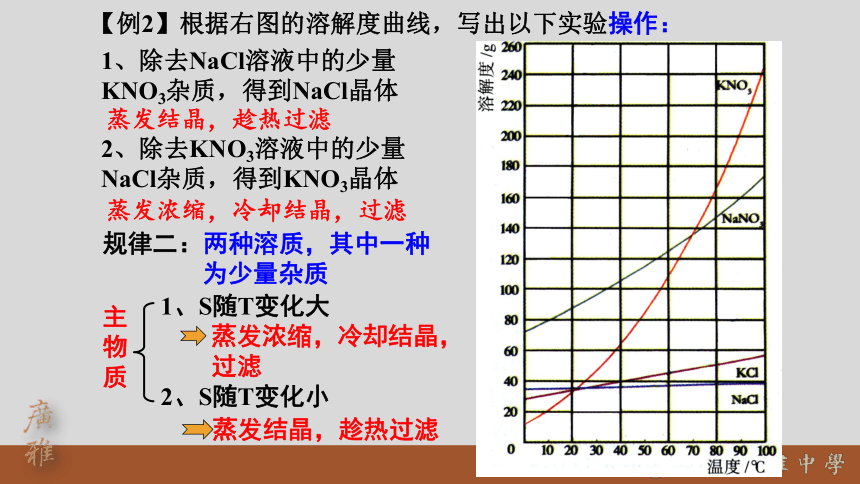
1、除去NaCl溶液中的少量KNO3杂质,得到NaCl晶体
蒸发结晶,趁热过滤
规律二:两种溶质,其中一种
为少量杂质
蒸发浓缩,冷却结晶,
过滤
蒸发结晶,趁热过滤
【例2】根据右图的溶解度曲线,写出以下实验操作:
1、S随T变化大
2、S随T变化小
主物质
2、除去KNO3溶液中的少量NaCl杂质,得到KNO3晶体
蒸发浓缩,冷却结晶,过滤
【例3】工业生产硝酸钾是以等物质的量的NaNO3和KCl为原料,
其原理为:NaNO3 + KCl = NaCl + KNO3。
根据溶解度曲线写出制备KNO3的操作步骤。
热水溶解
NaNO3 KCl
↓ ↓
蒸发结晶
趁热过滤
↓
↓
↓ ↓
滤液 NaCl固体
冷却结晶
↓
↓
过滤
→KNO3固体
NaCl在高温下溶解度最小,先析出晶体
KNO3溶解度受温度影响大,
且温度越低,溶解度越小
规律三:两种溶质,大量共存
蒸发结晶
趁热过滤
滤渣
滤渣
滤液
冷却结晶
过滤
(S随T变化小的)
(S随T变化大的)
三、重结晶
【实验1-2】 苯甲酸的重结晶
用什么方法除去粗苯甲酸中的泥沙和NaCl?
不溶性杂质( 过滤),可溶性杂质(重结晶)
阅读课本【实验1-2】,归纳重结晶的操作步骤。
温度/℃ 25 50 95
苯甲酸在水中的溶解度/g 0.17 0.95 6.8
粗苯甲酸混有少量泥沙和NaCl。已知:
氯化钠在水中的溶解度随温度变化不大,在100g水中其溶解度约35g。
粗产品
加热溶解
趁热过滤
滤液冷却结晶
过滤、洗涤、干燥
纯产品
【实验1-2】思考和交流
1.除去泥沙时为何要趁热过滤?
2.为了减少苯甲酸的损失,可采取什么措施?
3.冷却结晶时,是不是温度越低越好?
不是,因为随着温度过低,杂质的溶解度也会减小,杂质也会析出。
温度过低溶剂水也可能结冰。
由于苯甲酸的溶解度随温度降低迅速减小,这是为了减少过滤中损失苯甲酸。
把漏斗用热水浸泡后过滤或使用恒温漏斗过滤(趁热过滤)
在趁热过滤前加入少量的水(减小浓度)
加快过滤速度(抽滤)
抽滤装置
仪器:
真空泵
布氏漏斗
抽滤瓶
趁热过滤装置
链接高考:课后拓展练习
【变式训练1(P176:2-11 2016年北京27节选)】
以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq) NaHPbO2(aq)
其溶解度曲线如图所示。
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是__(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过程Ⅲ的目的是提纯。结合上述溶解度曲线,简述过程Ⅲ的操作:________。 。
链接高考:课后拓展练习
【变式训练2(2007广东21 )节选】
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程
氯化铵和硫酸钠的溶解度随温度变化如上图所示。
回答下列问题:
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是 。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 。
链接高考:课后拓展练习
【变式训练3(2008广东19节选】
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl—和SO42—等杂质,提纯工艺路线如下:
已知碳酸钠的溶解度(S)随温度变化的曲线如上图所示:
回答下列问题:
(1)滤渣的主要成分为 。
(2)“趁热过滤”的原因是 。
(3)若在实验室进行“趁热过滤”,可采取的措施是 (写出1种)。
若“母液”循环使用,可能出现的问题及其原因是 。
选取课后巩固习题的小建议
1、关于重结晶的拓展习题,选取3至5个小题专门考查对重结晶实验原理和实验操作的经典题进行训练,学生达到理解并巩固该知识点即可,更深入的应用可以留到高考复习时再进行专题归纳和复习。
2、总体分析来看,近几年全国卷中考查结晶的问题很少,涉及到的试题考查也比较简单。考查频率最高的是江苏卷,而且难度较大,像2014年山东卷用一道大题考查结晶与提纯的问题也比较少见。
3、强化基础,全面复习对物质进行分离提纯的方法。
重结晶只是对有机物进行分离提纯的其中一种方法,因此,根据混合物的存在状态和性质差异选择合适的分离提纯方法才是最核心的内容。
有机物分离、提纯的常用方法
方法 适用范围 主要仪器 实例
蒸馏
萃取
分液
重结晶
洗气
盐析
渗析
有机化合物的分离提纯方法和苯甲酸的提纯
——人教版选择性必修3 第一章
教学实施过程分享
广东广雅中学
一、教学实施的背景和意义
1、普通高中化学课程标准(2017版)的要求
围绕物质性质和反应规律的研究、物质的制备、物质的分离与提纯、物质的检测等方面选取实验活动,认识解决这些类型的实验任务的一般思路和常用方法,掌握必须的实验操作技能。
2、化学科学与实验探究必修的主要内容。
初步学会物质检验、分离、提纯和溶液配制的化学实验基本知识和实验技能。
3、体现学生学科素养的高考考查要求
无机实验题和工业流程题、化工生产过程中分离提纯、除杂等环节,与高中化学基本的实验原理紧密联系。
二、教学目标和重难点
教学目标
1、能根据混合物的组成与状态特点选择合适的分离提纯方法
2、能够辨识蒸馏装置中各仪器的名称、结构和操作要点
3、能运用重结晶的原理设计实验方案,分离不同组成特点的固体
混合物
4、通过苯甲酸的提纯实验掌握重结晶的操作方法
教学重难点
运用重结晶的原理设计实验方案,分离不同组成特点的固体混合物
通过苯甲酸的提纯实验掌握重结晶的操作方法
【例题(2014年山东32题)】
工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),工艺流程及相关物质溶解度曲线如图:
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为 ,
通过冷却结晶析出大量K2Cr2O7的原因是 。
(2)向Na2Cr2O7母液中加碱液调pH的目的是 。
(3)固体A主要为 (填化学式),固体B 主要为 (填化学式)
答案:
(1)Na2Cr2O7+2KCl=K2Cr2O7+2NaCl;
低温下K2Cr2O7溶解度远小于其他组分,随温度的降低,K2Cr2O7溶解度明显减小。
(2)除去Fe3+
(3)NaCl;K2Cr2O7
三、教学实施过程
(1)如何提取溴水中的溴?
(2)实验原理是什么?举例说明?
原理:利用混合物中一种溶质在互不相溶的两种溶剂中溶解性的不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来。
(3)用到的实验仪器(玻璃仪器)有哪些?
(4)如何选取萃取剂?
(5)归纳萃取的步骤。
(6)实验过程要注意哪些问题?
(7)萃取后的颜色特征?
分液漏斗
二、萃取
萃取剂条件:
与原溶剂互不相溶;
溶质在萃取剂中溶解度比在原溶剂中大;
与溶质不反应。
三、重结晶
1、基本概念:
辨析“结晶” 和“重结晶” :实验原理、操作方法、仪器相同,样品的起始状态不同,重结晶的目的多为除杂或使混合物分离。
2、实验原理:混合物中各组分在不同温度下溶解度不同来达到分离提纯的目的
3、实验操作:
结晶方法:蒸发结晶和冷却结晶
具体操作:“蒸发结晶,趁热过滤”或“蒸发浓缩、冷却结晶、过滤”
选择依据:溶解度大小及受其温度影响情况——可由“溶解度曲线” 获知
1、NaCl溶液制备NaCl晶体
【例1】根据右图的溶解度曲线,写出以下实验操作:
2、KNO3溶液制备KNO3晶体
蒸发结晶
蒸发浓缩,冷却结晶,过滤,
洗涤、干燥
规律一:一种溶质
3、CuSO4溶液制备胆矾(CuSO4·5H2O)
蒸发浓缩,冷却结晶,过滤,
洗涤、干燥
3、含结晶水或
受热易分解
蒸发浓缩,
冷却结晶,
过滤
(较多晶体)
(出现晶膜)
蒸发结晶
1、S随T变化小
2、S随T变化大
(出现晶膜)
1、除去NaCl溶液中的少量KNO3杂质,得到NaCl晶体
蒸发结晶,趁热过滤
规律二:两种溶质,其中一种
为少量杂质
蒸发浓缩,冷却结晶,
过滤
蒸发结晶,趁热过滤
【例2】根据右图的溶解度曲线,写出以下实验操作:
1、S随T变化大
2、S随T变化小
主物质
2、除去KNO3溶液中的少量NaCl杂质,得到KNO3晶体
蒸发浓缩,冷却结晶,过滤
【例3】工业生产硝酸钾是以等物质的量的NaNO3和KCl为原料,
其原理为:NaNO3 + KCl = NaCl + KNO3。
根据溶解度曲线写出制备KNO3的操作步骤。
热水溶解
NaNO3 KCl
↓ ↓
蒸发结晶
趁热过滤
↓
↓
↓ ↓
滤液 NaCl固体
冷却结晶
↓
↓
过滤
→KNO3固体
NaCl在高温下溶解度最小,先析出晶体
KNO3溶解度受温度影响大,
且温度越低,溶解度越小
规律三:两种溶质,大量共存
蒸发结晶
趁热过滤
滤渣
滤渣
滤液
冷却结晶
过滤
(S随T变化小的)
(S随T变化大的)
三、重结晶
【实验1-2】 苯甲酸的重结晶
用什么方法除去粗苯甲酸中的泥沙和NaCl?
不溶性杂质( 过滤),可溶性杂质(重结晶)
阅读课本【实验1-2】,归纳重结晶的操作步骤。
温度/℃ 25 50 95
苯甲酸在水中的溶解度/g 0.17 0.95 6.8
粗苯甲酸混有少量泥沙和NaCl。已知:
氯化钠在水中的溶解度随温度变化不大,在100g水中其溶解度约35g。
粗产品
加热溶解
趁热过滤
滤液冷却结晶
过滤、洗涤、干燥
纯产品
【实验1-2】思考和交流
1.除去泥沙时为何要趁热过滤?
2.为了减少苯甲酸的损失,可采取什么措施?
3.冷却结晶时,是不是温度越低越好?
不是,因为随着温度过低,杂质的溶解度也会减小,杂质也会析出。
温度过低溶剂水也可能结冰。
由于苯甲酸的溶解度随温度降低迅速减小,这是为了减少过滤中损失苯甲酸。
把漏斗用热水浸泡后过滤或使用恒温漏斗过滤(趁热过滤)
在趁热过滤前加入少量的水(减小浓度)
加快过滤速度(抽滤)
抽滤装置
仪器:
真空泵
布氏漏斗
抽滤瓶
趁热过滤装置
链接高考:课后拓展练习
【变式训练1(P176:2-11 2016年北京27节选)】
以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq) NaHPbO2(aq)
其溶解度曲线如图所示。
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是__(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过程Ⅲ的目的是提纯。结合上述溶解度曲线,简述过程Ⅲ的操作:________。 。
链接高考:课后拓展练习
【变式训练2(2007广东21 )节选】
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程
氯化铵和硫酸钠的溶解度随温度变化如上图所示。
回答下列问题:
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是 。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 。
链接高考:课后拓展练习
【变式训练3(2008广东19节选】
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl—和SO42—等杂质,提纯工艺路线如下:
已知碳酸钠的溶解度(S)随温度变化的曲线如上图所示:
回答下列问题:
(1)滤渣的主要成分为 。
(2)“趁热过滤”的原因是 。
(3)若在实验室进行“趁热过滤”,可采取的措施是 (写出1种)。
若“母液”循环使用,可能出现的问题及其原因是 。
选取课后巩固习题的小建议
1、关于重结晶的拓展习题,选取3至5个小题专门考查对重结晶实验原理和实验操作的经典题进行训练,学生达到理解并巩固该知识点即可,更深入的应用可以留到高考复习时再进行专题归纳和复习。
2、总体分析来看,近几年全国卷中考查结晶的问题很少,涉及到的试题考查也比较简单。考查频率最高的是江苏卷,而且难度较大,像2014年山东卷用一道大题考查结晶与提纯的问题也比较少见。
3、强化基础,全面复习对物质进行分离提纯的方法。
重结晶只是对有机物进行分离提纯的其中一种方法,因此,根据混合物的存在状态和性质差异选择合适的分离提纯方法才是最核心的内容。
有机物分离、提纯的常用方法
方法 适用范围 主要仪器 实例
蒸馏
萃取
分液
重结晶
洗气
盐析
渗析
