人教版(2019)选择性必修第三册 3.2.1 醇 课件(共20张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修第三册 3.2.1 醇 课件(共20张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-28 09:21:53 | ||
图片预览

文档简介
(共20张PPT)
第三章 烃的衍生物
第二节 醇 酚
第1课时
CH3OH
CH3CH2OH
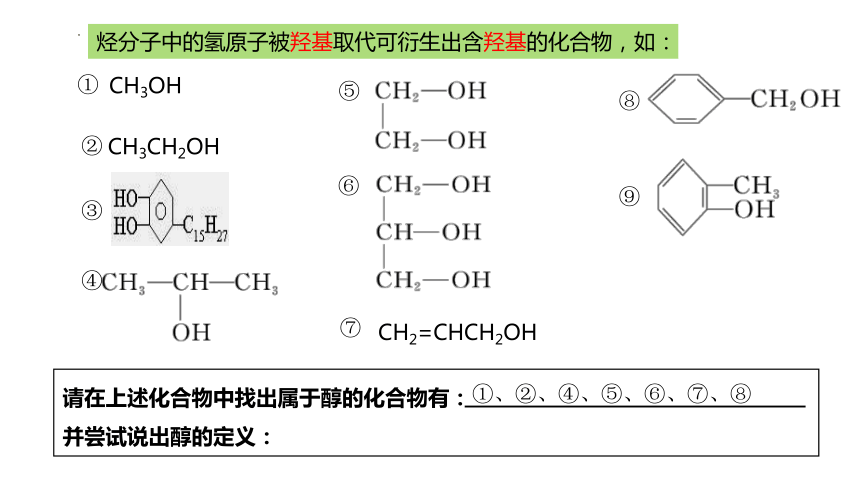
烃分子中的氢原子被羟基取代可衍生出含羟基的化合物,如:
请在上述化合物中找出属于醇的化合物有:
并尝试说出醇的定义:
①
②
③
④
⑤
⑥
⑧
⑨
①、②、④、⑤、⑥、⑦、⑧
CH2=CHCH2OH
⑦
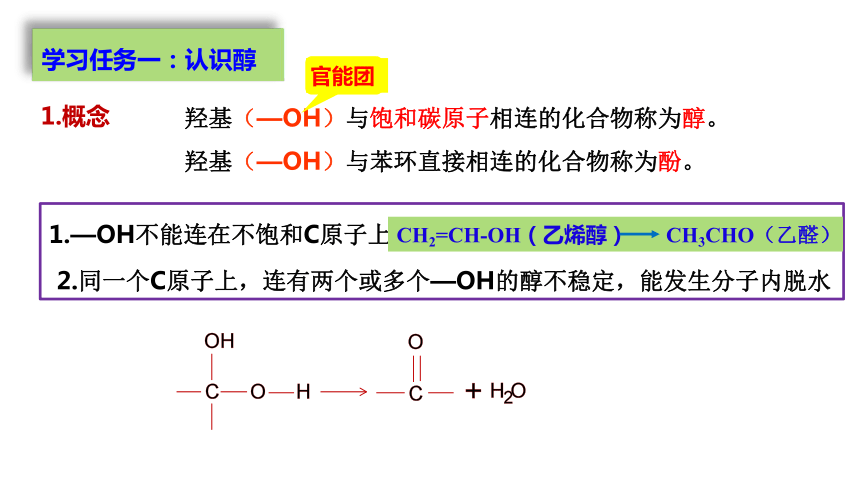
羟基(—OH)与饱和碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
1.概念
1.—OH不能连在不饱和C原子上
CH2=CH-OH(乙烯醇) CH3CHO(乙醛)
学习任务一:认识醇
2.同一个C原子上,连有两个或多个—OH的醇不稳定,能发生分子内脱水
官能团
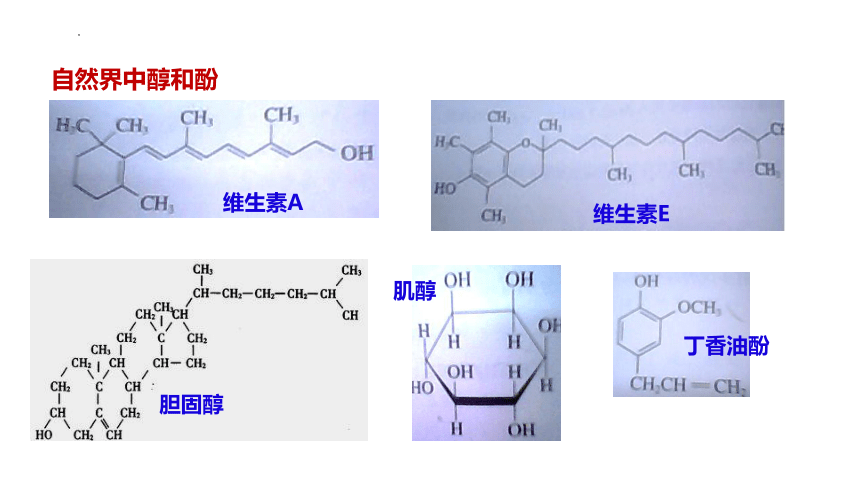
自然界中醇和酚
胆固醇
维生素A
肌醇
丁香油酚
维生素E
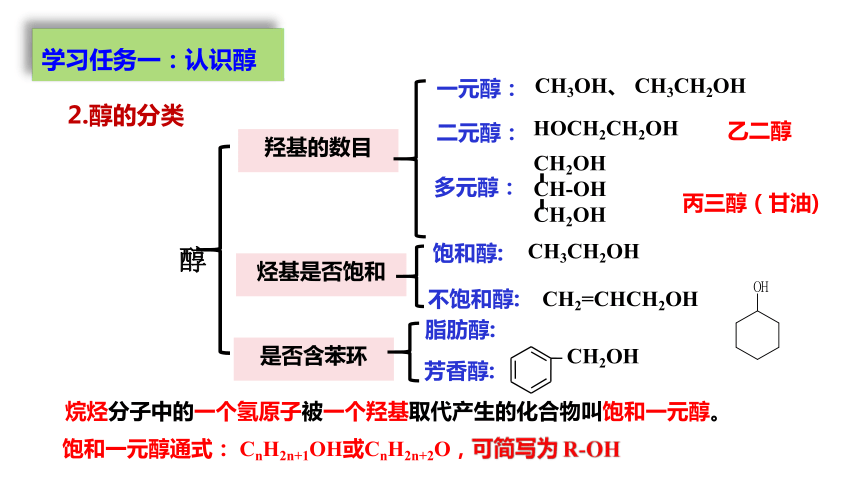
羟基的数目
烃基是否饱和
是否含苯环
一元醇:
CH3OH、 CH3CH2OH
二元醇:
多元醇:
HOCH2CH2OH
CH2OH
CH-OH
CH2OH
丙三醇(甘油)
乙二醇
饱和醇:
不饱和醇:
CH3CH2OH
CH2=CHCH2OH
脂肪醇:
CH2OH
芳香醇:
醇
2.醇的分类
学习任务一:认识醇
烷烃分子中的一个氢原子被一个羟基取代产生的化合物叫饱和一元醇。
饱和一元醇通式: CnH2n+1OH或CnH2n+2O,可简写为 R-OH
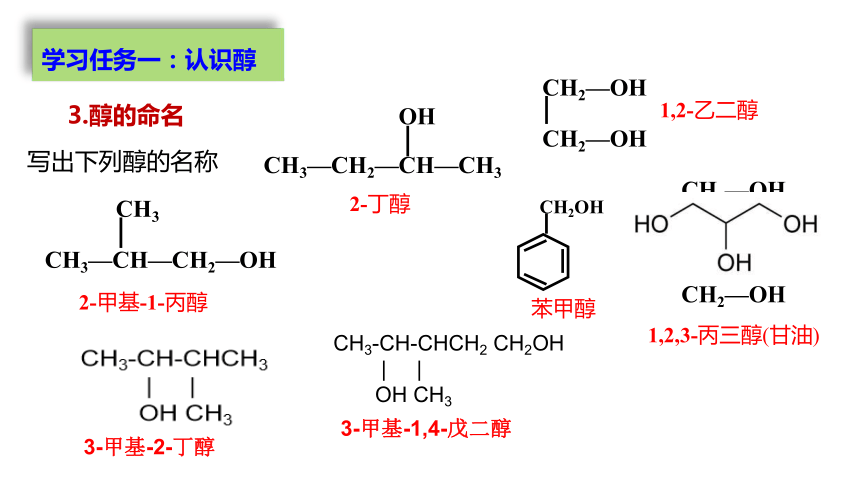
写出下列醇的名称
2-甲基-1-丙醇
2-丁醇
1,2-乙二醇
1,2,3-丙三醇(甘油)
苯甲醇
CH3—CH—CH2—OH
CH3
CH3—CH2—CH—CH3
OH
CH2—OH
CH2—OH
CH2—OH
CH—OH
CH2—OH
CH2OH
3.醇的命名
学习任务一:认识醇
CH3-CH-CHCH2 CH2OH
| |
OH CH3
3-甲基-1,4-戊二醇
3-甲基-2-丁醇
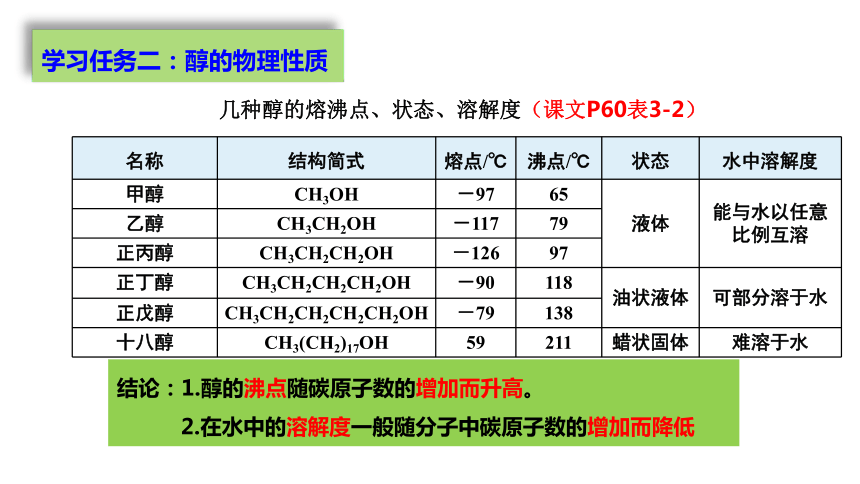
名称 结构简式 熔点/℃ 沸点/℃ 状态 水中溶解度
甲醇 CH3OH -97 65 液体 能与水以任意比例互溶
乙醇 CH3CH2OH -117 79 正丙醇 CH3CH2CH2OH -126 97 正丁醇 CH3CH2CH2CH2OH -90 118 油状液体 可部分溶于水
正戊醇 CH3CH2CH2CH2CH2OH -79 138 十八醇 CH3(CH2)17OH 59 211 蜡状固体 难溶于水
结论:1.醇的沸点随碳原子数的增加而升高。
2.在水中的溶解度一般随分子中碳原子数的增加而降低
几种醇的熔沸点、状态、溶解度(课文P60表3-2)
学习任务二:醇的物理性质
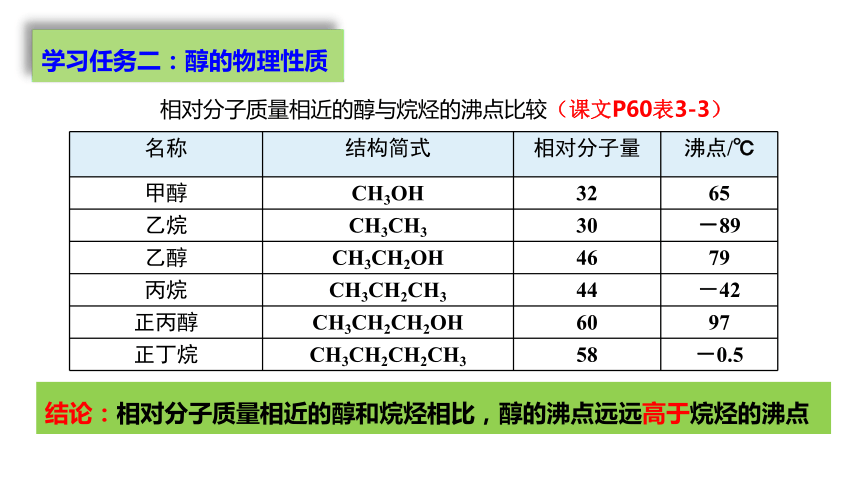
相对分子质量相近的醇与烷烃的沸点比较(课文P60表3-3)
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
结论:相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点
学习任务二:醇的物理性质
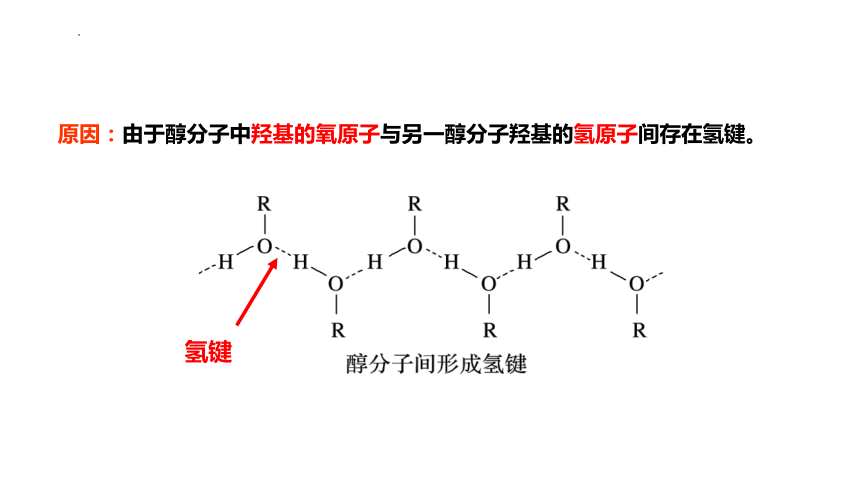
原因:由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子间存在氢键。
氢键
结论:含相同碳原子数的醇,羟基数越多,沸点越高。
变式:下表列举了一些醇的沸点。沸点变化有什么规律,并作出解释
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-二丙醇 2 188
1,2,3-丙三醇 3 259
解释:醇分子中羟基数越多,分子间形成的氢键数目越多,分子间作用力越大,沸点就越高,同理可推测醇分子中羟基数越多,在水中的溶解度增大
反应名称 反应类型 断键位置
与金属钠反应
燃烧反应
Cu或Ag催化氧化
浓硫酸条件下与乙酸加热
② ③
①②③④⑤
①
①
取代反应
氧化反应
氧化反应
取代反应
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
学习任务三:乙醇结构与化学性质
温故知新
球棍模型
充填模型
CH3CH2OH + Na → CH3CH2ONa + H2↑
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
2 2 2
①处O—H键断开
1.乙醇与活泼金属反应:写出乙醇与金属钠、镁反应的化学方程式、反应类型及断键位置
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
学习任务三:乙醇结构与化学性质
2.乙醇的氧化反应:分别写出下列乙醇氧化反应的化学方程式、现象、反应类型及断键位置
(1)燃烧反应(完全燃烧)
2CO2 +3H2O
C2H5OH + 3O2
点燃
淡蓝色火焰
CuO中间产物,Cu催化剂
(2)催化氧化
2C2H5OH + O2
Cu
2CH3CHO + 2 H2O
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
①处O—H和③处α-C—H键断开
学习任务三:乙醇结构与化学性质
催化氧化类型小结
(α-C上有无H),则不能氧化。
C OH
R2
R1
R3
(3)
(2) 2 CH—OH + O2
R2
R1
Cu
△
(1) 2R—CH2—OH + O2
Cu
△
(α-C上有2或3个H),氧化为醛
O
=
2R—C—H + 2H2O
(α-C上有1个H),氧化为酮
O
=
2R1—C—R2 + 2H2O
醇的催化氧化也可以用银作催化剂。
焊接银器时,表面会生成发黑的氧化膜;
银匠都是先把银在火上烧热,马上蘸一下酒精,银会光亮如初!这是何原理?
2C2H5OH + O2
Ag
2CH3CHO + 2 H2O
应用拓展
思考:若遇强氧化剂,乙醇会发生怎样的变化?
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
常见的强氧化剂:(课文P62实验3-3)
高锰酸钾(KMnO4) 酸性溶液:MnO4- Mn2+
重铬酸钾(K2Cr2O7)酸性溶液Cr2O72- Cr3+
(橙红色) (绿色)
紫红色 无色
2.乙醇的氧化反应:
(3)被强氧化剂(如酸性高锰酸钾、重铬酸钾)氧化成乙酸
学习任务三:乙醇结构与化学性质
醇被酸性高锰酸钾等强氧化剂氧化的规律
C OH + KMnO4(H+) 不褪色
R2
R1
R3
(3)
(2) CH—OH + KMnO4(H+) 褪色
R2
R1
(1) 2R—CH2—OH + KMnO4(H+) 褪色
伯醇
仲醇
叔醇
实质:酸脱羟基、醇脱羟基上的氢原子。
注意:可逆反应
3.乙醇的酯化反应:写出乙醇与乙酸的反应方程式、现象、反应类型及断键位置
学习任务三:乙醇结构与化学性质
(4) 导管末端为什么不能插入饱和Na2CO3溶液中?
(3) 浓硫酸的作用是什么?
防止溶液倒吸
催化剂和吸水剂
(5) 饱和Na2CO3溶液的作用是什么?
中和乙酸、吸收乙醇、降低酯的溶解度,便于分层。
【思考与交流】
(6) 长导管的作用是什么?
导气、冷凝
(2) 加热、碎瓷片的作用是什么?
加快反应速率、防止暴沸
(1)乙醇、乙酸、浓硫酸三种试剂在添加时要注意什么
一只试管中加入3ml乙醇,边振荡试管边慢慢加入2ml浓硫酸和2ml乙酸
酯化反应
——酸跟醇作用生成酯跟水的反应
羧酸
或无机含氧酸
变换:①写出乙醇与硝酸生成硝酸酯的方程式。
②乙二醇与乙酸生成二乙酸乙二酯的方程式
③苯甲酸与2-乙醇的方程式
④乙二醇与乙二酸生成乙二酸乙二酯的方程式(成环和聚合物)
3.乙醇的酯化反应
学习任务三:乙醇结构与化学性质
第三章 烃的衍生物
第二节 醇 酚
第1课时
CH3OH
CH3CH2OH
烃分子中的氢原子被羟基取代可衍生出含羟基的化合物,如:
请在上述化合物中找出属于醇的化合物有:
并尝试说出醇的定义:
①
②
③
④
⑤
⑥
⑧
⑨
①、②、④、⑤、⑥、⑦、⑧
CH2=CHCH2OH
⑦
羟基(—OH)与饱和碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
1.概念
1.—OH不能连在不饱和C原子上
CH2=CH-OH(乙烯醇) CH3CHO(乙醛)
学习任务一:认识醇
2.同一个C原子上,连有两个或多个—OH的醇不稳定,能发生分子内脱水
官能团
自然界中醇和酚
胆固醇
维生素A
肌醇
丁香油酚
维生素E
羟基的数目
烃基是否饱和
是否含苯环
一元醇:
CH3OH、 CH3CH2OH
二元醇:
多元醇:
HOCH2CH2OH
CH2OH
CH-OH
CH2OH
丙三醇(甘油)
乙二醇
饱和醇:
不饱和醇:
CH3CH2OH
CH2=CHCH2OH
脂肪醇:
CH2OH
芳香醇:
醇
2.醇的分类
学习任务一:认识醇
烷烃分子中的一个氢原子被一个羟基取代产生的化合物叫饱和一元醇。
饱和一元醇通式: CnH2n+1OH或CnH2n+2O,可简写为 R-OH
写出下列醇的名称
2-甲基-1-丙醇
2-丁醇
1,2-乙二醇
1,2,3-丙三醇(甘油)
苯甲醇
CH3—CH—CH2—OH
CH3
CH3—CH2—CH—CH3
OH
CH2—OH
CH2—OH
CH2—OH
CH—OH
CH2—OH
CH2OH
3.醇的命名
学习任务一:认识醇
CH3-CH-CHCH2 CH2OH
| |
OH CH3
3-甲基-1,4-戊二醇
3-甲基-2-丁醇
名称 结构简式 熔点/℃ 沸点/℃ 状态 水中溶解度
甲醇 CH3OH -97 65 液体 能与水以任意比例互溶
乙醇 CH3CH2OH -117 79 正丙醇 CH3CH2CH2OH -126 97 正丁醇 CH3CH2CH2CH2OH -90 118 油状液体 可部分溶于水
正戊醇 CH3CH2CH2CH2CH2OH -79 138 十八醇 CH3(CH2)17OH 59 211 蜡状固体 难溶于水
结论:1.醇的沸点随碳原子数的增加而升高。
2.在水中的溶解度一般随分子中碳原子数的增加而降低
几种醇的熔沸点、状态、溶解度(课文P60表3-2)
学习任务二:醇的物理性质
相对分子质量相近的醇与烷烃的沸点比较(课文P60表3-3)
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
结论:相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点
学习任务二:醇的物理性质
原因:由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子间存在氢键。
氢键
结论:含相同碳原子数的醇,羟基数越多,沸点越高。
变式:下表列举了一些醇的沸点。沸点变化有什么规律,并作出解释
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-二丙醇 2 188
1,2,3-丙三醇 3 259
解释:醇分子中羟基数越多,分子间形成的氢键数目越多,分子间作用力越大,沸点就越高,同理可推测醇分子中羟基数越多,在水中的溶解度增大
反应名称 反应类型 断键位置
与金属钠反应
燃烧反应
Cu或Ag催化氧化
浓硫酸条件下与乙酸加热
② ③
①②③④⑤
①
①
取代反应
氧化反应
氧化反应
取代反应
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
学习任务三:乙醇结构与化学性质
温故知新
球棍模型
充填模型
CH3CH2OH + Na → CH3CH2ONa + H2↑
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
2 2 2
①处O—H键断开
1.乙醇与活泼金属反应:写出乙醇与金属钠、镁反应的化学方程式、反应类型及断键位置
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
学习任务三:乙醇结构与化学性质
2.乙醇的氧化反应:分别写出下列乙醇氧化反应的化学方程式、现象、反应类型及断键位置
(1)燃烧反应(完全燃烧)
2CO2 +3H2O
C2H5OH + 3O2
点燃
淡蓝色火焰
CuO中间产物,Cu催化剂
(2)催化氧化
2C2H5OH + O2
Cu
2CH3CHO + 2 H2O
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
①处O—H和③处α-C—H键断开
学习任务三:乙醇结构与化学性质
催化氧化类型小结
(α-C上有无H),则不能氧化。
C OH
R2
R1
R3
(3)
(2) 2 CH—OH + O2
R2
R1
Cu
△
(1) 2R—CH2—OH + O2
Cu
△
(α-C上有2或3个H),氧化为醛
O
=
2R—C—H + 2H2O
(α-C上有1个H),氧化为酮
O
=
2R1—C—R2 + 2H2O
醇的催化氧化也可以用银作催化剂。
焊接银器时,表面会生成发黑的氧化膜;
银匠都是先把银在火上烧热,马上蘸一下酒精,银会光亮如初!这是何原理?
2C2H5OH + O2
Ag
2CH3CHO + 2 H2O
应用拓展
思考:若遇强氧化剂,乙醇会发生怎样的变化?
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
常见的强氧化剂:(课文P62实验3-3)
高锰酸钾(KMnO4) 酸性溶液:MnO4- Mn2+
重铬酸钾(K2Cr2O7)酸性溶液Cr2O72- Cr3+
(橙红色) (绿色)
紫红色 无色
2.乙醇的氧化反应:
(3)被强氧化剂(如酸性高锰酸钾、重铬酸钾)氧化成乙酸
学习任务三:乙醇结构与化学性质
醇被酸性高锰酸钾等强氧化剂氧化的规律
C OH + KMnO4(H+) 不褪色
R2
R1
R3
(3)
(2) CH—OH + KMnO4(H+) 褪色
R2
R1
(1) 2R—CH2—OH + KMnO4(H+) 褪色
伯醇
仲醇
叔醇
实质:酸脱羟基、醇脱羟基上的氢原子。
注意:可逆反应
3.乙醇的酯化反应:写出乙醇与乙酸的反应方程式、现象、反应类型及断键位置
学习任务三:乙醇结构与化学性质
(4) 导管末端为什么不能插入饱和Na2CO3溶液中?
(3) 浓硫酸的作用是什么?
防止溶液倒吸
催化剂和吸水剂
(5) 饱和Na2CO3溶液的作用是什么?
中和乙酸、吸收乙醇、降低酯的溶解度,便于分层。
【思考与交流】
(6) 长导管的作用是什么?
导气、冷凝
(2) 加热、碎瓷片的作用是什么?
加快反应速率、防止暴沸
(1)乙醇、乙酸、浓硫酸三种试剂在添加时要注意什么
一只试管中加入3ml乙醇,边振荡试管边慢慢加入2ml浓硫酸和2ml乙酸
酯化反应
——酸跟醇作用生成酯跟水的反应
羧酸
或无机含氧酸
变换:①写出乙醇与硝酸生成硝酸酯的方程式。
②乙二醇与乙酸生成二乙酸乙二酯的方程式
③苯甲酸与2-乙醇的方程式
④乙二醇与乙二酸生成乙二酸乙二酯的方程式(成环和聚合物)
3.乙醇的酯化反应
学习任务三:乙醇结构与化学性质
