人教版(2019)选择性必修第三册 3.2 醇酚 课件(共22张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修第三册 3.2 醇酚 课件(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-28 00:00:00 | ||
图片预览






文档简介
(共22张PPT)
烃的衍生物
第三章
第二节 醇 酚
1.醇的结构特点
(1)定义:羟基与饱和碳原子相连的化合物称为醇。
(2)官能团:羟基(—OH)
(3)结构: (R1、R2、R3为H或烃基)
(4)饱和一元醇通式:
一、醇的概述
CnH2n+1OH 或 CnH2n+2O (n≥1),可简写为R—OH。
一、醇的概述
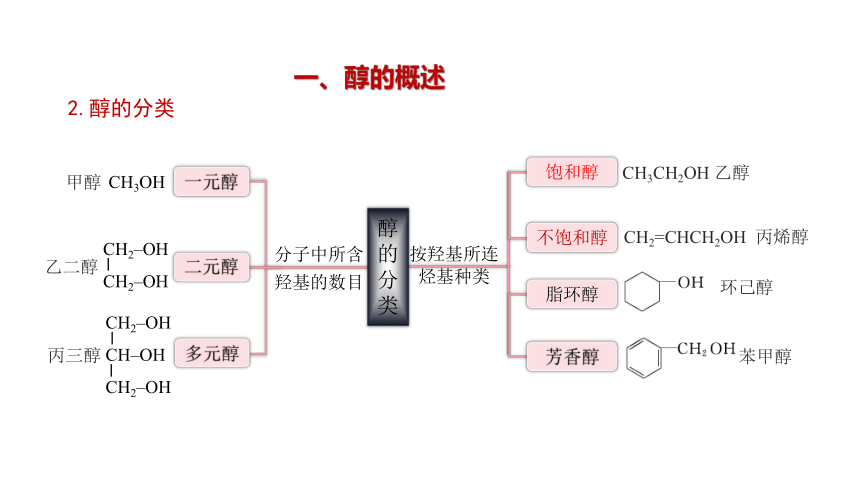
2.醇的分类
按羟基所连
烃基种类
饱和醇
不饱和醇
脂环醇
芳香醇
CH3CH2OH 乙醇
CH2=CHCH2OH 丙烯醇
苯甲醇
环己醇
乙二醇
分子中所含羟基的数目
一元醇
二元醇
多元醇
CH3OH
CH2–OH
CH2–OH
CH2–OH
CH–OH
CH2–OH
甲醇
丙三醇
醇的
分类
二、醇的化学性质——以乙醇为例
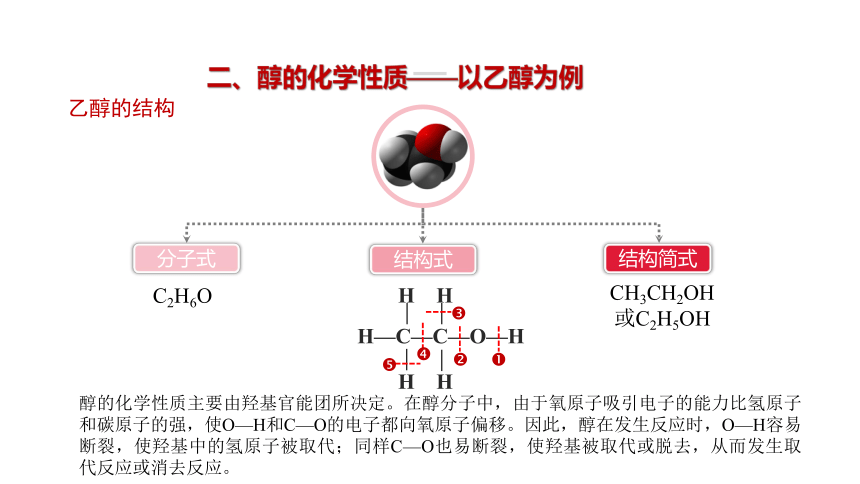
乙醇的结构
分子式
结构式
结构简式
CH3CH2OH
或C2H5OH
H—C—C—O—H
H H
H H
醇的化学性质主要由羟基官能团所决定。在醇分子中,由于氧原子吸引电子的能力比氢原子和碳原子的强,使O—H和C—O的电子都向氧原子偏移。因此,醇在发生反应时,O—H容易断裂,使羟基中的氢原子被取代;同样C—O也易断裂,使羟基被取代或脱去,从而发生取代反应或消去反应。
C2H6O
一、醇的置换反应
二、醇的取代反应
三、醇的催化氧化
乙醇的化学性质
二、醇的化学性质——以乙醇为例
2.取代反应
(1)乙醇与氢卤酸的取代反应
CH3CH2–OH+H–Br CH3CH2Br+H2O
乙醇与浓氢溴酸混合加热:
H—C—C—O—H
H H
H H
二、醇的化学性质——以乙醇为例
2.取代反应
(2)醇分子间脱水成醚的取代反应
H—C—C—O—H
H H
H H
CH3CH2–OH+H–OCH2CH3 CH3CH2–O–CH2CH3+H2O
浓H2SO4
140℃
乙醚
二、醇的化学性质——以乙醇为例
2.取代反应
(2)醇分子间脱水成醚的取代反应
乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,有麻醉作用。乙醚微溶于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机物。
CH3CH2–OH+H–OCH2CH3 CH3CH2–O–CH2CH3+H2O
浓H2SO4
140℃
乙醚
【醚类物质】
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚。
醚的结构可用R—O—R'来表示,R和R'都是烃基,可以相同,也可以不同。
饱和一元醚的通式:CnH2n+2O (n≥2)
二、醇的化学性质——以乙醇为例
3.消去反应
【实验3-2】
如图所示,在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3)的混合液20 mL;
放入几片碎瓷片,以防止混合液在受热时暴沸;
加热混合液,使液体温度迅速升到170℃;
将生成的气体先通入氢氧化钠溶液除去杂质,再通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察实验现象。
二、醇的化学性质——以乙醇为例
3.消去反应
乙醇在浓硫酸作用下,加热到170 ℃,发生了消去反应,生成乙烯。
H—C—C—O—H
H H
H H
二、醇的化学性质——以乙醇为例
3.消去反应
浓硫酸的作用——
温度计的位置——
混合液变黑的原因——
使液体温度迅速升到170℃的原因——
氢氧化钠溶液的作用——
【实验注意事项】
催化剂和脱水剂
反应液中
浓硫酸将无水乙醇氧化生成碳的单质
除去乙烯中混有的CO2、SO2,以及挥发出来的乙醇等气体
C+2H2SO4(浓)===CO2↑+2SO2↑+2H2O
无水乙醇和浓硫酸混合物在140℃时脱水生成乙醚
二、醇的化学性质——以乙醇为例
3.消去反应
【思考与讨论】溴乙烷与乙醇都能发生消去反应,二者的反应有什么异同?
名称 CH3CH2OH CH3CH2Br
反应条件 浓硫酸,170℃ NaOH的乙醇溶液,加热
化学键的断裂 C—O和相邻碳的C—H C—Br和相邻碳的C—H
生成物 CH2=CH2、H2O CH2=CH2、NaBr、H2O
二、醇的化学性质——以乙醇为例
4.氧化反应
(1) 燃烧
(2) 催化氧化
2Cu+O2 ==== 2CuO
△
红色Cu丝变为黑色
现象:淡蓝色火焰
CH3CH2OH+3O2 2CO2+3H2O
点燃
Cu丝黑色又变为红色,
液体有刺激性气味
CH3CH2OH+CuO CH3CHO+Cu+H2O
△
总反应: 2CH3CH2OH+O2 2CH3CHO+2H2O
Cu
△
H—C—C—O—H
H H
H H
二、醇的化学性质——以乙醇为例
4.氧化反应
(3)强氧化剂氧化
二、醇的化学性质——以乙醇为例
4.氧化反应
(3)强氧化剂氧化
酸性重铬酸钾(K2Cr2O7)
Cr3+
(橙红色) (暗绿色)
MnO4– Mn2+
酸性高锰酸钾(K2Cr2O7)
(紫红色) (无色)
资料卡片: 教材61页
“为什么有些人喝酒后会脸红”
二、醇的化学性质——以乙醇为例
【归纳小结】
乙醇的化学反应与断键位置
H—C—C—O—H
H H
H H
反应类型 反应物 反应条件 断键位置
置换反应 乙醇、活泼金属 — ①
取代反应 卤代 乙醇、浓HX △ ②
分子间脱水 乙醇 浓硫酸,140 ℃ ①②
酯化 乙醇、羧酸 浓硫酸,△ ①
消去反应 乙醇 浓硫酸,170 ℃ ②⑤
氧化反应 催化氧化 乙醇、O2 Cu或Ag,△ ①③
燃烧 乙醇、O2 点燃 全部
一、醇的概述
3.醇的物理性质
(1)几种重要的醇
名称 颜色、状态、气味 溶解性 用途
甲醇 无色、透明,具有挥发性的液体(沸点65℃)。 易溶于水 化工原料,车用燃料。
乙醇 无色、透明,具有挥发性的液体,具有特殊香味。 易溶于水,能与水互溶。 医用,饮料,燃料,
溶剂,化工原料。
乙二醇 无色、黏稠的液体,有甜味。 易溶于水和乙醇,能与水互溶。 化工原料,汽车防冻液。
丙三醇 无色、黏稠的液体,有甜味。 易溶于水和乙醇,能与水互溶,能吸潮。 化工原料,配制化妆品。
甲醇有毒,误服会损伤视神经,甚至致人死亡。
P57.58
三、醇的物理性质
醇的物理性质
(2)醇的沸点规律
表3-2 几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
【思考】对比表格中的数据,你能得出什么结论?为什么?
三、醇的物理性质
4.醇的物理性质
(2)醇的沸点规律
【思考】对比分析表格中的数据,你能得出什么结论?为什么?
表3-3 相对分子质量相近的醇与烷烃的沸点比较
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
三、醇的物理性质
4.醇的物理性质
(2)醇的沸点规律
①饱和一元醇,碳原子数越多,醇的沸点越高。
②相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点。
③碳原子数相同时,羟基个数越多,醇的沸点越高。
①甲醇、乙醇和丙醇均可与水互溶,因为醇分子与水分子间形成了氢键。
②醇在水中的溶解度一般随碳原子数的增加而减小。
③碳原子数相同时,羟基个数越多,醇的水溶性越好。
(3)醇的溶解性规律
醇的消去反应的规律
醇发生消去反应(分子内脱水)的断键位置:
—C—C—
H OH
浓H2SO4
+H2O
—C==C—
α
β
1. 醇发生消去反应的必备条件:有β–C,且β–C原子上必须连有氢原子。
否则不能发生消去反应。
如:CH3OH、(CH3)3CCH2OH、 不能发生消去反应生成烯烃。
2. 若醇分子中α–C原子连接两个或三个β–C,且β–C原子上均有氢原子时,发生
消去反应可能生成不同的产物。例如:
发生消去反应产物为CH3CH=CHCH3和CH3CH2CH=CH2
CH3—CH2—CH—CH3
OH
醇的催化氧化反应的规律
醇发生催化氧化的断键位置:
—C—C—H
O—H
+ Cu+H2O
α
+ Cu O
—C—C
O
1. 醇发生催化氧化的必备条件:α–C原子上必须连有氢原子。
2. 醇发生催化氧化的产物的类别,取决于α–C原子上的氢原子的个数 。
烃的衍生物
第三章
第二节 醇 酚
1.醇的结构特点
(1)定义:羟基与饱和碳原子相连的化合物称为醇。
(2)官能团:羟基(—OH)
(3)结构: (R1、R2、R3为H或烃基)
(4)饱和一元醇通式:
一、醇的概述
CnH2n+1OH 或 CnH2n+2O (n≥1),可简写为R—OH。
一、醇的概述
2.醇的分类
按羟基所连
烃基种类
饱和醇
不饱和醇
脂环醇
芳香醇
CH3CH2OH 乙醇
CH2=CHCH2OH 丙烯醇
苯甲醇
环己醇
乙二醇
分子中所含羟基的数目
一元醇
二元醇
多元醇
CH3OH
CH2–OH
CH2–OH
CH2–OH
CH–OH
CH2–OH
甲醇
丙三醇
醇的
分类
二、醇的化学性质——以乙醇为例
乙醇的结构
分子式
结构式
结构简式
CH3CH2OH
或C2H5OH
H—C—C—O—H
H H
H H
醇的化学性质主要由羟基官能团所决定。在醇分子中,由于氧原子吸引电子的能力比氢原子和碳原子的强,使O—H和C—O的电子都向氧原子偏移。因此,醇在发生反应时,O—H容易断裂,使羟基中的氢原子被取代;同样C—O也易断裂,使羟基被取代或脱去,从而发生取代反应或消去反应。
C2H6O
一、醇的置换反应
二、醇的取代反应
三、醇的催化氧化
乙醇的化学性质
二、醇的化学性质——以乙醇为例
2.取代反应
(1)乙醇与氢卤酸的取代反应
CH3CH2–OH+H–Br CH3CH2Br+H2O
乙醇与浓氢溴酸混合加热:
H—C—C—O—H
H H
H H
二、醇的化学性质——以乙醇为例
2.取代反应
(2)醇分子间脱水成醚的取代反应
H—C—C—O—H
H H
H H
CH3CH2–OH+H–OCH2CH3 CH3CH2–O–CH2CH3+H2O
浓H2SO4
140℃
乙醚
二、醇的化学性质——以乙醇为例
2.取代反应
(2)醇分子间脱水成醚的取代反应
乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,有麻醉作用。乙醚微溶于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机物。
CH3CH2–OH+H–OCH2CH3 CH3CH2–O–CH2CH3+H2O
浓H2SO4
140℃
乙醚
【醚类物质】
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚。
醚的结构可用R—O—R'来表示,R和R'都是烃基,可以相同,也可以不同。
饱和一元醚的通式:CnH2n+2O (n≥2)
二、醇的化学性质——以乙醇为例
3.消去反应
【实验3-2】
如图所示,在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3)的混合液20 mL;
放入几片碎瓷片,以防止混合液在受热时暴沸;
加热混合液,使液体温度迅速升到170℃;
将生成的气体先通入氢氧化钠溶液除去杂质,再通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察实验现象。
二、醇的化学性质——以乙醇为例
3.消去反应
乙醇在浓硫酸作用下,加热到170 ℃,发生了消去反应,生成乙烯。
H—C—C—O—H
H H
H H
二、醇的化学性质——以乙醇为例
3.消去反应
浓硫酸的作用——
温度计的位置——
混合液变黑的原因——
使液体温度迅速升到170℃的原因——
氢氧化钠溶液的作用——
【实验注意事项】
催化剂和脱水剂
反应液中
浓硫酸将无水乙醇氧化生成碳的单质
除去乙烯中混有的CO2、SO2,以及挥发出来的乙醇等气体
C+2H2SO4(浓)===CO2↑+2SO2↑+2H2O
无水乙醇和浓硫酸混合物在140℃时脱水生成乙醚
二、醇的化学性质——以乙醇为例
3.消去反应
【思考与讨论】溴乙烷与乙醇都能发生消去反应,二者的反应有什么异同?
名称 CH3CH2OH CH3CH2Br
反应条件 浓硫酸,170℃ NaOH的乙醇溶液,加热
化学键的断裂 C—O和相邻碳的C—H C—Br和相邻碳的C—H
生成物 CH2=CH2、H2O CH2=CH2、NaBr、H2O
二、醇的化学性质——以乙醇为例
4.氧化反应
(1) 燃烧
(2) 催化氧化
2Cu+O2 ==== 2CuO
△
红色Cu丝变为黑色
现象:淡蓝色火焰
CH3CH2OH+3O2 2CO2+3H2O
点燃
Cu丝黑色又变为红色,
液体有刺激性气味
CH3CH2OH+CuO CH3CHO+Cu+H2O
△
总反应: 2CH3CH2OH+O2 2CH3CHO+2H2O
Cu
△
H—C—C—O—H
H H
H H
二、醇的化学性质——以乙醇为例
4.氧化反应
(3)强氧化剂氧化
二、醇的化学性质——以乙醇为例
4.氧化反应
(3)强氧化剂氧化
酸性重铬酸钾(K2Cr2O7)
Cr3+
(橙红色) (暗绿色)
MnO4– Mn2+
酸性高锰酸钾(K2Cr2O7)
(紫红色) (无色)
资料卡片: 教材61页
“为什么有些人喝酒后会脸红”
二、醇的化学性质——以乙醇为例
【归纳小结】
乙醇的化学反应与断键位置
H—C—C—O—H
H H
H H
反应类型 反应物 反应条件 断键位置
置换反应 乙醇、活泼金属 — ①
取代反应 卤代 乙醇、浓HX △ ②
分子间脱水 乙醇 浓硫酸,140 ℃ ①②
酯化 乙醇、羧酸 浓硫酸,△ ①
消去反应 乙醇 浓硫酸,170 ℃ ②⑤
氧化反应 催化氧化 乙醇、O2 Cu或Ag,△ ①③
燃烧 乙醇、O2 点燃 全部
一、醇的概述
3.醇的物理性质
(1)几种重要的醇
名称 颜色、状态、气味 溶解性 用途
甲醇 无色、透明,具有挥发性的液体(沸点65℃)。 易溶于水 化工原料,车用燃料。
乙醇 无色、透明,具有挥发性的液体,具有特殊香味。 易溶于水,能与水互溶。 医用,饮料,燃料,
溶剂,化工原料。
乙二醇 无色、黏稠的液体,有甜味。 易溶于水和乙醇,能与水互溶。 化工原料,汽车防冻液。
丙三醇 无色、黏稠的液体,有甜味。 易溶于水和乙醇,能与水互溶,能吸潮。 化工原料,配制化妆品。
甲醇有毒,误服会损伤视神经,甚至致人死亡。
P57.58
三、醇的物理性质
醇的物理性质
(2)醇的沸点规律
表3-2 几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
【思考】对比表格中的数据,你能得出什么结论?为什么?
三、醇的物理性质
4.醇的物理性质
(2)醇的沸点规律
【思考】对比分析表格中的数据,你能得出什么结论?为什么?
表3-3 相对分子质量相近的醇与烷烃的沸点比较
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
三、醇的物理性质
4.醇的物理性质
(2)醇的沸点规律
①饱和一元醇,碳原子数越多,醇的沸点越高。
②相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点。
③碳原子数相同时,羟基个数越多,醇的沸点越高。
①甲醇、乙醇和丙醇均可与水互溶,因为醇分子与水分子间形成了氢键。
②醇在水中的溶解度一般随碳原子数的增加而减小。
③碳原子数相同时,羟基个数越多,醇的水溶性越好。
(3)醇的溶解性规律
醇的消去反应的规律
醇发生消去反应(分子内脱水)的断键位置:
—C—C—
H OH
浓H2SO4
+H2O
—C==C—
α
β
1. 醇发生消去反应的必备条件:有β–C,且β–C原子上必须连有氢原子。
否则不能发生消去反应。
如:CH3OH、(CH3)3CCH2OH、 不能发生消去反应生成烯烃。
2. 若醇分子中α–C原子连接两个或三个β–C,且β–C原子上均有氢原子时,发生
消去反应可能生成不同的产物。例如:
发生消去反应产物为CH3CH=CHCH3和CH3CH2CH=CH2
CH3—CH2—CH—CH3
OH
醇的催化氧化反应的规律
醇发生催化氧化的断键位置:
—C—C—H
O—H
+ Cu+H2O
α
+ Cu O
—C—C
O
1. 醇发生催化氧化的必备条件:α–C原子上必须连有氢原子。
2. 醇发生催化氧化的产物的类别,取决于α–C原子上的氢原子的个数 。
