专题1 有机化学的发展及研究思路 单元测试卷(含解析) 2022-2023学年高二下学期化学苏教版(2019)选择性必修3
文档属性
| 名称 | 专题1 有机化学的发展及研究思路 单元测试卷(含解析) 2022-2023学年高二下学期化学苏教版(2019)选择性必修3 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-30 15:57:41 | ||
图片预览



文档简介
专题1《有机化学的发展及研究思路》单元测试卷
一、单选题
1.某混合气体由两种气态烃组成。2.24L该混合气体完全燃烧后,得到4.48L二氧化碳(气体已折算成标准状况)和3.6g水。则这两种气体可能是
A.CH4和C3H8 B.CH4和C3H4 C.C2H4和C3H4 D.C2H4和C2H6
2.有机物X和Y在一定条件下可制得环氧树脂粘合剂Z,其结构:X为,Y为,Z为,下列说法正确的是
A.X核磁共振氢谱有3个吸收峰
B.X、Y反应生成Z的过程既有取代反应,也有聚合反应
C.相同条件下,苯酚和Y反应生成结构与Z相似的高分子
D.生成的同时生成
3.科学技术在物质结构的研究中具有非常重要的作用。下列说法错误的是
A.质谱仪可以测定分子的相对分子质量
B.用李比希元素分析仪可以确定有机物的分子式
C.可通过红外光谱分析物质中含有何种化学键
D.X射线衍射技术可用于有机化合物(特别是复杂的生物大分子)晶体结构的测定
4.除去下列物质中含有的少量杂质(括号内为杂质),所用除杂试剂合理的是
A.溶液 B.催化剂
C.溶液():铁粉 D.:饱和溶液
5.溴化苄是重要的有机合成工业原料,可由苯甲醇为原料合成,实验原理及装置如图所示:
下列有关说法不正确的是
A.先加热至反应温度,然后从冷凝管接口b处通水
B.该实验适宜用热水浴加热
C.浓硫酸作催化剂和吸水剂
D.反应液可按下列步骤分离和纯化:静置→分液→水洗→纯碱洗→水洗→干燥→减压蒸馏
6.下列有机物分子中,在氢核磁共振谱中信号强度(个数比)是1:3的是
A.邻二甲苯 B.均三甲苯 C.异丙醇 D.丙酸乙酯
7.由E(金属铁)制备的E(C5H5)2的结构如图甲所示,其中氢原子的类型完全相同。但早期人们却错误地认为它的结构如图乙所示。核磁共振氢谱能够区分这两种结构。甲和乙的核磁共振氢谱中,分别有几种吸收峰
A.1种 1种 B.1种 2种
C.1种 3种 D.2种 3种
8.某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,至少需要的条件是
①X中所含碳元素的质量分数②X中所含氢元素的质量分数③X在标准状况下的体积④X的相对分子质量⑤X的质量
A.①②③ B.①②④ C.①②⑤ D.③④⑤
9.2013年诺贝尔化学奖授予美国科学家马丁·卡普拉斯、迈克尔·莱维特、阿里耶·瓦谢勒,以表彰他们“在开发多尺度复杂化学系统模型方面所做的贡献”。这种用电脑取代木棒作试验模型,催生了现代化学研究手段的一次新飞跃。下列不属于现代化学对物质结构进行研究的手段的是
A.天平 B.红外光谱 C.质谱 D.核磁共振
10.a mL三种气态烃与足量的氧气形成的混合物点燃爆炸后,恢复到原来的状态(150℃、1.01×105 Pa)气体体积仍为a mL,则三种烃可能是:
A.CH4、C2H4、C3H4 B.C2H6、C3H6、C4H6
C.CH4、C2H6、C3H6 D.C3H8、C2H4、C2H6
11.苯乙烯与溴苯在一定条件下发生Heck反应:
溴苯用量(mmol) 100 100 100 100 100 100 100
催化剂用量(mmol) 2 2 2 2 2 2 2
反应温度(℃) 100 100 100 100 120 140 160
反应时间(h) 10 12 14 16 14 14 14
产率(%) 81.2 84.4 86.6 86.2 93.5 96.6 89.0
根据上表数据及产品的结构性质,下列说法正确的是A.最佳反应条件为14h、100 ℃ B.温度升高,反应速率先升高后降低
C.合成的产品可能存在两种结构 D.合成的产品易溶于有机物与水
12.现有由过氧乙酸(CH3COOOH)、环己烷、戊烯组成的混合物,其中氧的质量分数为16%,则氢的质量分数是
A.6% B.12% C.18% D.24%
13.化学与生产、科技、生活密切相关,下列说法不正确的是
A.空间站的“太阳翼”及光伏发电系统能将太阳能转化为电能
B.红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物组成与结构的分析
C.我国科学家突破的人工合成淀粉技术有利于我国实现碳中和
D.纯碱可作化工原料,也是治疗胃酸过多的一种药剂
14.下列说法正确的是
A.苯甲酸重结晶实验中粗苯甲酸溶解后还要加点水,目的是减少过滤时苯甲酸的损失
B.的核磁共振氢谱中有4种峰
C.石油是混合物,其分馏产品汽油为纯净物
D.苯中滴加浓溴水,充分振荡后溴水层褪色,是因为苯与溴水中的溴发生了加成反应
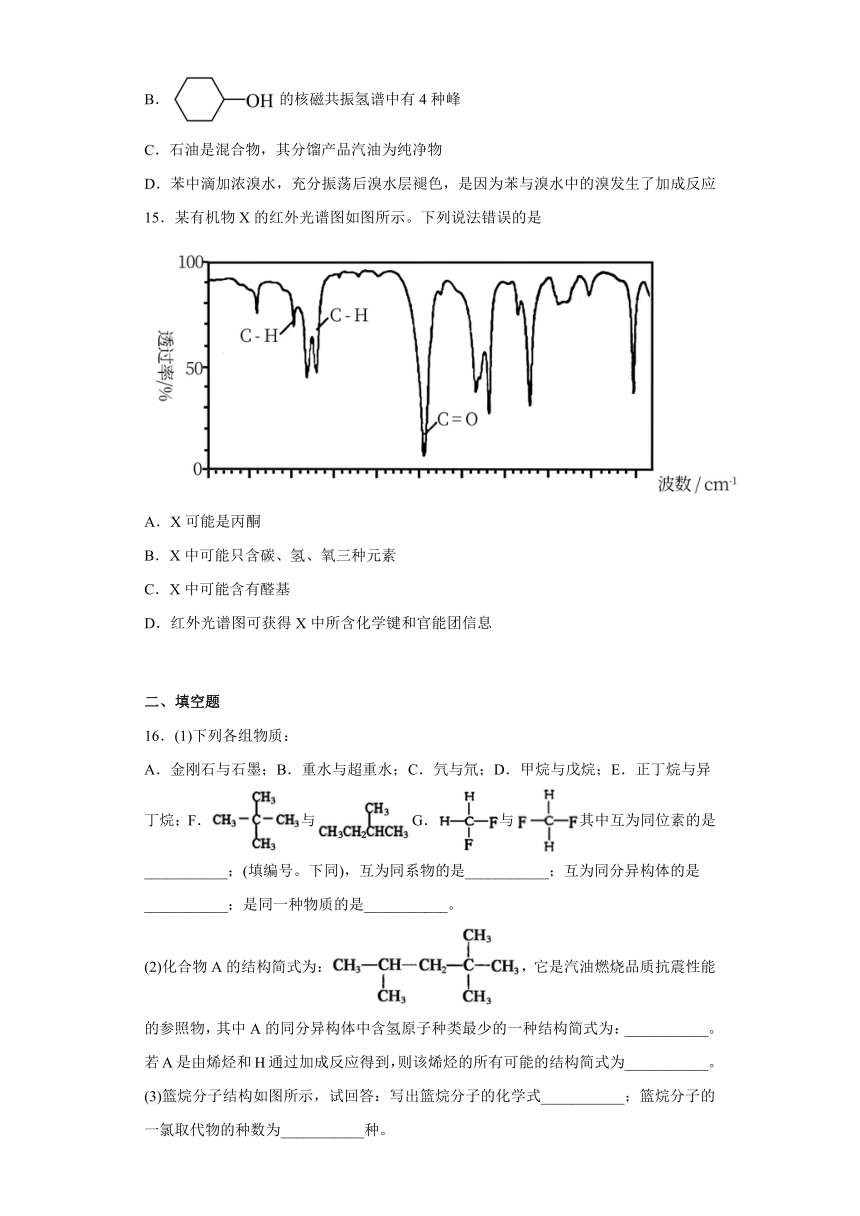
15.某有机物X的红外光谱图如图所示。下列说法错误的是
A.X可能是丙酮
B.X中可能只含碳、氢、氧三种元素
C.X中可能含有醛基
D.红外光谱图可获得X中所含化学键和官能团信息
二、填空题
16.(1)下列各组物质:
A.金刚石与石墨;B.重水与超重水;C.氕与氘;D.甲烷与戊烷;E.正丁烷与异丁烷;F.与G.与其中互为同位素的是___________;(填编号。下同),互为同系物的是___________;互为同分异构体的是___________;是同一种物质的是___________。
(2)化合物A的结构简式为:,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含氢原子种类最少的一种结构简式为:___________。若A是由烯烃和H通过加成反应得到,则该烯烃的所有可能的结构简式为___________。
(3)篮烷分子结构如图所示,试回答:写出篮烷分子的化学式___________;篮烷分子的一氯取代物的种数为___________种。
17.青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用有机溶剂A从中药中提取。
(1)下列关于青蒿素的说法不正确的是___________(填字母)。
a.分子式为C14H20O5 b.分子中含有酯基和醚键
c.易溶于有机溶剂A,不易溶于水 d.分子的空间结构不是平面形
(2)使用现代分析仪器对有机化合物A的分子结构进行测定,相关结果如下:
①根据图1,A的相对分子质量为___________。
②根据图2,推测A可能所属的有机化合物类别和其分子式___________、___________。
③根据以上结果和图3(两个峰的面积比为2∶3),推测A的结构简式___________。
18.某烃A,相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定条件下氧化只生成G,G能使石蕊试液变红。
已知:试写出:
(1)A的分子式:___________________。
(2)化合物A和G的结构简式:A_________________,G___________________
(3)与G同类的同分异构体(含G)可能有_______________种。
三、计算题
19.含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,其蒸气相对于氢气的密度为58,它能与小苏打反应放出CO2,也能使溴水褪色,0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应。试回答:
(1)该有机物中各原子个数比N(C)∶N(H)∶N(O)= ______________
(2)该有机物的摩尔质量为__________,写出分子式_____________
(3)该有机物的可能结构简式有___________________
20.某烃2.8g,在氧气中燃烧生成4.48L(标准状况)二氧化碳,3.6g水,它相对氢气的密度是14,求此烃的化学式_______,写出它的结构简式_______。
四、实验题
21.有机物M(只含C、H、O三种元素中的两种或三种)具有令人愉悦的牛奶香气,主要用于配制奶油、乳品、酸奶和草莓等型香精,是我国批准使用的香料产品,其沸点为148℃。某化学兴趣小组从粗品中分离提纯有机物M,然后借助李比希法、现代科学仪器测定有机物M的分子组成和结构,具体实验过程如下:
步骤一:将粗品用蒸馏法进行纯化。
(1)如图1所示,仪器a的名称是_______,图中虚线框内应选用右侧的_______(填“仪器x”或“仪器y”)。
步骤二:确定M的实验式和分子式。
(2)利用元素分析仪测得有机物M中碳的质量分数为54.5%,氢的质量分数为9.1%。
①M的实验式为_______。
②已知M的密度是同温同压下CO2密度的2倍,则M的分子式为_______。
步骤三:确定M的结构简式。
(3)用核磁共振仪测出M的核磁共振氢谱如图2所示,图中峰面积之比为1∶3∶1∶3;利用红外光谱仪测得M的红外光谱如图3所示。
①M中官能团的名称为_______,M的结构简式为_______(填键线式)。
②写出两种含有酯基的M的同分异构体的结构简式:_______。
22.电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。
(1)C装置中浓H2SO4的作用是_______;
(2)D装置发生的化学反应方程式_______;
(3)燃烧管中CuO的作用是_______;
(4)若准确称取12g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加26.4g。B管质量增加14.4g,能否_______(答“是或否”)确定该有机物的分子式。若能确定,分子式为_______,若不能确定,还要知道_______。
参考答案:
1.B
【详解】2.24L该混合气体即0.1mol完全燃烧后,得到4.48L二氧化碳(气体已折算成标准状况)和3.6g水。即二氧化碳的物质的量为0.2mol,水的物资的量为0.2mol,则平均分子式为C2H4。
A.CH4和C3H8的平均分子式中氢原子个数不可能是4,A错误;
B.CH4和C3H4若按1:1混合,平均分子式为C2H4,B正确;
C.C2H4和C3H4混合气体平均分子式中碳原子个数不可能为2,C错误;
D.C2H4和C2H6混合气体平均分子式中氢原子个数不可能是4,D错误;
故选B。
2.B
【详解】A.X中含有4种氢原子,其核磁共振氢谱有4组峰,故A错误;
B.X和Y发生反应生成Z时,氯原子被取代、同时还发生缩聚反应生成高分子化合物,所以该反应过程中有取代反应和聚合反应,故B正确;
C.苯酚分子中只有-个酚羟基,所以和Y只能发生取代反应或环加成反应,所以不能生成与Z相似的高分子,故C错误;
D.根据图知,生成1mol Z同时生成(n + 2)molHCl,故D错误;
故选B。
3.B
【详解】A.质谱法是近代发展起来的快速、微量、精确测定相对分子质量的方法,故A正确;
B.李比希分析仪可以测定有机化合物中碳、氢元素质量分数的方法,故B错误;
C.不同的化学键或官能团吸收频率不同,在红外光谱图上将处于不同位置,从而可以获得分子中含有何种化学键或官能团,故C正确;
D.X射线衍射技术可用于有机化合物,特别是复杂的生物大分子晶体结构的测定,故D正确;
故选B。
4.A
【详解】A.硫化氢和硫酸铜反应生成硫化铜沉淀,乙炔不反应,故能除杂,A正确;
B.乙烯能和氢气反应,但不能完全反应,B错误;
C.铁和氯化铁反应生成氯化亚铁,C错误;
D.二氧化硫和二氧化碳都能和碳酸钠反应,D错误;
故选A。
5.A
【详解】A.为防止原料加热蒸发损失,应先从冷凝管接口b处通水,再先加热至反应温度,故A错误;
B.该实验要求温度较准确,适宜用热水浴加热,以便控制温度,故B正确;
C.从反应方程式看,浓硫酸做催化剂,产物中有水,通过浓硫酸吸水,促进反应更完全,故C正确;
D.反应液经水洗可溶解反应物中的醇类,碱洗可除去氢溴酸,再水洗除去碱和盐类,可按下列步骤分离和纯化:静置→分液→水洗→纯碱洗→水洗→干燥→减压蒸馏,故D正确;
故选:A。
6.B
【详解】A.邻二甲苯的结构简式为:,该分子的核磁共振氢谱有3种峰,其峰面积之比是3:1:1,故A不符合题意;
B.均三甲苯的结构简式为:,该分子的核磁共振氢谱有2种峰,其峰面积之比是1:3,故B符合题意;
C.异丙醇的结构简式为:CH3CH(OH)CH3,该分子中的核磁共振氢谱有3种峰,其峰面积之比是6:1:1,故C不符合题意;
D.丙酸乙酯的结构简式为:CH3CH2COOCH2CH3,该分子的核磁共振氢谱有4种峰,其峰面积之比是3:3:2:2,故D不符合题意;
答案选B。
7.C
【详解】图甲E(C5H5)2的结构中氢原子的类型完全相同、则只有1种氢原子,图乙E的结构为轴对称、则有3种氢原子,C符合;
答案选C。
8.B
【详解】由气态有机物中含碳元素和氢元素的质量分数可推出氧元素的质量分数,由各元素的质量分数可确定X的实验式,由相对分子质量和实验式可确定X的分子式,则欲确定X的分子式至少需要的条件是①②④,故选B。
9.A
【详解】现代化学测定物质结构的方法有:核磁共振、红外光谱、质谱法、X-射线等,天平称量不属于现代化学研究重要手段,故选:A。
10.A
【详解】150℃下水为气体,设混合烃的平均组成为CxHy,CxHy+(x+)O2xCO2+H2O,燃烧前后气体的体积不变,则有1+ x+=x+,解得:y=4;即混合气体分子中平均含有4个H原子,故选:A。
11.C
【详解】A.最佳反应条件为14h、140 ℃,A错误;
B.温度升高,反应速率升高,B错误;
C.产品存在顺反异构,C正确;
D.合成的产品易溶于有机物,难溶于水,D错误;
故选C。
12.B
【详解】混合物中只有过氧乙酸中含有氧,氧的质量分数为16%,则碳、氢的总质量分数为84%,混合物中各物质的碳、氢原子个数比均为1:2,即混合物中碳、氢的质量比始终是6:1,因此氢的质量分数为84%×= 12%,B项符合题意。
13.D
【详解】A.“太阳翼”及光伏发电系统利用硅与某些金属的光电效应将太阳能转化为电能,A项正确;
B.红外光谱仪用于测定有机物的官能团;核磁共振仪用于测定有机物分子中氢原子的种类和数目;质谱法用于测定有机物的相对分子质量;以上都可用于有机化合物组成与结构的分析,B项正确;
C.人工合成淀粉技术有利于节能减排,即实现碳中和,C项正确;
D.治疗胃酸过多的常用药剂是小苏打NaHCO3或Al(OH)3,纯碱碱性太强,不能用于治疗胃酸过多,D项错误;
答案选D。
14.A
【详解】A.水在加热过程中会蒸发,苯甲酸能溶于水,则粗苯甲酸溶解后还要加点水的目的是使其溶解,减少过滤时苯甲酸的损失,A正确;
B. 的核磁共振氢谱中有5种峰,B错误;
C.石油是混合物,其分馏产品汽油是一定温度范围内的馏分,属于多种烃的混合物,C错误;
D.溴易溶于苯中,为萃取现象,没有发生化学反应,D错误;
故答案为:A。
15.A
【详解】A.由红外光谱图可知X中含两种C-H键,而丙酮只含有一种C-H键,故A错误;
B.由红外光谱图可知X中含C-H键和C=O键,故X中可能只含碳、氢、氧三种元素,故B正确;
C.由红外光谱图可知X中含C-H键和C=O键,X中可能含有醛基,故C正确;
D.由红外光谱图可知X中含C-H键和C=O键,故D正确;
故选A。
16. C D E、F B、G 和 C10H12 4
【详解】(1)A.金刚石与石墨都是碳元素的单质,二者互为同素异形体;
B.重水与超重水都是水,二者属于同一种物质;
C.氕与氘是质子数相同,中子数不同,属于同位素;
D.甲烷与戊烷结构相似,分子组成上相差4个CH2原子团,属于同系物;
E.正丁烷与异丁烷分子式相同,结构不同,属于同分异构体;
F.与分子式相同,结构不同,属于同分异构体;
G.与属于同种物质;
故互为同位素的是C;互为同系物的是D;互为同分异构体的是E、F;是同一种物质的是B、G;
(2)A的同分异构体中含氢原子种类最少的一种结构简式为;A是由烯烃和H通过加成反应得到,则该烯烃的所有可能的结构简式为、;
(3)根据篮烷分子结构可知,篮烷分子的化学式为C10H12;篮烷分子中含有4种不同环境的H原子,如图,则其一氯代物有4种。
17.(1)a
(2) 74 醚 C4H10O CH3CH2OCH2CH3
【解析】(1)
a.根据物质结构简式可知青蒿素分子中含有15个C原子,22个H原子,5个O原子,所以其分子式是C15H22O5,a错误;
b.根据物质结构简式可知青蒿素分子中含有的官能团是酯基和醚键,b正确;
c.青蒿素分子中含有的官能团是酯基和醚键,不含有亲水基羟基和羧基,因此青蒿素易溶于有机溶剂A,不易溶于水,c正确;
d.青蒿素分子中含有饱和C原子,具有甲烷的四面体结构,因此青蒿素分子的空间结构不是平面形,d正确;
故合理选项是a;
(2)
①物质的最大质合比就是物质的相对分子质量,根据图1,A的相对分子质量为74;
②根据图可知:A中含有烃基、醚键, 所以属于醚,A中碳原子个数=,则分子式为C4H10O;
③A的分子式为C4H10O,吸收峰有2个,说明含有两种氢原子,吸收峰面积之比为2:3,则氢原子个数之比为2:3,则A结构对称,含有两个甲基和两个亚甲基,故A的结构简式为CH3CH2OCH2CH3。
18. C10H20 4
【分析】根据烃的相对分子质量和碳元素的含量分析其分子式,在根据结构要求书写其结构。
【详解】(1) 烃A中N(C)=140×0.857/12=10,N(H)=140×0.143/1=20,故A的分子式为C10H20
(2) A分子中有两个碳原子不与氢原子直接相连,说明有两个的结构,A在一定条件下氧化只生成G,G能使石蕊试液变红,则G含有羧基,说明A分子中有—CH=CH—,且为对称结构,则A的结构简式为,则G为
(3)的同分异构体中属于羧酸类,即为C4H9COOH,C4H9—有4种结构:C—C—C—C—、、、,则与G同类的同分异构体(含G)可能有4种。
考点:有机推断
19. 1:1:1 116g/mol C4H4O4 HOOC-CH=CH-COOH 、CH2=C(COOH)2
【分析】(1)含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,则该有机物中各原子个数比N(C)∶N(H)∶N(O)=;
(2)有机物的最简式为CHO,该有机物的摩尔质量为58×2g/mol,设分子式(CHO)n,则29n=58×2,n=4,分子式为C4H4O4;
(3)它能与小苏打反应放出CO2,说明分子中含有-COOH;也能使溴水褪色,说明分子内含有碳碳不饱和键;0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应,则1mol该有机物含有2mol-COOH;与同数碳原子的烷烃相比,分子中除含2个羧基外,还应含有一个碳碳双键。由此可确定该有机物的可能结构简式。
【详解】(1)含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,则该有机物中各原子个数比N(C)∶N(H)∶N(O)==1:1:1;答案为:1:1:1;
(2)有机物的最简式为CHO,该有机物的摩尔质量为58×2g/mol,设分子式为(CHO)n,则29n=58×2,n=4,分子式为C4H4O4;答案为:116g/mol;C4H4O4;
(3)它能与小苏打反应放出CO2,说明分子中含有-COOH;也能使溴水褪色,说明分子内含有碳碳不饱和键;0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应,则1mol该有机物含有2mol-COOH;与同数碳原子的烷烃相比,分子中除含2个羧基外,还应含有一个碳碳双键,由此可确定该有机物的可能结构简式中,两个羧基可能连在两个不同的双键碳原子上,也可能连在同一个双键碳原子上。答案为:HOOC-CH=CH-COOH 、CH2=C(COOH)2。
20. C2H4 CH2=CH2
【详解】该烃的相对分子质量是氢气的14倍,则经的相对分子质量是14×2=28。燃烧生成的二氧化碳和水的物质的量分别是、,即碳氢原子的个数之比是1:2,所以该烃的分子式为C2H4,结构简式为H2C=CH2。
21.(1) 蒸馏烧瓶 仪器y
(2)
(3) 羟基、羰基 、、、
【分析】本题是一道测定某有机物的结构式的实验题,首先对样品进行纯化,随后根据M中碳元素和氢元素的质量分数计算其实验式,再根据核磁共振氢谱已经红外光谱 分析其结构中含有的官能团,进而分析其结构式,以此解题。
(1)
仪器a的名称为蒸馏烧瓶;蒸馏时使用仪器y(直形冷凝管),仪器x(球形冷凝管)一般用于冷凝回流装置中,故答案为:蒸馏烧瓶;仪器y;
(2)
①计算该有机物中氧元素的质量分数:,分子内各元素原子的个数比:,即实验式为:,故答案为:;
②M的密度是同温同压下二氧化碳密度的2倍,则M的相对分子质量为,设分子式为,则,n=2,则分子式为,
(3)
①根据核磁共振氢谱图中有4组峰,且峰面积之比为1∶3∶1∶3,说明分子中含有4种不同化学环境的氢原子,且个数比为1∶3∶1∶3,结合红外光谱图所示含有C-H、H-O、C=O等化学键,其结构简式为,所含官能团为羟基、羰基,其键线式写作,故答案为:羟基、羰基;;
②酯基结构为,含有酯基的M的同分异构体的结构简式为、、、,故答案为:、、、。
22.(1)吸收水分,保证氧气干燥纯净
(2)2H2O22H2O+O2↑
(3)使有机物充分氧化生成CO2
(4) 是 C3H8O 有机物的相对分子质量
【分析】由实验装置图可知,装置D中过氧化氢在二氧化锰做催化剂条件下发生分解反应制备氧气,装置C中盛有的浓硫酸用于干燥氧气,装置E用于氧气氧化管内样品,其中氧化铜的作用是将有机物未完全燃烧生成的一氧化碳氧化为二氧化碳,装置B中氯化钙用于吸收、测定反应生成的水蒸气,装置A用于吸收、测定反应生成的二氧化碳,则实验装置的连接顺序为DCEBA。
(1)
由分析可知,装置C中盛有的浓硫酸用于干燥氧气,保证氧气干燥纯净,故答案为:吸收水分,保证氧气干燥纯净;
(2)
由分析可知,装置D中过氧化氢在二氧化锰做催化剂条件下发生分解反应生成氧气和水,反应的化学方程式为2H2O22H2O+O2↑,故答案为:2H2O22H2O+O2↑;
(3)
由分析可知,氧化铜的作用是将有机物未完全燃烧生成的一氧化碳氧化为二氧化碳,故答案为:使有机物充分氧化生成CO2;
(4)
由B管质量增加14.4g可知,有机物分子中氢原子的物质的量为×2=1.6mol,由A管质量增加26.4g可知,有机物分子中碳原子的物质的量为=0.6mol,由有机物的质量为12g可知,有机物分子中氧原子的物质的量为=0.1mol,则有机物分子中碳氢氧的原子个数比为0.3mol:0.8mol:0.1mol=3:8:1,实验式为C3H8O,若要确定有机物的分子式,应知道有机物的相对分子质量,由于分子中碳原子结合氢原子个数已达到饱和,所以有机物的分子式为C3H8O,故答案为:是;C3H8O;有机物的相对分子质量。
一、单选题
1.某混合气体由两种气态烃组成。2.24L该混合气体完全燃烧后,得到4.48L二氧化碳(气体已折算成标准状况)和3.6g水。则这两种气体可能是
A.CH4和C3H8 B.CH4和C3H4 C.C2H4和C3H4 D.C2H4和C2H6
2.有机物X和Y在一定条件下可制得环氧树脂粘合剂Z,其结构:X为,Y为,Z为,下列说法正确的是
A.X核磁共振氢谱有3个吸收峰
B.X、Y反应生成Z的过程既有取代反应,也有聚合反应
C.相同条件下,苯酚和Y反应生成结构与Z相似的高分子
D.生成的同时生成
3.科学技术在物质结构的研究中具有非常重要的作用。下列说法错误的是
A.质谱仪可以测定分子的相对分子质量
B.用李比希元素分析仪可以确定有机物的分子式
C.可通过红外光谱分析物质中含有何种化学键
D.X射线衍射技术可用于有机化合物(特别是复杂的生物大分子)晶体结构的测定
4.除去下列物质中含有的少量杂质(括号内为杂质),所用除杂试剂合理的是
A.溶液 B.催化剂
C.溶液():铁粉 D.:饱和溶液
5.溴化苄是重要的有机合成工业原料,可由苯甲醇为原料合成,实验原理及装置如图所示:
下列有关说法不正确的是
A.先加热至反应温度,然后从冷凝管接口b处通水
B.该实验适宜用热水浴加热
C.浓硫酸作催化剂和吸水剂
D.反应液可按下列步骤分离和纯化:静置→分液→水洗→纯碱洗→水洗→干燥→减压蒸馏
6.下列有机物分子中,在氢核磁共振谱中信号强度(个数比)是1:3的是
A.邻二甲苯 B.均三甲苯 C.异丙醇 D.丙酸乙酯
7.由E(金属铁)制备的E(C5H5)2的结构如图甲所示,其中氢原子的类型完全相同。但早期人们却错误地认为它的结构如图乙所示。核磁共振氢谱能够区分这两种结构。甲和乙的核磁共振氢谱中,分别有几种吸收峰
A.1种 1种 B.1种 2种
C.1种 3种 D.2种 3种
8.某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,至少需要的条件是
①X中所含碳元素的质量分数②X中所含氢元素的质量分数③X在标准状况下的体积④X的相对分子质量⑤X的质量
A.①②③ B.①②④ C.①②⑤ D.③④⑤
9.2013年诺贝尔化学奖授予美国科学家马丁·卡普拉斯、迈克尔·莱维特、阿里耶·瓦谢勒,以表彰他们“在开发多尺度复杂化学系统模型方面所做的贡献”。这种用电脑取代木棒作试验模型,催生了现代化学研究手段的一次新飞跃。下列不属于现代化学对物质结构进行研究的手段的是
A.天平 B.红外光谱 C.质谱 D.核磁共振
10.a mL三种气态烃与足量的氧气形成的混合物点燃爆炸后,恢复到原来的状态(150℃、1.01×105 Pa)气体体积仍为a mL,则三种烃可能是:
A.CH4、C2H4、C3H4 B.C2H6、C3H6、C4H6
C.CH4、C2H6、C3H6 D.C3H8、C2H4、C2H6
11.苯乙烯与溴苯在一定条件下发生Heck反应:
溴苯用量(mmol) 100 100 100 100 100 100 100
催化剂用量(mmol) 2 2 2 2 2 2 2
反应温度(℃) 100 100 100 100 120 140 160
反应时间(h) 10 12 14 16 14 14 14
产率(%) 81.2 84.4 86.6 86.2 93.5 96.6 89.0
根据上表数据及产品的结构性质,下列说法正确的是A.最佳反应条件为14h、100 ℃ B.温度升高,反应速率先升高后降低
C.合成的产品可能存在两种结构 D.合成的产品易溶于有机物与水
12.现有由过氧乙酸(CH3COOOH)、环己烷、戊烯组成的混合物,其中氧的质量分数为16%,则氢的质量分数是
A.6% B.12% C.18% D.24%
13.化学与生产、科技、生活密切相关,下列说法不正确的是
A.空间站的“太阳翼”及光伏发电系统能将太阳能转化为电能
B.红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物组成与结构的分析
C.我国科学家突破的人工合成淀粉技术有利于我国实现碳中和
D.纯碱可作化工原料,也是治疗胃酸过多的一种药剂
14.下列说法正确的是
A.苯甲酸重结晶实验中粗苯甲酸溶解后还要加点水,目的是减少过滤时苯甲酸的损失
B.的核磁共振氢谱中有4种峰
C.石油是混合物,其分馏产品汽油为纯净物
D.苯中滴加浓溴水,充分振荡后溴水层褪色,是因为苯与溴水中的溴发生了加成反应
15.某有机物X的红外光谱图如图所示。下列说法错误的是
A.X可能是丙酮
B.X中可能只含碳、氢、氧三种元素
C.X中可能含有醛基
D.红外光谱图可获得X中所含化学键和官能团信息
二、填空题
16.(1)下列各组物质:
A.金刚石与石墨;B.重水与超重水;C.氕与氘;D.甲烷与戊烷;E.正丁烷与异丁烷;F.与G.与其中互为同位素的是___________;(填编号。下同),互为同系物的是___________;互为同分异构体的是___________;是同一种物质的是___________。
(2)化合物A的结构简式为:,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含氢原子种类最少的一种结构简式为:___________。若A是由烯烃和H通过加成反应得到,则该烯烃的所有可能的结构简式为___________。
(3)篮烷分子结构如图所示,试回答:写出篮烷分子的化学式___________;篮烷分子的一氯取代物的种数为___________种。
17.青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,其分子结构如图所示,它可以用有机溶剂A从中药中提取。
(1)下列关于青蒿素的说法不正确的是___________(填字母)。
a.分子式为C14H20O5 b.分子中含有酯基和醚键
c.易溶于有机溶剂A,不易溶于水 d.分子的空间结构不是平面形
(2)使用现代分析仪器对有机化合物A的分子结构进行测定,相关结果如下:
①根据图1,A的相对分子质量为___________。
②根据图2,推测A可能所属的有机化合物类别和其分子式___________、___________。
③根据以上结果和图3(两个峰的面积比为2∶3),推测A的结构简式___________。
18.某烃A,相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定条件下氧化只生成G,G能使石蕊试液变红。
已知:试写出:
(1)A的分子式:___________________。
(2)化合物A和G的结构简式:A_________________,G___________________
(3)与G同类的同分异构体(含G)可能有_______________种。
三、计算题
19.含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,其蒸气相对于氢气的密度为58,它能与小苏打反应放出CO2,也能使溴水褪色,0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应。试回答:
(1)该有机物中各原子个数比N(C)∶N(H)∶N(O)= ______________
(2)该有机物的摩尔质量为__________,写出分子式_____________
(3)该有机物的可能结构简式有___________________
20.某烃2.8g,在氧气中燃烧生成4.48L(标准状况)二氧化碳,3.6g水,它相对氢气的密度是14,求此烃的化学式_______,写出它的结构简式_______。
四、实验题
21.有机物M(只含C、H、O三种元素中的两种或三种)具有令人愉悦的牛奶香气,主要用于配制奶油、乳品、酸奶和草莓等型香精,是我国批准使用的香料产品,其沸点为148℃。某化学兴趣小组从粗品中分离提纯有机物M,然后借助李比希法、现代科学仪器测定有机物M的分子组成和结构,具体实验过程如下:
步骤一:将粗品用蒸馏法进行纯化。
(1)如图1所示,仪器a的名称是_______,图中虚线框内应选用右侧的_______(填“仪器x”或“仪器y”)。
步骤二:确定M的实验式和分子式。
(2)利用元素分析仪测得有机物M中碳的质量分数为54.5%,氢的质量分数为9.1%。
①M的实验式为_______。
②已知M的密度是同温同压下CO2密度的2倍,则M的分子式为_______。
步骤三:确定M的结构简式。
(3)用核磁共振仪测出M的核磁共振氢谱如图2所示,图中峰面积之比为1∶3∶1∶3;利用红外光谱仪测得M的红外光谱如图3所示。
①M中官能团的名称为_______,M的结构简式为_______(填键线式)。
②写出两种含有酯基的M的同分异构体的结构简式:_______。
22.电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。
(1)C装置中浓H2SO4的作用是_______;
(2)D装置发生的化学反应方程式_______;
(3)燃烧管中CuO的作用是_______;
(4)若准确称取12g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加26.4g。B管质量增加14.4g,能否_______(答“是或否”)确定该有机物的分子式。若能确定,分子式为_______,若不能确定,还要知道_______。
参考答案:
1.B
【详解】2.24L该混合气体即0.1mol完全燃烧后,得到4.48L二氧化碳(气体已折算成标准状况)和3.6g水。即二氧化碳的物质的量为0.2mol,水的物资的量为0.2mol,则平均分子式为C2H4。
A.CH4和C3H8的平均分子式中氢原子个数不可能是4,A错误;
B.CH4和C3H4若按1:1混合,平均分子式为C2H4,B正确;
C.C2H4和C3H4混合气体平均分子式中碳原子个数不可能为2,C错误;
D.C2H4和C2H6混合气体平均分子式中氢原子个数不可能是4,D错误;
故选B。
2.B
【详解】A.X中含有4种氢原子,其核磁共振氢谱有4组峰,故A错误;
B.X和Y发生反应生成Z时,氯原子被取代、同时还发生缩聚反应生成高分子化合物,所以该反应过程中有取代反应和聚合反应,故B正确;
C.苯酚分子中只有-个酚羟基,所以和Y只能发生取代反应或环加成反应,所以不能生成与Z相似的高分子,故C错误;
D.根据图知,生成1mol Z同时生成(n + 2)molHCl,故D错误;
故选B。
3.B
【详解】A.质谱法是近代发展起来的快速、微量、精确测定相对分子质量的方法,故A正确;
B.李比希分析仪可以测定有机化合物中碳、氢元素质量分数的方法,故B错误;
C.不同的化学键或官能团吸收频率不同,在红外光谱图上将处于不同位置,从而可以获得分子中含有何种化学键或官能团,故C正确;
D.X射线衍射技术可用于有机化合物,特别是复杂的生物大分子晶体结构的测定,故D正确;
故选B。
4.A
【详解】A.硫化氢和硫酸铜反应生成硫化铜沉淀,乙炔不反应,故能除杂,A正确;
B.乙烯能和氢气反应,但不能完全反应,B错误;
C.铁和氯化铁反应生成氯化亚铁,C错误;
D.二氧化硫和二氧化碳都能和碳酸钠反应,D错误;
故选A。
5.A
【详解】A.为防止原料加热蒸发损失,应先从冷凝管接口b处通水,再先加热至反应温度,故A错误;
B.该实验要求温度较准确,适宜用热水浴加热,以便控制温度,故B正确;
C.从反应方程式看,浓硫酸做催化剂,产物中有水,通过浓硫酸吸水,促进反应更完全,故C正确;
D.反应液经水洗可溶解反应物中的醇类,碱洗可除去氢溴酸,再水洗除去碱和盐类,可按下列步骤分离和纯化:静置→分液→水洗→纯碱洗→水洗→干燥→减压蒸馏,故D正确;
故选:A。
6.B
【详解】A.邻二甲苯的结构简式为:,该分子的核磁共振氢谱有3种峰,其峰面积之比是3:1:1,故A不符合题意;
B.均三甲苯的结构简式为:,该分子的核磁共振氢谱有2种峰,其峰面积之比是1:3,故B符合题意;
C.异丙醇的结构简式为:CH3CH(OH)CH3,该分子中的核磁共振氢谱有3种峰,其峰面积之比是6:1:1,故C不符合题意;
D.丙酸乙酯的结构简式为:CH3CH2COOCH2CH3,该分子的核磁共振氢谱有4种峰,其峰面积之比是3:3:2:2,故D不符合题意;
答案选B。
7.C
【详解】图甲E(C5H5)2的结构中氢原子的类型完全相同、则只有1种氢原子,图乙E的结构为轴对称、则有3种氢原子,C符合;
答案选C。
8.B
【详解】由气态有机物中含碳元素和氢元素的质量分数可推出氧元素的质量分数,由各元素的质量分数可确定X的实验式,由相对分子质量和实验式可确定X的分子式,则欲确定X的分子式至少需要的条件是①②④,故选B。
9.A
【详解】现代化学测定物质结构的方法有:核磁共振、红外光谱、质谱法、X-射线等,天平称量不属于现代化学研究重要手段,故选:A。
10.A
【详解】150℃下水为气体,设混合烃的平均组成为CxHy,CxHy+(x+)O2xCO2+H2O,燃烧前后气体的体积不变,则有1+ x+=x+,解得:y=4;即混合气体分子中平均含有4个H原子,故选:A。
11.C
【详解】A.最佳反应条件为14h、140 ℃,A错误;
B.温度升高,反应速率升高,B错误;
C.产品存在顺反异构,C正确;
D.合成的产品易溶于有机物,难溶于水,D错误;
故选C。
12.B
【详解】混合物中只有过氧乙酸中含有氧,氧的质量分数为16%,则碳、氢的总质量分数为84%,混合物中各物质的碳、氢原子个数比均为1:2,即混合物中碳、氢的质量比始终是6:1,因此氢的质量分数为84%×= 12%,B项符合题意。
13.D
【详解】A.“太阳翼”及光伏发电系统利用硅与某些金属的光电效应将太阳能转化为电能,A项正确;
B.红外光谱仪用于测定有机物的官能团;核磁共振仪用于测定有机物分子中氢原子的种类和数目;质谱法用于测定有机物的相对分子质量;以上都可用于有机化合物组成与结构的分析,B项正确;
C.人工合成淀粉技术有利于节能减排,即实现碳中和,C项正确;
D.治疗胃酸过多的常用药剂是小苏打NaHCO3或Al(OH)3,纯碱碱性太强,不能用于治疗胃酸过多,D项错误;
答案选D。
14.A
【详解】A.水在加热过程中会蒸发,苯甲酸能溶于水,则粗苯甲酸溶解后还要加点水的目的是使其溶解,减少过滤时苯甲酸的损失,A正确;
B. 的核磁共振氢谱中有5种峰,B错误;
C.石油是混合物,其分馏产品汽油是一定温度范围内的馏分,属于多种烃的混合物,C错误;
D.溴易溶于苯中,为萃取现象,没有发生化学反应,D错误;
故答案为:A。
15.A
【详解】A.由红外光谱图可知X中含两种C-H键,而丙酮只含有一种C-H键,故A错误;
B.由红外光谱图可知X中含C-H键和C=O键,故X中可能只含碳、氢、氧三种元素,故B正确;
C.由红外光谱图可知X中含C-H键和C=O键,X中可能含有醛基,故C正确;
D.由红外光谱图可知X中含C-H键和C=O键,故D正确;
故选A。
16. C D E、F B、G 和 C10H12 4
【详解】(1)A.金刚石与石墨都是碳元素的单质,二者互为同素异形体;
B.重水与超重水都是水,二者属于同一种物质;
C.氕与氘是质子数相同,中子数不同,属于同位素;
D.甲烷与戊烷结构相似,分子组成上相差4个CH2原子团,属于同系物;
E.正丁烷与异丁烷分子式相同,结构不同,属于同分异构体;
F.与分子式相同,结构不同,属于同分异构体;
G.与属于同种物质;
故互为同位素的是C;互为同系物的是D;互为同分异构体的是E、F;是同一种物质的是B、G;
(2)A的同分异构体中含氢原子种类最少的一种结构简式为;A是由烯烃和H通过加成反应得到,则该烯烃的所有可能的结构简式为、;
(3)根据篮烷分子结构可知,篮烷分子的化学式为C10H12;篮烷分子中含有4种不同环境的H原子,如图,则其一氯代物有4种。
17.(1)a
(2) 74 醚 C4H10O CH3CH2OCH2CH3
【解析】(1)
a.根据物质结构简式可知青蒿素分子中含有15个C原子,22个H原子,5个O原子,所以其分子式是C15H22O5,a错误;
b.根据物质结构简式可知青蒿素分子中含有的官能团是酯基和醚键,b正确;
c.青蒿素分子中含有的官能团是酯基和醚键,不含有亲水基羟基和羧基,因此青蒿素易溶于有机溶剂A,不易溶于水,c正确;
d.青蒿素分子中含有饱和C原子,具有甲烷的四面体结构,因此青蒿素分子的空间结构不是平面形,d正确;
故合理选项是a;
(2)
①物质的最大质合比就是物质的相对分子质量,根据图1,A的相对分子质量为74;
②根据图可知:A中含有烃基、醚键, 所以属于醚,A中碳原子个数=,则分子式为C4H10O;
③A的分子式为C4H10O,吸收峰有2个,说明含有两种氢原子,吸收峰面积之比为2:3,则氢原子个数之比为2:3,则A结构对称,含有两个甲基和两个亚甲基,故A的结构简式为CH3CH2OCH2CH3。
18. C10H20 4
【分析】根据烃的相对分子质量和碳元素的含量分析其分子式,在根据结构要求书写其结构。
【详解】(1) 烃A中N(C)=140×0.857/12=10,N(H)=140×0.143/1=20,故A的分子式为C10H20
(2) A分子中有两个碳原子不与氢原子直接相连,说明有两个的结构,A在一定条件下氧化只生成G,G能使石蕊试液变红,则G含有羧基,说明A分子中有—CH=CH—,且为对称结构,则A的结构简式为,则G为
(3)的同分异构体中属于羧酸类,即为C4H9COOH,C4H9—有4种结构:C—C—C—C—、、、,则与G同类的同分异构体(含G)可能有4种。
考点:有机推断
19. 1:1:1 116g/mol C4H4O4 HOOC-CH=CH-COOH 、CH2=C(COOH)2
【分析】(1)含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,则该有机物中各原子个数比N(C)∶N(H)∶N(O)=;
(2)有机物的最简式为CHO,该有机物的摩尔质量为58×2g/mol,设分子式(CHO)n,则29n=58×2,n=4,分子式为C4H4O4;
(3)它能与小苏打反应放出CO2,说明分子中含有-COOH;也能使溴水褪色,说明分子内含有碳碳不饱和键;0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应,则1mol该有机物含有2mol-COOH;与同数碳原子的烷烃相比,分子中除含2个羧基外,还应含有一个碳碳双键。由此可确定该有机物的可能结构简式。
【详解】(1)含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,则该有机物中各原子个数比N(C)∶N(H)∶N(O)==1:1:1;答案为:1:1:1;
(2)有机物的最简式为CHO,该有机物的摩尔质量为58×2g/mol,设分子式为(CHO)n,则29n=58×2,n=4,分子式为C4H4O4;答案为:116g/mol;C4H4O4;
(3)它能与小苏打反应放出CO2,说明分子中含有-COOH;也能使溴水褪色,说明分子内含有碳碳不饱和键;0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应,则1mol该有机物含有2mol-COOH;与同数碳原子的烷烃相比,分子中除含2个羧基外,还应含有一个碳碳双键,由此可确定该有机物的可能结构简式中,两个羧基可能连在两个不同的双键碳原子上,也可能连在同一个双键碳原子上。答案为:HOOC-CH=CH-COOH 、CH2=C(COOH)2。
20. C2H4 CH2=CH2
【详解】该烃的相对分子质量是氢气的14倍,则经的相对分子质量是14×2=28。燃烧生成的二氧化碳和水的物质的量分别是、,即碳氢原子的个数之比是1:2,所以该烃的分子式为C2H4,结构简式为H2C=CH2。
21.(1) 蒸馏烧瓶 仪器y
(2)
(3) 羟基、羰基 、、、
【分析】本题是一道测定某有机物的结构式的实验题,首先对样品进行纯化,随后根据M中碳元素和氢元素的质量分数计算其实验式,再根据核磁共振氢谱已经红外光谱 分析其结构中含有的官能团,进而分析其结构式,以此解题。
(1)
仪器a的名称为蒸馏烧瓶;蒸馏时使用仪器y(直形冷凝管),仪器x(球形冷凝管)一般用于冷凝回流装置中,故答案为:蒸馏烧瓶;仪器y;
(2)
①计算该有机物中氧元素的质量分数:,分子内各元素原子的个数比:,即实验式为:,故答案为:;
②M的密度是同温同压下二氧化碳密度的2倍,则M的相对分子质量为,设分子式为,则,n=2,则分子式为,
(3)
①根据核磁共振氢谱图中有4组峰,且峰面积之比为1∶3∶1∶3,说明分子中含有4种不同化学环境的氢原子,且个数比为1∶3∶1∶3,结合红外光谱图所示含有C-H、H-O、C=O等化学键,其结构简式为,所含官能团为羟基、羰基,其键线式写作,故答案为:羟基、羰基;;
②酯基结构为,含有酯基的M的同分异构体的结构简式为、、、,故答案为:、、、。
22.(1)吸收水分,保证氧气干燥纯净
(2)2H2O22H2O+O2↑
(3)使有机物充分氧化生成CO2
(4) 是 C3H8O 有机物的相对分子质量
【分析】由实验装置图可知,装置D中过氧化氢在二氧化锰做催化剂条件下发生分解反应制备氧气,装置C中盛有的浓硫酸用于干燥氧气,装置E用于氧气氧化管内样品,其中氧化铜的作用是将有机物未完全燃烧生成的一氧化碳氧化为二氧化碳,装置B中氯化钙用于吸收、测定反应生成的水蒸气,装置A用于吸收、测定反应生成的二氧化碳,则实验装置的连接顺序为DCEBA。
(1)
由分析可知,装置C中盛有的浓硫酸用于干燥氧气,保证氧气干燥纯净,故答案为:吸收水分,保证氧气干燥纯净;
(2)
由分析可知,装置D中过氧化氢在二氧化锰做催化剂条件下发生分解反应生成氧气和水,反应的化学方程式为2H2O22H2O+O2↑,故答案为:2H2O22H2O+O2↑;
(3)
由分析可知,氧化铜的作用是将有机物未完全燃烧生成的一氧化碳氧化为二氧化碳,故答案为:使有机物充分氧化生成CO2;
(4)
由B管质量增加14.4g可知,有机物分子中氢原子的物质的量为×2=1.6mol,由A管质量增加26.4g可知,有机物分子中碳原子的物质的量为=0.6mol,由有机物的质量为12g可知,有机物分子中氧原子的物质的量为=0.1mol,则有机物分子中碳氢氧的原子个数比为0.3mol:0.8mol:0.1mol=3:8:1,实验式为C3H8O,若要确定有机物的分子式,应知道有机物的相对分子质量,由于分子中碳原子结合氢原子个数已达到饱和,所以有机物的分子式为C3H8O,故答案为:是;C3H8O;有机物的相对分子质量。
