化学人教版(2019)必修第一册3.1.2铁的重要化合物 课件(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1.2铁的重要化合物 课件(共20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-04-30 14:20:39 | ||
图片预览







文档简介
(共20张PPT)
铁及其化合物
第2课时 铁的重要化合物
名称 氧化亚铁 氧化铁 四氧化三铁
化学式 FeO Fe2O3 Fe3O4
俗名 ——
颜色、状态
水溶性
稳定性
铁红
红棕色粉末
黑色晶体
黑色粉末
磁性氧化铁
不溶于水
不溶于水
不溶于水
不稳定
稳定
稳定
在空气中受热,能迅速被氧化成Fe3O4
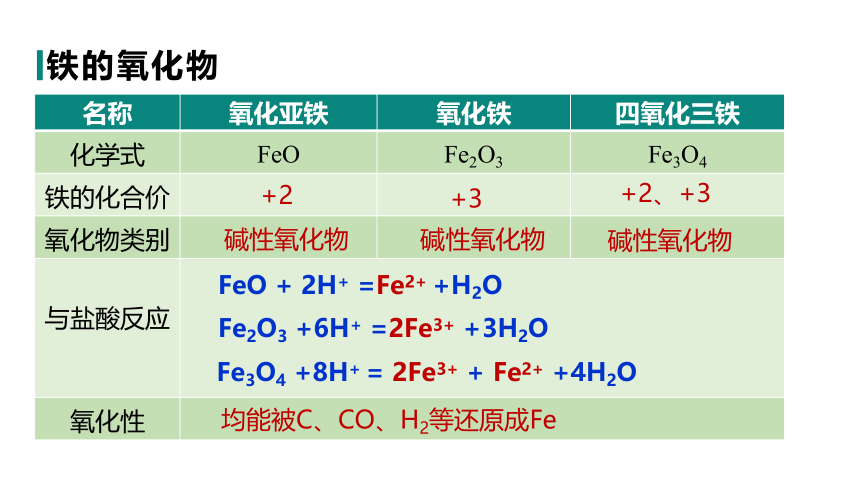
铁的氧化物
名称 氧化亚铁 氧化铁 四氧化三铁
化学式 FeO Fe2O3 Fe3O4
铁的化合价
氧化物类别
与盐酸反应 氧化性 铁的氧化物
碱性氧化物
碱性氧化物
碱性氧化物
+2
+3
+2、+3
FeO + 2H+ =Fe2+ +H2O
Fe3O4 +8H+ = 2Fe3+ + Fe2+ +4H2O
Fe2O3 +6H+ =2Fe3+ +3H2O
均能被C、CO、H2等还原成Fe
铁的氧化物的用途
Fe2O3可作为冶炼金属的原料
Fe2O3常用于制造红色油漆和涂料
Fe2O3+3CO===2Fe+3CO2
高温
Fe3O4用于电磁领域(制录音磁带和电讯器材)
课堂巩固
1.判断正误(正确的打“√”,错误的打“×”)。
1)铁的化学性质活泼,所以铁在自然界中全部以化合态存在。 ( )
2)铁粉作食品袋内的脱氧剂时起氧化作用。 ( )
3)铁与稀硫酸反应的离子方程式:2Fe+6H+=2Fe3++3H2↑。( )
4)Fe2O3俗称铁红,常用作红色油漆和涂料。( )
5)FeO和Fe2O3都是碱性氧化物,都能与酸发生反应( )
6)3 mol单质Fe完全转变为Fe3O4,失去8 mol电子( )
X
X
X
√
√
√
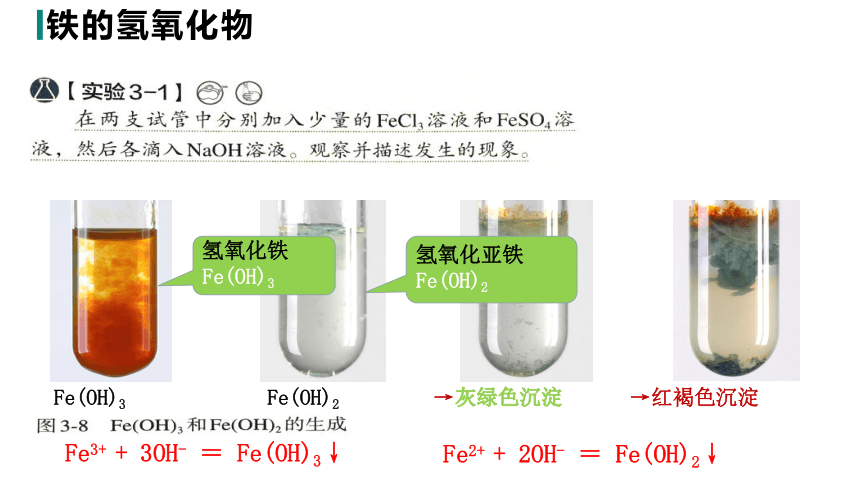
铁的氢氧化物
【实验3-】1在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后滴入NaOH溶液,观察并描述现象。
白色沉淀
灰绿色沉淀
红褐色沉淀
Fe(OH)3
氢氧化亚铁Fe(OH)2
→灰绿色沉淀
→红褐色沉淀
Fe(OH)2
氢氧化铁Fe(OH)3
Fe3+ + 3OH- = Fe(OH)3↓
Fe2+ + 2OH- = Fe(OH)2↓
铁的氢氧化物
铁的氢氧化物
现象 离子方程式
FeCl3溶液
FeSO4溶液
生成红褐色沉淀
生成白色沉淀,迅速变成灰绿色,最后变成红褐色
Fe3++3OH- = Fe(OH)3 ↓
Fe2++2OH- = Fe(OH)2 ↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
【想一想】如何制取 Fe(OH)2 ?实验过程中要注意哪些问题?
制取氢氧化亚铁
【分析】 Fe(OH)2会被O2氧化,因此制取Fe(OH)2的关键是防止O2的干扰,做到:1.溶液中不含O2 2.生成的Fe(OH)2隔绝O2
【具体措施】
1.使用新配制的FeSO4溶液和NaOH溶液。
2.把NaOH溶液或配制溶液用的蒸馏水加热煮沸除去溶解氧
3.向盛有FeSO4溶液的试管中加入少量的煤油或苯等有机物,以隔绝空气
4.将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液
Fe(OH)2 由于易被空气中的氧气氧化, 在制备Fe(OH)2时应采取哪些措施防止其被氧化
思考交流
化学式 Fe(OH)2 Fe(OH)3
色态
溶解性
稳定性
与O2反应
与酸反应
制备
白色固体
红褐色固体
难溶
难溶
不稳定,易被氧化
Fe(OH)2+2H+=Fe2++2H2O
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe2++2OH-=Fe(OH)2↓
Fe(OH)3+3H+= Fe3++3H2O
Fe3++3OH-=Fe(OH)3↓
2Fe(OH)3 == Fe2O3+3H2O
△
铁的氢氧化物
【想一想】Fe(OH)2在空气中灼烧,最终得到什么物质?
3.铁盐和亚铁盐
氯化铁[FeCl3]
硫酸铁[Fe2(SO4)3]
氯化亚铁[FeCl2]
硫酸亚铁[FeSO4]
棕黄色
浅绿色
向FeCl3溶液中
滴入KSCN溶液:
向FeCl2溶液中
滴入KSCN溶液:
【思考与讨论】如何用KSCN证明Fe2+的存在呢?
溶液显黄色,滴加硫氰化钾溶液后,溶液显红色
Fe3+ + 3SCN- = Fe(SCN)3
溶液显浅绿色,滴加硫氰化钾溶液后无变化
实验现象及结论
实验:在氯化铁和氯化亚铁溶液中分别滴加硫氰化钾溶液
铁盐的化学性质 与铁反应 氧 化 性
与铜反应
与碘化钾反应
与强碱反应
特征反应
2Fe3++Fe=3Fe2+
2Fe3++Cu=2Fe2++Cu2+
2Fe3++2I-=2Fe2++I2
Fe3++OH-=Fe(OH)3↓
Fe3+ + 3SCN- = Fe(SCN)3
3.铁盐和亚铁盐
亚铁盐的化学性质 与锌反应(氧化性)
与氯水反应(还原性)
与强碱反应
Fe2++Zn=Fe+Zn2+
2Fe2++Cl2=2Fe3++2Cl-
Fe2++2OH-=Fe(OH)2↓
思考、怎么除去FeCl2溶液中的少量Fe3+
3、铁盐及亚铁盐
Fe3+与Fe2+的检验
鉴别方法 Fe3+ Fe2+
方法一
观察溶液颜色
浅绿色
棕黄色
滴加NaOH溶液
产生红褐色的沉淀
生成白色沉淀,迅速变成灰绿色,最后变成红褐色
方法二
Fe3+与Fe2+的检验
【实验3-2】在两支试管中分别加入少量FeCl3溶液和FeCl2溶液,各滴入几滴KSCN溶液,观察并记录现象
鉴别方法 Fe3+ Fe2+
方法三
加入KSCN溶液
无明显现象
溶液呈红色
实验3-3
FeCl3溶液
加入过量铁粉
滴入KSCN溶液
取上层清液滴入氯水
溶液由棕黄色变为浅绿色
无明显现象
溶液呈红色
2Fe3++Fe=3Fe2+
2Fe2++Cl2=2Fe3++2Cl-
Fe、Fe3+与Fe2+的相互转化
Fe
Fe2+
Fe3+
还原剂 如Fe、Zn、Cu、I-等
强氧化剂 如Cl2、O2、HNO3、KMnO4等
弱氧化剂 如H+、Cu2+、S等
强还原剂 如Zn、Al、CO、H2等
强氧化剂 如Cl2、HNO3、浓硫酸等
强还原剂 如Zn、Al、CO、H2等
谢谢大家
铁及其化合物
第2课时 铁的重要化合物
名称 氧化亚铁 氧化铁 四氧化三铁
化学式 FeO Fe2O3 Fe3O4
俗名 ——
颜色、状态
水溶性
稳定性
铁红
红棕色粉末
黑色晶体
黑色粉末
磁性氧化铁
不溶于水
不溶于水
不溶于水
不稳定
稳定
稳定
在空气中受热,能迅速被氧化成Fe3O4
铁的氧化物
名称 氧化亚铁 氧化铁 四氧化三铁
化学式 FeO Fe2O3 Fe3O4
铁的化合价
氧化物类别
与盐酸反应 氧化性 铁的氧化物
碱性氧化物
碱性氧化物
碱性氧化物
+2
+3
+2、+3
FeO + 2H+ =Fe2+ +H2O
Fe3O4 +8H+ = 2Fe3+ + Fe2+ +4H2O
Fe2O3 +6H+ =2Fe3+ +3H2O
均能被C、CO、H2等还原成Fe
铁的氧化物的用途
Fe2O3可作为冶炼金属的原料
Fe2O3常用于制造红色油漆和涂料
Fe2O3+3CO===2Fe+3CO2
高温
Fe3O4用于电磁领域(制录音磁带和电讯器材)
课堂巩固
1.判断正误(正确的打“√”,错误的打“×”)。
1)铁的化学性质活泼,所以铁在自然界中全部以化合态存在。 ( )
2)铁粉作食品袋内的脱氧剂时起氧化作用。 ( )
3)铁与稀硫酸反应的离子方程式:2Fe+6H+=2Fe3++3H2↑。( )
4)Fe2O3俗称铁红,常用作红色油漆和涂料。( )
5)FeO和Fe2O3都是碱性氧化物,都能与酸发生反应( )
6)3 mol单质Fe完全转变为Fe3O4,失去8 mol电子( )
X
X
X
√
√
√
铁的氢氧化物
【实验3-】1在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后滴入NaOH溶液,观察并描述现象。
白色沉淀
灰绿色沉淀
红褐色沉淀
Fe(OH)3
氢氧化亚铁Fe(OH)2
→灰绿色沉淀
→红褐色沉淀
Fe(OH)2
氢氧化铁Fe(OH)3
Fe3+ + 3OH- = Fe(OH)3↓
Fe2+ + 2OH- = Fe(OH)2↓
铁的氢氧化物
铁的氢氧化物
现象 离子方程式
FeCl3溶液
FeSO4溶液
生成红褐色沉淀
生成白色沉淀,迅速变成灰绿色,最后变成红褐色
Fe3++3OH- = Fe(OH)3 ↓
Fe2++2OH- = Fe(OH)2 ↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
【想一想】如何制取 Fe(OH)2 ?实验过程中要注意哪些问题?
制取氢氧化亚铁
【分析】 Fe(OH)2会被O2氧化,因此制取Fe(OH)2的关键是防止O2的干扰,做到:1.溶液中不含O2 2.生成的Fe(OH)2隔绝O2
【具体措施】
1.使用新配制的FeSO4溶液和NaOH溶液。
2.把NaOH溶液或配制溶液用的蒸馏水加热煮沸除去溶解氧
3.向盛有FeSO4溶液的试管中加入少量的煤油或苯等有机物,以隔绝空气
4.将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液
Fe(OH)2 由于易被空气中的氧气氧化, 在制备Fe(OH)2时应采取哪些措施防止其被氧化
思考交流
化学式 Fe(OH)2 Fe(OH)3
色态
溶解性
稳定性
与O2反应
与酸反应
制备
白色固体
红褐色固体
难溶
难溶
不稳定,易被氧化
Fe(OH)2+2H+=Fe2++2H2O
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe2++2OH-=Fe(OH)2↓
Fe(OH)3+3H+= Fe3++3H2O
Fe3++3OH-=Fe(OH)3↓
2Fe(OH)3 == Fe2O3+3H2O
△
铁的氢氧化物
【想一想】Fe(OH)2在空气中灼烧,最终得到什么物质?
3.铁盐和亚铁盐
氯化铁[FeCl3]
硫酸铁[Fe2(SO4)3]
氯化亚铁[FeCl2]
硫酸亚铁[FeSO4]
棕黄色
浅绿色
向FeCl3溶液中
滴入KSCN溶液:
向FeCl2溶液中
滴入KSCN溶液:
【思考与讨论】如何用KSCN证明Fe2+的存在呢?
溶液显黄色,滴加硫氰化钾溶液后,溶液显红色
Fe3+ + 3SCN- = Fe(SCN)3
溶液显浅绿色,滴加硫氰化钾溶液后无变化
实验现象及结论
实验:在氯化铁和氯化亚铁溶液中分别滴加硫氰化钾溶液
铁盐的化学性质 与铁反应 氧 化 性
与铜反应
与碘化钾反应
与强碱反应
特征反应
2Fe3++Fe=3Fe2+
2Fe3++Cu=2Fe2++Cu2+
2Fe3++2I-=2Fe2++I2
Fe3++OH-=Fe(OH)3↓
Fe3+ + 3SCN- = Fe(SCN)3
3.铁盐和亚铁盐
亚铁盐的化学性质 与锌反应(氧化性)
与氯水反应(还原性)
与强碱反应
Fe2++Zn=Fe+Zn2+
2Fe2++Cl2=2Fe3++2Cl-
Fe2++2OH-=Fe(OH)2↓
思考、怎么除去FeCl2溶液中的少量Fe3+
3、铁盐及亚铁盐
Fe3+与Fe2+的检验
鉴别方法 Fe3+ Fe2+
方法一
观察溶液颜色
浅绿色
棕黄色
滴加NaOH溶液
产生红褐色的沉淀
生成白色沉淀,迅速变成灰绿色,最后变成红褐色
方法二
Fe3+与Fe2+的检验
【实验3-2】在两支试管中分别加入少量FeCl3溶液和FeCl2溶液,各滴入几滴KSCN溶液,观察并记录现象
鉴别方法 Fe3+ Fe2+
方法三
加入KSCN溶液
无明显现象
溶液呈红色
实验3-3
FeCl3溶液
加入过量铁粉
滴入KSCN溶液
取上层清液滴入氯水
溶液由棕黄色变为浅绿色
无明显现象
溶液呈红色
2Fe3++Fe=3Fe2+
2Fe2++Cl2=2Fe3++2Cl-
Fe、Fe3+与Fe2+的相互转化
Fe
Fe2+
Fe3+
还原剂 如Fe、Zn、Cu、I-等
强氧化剂 如Cl2、O2、HNO3、KMnO4等
弱氧化剂 如H+、Cu2+、S等
强还原剂 如Zn、Al、CO、H2等
强氧化剂 如Cl2、HNO3、浓硫酸等
强还原剂 如Zn、Al、CO、H2等
谢谢大家
