7.1.1碳原子成键特点和烷烃 课件 (共58张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 7.1.1碳原子成键特点和烷烃 课件 (共58张PPT) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-02 14:36:34 | ||
图片预览










文档简介
(共58张PPT)
第一课时 碳原子成键特点 烷烃
第七章 有机化合物
第一节 认识有机化合物
教学目标
1. 了解有机物的定义。
2.理解有机化合物中碳原子的成键特点。
3. 掌握烷烃的定义、通式以及命名。
衣
食
行
住
【思考】有机物在生活中随处可见,你能想到哪些例子?
1、定义:
狭义上有机化合物主要由碳元素、氢元素组成的含碳化合物。
含碳的化合物一定是有机物吗?
碳的氧化物、硫化物、碳酸、碳酸盐、氰化物、硫氰化物、氰酸盐、碳化物等都不属于有机物。
2、元素组成
C、H、O、N、S、P、X(卤素)等是有机物中的主要组成元素
一.有机化合物
3、有机物特点(通性)
①有机物种类繁多
②大多数有机物熔点较低,难溶于水,易溶于有机溶剂,
不导电(聚乙炔导电);
③易燃烧,受热易分解;发生化学反应较复杂,常伴有副反应发生。
有机方程式书写一般用“→”
一.有机化合物
1、代表物-甲烷(最简单的有机化合物)
①存在:是天然气、沼气、油田气、煤矿坑道气(瓦斯)等
主要成分。
②:物理性质:无色、无味、可燃、难溶于水的有毒气体。
③:组成及结构
(1)实验式(最简式):CH4
(2)分子式(用元素符号表示物质组成):CH4
二.烷烃
(3)电子式(用"."或"×"来表示原子的最外层电子成键情况)
(4)结构式(用短划线替代共用电子对):
平面结构
立体结构
甲烷分子的结构是正四面体结构,碳原子位于正四面体的中心,4个氢原子分别位于正四面体的4个顶点上(键角是109028/)。C-H的长度、强度相同,五个原子不共面
(5)结构简式(表示单键“-”可省略,将与碳原子相连的其他
原子写在旁边,右下角注明个数):CH4
(6)球棍模型(小球表示原子,短棍表示化学键):
球棍模型
注:
同球表示同种原子:球的大小表示原子半径大小;棍的多少反应是哪一族(棍有时代表单键和双键。
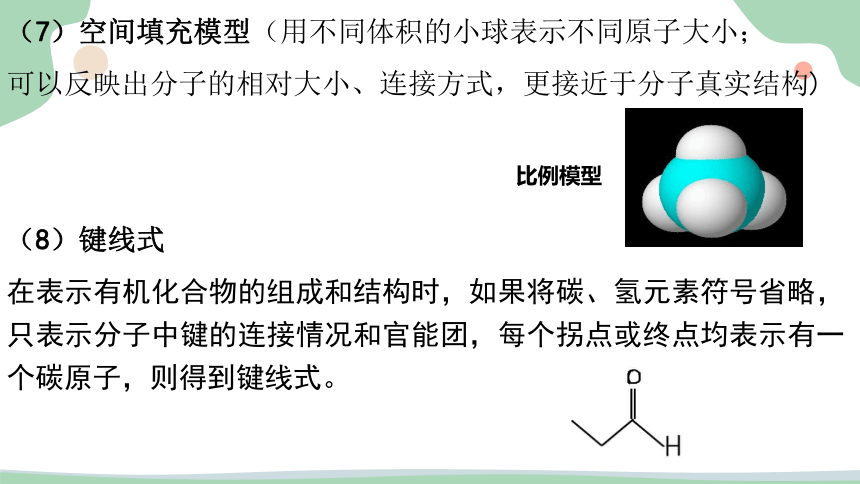
(7)空间填充模型(用不同体积的小球表示不同原子大小;
可以反映出分子的相对大小、连接方式,更接近于分子真实结构)
(8)键线式
在表示有机化合物的组成和结构时,如果将碳、氢元素符号省略,只表示分子中键的连接情况和官能团,每个拐点或终点均表示有一个碳原子,则得到键线式。
比例模型
【思考·讨论】
(1)一种烃的球棍模型为 ,试着写出其分子式和结构简式。
提示:分子式为C4H10,结构简式为CH3CH2CH2CH3。
(2)结合化学键理论分析有机物的分子结构中是否真像球棍模型一样原子通过“棍”相互连接?球棍模型中的“棍”表示什么?
提示:有机物分子中原子通过化学键相互结合,球棍模型中的“棍”表示的是化学键。
【迁移·应用】
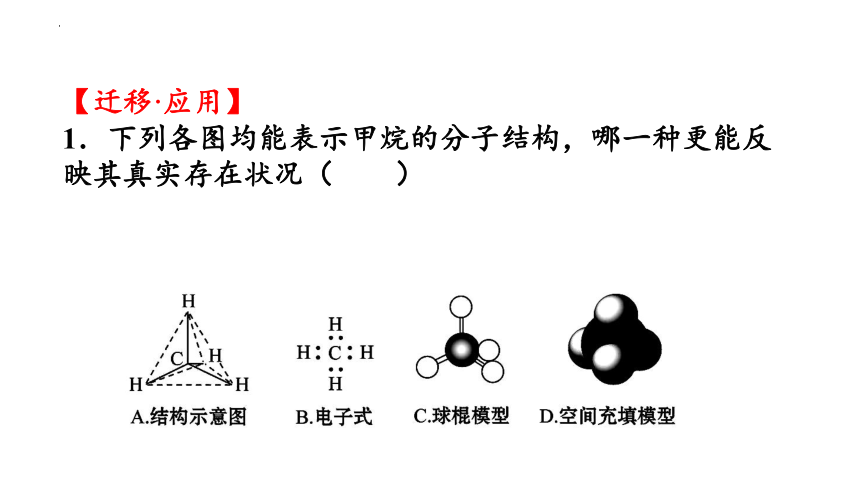
1.下列各图均能表示甲烷的分子结构,哪一种更能反映其真实存在状况( )
【解析】选D。这几种形式都可表示甲烷分子,其中分子结构示意图、球棍模型及空间充填模型均能反映甲烷分子的空间构型,但空间充填模型更能形象地表达出甲烷分子中H、C的位置及所占比例。电子式只反映出原子的最外层电子的成键情况。
2、碳原子的成键特点P60
(1)结构:
碳原子最外层有4个电子,在化学反应中不易得失电子形成阴阳离子
(2)成键特点:
每个碳原子都与其他原子形成4个共价键,通常与H、O、S、N等非金属原子以共价键的成键方式形成共价化合物。
(N为3,O为2,H、X为1)
+6
2 4
C
(3)成键种类:
碳原子与碳原子之间可以形成单键、双键、三键。
单键 双键 三键
(4)碳连接方式:
链状结构或环状结构为碳骨架
链状-直连 链状-支链 环状
【思考】结合下列碳原子相互结合的几种方式,分析以碳为骨架的有机物种类繁多的原因
⑴碳原子最外层有4个电子,在有机物中,每个碳原子能与其他原子形成4个共价键;
⑵有机化合物中可以含一个碳原子,也可以含多个甚至成千上万个碳原子;
⑶每个碳原子之间结合的方式可有单键、双键、三键,多个碳原子可以相互结合形成长的碳链,也可以形成碳环;
⑷大量存在同分异构现象。
1.碳原子的不同结合方式使得有机物种类繁多,下列碳原子的结合方式中错误的是( )
2.有机物分子中的碳原子与其他原子的结合方式是( )
A.通过两个共价键 B.通过非极性键
C.形成四对共用电子对 D.通过离子键和共价键
C
C
随堂练习
碳 + 氢 =
3、烷烃P63
烃
你知道烃的由来吗?
(1)烃:
仅含碳氢两种元素的有机化合物称为碳氢化合物,也称为烃。
tàn qīng
tīng
丁烷
丙烷
乙烷
【思考】上述化合物有什么共同特点?分子式有什么规律?
C2H6 C3H8 C4H10
与甲烷结构相似的有机化合物还有很多,如乙烷、丙烷、丁烷。
P62
① 元素组成上只含碳、氢两种元素
② 分子中的碳原子之间都以碳碳单键结合
③ 碳原子的剩余价键均与氢原子结合,化合价达到“饱和”
链状烷烃的通式:CnH2n+2
(2)烷烃(饱和烃):
(3)烷烃通式:
③、碳数增加,状态不同,气态(1~4) 液态 (5~16)固态(>16)
②、碳数增加,熔沸点增加,密度增加(<1),碳数相同时,支链越多,熔沸点越低
(5)烃基
烃分子失去一个或几个H原子后剩余的部分,用R-表示,如甲基: CH3- 或- CH3
·
·
·
·
·
·
·
C
H
H
H
(4)烷烃的物理性质:
(适用于所有烃①②③)
①、难溶于水的无色物质
④、化学性质较稳定,与强酸强碱或高锰酸钾不反应
3、烃是( )
A 含有C、H元素的有机物
B 含有C元素的化合物
C 仅由C、H两种元素组成的有机物
D 完全燃烧只生成CO2和H2O的化合物
C
随堂练习
烷烃CnH2n+2的命名 实例
C4H10的名称为________
C9H20的名称为________
C14H30的名称为________
带支链的烷烃 用正、异、新表示
n≤10时,以甲、乙、丙、丁、戊、己、庚、辛、壬、癸依次代表碳原子数,其后加“烷”字
n>10时,以汉字数字加“烷”字代表
丁烷
壬烷
十四烷
CH3CH2CH2CH2CH3
CH3CHCH2CH3
CH3
正戊烷
异戊烷
新戊烷
CH3
CH3 C CH3
CH3
无支链
带一支链
带二支链
4、烷烃的命名
a、习惯命名法:
C17H36
十七烷
C8H18
C12H26
辛烷
十二烷
例:
“三步骤”、“五原则”
(1)找主链:选最长碳链为主链,遇等长碳链时,支链最多为主链。
,叫“某烷”(可转弯,等长中选最简)。
(2)编碳号:由距离支链最近的一端开始,将主链上的碳原子用1,2,3 …,等数字依次编号,以确定支链的位置,若均符合”近-----离支链最近一端编号”的原则则使支链编号之和最小,若两取代基距离主链两端等距离时,从简单取代基开始编号。
b、系统命名法:
(3)写名称:(简前杂后母最后)
名称组成:取代基位置-----取代基名称-----母体名称。
用阿拉伯数字标明所有取代基位置(由小到大)相同取代基可以合并;
汉字数字标明相同取代基的个数。阿拉伯数字与汉字间用短划线“-”隔开,阿拉伯数字间用逗号“,”隔开。
若烷烃命名中有”一甲基、二乙基、三丙基.......“一定错
CH3—CH2—CH—CH—CH2—CH2—CH3
CH3
CH3
CH3
CH—CH—CH3
2,3,5—三甲基—4—丙基庚烷
CH3—CH—CH2—CH—CH—CH3
CH3
CH3
CH3
2,3,5—三甲基己烷
烷烃的命名练习
CH3—CH—CH—CH—CH2—CH3
CH3
CH3
CH3
CH2
CH3—CH2—CH—CH2—CH2—CH3
CH3
CH3
CH2
3—甲基—3—乙基己烷
2,4—二甲基—3—乙基己烷
1、同位素
具有相同质子数(即核电荷数)和不同中子数的同一元素的不同原子互称为同位素。
eg:氕、氘、氚
三.五同概念
2、同素异形体
是指由同种化学元素组成,但不同性质的单质
eg:金刚石、石墨
3、同系物
结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物
烷烃的结构相似是指:
(1)碳和碳只存在碳、碳单键
(2)链状结构
(3)在组成上相差一个或者n个CH2
4、同系列
结构相似,在分子组成上相差为一个或若干个CH2原子团之外的任何系差。
P63
②同分异构体:具有同分异构现象的化合物互称为同分异构体。
5、同分异构体
① 同分异构现象:化合物具有相同的分子式,但具有不同的结构的现象,叫做同分异构现象。
2.下列各组物质互为同系物的是( )
A.O2和O3
B.CH4和C3H8
C.CH3CH2CH2CH3和(CH3)3CH
D.
【解析】选B。O2和O3互为同素异形体; 互为同位素;CH3CH2CH2CH3和(CH3)3CH分子式相同,只有CH4和C3H8满足同系物的概念。
随堂练习
【巧判断】
(1)同分异构体具有相同的组成元素。( )
提示:√。同分异构体具有相同的分子式,所以组成元素一定相同。
(2)相对分子质量相同的化合物互为同分异构体。( )
提示:×。同分异构体具有相同的分子式,相对分子质量一定相同。但相对分子质量相同的化合物不一定是同分异构体。
【思考·讨论】
(1)CH3CH2CH2CH3与 是否属于同系物?为什么?
提示:不是。因为同系物在分子组成上必须相差1个或若干个CH2原子团,一定具有不同的分子式。而CH3CH2CH2CH3与 分子式相同,属于同分异构体。
(2)CH2=CHCH3和 的组成相同,二者中哪一个与CH2=CH2互为同系物?由此判断,分子组成上相差一个或若干个CH2原子团的有机物一定是同系物吗?
提示:与CH2=CH2互为同系物的是CH2=CHCH3,因为CH2=CH2和CH2=CHCH3分子中都含有 ,结构相似,且分子组成上相差1个CH2原子团。 分子中含碳碳单键而不含双键,化学键类型不同,结构不相似。由此可知分子组成上相差一个或若干个CH2原子团的有机物结构不一定相似,故不一定是同系物。
例如C5H12有3种同分异构体
正戊烷
异戊烷
新戊烷
物理性质不同,化学性质相似。
C5H12的三种同分异构体的结构简式
链状、无支链
链状、有支链
链状、多支链
36.07℃
27.9℃
9.5℃
结构特点
沸点
结论:物质的分子式相同,形成的分子的结构可能不同
CH3CH2CH2CH2CH3
CH3CH2CHCH3
CH3
CH3-C-CH3
CH3
CH3
支
链
越
多
沸
点
越
低
碳原子数目越多,同分异构体越多
碳原子数 (烷烃) 1 2 3 4 5 6 7 8 9 10
同分异构体数 无 无 无 2 3 5 9 18 35 75
碳原子数 (烷烃) 11 12 …. 15 4347 20 40
同分异构体数 159 355 …. 366319 62491178805931
新课讲解
4.下列叙述中正确的是( )
A.同系物可能互为同分异构体
B.CH3Cl和HCl互为同系物
C.同分异构体不能互称为同系物
D.C4H10分子中四个碳原子在一条直线上
C
随堂练习
5如图是几种烷烃的球棍模型,试回答下列问题:
(1)A、B、C三者的关系是____________。
(2)A的分子式为____________________, C的名称为____________。
同系物
C2H6
正丁烷
1、有机化合物中的同分异构
构造异构:碳架异构(烷烃异构);位置异构;官能团异构
立体异构:顺反异构;对映异构
四、同分异构体的书写
2.同碳(或等效碳)的确定
①连在同一个碳原子上的相同基团的对应碳原子是等效的;
②处于对称位置或镜面对称位置的碳原子是等效的
3.烷烃异构的书写方法(减碳移位法)
(1)定碳链:碳链由长到短;每减少一个碳原子,就将其作为取代基
(2)连支链:取代基由大到小,由整到散,位置由一边到中心
(无中心则一遍到另一边)
注意:端点不带甲基,2点不带乙基等,防重复,不遗漏。
(3)填氢:根据C四价论,补写各碳原子所结合的氢原子数。
随堂练习
1、试写出符合C4H10所有同分异构体的结构简式
2、试写出符合C5H12所有同分异构体的结构简式
3、试写出符合C6H14所有同分异构体的结构简式
4、试写出符合C7H16所有同分异构体的结构简式
5.下列分子式中,只表示一种物质的是( )
A.C3H8 B.C5H12
C.C6H14 D.C4H10
A
【解析】表示一种物质,说明该物质不存在同分异构体
【案例示范】
【典例】已知某烷烃分子中电子数为42。
(1)该烷烃的分子式为____________。
(2)写出该烷烃分子的所有同分异构体的结构简式:
______________________。
C5H12
CH3—CH2—CH2—CH2—CH3
1、定义
是指在有机物分子中,位置等同的氢原子称为等效氢
五、等效氢
2.等效氢的判断方法
①连在同一个碳原子上的氢原子等效;
②处于对称位置烷基上的氢原子等效;
③处于镜面对称上的氢原子等效。
3.应用
判断同分异构体的一种方法,处于不同环境中的氢原子(等效氢)有多少种,其一元取代物结构就有多少种。
1、与氢形成的单键全部省略。
七、有机物分子结构简式的书写规则
2、主链上的碳碳单键全部省略(支链与主链相连的碳碳单键不省)。
3、相近且相同的基团可以合并
【迁移·应用】
1.下列化合物中有三种不同氢原子的是( )
A.(CH3)3CC(CH3)3
B.(CH3)2CH(CH2)2CH(CH3)2
C.(CH3)2CHCH2CH3
D.CH3C(CH3)3
【解析】
1、确定元素组成
一般说来,有机物完全燃烧后,各元素对应产物为:C→CO2、H→H2O、Cl→HCl。某有机物完全燃烧后若产物只有CO2和H2O,则其元素组成可能为C、H或C、H、O。欲判断该有机物是否含氧元素,首先应求出产物CO2中碳元素的质量及H2O中氧元素的质量,然后将碳、氢质量之和与原有机物质量比较,若两者相等,则原有机物中不含氧;否则,原有机物的组成中含氧。
六、确定有机物分子式
2.确定分子式
①相对分子质量+实验式法
根据有机物的分子式为实验式(最简式)的整数倍,利用其相对分子质量和实验式可确定其分子式。
②列方程组法
若已知有机物的元素组成,则可直接设1个分子中各元素的原子个数为x、y、z等[如含碳、氢、或碳、氢、氧时均可设为CxHyOz(当z=0时不含氧),根据原子守恒建立方程组解出x、y、z等即可]。
③不定方程法
当未知数的个数多于等式个数时的方程(组)属于不定方程(组),从数学角度无确定解;但若结合未知数的化学意义,则可能只有少数解合理。
已知甲烷的密度在标准状况下是0.717 g·L-1,含碳75%,含氢25%,利用这些数据怎样确定它的分子式?
随堂练习
成才之路大册P77
提示:甲烷的摩尔质量为M=22.4 L·mol-1×0.717 g·
L-1≈16 g·mol-1, 1 mol甲烷气体中含碳原子的物质
的量: 1 mol甲烷气体中含氢原子的物质的量: 所以甲烷的分子式为CH4。
1.有下列结构的物质:①CH3(CH2)3CH3
②CH3CH2CH2CH2CH3 ③CH3CH2CH2CH2CH2CH3
其中,属于同系物的是________;属于同分异构体的是______________;
属于同种物质的是________。
A.①② B.②③ C.③④⑤⑥⑦
D.①③ E.③④⑤⑦ F.④⑥
成才之路大册P70
E
AF
BD
【补偿训练】
下列说法中正确的是( )
A.C3H7Cl有3种同分异构体
B.相对分子质量相同、结构不同的两种化合物互为同分异构体
C.同分异构体之间的转化是化学变化
C
【素养提升】
“手性”指一个物体不能与其镜像相重合 。如我们的双手,左手与互成镜像的右手不重合。一个手性分子与其镜像不重合,分子的手性通常是由不对称碳引起的,即一个碳上的四个基团互不相同。 通常用(RS)、(DL)对其进行识别。例如:
(1)互为手性分子的物质是同一种物质吗? 二者具有什么关系?
提示:不是同一种物质,二者互为同分异构体。
(2)互为手性分子的物质化学性质几乎完全相同,分析其原因。
提示:物质结构决定性质。互为手性分子的物质组成、结构几乎完全相同,所以其化学性质几乎完全相同。
1、认识甲烷的结构
2、掌握烃的定义以及烷烃的通式:CnH2n+2
4、能够写出简单烷烃的同分异构体
3、掌握烷烃的命名方法和原则,能够对烷烃进行命名。
课堂小结
烷烃(减碳移位法)
主链由长到短
支链由整到散
位置由心到边
第一课时 碳原子成键特点 烷烃
第七章 有机化合物
第一节 认识有机化合物
教学目标
1. 了解有机物的定义。
2.理解有机化合物中碳原子的成键特点。
3. 掌握烷烃的定义、通式以及命名。
衣
食
行
住
【思考】有机物在生活中随处可见,你能想到哪些例子?
1、定义:
狭义上有机化合物主要由碳元素、氢元素组成的含碳化合物。
含碳的化合物一定是有机物吗?
碳的氧化物、硫化物、碳酸、碳酸盐、氰化物、硫氰化物、氰酸盐、碳化物等都不属于有机物。
2、元素组成
C、H、O、N、S、P、X(卤素)等是有机物中的主要组成元素
一.有机化合物
3、有机物特点(通性)
①有机物种类繁多
②大多数有机物熔点较低,难溶于水,易溶于有机溶剂,
不导电(聚乙炔导电);
③易燃烧,受热易分解;发生化学反应较复杂,常伴有副反应发生。
有机方程式书写一般用“→”
一.有机化合物
1、代表物-甲烷(最简单的有机化合物)
①存在:是天然气、沼气、油田气、煤矿坑道气(瓦斯)等
主要成分。
②:物理性质:无色、无味、可燃、难溶于水的有毒气体。
③:组成及结构
(1)实验式(最简式):CH4
(2)分子式(用元素符号表示物质组成):CH4
二.烷烃
(3)电子式(用"."或"×"来表示原子的最外层电子成键情况)
(4)结构式(用短划线替代共用电子对):
平面结构
立体结构
甲烷分子的结构是正四面体结构,碳原子位于正四面体的中心,4个氢原子分别位于正四面体的4个顶点上(键角是109028/)。C-H的长度、强度相同,五个原子不共面
(5)结构简式(表示单键“-”可省略,将与碳原子相连的其他
原子写在旁边,右下角注明个数):CH4
(6)球棍模型(小球表示原子,短棍表示化学键):
球棍模型
注:
同球表示同种原子:球的大小表示原子半径大小;棍的多少反应是哪一族(棍有时代表单键和双键。
(7)空间填充模型(用不同体积的小球表示不同原子大小;
可以反映出分子的相对大小、连接方式,更接近于分子真实结构)
(8)键线式
在表示有机化合物的组成和结构时,如果将碳、氢元素符号省略,只表示分子中键的连接情况和官能团,每个拐点或终点均表示有一个碳原子,则得到键线式。
比例模型
【思考·讨论】
(1)一种烃的球棍模型为 ,试着写出其分子式和结构简式。
提示:分子式为C4H10,结构简式为CH3CH2CH2CH3。
(2)结合化学键理论分析有机物的分子结构中是否真像球棍模型一样原子通过“棍”相互连接?球棍模型中的“棍”表示什么?
提示:有机物分子中原子通过化学键相互结合,球棍模型中的“棍”表示的是化学键。
【迁移·应用】
1.下列各图均能表示甲烷的分子结构,哪一种更能反映其真实存在状况( )
【解析】选D。这几种形式都可表示甲烷分子,其中分子结构示意图、球棍模型及空间充填模型均能反映甲烷分子的空间构型,但空间充填模型更能形象地表达出甲烷分子中H、C的位置及所占比例。电子式只反映出原子的最外层电子的成键情况。
2、碳原子的成键特点P60
(1)结构:
碳原子最外层有4个电子,在化学反应中不易得失电子形成阴阳离子
(2)成键特点:
每个碳原子都与其他原子形成4个共价键,通常与H、O、S、N等非金属原子以共价键的成键方式形成共价化合物。
(N为3,O为2,H、X为1)
+6
2 4
C
(3)成键种类:
碳原子与碳原子之间可以形成单键、双键、三键。
单键 双键 三键
(4)碳连接方式:
链状结构或环状结构为碳骨架
链状-直连 链状-支链 环状
【思考】结合下列碳原子相互结合的几种方式,分析以碳为骨架的有机物种类繁多的原因
⑴碳原子最外层有4个电子,在有机物中,每个碳原子能与其他原子形成4个共价键;
⑵有机化合物中可以含一个碳原子,也可以含多个甚至成千上万个碳原子;
⑶每个碳原子之间结合的方式可有单键、双键、三键,多个碳原子可以相互结合形成长的碳链,也可以形成碳环;
⑷大量存在同分异构现象。
1.碳原子的不同结合方式使得有机物种类繁多,下列碳原子的结合方式中错误的是( )
2.有机物分子中的碳原子与其他原子的结合方式是( )
A.通过两个共价键 B.通过非极性键
C.形成四对共用电子对 D.通过离子键和共价键
C
C
随堂练习
碳 + 氢 =
3、烷烃P63
烃
你知道烃的由来吗?
(1)烃:
仅含碳氢两种元素的有机化合物称为碳氢化合物,也称为烃。
tàn qīng
tīng
丁烷
丙烷
乙烷
【思考】上述化合物有什么共同特点?分子式有什么规律?
C2H6 C3H8 C4H10
与甲烷结构相似的有机化合物还有很多,如乙烷、丙烷、丁烷。
P62
① 元素组成上只含碳、氢两种元素
② 分子中的碳原子之间都以碳碳单键结合
③ 碳原子的剩余价键均与氢原子结合,化合价达到“饱和”
链状烷烃的通式:CnH2n+2
(2)烷烃(饱和烃):
(3)烷烃通式:
③、碳数增加,状态不同,气态(1~4) 液态 (5~16)固态(>16)
②、碳数增加,熔沸点增加,密度增加(<1),碳数相同时,支链越多,熔沸点越低
(5)烃基
烃分子失去一个或几个H原子后剩余的部分,用R-表示,如甲基: CH3- 或- CH3
·
·
·
·
·
·
·
C
H
H
H
(4)烷烃的物理性质:
(适用于所有烃①②③)
①、难溶于水的无色物质
④、化学性质较稳定,与强酸强碱或高锰酸钾不反应
3、烃是( )
A 含有C、H元素的有机物
B 含有C元素的化合物
C 仅由C、H两种元素组成的有机物
D 完全燃烧只生成CO2和H2O的化合物
C
随堂练习
烷烃CnH2n+2的命名 实例
C4H10的名称为________
C9H20的名称为________
C14H30的名称为________
带支链的烷烃 用正、异、新表示
n≤10时,以甲、乙、丙、丁、戊、己、庚、辛、壬、癸依次代表碳原子数,其后加“烷”字
n>10时,以汉字数字加“烷”字代表
丁烷
壬烷
十四烷
CH3CH2CH2CH2CH3
CH3CHCH2CH3
CH3
正戊烷
异戊烷
新戊烷
CH3
CH3 C CH3
CH3
无支链
带一支链
带二支链
4、烷烃的命名
a、习惯命名法:
C17H36
十七烷
C8H18
C12H26
辛烷
十二烷
例:
“三步骤”、“五原则”
(1)找主链:选最长碳链为主链,遇等长碳链时,支链最多为主链。
,叫“某烷”(可转弯,等长中选最简)。
(2)编碳号:由距离支链最近的一端开始,将主链上的碳原子用1,2,3 …,等数字依次编号,以确定支链的位置,若均符合”近-----离支链最近一端编号”的原则则使支链编号之和最小,若两取代基距离主链两端等距离时,从简单取代基开始编号。
b、系统命名法:
(3)写名称:(简前杂后母最后)
名称组成:取代基位置-----取代基名称-----母体名称。
用阿拉伯数字标明所有取代基位置(由小到大)相同取代基可以合并;
汉字数字标明相同取代基的个数。阿拉伯数字与汉字间用短划线“-”隔开,阿拉伯数字间用逗号“,”隔开。
若烷烃命名中有”一甲基、二乙基、三丙基.......“一定错
CH3—CH2—CH—CH—CH2—CH2—CH3
CH3
CH3
CH3
CH—CH—CH3
2,3,5—三甲基—4—丙基庚烷
CH3—CH—CH2—CH—CH—CH3
CH3
CH3
CH3
2,3,5—三甲基己烷
烷烃的命名练习
CH3—CH—CH—CH—CH2—CH3
CH3
CH3
CH3
CH2
CH3—CH2—CH—CH2—CH2—CH3
CH3
CH3
CH2
3—甲基—3—乙基己烷
2,4—二甲基—3—乙基己烷
1、同位素
具有相同质子数(即核电荷数)和不同中子数的同一元素的不同原子互称为同位素。
eg:氕、氘、氚
三.五同概念
2、同素异形体
是指由同种化学元素组成,但不同性质的单质
eg:金刚石、石墨
3、同系物
结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物
烷烃的结构相似是指:
(1)碳和碳只存在碳、碳单键
(2)链状结构
(3)在组成上相差一个或者n个CH2
4、同系列
结构相似,在分子组成上相差为一个或若干个CH2原子团之外的任何系差。
P63
②同分异构体:具有同分异构现象的化合物互称为同分异构体。
5、同分异构体
① 同分异构现象:化合物具有相同的分子式,但具有不同的结构的现象,叫做同分异构现象。
2.下列各组物质互为同系物的是( )
A.O2和O3
B.CH4和C3H8
C.CH3CH2CH2CH3和(CH3)3CH
D.
【解析】选B。O2和O3互为同素异形体; 互为同位素;CH3CH2CH2CH3和(CH3)3CH分子式相同,只有CH4和C3H8满足同系物的概念。
随堂练习
【巧判断】
(1)同分异构体具有相同的组成元素。( )
提示:√。同分异构体具有相同的分子式,所以组成元素一定相同。
(2)相对分子质量相同的化合物互为同分异构体。( )
提示:×。同分异构体具有相同的分子式,相对分子质量一定相同。但相对分子质量相同的化合物不一定是同分异构体。
【思考·讨论】
(1)CH3CH2CH2CH3与 是否属于同系物?为什么?
提示:不是。因为同系物在分子组成上必须相差1个或若干个CH2原子团,一定具有不同的分子式。而CH3CH2CH2CH3与 分子式相同,属于同分异构体。
(2)CH2=CHCH3和 的组成相同,二者中哪一个与CH2=CH2互为同系物?由此判断,分子组成上相差一个或若干个CH2原子团的有机物一定是同系物吗?
提示:与CH2=CH2互为同系物的是CH2=CHCH3,因为CH2=CH2和CH2=CHCH3分子中都含有 ,结构相似,且分子组成上相差1个CH2原子团。 分子中含碳碳单键而不含双键,化学键类型不同,结构不相似。由此可知分子组成上相差一个或若干个CH2原子团的有机物结构不一定相似,故不一定是同系物。
例如C5H12有3种同分异构体
正戊烷
异戊烷
新戊烷
物理性质不同,化学性质相似。
C5H12的三种同分异构体的结构简式
链状、无支链
链状、有支链
链状、多支链
36.07℃
27.9℃
9.5℃
结构特点
沸点
结论:物质的分子式相同,形成的分子的结构可能不同
CH3CH2CH2CH2CH3
CH3CH2CHCH3
CH3
CH3-C-CH3
CH3
CH3
支
链
越
多
沸
点
越
低
碳原子数目越多,同分异构体越多
碳原子数 (烷烃) 1 2 3 4 5 6 7 8 9 10
同分异构体数 无 无 无 2 3 5 9 18 35 75
碳原子数 (烷烃) 11 12 …. 15 4347 20 40
同分异构体数 159 355 …. 366319 62491178805931
新课讲解
4.下列叙述中正确的是( )
A.同系物可能互为同分异构体
B.CH3Cl和HCl互为同系物
C.同分异构体不能互称为同系物
D.C4H10分子中四个碳原子在一条直线上
C
随堂练习
5如图是几种烷烃的球棍模型,试回答下列问题:
(1)A、B、C三者的关系是____________。
(2)A的分子式为____________________, C的名称为____________。
同系物
C2H6
正丁烷
1、有机化合物中的同分异构
构造异构:碳架异构(烷烃异构);位置异构;官能团异构
立体异构:顺反异构;对映异构
四、同分异构体的书写
2.同碳(或等效碳)的确定
①连在同一个碳原子上的相同基团的对应碳原子是等效的;
②处于对称位置或镜面对称位置的碳原子是等效的
3.烷烃异构的书写方法(减碳移位法)
(1)定碳链:碳链由长到短;每减少一个碳原子,就将其作为取代基
(2)连支链:取代基由大到小,由整到散,位置由一边到中心
(无中心则一遍到另一边)
注意:端点不带甲基,2点不带乙基等,防重复,不遗漏。
(3)填氢:根据C四价论,补写各碳原子所结合的氢原子数。
随堂练习
1、试写出符合C4H10所有同分异构体的结构简式
2、试写出符合C5H12所有同分异构体的结构简式
3、试写出符合C6H14所有同分异构体的结构简式
4、试写出符合C7H16所有同分异构体的结构简式
5.下列分子式中,只表示一种物质的是( )
A.C3H8 B.C5H12
C.C6H14 D.C4H10
A
【解析】表示一种物质,说明该物质不存在同分异构体
【案例示范】
【典例】已知某烷烃分子中电子数为42。
(1)该烷烃的分子式为____________。
(2)写出该烷烃分子的所有同分异构体的结构简式:
______________________。
C5H12
CH3—CH2—CH2—CH2—CH3
1、定义
是指在有机物分子中,位置等同的氢原子称为等效氢
五、等效氢
2.等效氢的判断方法
①连在同一个碳原子上的氢原子等效;
②处于对称位置烷基上的氢原子等效;
③处于镜面对称上的氢原子等效。
3.应用
判断同分异构体的一种方法,处于不同环境中的氢原子(等效氢)有多少种,其一元取代物结构就有多少种。
1、与氢形成的单键全部省略。
七、有机物分子结构简式的书写规则
2、主链上的碳碳单键全部省略(支链与主链相连的碳碳单键不省)。
3、相近且相同的基团可以合并
【迁移·应用】
1.下列化合物中有三种不同氢原子的是( )
A.(CH3)3CC(CH3)3
B.(CH3)2CH(CH2)2CH(CH3)2
C.(CH3)2CHCH2CH3
D.CH3C(CH3)3
【解析】
1、确定元素组成
一般说来,有机物完全燃烧后,各元素对应产物为:C→CO2、H→H2O、Cl→HCl。某有机物完全燃烧后若产物只有CO2和H2O,则其元素组成可能为C、H或C、H、O。欲判断该有机物是否含氧元素,首先应求出产物CO2中碳元素的质量及H2O中氧元素的质量,然后将碳、氢质量之和与原有机物质量比较,若两者相等,则原有机物中不含氧;否则,原有机物的组成中含氧。
六、确定有机物分子式
2.确定分子式
①相对分子质量+实验式法
根据有机物的分子式为实验式(最简式)的整数倍,利用其相对分子质量和实验式可确定其分子式。
②列方程组法
若已知有机物的元素组成,则可直接设1个分子中各元素的原子个数为x、y、z等[如含碳、氢、或碳、氢、氧时均可设为CxHyOz(当z=0时不含氧),根据原子守恒建立方程组解出x、y、z等即可]。
③不定方程法
当未知数的个数多于等式个数时的方程(组)属于不定方程(组),从数学角度无确定解;但若结合未知数的化学意义,则可能只有少数解合理。
已知甲烷的密度在标准状况下是0.717 g·L-1,含碳75%,含氢25%,利用这些数据怎样确定它的分子式?
随堂练习
成才之路大册P77
提示:甲烷的摩尔质量为M=22.4 L·mol-1×0.717 g·
L-1≈16 g·mol-1, 1 mol甲烷气体中含碳原子的物质
的量: 1 mol甲烷气体中含氢原子的物质的量: 所以甲烷的分子式为CH4。
1.有下列结构的物质:①CH3(CH2)3CH3
②CH3CH2CH2CH2CH3 ③CH3CH2CH2CH2CH2CH3
其中,属于同系物的是________;属于同分异构体的是______________;
属于同种物质的是________。
A.①② B.②③ C.③④⑤⑥⑦
D.①③ E.③④⑤⑦ F.④⑥
成才之路大册P70
E
AF
BD
【补偿训练】
下列说法中正确的是( )
A.C3H7Cl有3种同分异构体
B.相对分子质量相同、结构不同的两种化合物互为同分异构体
C.同分异构体之间的转化是化学变化
C
【素养提升】
“手性”指一个物体不能与其镜像相重合 。如我们的双手,左手与互成镜像的右手不重合。一个手性分子与其镜像不重合,分子的手性通常是由不对称碳引起的,即一个碳上的四个基团互不相同。 通常用(RS)、(DL)对其进行识别。例如:
(1)互为手性分子的物质是同一种物质吗? 二者具有什么关系?
提示:不是同一种物质,二者互为同分异构体。
(2)互为手性分子的物质化学性质几乎完全相同,分析其原因。
提示:物质结构决定性质。互为手性分子的物质组成、结构几乎完全相同,所以其化学性质几乎完全相同。
1、认识甲烷的结构
2、掌握烃的定义以及烷烃的通式:CnH2n+2
4、能够写出简单烷烃的同分异构体
3、掌握烷烃的命名方法和原则,能够对烷烃进行命名。
课堂小结
烷烃(减碳移位法)
主链由长到短
支链由整到散
位置由心到边
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
