【期末复习】2013-2014学年高中化学(人教版,必修2)第二章+化学反应与能量+易错题训练
文档属性
| 名称 | 【期末复习】2013-2014学年高中化学(人教版,必修2)第二章+化学反应与能量+易错题训练 |  | |
| 格式 | zip | ||
| 文件大小 | 266.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-06-25 16:50:12 | ||
图片预览


文档简介
第二章 化学反应与能量
一、选择题
1.(2013?天津)运用有关概念判断下列叙述正确的是( )
A.1?mol?H2燃烧放出的热量为H2的燃烧热
B.Na2SO3与H2O2的反应为氧化还原反应
C.和互为同系物
D.BaSO4的水溶液不易导电,故BaSO4是弱电解质
2.(2013?北京)下列设备工作时,将化学能转化为热能的是( )
A
B
C
D
硅太阳能电池
锂离子电池
太阳能集热器
燃气灶
A.A B.B C.C D.D
3.(2012?安徽)科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:储氢释氢下列有关说法正确的是( )
A.储氢、释氢过程均无能量变化
B.NaHCO3、HCOONa均含有离子键和共价键
C.储氢过程中,NaHCO3被氧化
D.释氢过程中,每消耗0.1molH2O放出2.24L的H2
4.(2010?浙江)下列热化学方程式或离子方程式中,正确的是( )
A.甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: C.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓
D.氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O=2Al(OH)4-
5.(2010?山东)下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
6.(2010?江苏)如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH-
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
二、填空题
1.(2014?益阳模拟)2013年全国各地都遭遇“十面霾伏”.其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大. (1)汽车尾气净化的主要原理为:
若该反应在绝热、恒容的密闭体系中进行,下列示意图甲正确且能说明反应在进行到t1时刻达到平衡状态的是_(填代号). (下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
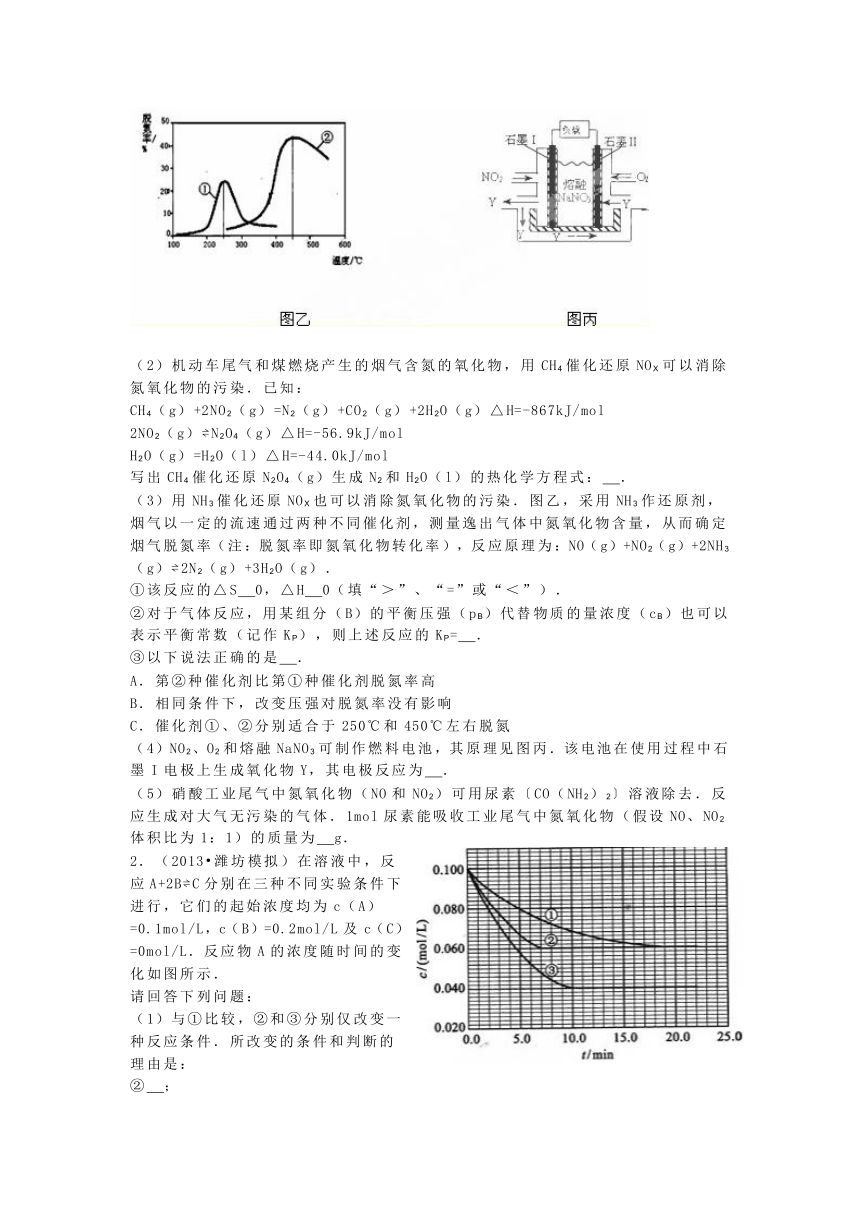
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染.已知: CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol 2NO2(g)?N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol 写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:_. (3)用NH3催化还原NOX也可以消除氮氧化物的污染.图乙,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g). ①该反应的△S_0,△H_0(填“>”、“=”或“<”). ②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的KP=_. ③以下说法正确的是_. A.第②种催化剂比第①种催化剂脱氮率高 B.相同条件下,改变压强对脱氮率没有影响 C.催化剂①、②分别适合于250℃和450℃左右脱氮 (4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图丙.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为_. (5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去.反应生成对大气无污染的气体.1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为_g.
2.(2013?潍坊模拟)在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.1mol/L,c(B)=0.2mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示. 请回答下列问题: (1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是: ②_; ③_; (2)实验②平衡时B的转化率为_;实验③平衡时C的浓度为_; (3)该反应为_(填“吸热”或“放热”)反应,判断其理由是_; (4)该反应进行到4.0min时的平均反应速度率: 实验②:vB=_,实验③:vC=_.
三、解答题
1.(2011?浙江)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定. (1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g). 实验测得不同温度下的平衡数据列于下表:
温度(℃)
15.0
20.0
25.0
30.0
35.0
平衡总压强(kPa)
5.7
8.3
12.0
17.1
24.0
平衡气体总浓度(×10-3mol/L)
2.4
3.4
4.8
6.8
9.4
①可以判断该分解反应已经达到化学平衡的是_. A.2v(NH3)=v(CO2)B.密闭容器中总压强不变 C.密闭容器中混合气体的密度不变D.密闭容器中氨气的体积分数不变 ②根据表中数据,列式计算25.0℃时的分解平衡常数:_. ③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量_(填“增加”、“减小”或“不变”). ④氨基甲酸铵分解反应的焓变△H_0,熵变△S_0(填>、<或=). (2)已知:NH2COONH4+2H2O?NH4HCO3+NH3?H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示. ⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率_. ⑥根据图中信息,如何说明水解反应速率随温度升高而增大:?_. 答案
1、解:A.1mol氢气燃烧生成液态水时放出的热量为氢气的燃烧热,故A错误; B.亚硫酸钠有还原性,双氧水具有氧化性,二者发生氧化还原反应,故B正确; C.苯酚和苯甲醇不属于同一类物质,不是同系物,故C错误; D.硫酸钡属于难溶强电解质,故D错误; 故选B.
2、解:A.硅太阳能电池是太阳能转化为电能,故A错误;? B.锂离子电池是把化学能转化为电能,故B错误; C.太阳能集热器是把太阳能转化为热能,故C错误; D.燃烧是放热反应,是化学能转化为热能,故D正确. 故选D.
3、解:A.储氢释氢,储氢、释氢过程都是化学变化,化学变化中一定伴随能量变化,故A错误; B.NaHCO3晶体是离子晶体,由Na+与HCO3-构成,HCO3-中含有共价键,HCOONa晶体是离子晶体,由Na+与HCOO-构成,HCOO-中含有共价键,故B正确; C.储氢过程中C元素的化合价由+4降低为+2,NaHCO3被还原,故C错误; D.储氢释氢,释氢过程中,每消耗0.1molH2O放出0.1mol的H2,只有在标准状况下0.1mol的H2为2.24L,该题未指明在标准状况下,所以0.1mol的H2不一定为2.24L,故D错误; 故选B.
4、解:A、燃烧热是指1mol可燃物完全燃烧生成稳定的化合物时所放出的能量,气态水不属于稳定的化合物,故A错误; B、合成氨反应是可逆的,所以0.5mol?N2完全反应时放出的热量应该大于19.3kJ,故B错误; C、一水合氨是弱电解质,离子方程式中要用化学式表示,故C错误; D、Al2O3与碱反应在溶液中是以Al(OH)4-的形式存在,故D正确; 故选D.
5、解:A、生成物的总能量低于反应总能量的反应,是放热反应,若是吸热反应则相反,故A错; B、反应速率与反应是吸热还是放热没有必然的联系,故B错; C、化学反应的反应热大小取决于反应物和生成物的总能量大小,与反应途径无关,应用盖斯定律,可计算某些难以直接测量的反应焓变,故C正确; D、根据△H=生成物的焓-反应物的焓可知,焓变与反应条件无关,在光照和点燃条件下该反应的△H相同,故D错. 故选:C.
6、A、存在能量转化形式有太阳能、机械能、化学能、电能,则不只是三种,故A错误; B、装置Y为燃料电池,正极电极反应式是O2+2H2O+4e-=4OH-,故B错误; C、由装置X可知,水分解生成氢气和氧气,燃料电池的原料是氢气和氧气,则能实现燃料电池的燃料和氧化剂再生,故C正确; D、太阳能电池白天发出的直流电一部分供工作马达运转,富余的电力通过装置X进行水的电解,生成氢气和氧气,夜间再通过装置Y燃烧氢氧来发电,以继续支持工作马达运转.装置X和Y实际上是存储了部分太阳能电池产生的电能.该系统能量并非完全转化,故D错误; 故选:C.
二、填空题
解:(1)A、t1时正反应速率仍然在变化,说明没有达到平衡状态,故A错误; B、t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,故B正确; C、t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故C错误; D、t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,故D正确; 故选BD; (2)已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol① 2NO2(g)?N2O4(g)△H2=-56.9kJ/mol② H2O(g)=H2O(l)△H=-44.0kJ/mol③ 根据盖斯定律,①-②+④×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol 即CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol, 故答案为:CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol; (3)①反应前气体的化学计量数为4,反应后计量数之和为5,正反应是混乱度增加的反应,所以△S>0;根据①、②图象可知,达到平衡后升高温度后,氮氧化物的转化率减小,说明升高温度平衡向着逆向移动,正反应为放热反应,△H<0, 故答案为:>;<;?????? ②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则反应NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)的 故答案为:;? ③A.催化剂不会影响转化率,只影响反应速率,所以第②种催化剂和第①种催化剂对转化率没有影响,故A错误; B.该反应为体积增大的反应,增大压强,平衡向着逆向移动,所以压强对脱氮率有影响,故B错误; C.由图象可知,催化剂①、②分别适合于250℃和450℃左右脱氮,其催化活性最好,故C正确; 故选C; (4)以NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,二氧化氮在负极失电子发生氧化反应,元素化合价升高为+5价,其氧化物为N2O5,发生的电极反应为:NO2+NO3--e-=N2O5, 故答案为:NO2+NO3--e-=N2O5; (5)由题目信息可知,NO、NO2与尿素反应生成CO2和N2,反应方程式为:NO+NO2+CO(NH2)2=CO2+2N2+2H2O, ????? NO+NO2?~CO(NH2)2 ???? (30+46)g??? 1mol 1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1: 1)的质量为76g, 故答案为:76.
2、解:(1)因催化剂能加快化学反应速度率,缩短达到平衡的时间,化学平衡不移动,所以②为使用催化剂;因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,故答案为:②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变;③温度升高;达到平衡的时间缩短,平衡时A的浓度减小; (2)实验②平衡时B的转化率为; 根据?????????????? A+2B?C ??初始 (mol/L)??? 0.1???? 0.2????????0?????? ? 转化 (mol/L)?? 0.06???? 0.12????? 0.06??? ? 平衡(mol/L)??? 0.04???? 0.08????? 0.06???? 平衡时C的浓度为0.06mol/L, 故答案:40%;0.06mol/L; (3)因③温度升高,化学平衡向吸热的方向移动,平衡时A的浓度减小,说明正反应方向吸热,故答案为:吸热;升高温度向正方向移动,故该反应是吸热反应. (4)因vA=△C/△t==0.007mol(L?min)-1,所以vB=2vA=0.014mol(L?min)-1; 同理vC=0.008mol(L?min)-1, 故答案为:0.014mol(L?min)-1;0.008mol(L?min)-1.
三、解答题
解:(1)①A、因未指明速率的方向,无法确定正逆反应速率的关系,故A错误; B、该反应是气体体积增大的反应,故当容器内压强不变时,已达到平衡,故B正确; C、该反应是气体质量增大的反应,故当密闭容器中混合气体的密度不变,已达到平衡,故C正确; D、因反应物(NH2COONH4)是固体物质,所以密闭容器中NH3的体积分数始终不变,为2/3,故D错误; 故选:BC; ②容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为3.2×10-3?mol/L、1.6×10-3?mol/L,代入平衡常数表达式:K=(3.2×10-3)2×1.6×10-3?=1.6×10-8,故答案为:1.6×10-8; ③压缩容器体积,气体压强增大,平衡向逆向移动,氨基甲酸铵质量增加,故答案为:增加;? ④从表中数据可以看出,随着温度升高,气体的总浓度增大,平衡正向移动,则该反应为吸热反应,△H>0;反应中固体变为气体,混乱度增大,△S>0,故答案为:>;>;
(2)①化学反应速率,故答案为:0.05mol/(L?min); ②因25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大,故答案为:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
一、选择题
1.(2013?天津)运用有关概念判断下列叙述正确的是( )
A.1?mol?H2燃烧放出的热量为H2的燃烧热
B.Na2SO3与H2O2的反应为氧化还原反应
C.和互为同系物
D.BaSO4的水溶液不易导电,故BaSO4是弱电解质
2.(2013?北京)下列设备工作时,将化学能转化为热能的是( )
A
B
C
D
硅太阳能电池
锂离子电池
太阳能集热器
燃气灶
A.A B.B C.C D.D
3.(2012?安徽)科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:储氢释氢下列有关说法正确的是( )
A.储氢、释氢过程均无能量变化
B.NaHCO3、HCOONa均含有离子键和共价键
C.储氢过程中,NaHCO3被氧化
D.释氢过程中,每消耗0.1molH2O放出2.24L的H2
4.(2010?浙江)下列热化学方程式或离子方程式中,正确的是( )
A.甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: C.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓
D.氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O=2Al(OH)4-
5.(2010?山东)下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
6.(2010?江苏)如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH-
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
二、填空题
1.(2014?益阳模拟)2013年全国各地都遭遇“十面霾伏”.其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大. (1)汽车尾气净化的主要原理为:
若该反应在绝热、恒容的密闭体系中进行,下列示意图甲正确且能说明反应在进行到t1时刻达到平衡状态的是_(填代号). (下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染.已知: CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol 2NO2(g)?N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol 写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:_. (3)用NH3催化还原NOX也可以消除氮氧化物的污染.图乙,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g). ①该反应的△S_0,△H_0(填“>”、“=”或“<”). ②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的KP=_. ③以下说法正确的是_. A.第②种催化剂比第①种催化剂脱氮率高 B.相同条件下,改变压强对脱氮率没有影响 C.催化剂①、②分别适合于250℃和450℃左右脱氮 (4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图丙.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为_. (5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去.反应生成对大气无污染的气体.1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为_g.
2.(2013?潍坊模拟)在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.1mol/L,c(B)=0.2mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示. 请回答下列问题: (1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是: ②_; ③_; (2)实验②平衡时B的转化率为_;实验③平衡时C的浓度为_; (3)该反应为_(填“吸热”或“放热”)反应,判断其理由是_; (4)该反应进行到4.0min时的平均反应速度率: 实验②:vB=_,实验③:vC=_.
三、解答题
1.(2011?浙江)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定. (1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g). 实验测得不同温度下的平衡数据列于下表:
温度(℃)
15.0
20.0
25.0
30.0
35.0
平衡总压强(kPa)
5.7
8.3
12.0
17.1
24.0
平衡气体总浓度(×10-3mol/L)
2.4
3.4
4.8
6.8
9.4
①可以判断该分解反应已经达到化学平衡的是_. A.2v(NH3)=v(CO2)B.密闭容器中总压强不变 C.密闭容器中混合气体的密度不变D.密闭容器中氨气的体积分数不变 ②根据表中数据,列式计算25.0℃时的分解平衡常数:_. ③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量_(填“增加”、“减小”或“不变”). ④氨基甲酸铵分解反应的焓变△H_0,熵变△S_0(填>、<或=). (2)已知:NH2COONH4+2H2O?NH4HCO3+NH3?H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示. ⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率_. ⑥根据图中信息,如何说明水解反应速率随温度升高而增大:?_. 答案
1、解:A.1mol氢气燃烧生成液态水时放出的热量为氢气的燃烧热,故A错误; B.亚硫酸钠有还原性,双氧水具有氧化性,二者发生氧化还原反应,故B正确; C.苯酚和苯甲醇不属于同一类物质,不是同系物,故C错误; D.硫酸钡属于难溶强电解质,故D错误; 故选B.
2、解:A.硅太阳能电池是太阳能转化为电能,故A错误;? B.锂离子电池是把化学能转化为电能,故B错误; C.太阳能集热器是把太阳能转化为热能,故C错误; D.燃烧是放热反应,是化学能转化为热能,故D正确. 故选D.
3、解:A.储氢释氢,储氢、释氢过程都是化学变化,化学变化中一定伴随能量变化,故A错误; B.NaHCO3晶体是离子晶体,由Na+与HCO3-构成,HCO3-中含有共价键,HCOONa晶体是离子晶体,由Na+与HCOO-构成,HCOO-中含有共价键,故B正确; C.储氢过程中C元素的化合价由+4降低为+2,NaHCO3被还原,故C错误; D.储氢释氢,释氢过程中,每消耗0.1molH2O放出0.1mol的H2,只有在标准状况下0.1mol的H2为2.24L,该题未指明在标准状况下,所以0.1mol的H2不一定为2.24L,故D错误; 故选B.
4、解:A、燃烧热是指1mol可燃物完全燃烧生成稳定的化合物时所放出的能量,气态水不属于稳定的化合物,故A错误; B、合成氨反应是可逆的,所以0.5mol?N2完全反应时放出的热量应该大于19.3kJ,故B错误; C、一水合氨是弱电解质,离子方程式中要用化学式表示,故C错误; D、Al2O3与碱反应在溶液中是以Al(OH)4-的形式存在,故D正确; 故选D.
5、解:A、生成物的总能量低于反应总能量的反应,是放热反应,若是吸热反应则相反,故A错; B、反应速率与反应是吸热还是放热没有必然的联系,故B错; C、化学反应的反应热大小取决于反应物和生成物的总能量大小,与反应途径无关,应用盖斯定律,可计算某些难以直接测量的反应焓变,故C正确; D、根据△H=生成物的焓-反应物的焓可知,焓变与反应条件无关,在光照和点燃条件下该反应的△H相同,故D错. 故选:C.
6、A、存在能量转化形式有太阳能、机械能、化学能、电能,则不只是三种,故A错误; B、装置Y为燃料电池,正极电极反应式是O2+2H2O+4e-=4OH-,故B错误; C、由装置X可知,水分解生成氢气和氧气,燃料电池的原料是氢气和氧气,则能实现燃料电池的燃料和氧化剂再生,故C正确; D、太阳能电池白天发出的直流电一部分供工作马达运转,富余的电力通过装置X进行水的电解,生成氢气和氧气,夜间再通过装置Y燃烧氢氧来发电,以继续支持工作马达运转.装置X和Y实际上是存储了部分太阳能电池产生的电能.该系统能量并非完全转化,故D错误; 故选:C.
二、填空题
解:(1)A、t1时正反应速率仍然在变化,说明没有达到平衡状态,故A错误; B、t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,故B正确; C、t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故C错误; D、t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,故D正确; 故选BD; (2)已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol① 2NO2(g)?N2O4(g)△H2=-56.9kJ/mol② H2O(g)=H2O(l)△H=-44.0kJ/mol③ 根据盖斯定律,①-②+④×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol 即CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol, 故答案为:CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol; (3)①反应前气体的化学计量数为4,反应后计量数之和为5,正反应是混乱度增加的反应,所以△S>0;根据①、②图象可知,达到平衡后升高温度后,氮氧化物的转化率减小,说明升高温度平衡向着逆向移动,正反应为放热反应,△H<0, 故答案为:>;<;?????? ②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则反应NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)的 故答案为:;? ③A.催化剂不会影响转化率,只影响反应速率,所以第②种催化剂和第①种催化剂对转化率没有影响,故A错误; B.该反应为体积增大的反应,增大压强,平衡向着逆向移动,所以压强对脱氮率有影响,故B错误; C.由图象可知,催化剂①、②分别适合于250℃和450℃左右脱氮,其催化活性最好,故C正确; 故选C; (4)以NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,二氧化氮在负极失电子发生氧化反应,元素化合价升高为+5价,其氧化物为N2O5,发生的电极反应为:NO2+NO3--e-=N2O5, 故答案为:NO2+NO3--e-=N2O5; (5)由题目信息可知,NO、NO2与尿素反应生成CO2和N2,反应方程式为:NO+NO2+CO(NH2)2=CO2+2N2+2H2O, ????? NO+NO2?~CO(NH2)2 ???? (30+46)g??? 1mol 1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1: 1)的质量为76g, 故答案为:76.
2、解:(1)因催化剂能加快化学反应速度率,缩短达到平衡的时间,化学平衡不移动,所以②为使用催化剂;因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,故答案为:②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变;③温度升高;达到平衡的时间缩短,平衡时A的浓度减小; (2)实验②平衡时B的转化率为; 根据?????????????? A+2B?C ??初始 (mol/L)??? 0.1???? 0.2????????0?????? ? 转化 (mol/L)?? 0.06???? 0.12????? 0.06??? ? 平衡(mol/L)??? 0.04???? 0.08????? 0.06???? 平衡时C的浓度为0.06mol/L, 故答案:40%;0.06mol/L; (3)因③温度升高,化学平衡向吸热的方向移动,平衡时A的浓度减小,说明正反应方向吸热,故答案为:吸热;升高温度向正方向移动,故该反应是吸热反应. (4)因vA=△C/△t==0.007mol(L?min)-1,所以vB=2vA=0.014mol(L?min)-1; 同理vC=0.008mol(L?min)-1, 故答案为:0.014mol(L?min)-1;0.008mol(L?min)-1.
三、解答题
解:(1)①A、因未指明速率的方向,无法确定正逆反应速率的关系,故A错误; B、该反应是气体体积增大的反应,故当容器内压强不变时,已达到平衡,故B正确; C、该反应是气体质量增大的反应,故当密闭容器中混合气体的密度不变,已达到平衡,故C正确; D、因反应物(NH2COONH4)是固体物质,所以密闭容器中NH3的体积分数始终不变,为2/3,故D错误; 故选:BC; ②容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为3.2×10-3?mol/L、1.6×10-3?mol/L,代入平衡常数表达式:K=(3.2×10-3)2×1.6×10-3?=1.6×10-8,故答案为:1.6×10-8; ③压缩容器体积,气体压强增大,平衡向逆向移动,氨基甲酸铵质量增加,故答案为:增加;? ④从表中数据可以看出,随着温度升高,气体的总浓度增大,平衡正向移动,则该反应为吸热反应,△H>0;反应中固体变为气体,混乱度增大,△S>0,故答案为:>;>;
(2)①化学反应速率,故答案为:0.05mol/(L?min); ②因25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大,故答案为:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
