第1章《原子结构元素周期律》强化基础(含解析)2022--2023学年下学期高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第1章《原子结构元素周期律》强化基础(含解析)2022--2023学年下学期高一化学鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 665.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-03 07:24:49 | ||
图片预览



文档简介
第1章《原子结构 元素周期律》强化基础
一、单选题
1.下列说法中正确的是( )
A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B.同一周期中(除第一周期外),从左到右,各元素原子核的电子数都是从1个逐渐增加到8个
C.第二、三周期上下相邻元素的原子核外电子数相差8个
D.第七周期只有23种元素
2.化学与生活密切有关,下列说法不正确的是
A.高纯硅用于生产光导纤维 B.氢氧化铝可作胃酸的中和剂
C.Fe2O3常用作红色油漆和涂料 D.NaHCO3在食品工业中可作为焙制糕点的膨松剂
3.下列递变规律正确的是
A.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
B.Na、Mg、Al、Si的金属性逐渐增强
C.O、S、Na、K的原子半径依次增大
D.HF、HCl、H2S、PH3的稳定性依次增强
4.下列元素的原子半径最小的是
A.F B.Al C.S D.Cl
5.下列说法不正确的是
A.传统的无机非金属材料主要是指玻璃、水泥、陶瓷等硅酸盐材料
B.碳纳米材料属于新型无机非金属材料,主要包括富勒烯、碳纳米管、石墨烯等
C.硅酸钠溶液可以保存在具有磨口玻璃塞的试剂瓶中
D.大多数硅酸盐结构复杂,具有硬度高、难溶于水、耐高温、耐腐蚀等特点
6.我国拥有自主知识产权的硅衬底高光效氮化镓发光二极管(简称LED)技术,已广泛用于照明、显像等多个领域。氮元素、镓元素的原子结构示意图及镓在元素周期表中的信息如图所示,下列说法不正确的是
A.氮元素位于元素周期表的第二周期
B.镓原子与镓离子质量几乎相等
C.镓的相对原子质量为69.72
D.一个Ga3+有34个电子
7.下列有关化学试剂在实验室中的保存方法 正确的是
A.少量钠用石蜡封存 B.用塑料瓶保存氢氟酸
C.用无色透明试剂瓶保存氯水 D.用磨口玻璃塞的试剂瓶保存氢氧化钠溶液
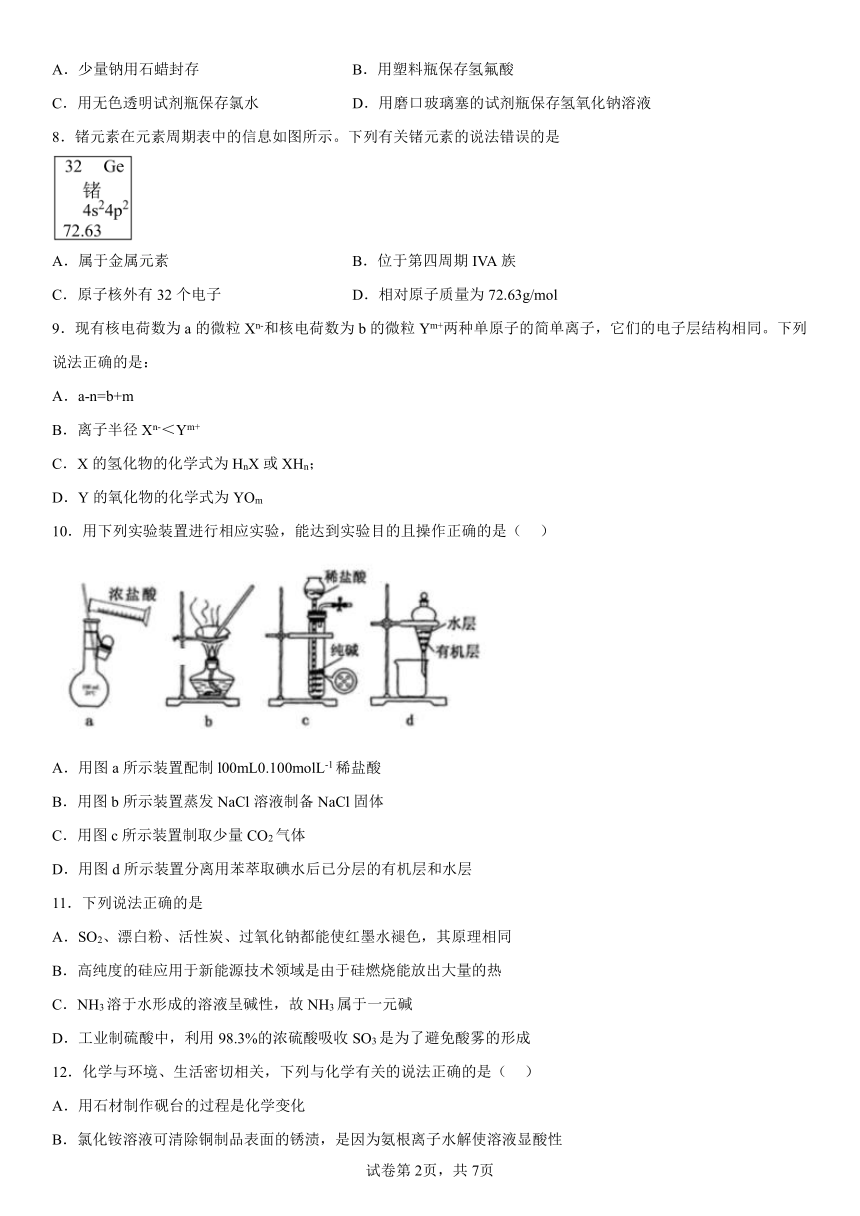
8.锗元素在元素周期表中的信息如图所示。下列有关锗元素的说法错误的是
A.属于金属元素 B.位于第四周期IVA族
C.原子核外有32个电子 D.相对原子质量为72.63g/mol
9.现有核电荷数为a的微粒Xn-和核电荷数为b的微粒Ym+两种单原子的简单离子,它们的电子层结构相同。下列说法正确的是:
A.a-n=b+m
B.离子半径Xn-<Ym+
C.X的氢化物的化学式为HnX或XHn;
D.Y的氧化物的化学式为YOm
10.用下列实验装置进行相应实验,能达到实验目的且操作正确的是( )
A.用图a所示装置配制l00mL0.100molL-1稀盐酸
B.用图b所示装置蒸发NaCl溶液制备NaCl固体
C.用图c所示装置制取少量CO2气体
D.用图d所示装置分离用苯萃取碘水后已分层的有机层和水层
11.下列说法正确的是
A.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色,其原理相同
B.高纯度的硅应用于新能源技术领域是由于硅燃烧能放出大量的热
C.NH3溶于水形成的溶液呈碱性,故NH3属于一元碱
D.工业制硫酸中,利用98.3%的浓硫酸吸收SO3是为了避免酸雾的形成
12.化学与环境、生活密切相关,下列与化学有关的说法正确的是( )
A.用石材制作砚台的过程是化学变化
B.氯化铵溶液可清除铜制品表面的锈渍,是因为氨根离子水解使溶液显酸性
C.月饼因为富含油脂而易发生氧化,保存时常放入装有硅胶的透气袋
D.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
13.2022年12月7日国务院联防联控机制发布《新冠病毒感染者居家治疗指南》,为新冠病毒感染者居家治疗提供参照。下列相关说法错误的是
A.家庭使用的玻璃体温计中含有副族元素汞
B.连花清瘟胶囊成分中的石膏属于混合物
C.止咳祛痰药盐酸氨溴索中含有两种卤族元素
D.医用酒精凝胶中的乙醇属于有机化合物
14.著名科学家张青莲教授主持测定了铟、铱、锑、铕等几种元素的相对原子质量新值,其中他测定核电荷数为63的铕元素的相对原子质量的新值为152。则下列说法正确的是( )
A.铕元素的原子质子数为63 B.铕元素的原子中子数为63
C.铕元素的原子核外电子数为152 D.铕元素的原子的质量为152
二、填空题
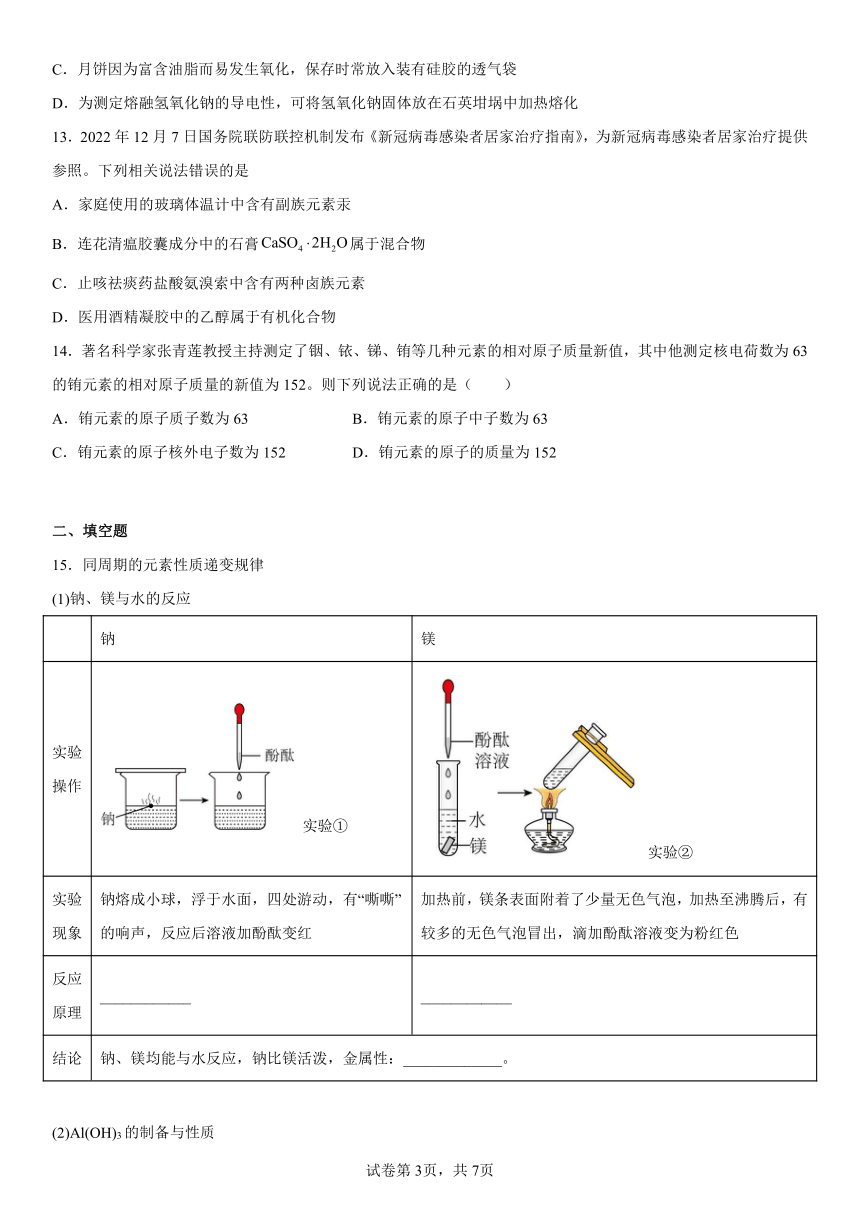
15.同周期的元素性质递变规律
(1)钠、镁与水的反应
钠 镁
实验操作 实验① 实验②
实验现象 钠熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红 加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为粉红色
反应原理 ____________ ____________
结论 钠、镁均能与水反应,钠比镁活泼,金属性:_____________。
(2)Al(OH)3的制备与性质
实验探究:
①向AlCl3溶液中加入足量氨水,现象为__________,反应的离子方程式为__________;
②将①实验得到的沉淀分装两支试管中,一支试管中加入盐酸,现象为__________,离子方程式为_________;另一支试管中加入NaOH溶液,现象为________,离子方程式为______________。
③向MgCl2溶液加入过量NaOH溶液,现象_________,离子方程式为_____________。
两性氢氧化物:既能与酸反应又能与强碱反应,且均生成盐和水的氢氧化物。如 Al(OH)3。
(3)第三周期递变规律
①第三周期的Na、Mg、Al的金属性逐渐__________,NaOH、Mg(OH)2、Al(OH)3的碱性逐渐__________,NaOH为强碱,Mg(OH)2为中强碱,Al(OH)3为两性氢氧化物。
②第三周期的Si、P、S、Cl的非金属性逐渐__________,H3SiO3、H3PO4、H2SO4、HClO4的酸性逐渐__________。HClO4是最强的含氧酸,H2SiO3为难溶的弱酸,H3PO4为中强酸,H2SO4为强酸。
③同一周期从左到右,原子半径逐渐__________,失电子能力逐渐__________,得电子能力逐渐__________,金属性逐渐__________,非金属性逐渐__________。
16.元素周期表体现了元素“位—构—性”的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:
(1)元素Ga在元素周期表中的位置为:第_______周期第_______族;
(2)Sn的最高正价为_______,Cl的最高价氧化物对应的水化物的化学式为_______,Bi的最高价氧化物为_______;
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最强的是_______元素(填元素符号);
②H3AsO4、H2SeO4的酸性强弱:H3AsO4_______(填“>”“<”或“=”)H2SeO4;
③氢化物的还原性:H2O_______(填“>”“<”或“=”)H2S;
(4)Al的最高价氧化物可以和S的最高价氧化物的水化物反应,其反应方程式为_______。
17.下图是短周期元素①~⑤在元素周期表中的位置。
(1)②在周期表中的位置是第___________周期第___________族,其与反应的化学方程式是___________。
(2)③的一种核素的中子数是10,表示该核素的符号是___________。
(3)非金属性:④___________⑤(填“>”或“<”),从原子结构角度解释其原因:___________。
(4)②、⑤两种元素形成的化合物有重要的用途,用电子式表示它的形成过程___________。
(5)下列关于①的说法正确的是___________。
a、原子结构示意图为
b、在同周期中,①最高价氧化物的水化物的碱性最强
c、在同主族的元素中,①的金属性最强
18.下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
(1)①的元素符号是_________;
(2)②的原子结构示意图是_________;
(3)①和③的原子半径大小关系是:①____③(填“>”、“<”或“=”);
(4)③、④和⑤中,最高价氧化物对应的水化物酸性最强的酸的化学式是____________。
正误判断
19.1mol羟基中电子数为10NA。(_______)
20.1.7gH2O2中含有电子数为0.9NA。(_______)
21.3g3He含有的中子数为1NA。(_______)
22.24g镁的原子最外层电子数为NA。(_______)
23.新的课程理念要求普及科学知识,提高公民素养,让知识走进社会、走进生活,充分体现化学的社会价值,下面是两则生活中的化学知识,请按要求作答:
(1)硅及其化合物在无机非金属材料中一直扮演着主要的角色,则:
①有下列物品或设备:
a.陶瓷餐具 b.门窗玻璃 c.硅太阳能电池 d.水晶镜片
e.计算机芯片 f.石英光导纤维
用到硅单质的是__________(填字母标号,下同)。
所用材料为SiO2或要用到SiO2的是___________。
所用材料为硅酸盐的是___________。
②赏心悦目的雕花玻璃是用下列物质中的一种对玻璃进行刻蚀而制成的,这种物质是________。
A.盐酸 B.氢氟酸 C.烧碱 D.纯碱
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式C6H12O6)的水溶液,其标签上的部分内容如图所示,利用标签所提供的信息,回答下列问题:
①该注射液中葡萄糖的摩尔质量为:_______________
②该注射液中葡萄糖的物质的量浓度为:______________
③如果要配制一定物质的量浓度的葡萄糖溶液250mL,所需仪器除了托盘天平、药匙、烧杯、玻璃棒、胶头滴管外,还缺少的仪器是___________
24.配平化学反应方程式并标出电子转移的方向和总数:
____Fe(NO3)3 + ____NaOH + ___Cl2 → ___Na2FeO4 + ____NaNO3 + ___NaCl + ____H2O
(1)___________
(2)上述反应中______元素被氧化,发生还原反应的物质是_________
(3)写出铁元素在元素周期表中的位置是第______周期第____________族
(4)写出上述反应中还原产物的电子式___________________
(5)若反应中转移了0.1 mol电子,则消耗了_______L Cl2(标准状况)。
25.FeCl3是一种用途比较广泛的铁盐。
(1)印刷电路板是由高分子材料和铜箔复合而成的,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,请写出该反应的离子方程式:___________________。
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速率高于铝盐,是城市污水和工业废水处理的高效絮凝剂.实验中制取氢氧化铁胶体的方法是_______(填序号)。
①向FeCl3溶液中加入足量的NaOH溶液;
②将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体;
③将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色沉淀;
含有Fe3+的盐溶液遇到___________溶液时变成红色,我们可以利用这一反应检验Fe3+的存在。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式为2FeCl3+2KI=2FeCl2+I2+2KCl,用双线桥法标出该反应中电子转移的方向和数目__________________________
将一定量的CCl4加入上述反应后的溶液中,振荡、静置后会发现下层液体为__________色,再将混合液倒入_________(填仪器名称)中,可将两层液体分离。
26.钴具有广泛用途,其正三价化合物具有强氧化性。利用含钴废料(主要成分为Co3O4,还含有少量的铝箔、LiCoO2等杂质)制备碳酸钴的工艺流程如下图所示:
(1)Co2+萃取的反应原理如下:Co2++2HR(有机层)CoR2+2H+,则从有机相中分离出CoSO4需向有机溶剂中加入以下哪种试剂__________ (填选项字母)。
A.H2SO4 B.NaOH C.Co(OH)2 D.HR
(2)“沉钴”时,Na2CO3的滴速过快或浓度太大,可生成碱式碳酸钴(CoCO3)2·3Co(OH)2沉淀,会导致产品不纯。生成(CoCO3)2·3Co(OH)2沉淀的化学方程式为__________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.某微粒核外电子排布为2、8、8结构,则该微粒可能为氩原子、氯离子、钾离子等,故A错误;
B.最外层电子数不能超过8个,但长周期中最外层电子数没有明显的递增规律,如第四周期钙、钪、钛等最外层电子数均为2,故B错误;
C.第二、三周期各有8种元素,上下相邻的元素为同主族元素,则上下相邻的元素的原子核外电子数相差8个,故C正确;
D.第七周期包括锕系元素,若排满为32种元素,故D错误;
答案为C。
2.A
【详解】A. 二氧化硅有良好的光学性能,用于制作光导纤维,单晶硅用于制作芯片,故A错误;
B. 氢氧化铝能与HCl反应,而且没有腐蚀性,所以氢氧化铝可作胃酸的中和剂,故B正确;
C. 氧化铁为红棕色,氧化铁可以作红色油漆和涂料,故C正确;
D. 碳酸氢钠不稳定受热分解生成气体,在制作食品时加碳酸氢钠会使食品疏松多孔,故D正确;
答案选A。
3.C
【详解】A、同周期元素从左到右金属性逐渐减弱,同主族元素从上到下金属性逐渐增强,金属性越强,对应的最高价氧化物的水化物的碱性越强,故碱性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3,故A错误;
B、Si是非金属元素,无金属性,故B错误;
C、同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,原子半径:OD、非金属性越强,气态氢化物越稳定,非金属性:F>Cl>S>P,故稳定性:HF>HCl>H2S>PH3,故D错误;
答案选C。
4.A
【详解】Al、S、Cl为同周期元素,同周期元素的原子半径从左到右逐渐减小,F、Cl为同主族元素,同主族元素的原子半径从上到下逐渐增大,则原子半径最小的是F;
答案选A。
5.C
【详解】A.传统的无机非金属材料多为硅酸盐材料,主要是指陶瓷、玻璃、水泥,故A正确;
B.碳纳米材料为新型无机非金属材料,包含富勒烯、碳纳米管、石墨烯等,故B正确;
C.硅酸钠溶液是一种无机粘合剂,能将玻璃塞和瓶体粘在一起,不便于打开,所以硅酸钠不可以保存在磨口玻璃塞试剂瓶中,故C错误;
D.硅酸盐属于离子晶体,因此具有熔点高、硬度大的特点;大多数硅酸盐难溶于水;大多数硅酸盐化学性质稳定,因此其耐高温、耐腐蚀,故D正确;
故选:C。
6.D
【详解】A.氮元素原子核外电子层数是2,位于元素周期表的第二周期,A项正确;
B.镓原子与镓离子质量几乎相等,这是因为电子相对于质子、中子来说,质量很小,B项正确;
C.镓的相对原子质量是69.72,C项正确;
D.阳离子由原子失电子形成,所以一个Ga3+有31-3=28个电子,D项错误;
故选D。
7.B
【分析】钠能够与空气中氧气和水反应;氢氟酸能够与玻璃中二氧化硅反应;依据氯水中次氯酸见光分解的性质判断;氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住。
【详解】A、钠能够与空气中氧气和水反应,少量钠通常保存在煤油中,故A不选;
B、氢氟酸能够与玻璃中二氧化硅反应,所以不能用玻璃瓶盛放,应用塑料瓶盛放,故B选;
C、氯水中次氯酸见光分解,所以氯水用棕色瓶保存,故C不选;
D、氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住,所以不能用磨口玻璃塞的试剂瓶保存氢氧化钠溶液,故D不选。
答案选B。
【点睛】本题考查化学试剂的保存,注意化学试剂的保存与物质的性质有关,学习中注意相关知识的积累。
8.D
【详解】A. 锗元素带“钅”字旁,属于金属元素,故A不选;
B. 锗原子有4个电子层,最外层有4个电子,位于第四周期IVA族,故B不选;
C. 原子序数是32号,原子核外有32个电子,故C不选
D. 相对原子质量的单位不是“g/mol”而是“1”,通常省略不写,故D选;
故选D。
9.C
【详解】核电荷数为a的微粒Xn-和核电荷数为b的微粒Ym+两种单原子的简单离子,它们的电子层结构相同;Xn-是原子得到n个电子得到的,其核外电子数为a+n;Ym+是Y原子失去m个电子得到的,其核外电子数为b-m;则a+n=b-m。
A、它们的关系式为a+n=b-m,选项A错误;
B、具有相同电子层结构的离子,核电荷数越大半径越小,故离子半径Xn- >Ym+,选项B错误;
C、Xn-带n个单位的负电荷,其元素化合价为-n价,氢元素显+1价,其氢化物化学式为HnX或XHn,选项C正确;
D、Ym+带m个单位的正电荷,其元素化合价为+m价,氧元素显-2价,其氧化物化学式为Y2Om,选项D错误。
答案选C。
【点睛】掌握元素在周期表中的相对位置关系、原子和离子之间的相互转化、原子的最外层电子数与主要化合价之间的关系等是正确解答本题的关键。
10.B
【详解】A. 浓盐酸应稀释后转移到容量瓶中,不能直接转移到容量瓶中,容量瓶不能直接溶解或稀释溶液,故A错误;
B. 图b所示为蒸发装置,NaCl为强酸强碱盐,不水解,通过蒸干NaCl溶液可制备NaCl固体,故B正确;
C. 纯碱为粉末固体且易溶于水,关闭止水夹不能使固、液分离,且盐酸易挥发,则不能利用图中装置制取少量纯净的CO2气体,故C错误;
D. 苯和水互不相溶,可用分液分离,但苯的密度比水小,有机层在上,水层在下,故D错误;
答案选B。
11.D
【详解】A.漂白粉、过氧化钠具有强氧化性,活性炭具有吸附性,二氧化硫与有色物质化合体现其漂白性,漂白原理不完全相同,A错误;
B.高纯度的硅应用于新能源技术领域是由于硅具有良好的半导体性能,B错误;
C.氨气不是一元碱,氨气与水反应生成一水合氨,一水合氨为一元碱,C错误;
D.在吸收塔中三氧化硫和水反应生成硫酸,但水直接吸收三氧化硫会形成酸雾,使三氧化硫的吸收率降低,故可利用98.3%的浓硫酸吸收SO3是为了避免酸雾的形成,D正确;
故选D。
12.B
【详解】A.用石材制作砚台的过程没有新物质生成,属于物理变化,故A错误;
B.氨根离子水解使溶液显酸性,酸性溶液可以用来除锈,故B正确;
C.硅胶具有吸水性,可作食品包装中的硅胶为干燥剂,但硅胶没有还原性、不能除去月饼包装袋中的氧气,可放入装有铁粉的透气袋,故C错误;
D.石英坩埚中含有二氧化硅,二氧化硅能和氢氧化钠发生反应,故D错误;
故答案选B。
13.B
【详解】A.汞为第ⅡB族元素,A正确;
B.为结晶水合物,为纯净物,B错误;
C.盐酸氨溴索中含有氯()和溴()两种卤族元素,C正确;
D.乙醇()属于有机化合物,D正确;
故选B。
14.A
【详解】A.原子的质子数=核电荷数=63,故A正确;
B.中子数=质量数-质子数=152-63=89,故B错误;
C.原子核外电子数=核电荷数=63,故C错误;
D.铕元素原子的质量是指实际质量,单位为g,该题中无法判断,故D错误;
故答案为A。
【点睛】原子符号的左上角数字表示质量数,左下角数字为质子数,质量数=质子数+中子数; 质子数=原子序数=核电荷数=原子核外电子数。
15.(1) 2Na+2H2O=2NaOH+H2↑ Mg+2H2OMg(OH)2↓+H2↑ 金属性:Na>Mg
(2) 产生白色沉淀 Al3++3NH3·H2O=Al(OH)3↓+3NH 白色沉淀逐渐溶解 Al(OH)3+3H+=Al3++3H2O 白色沉淀逐渐溶解 Al(OH)3+OH-=AlO+2H2O 产生白色沉淀 Mg2++2OH-=Mg(OH)2↓
(3) 减弱 减弱 增强 增强 减小 减弱 增强 减弱 增强
【详解】(1)钠和水常温下剧烈反应生成碱和气体,化学方程式2Na+2H2O=2NaOH+H2↑,镁常温下和水不反应,加热时剧烈反应,生成碱和气体,化学方程式Mg+2H2OMg(OH)2↓+H2↑,金属单质和水或酸反应越剧烈,金属的金属性越强,所以金属性:Na>Mg,答案:2Na+2H2O=2NaOH+H2↑;Mg+2H2OMg(OH)2↓+H2↑;金属性:Na>Mg;
(2)向AlCl3溶液中加入足量氨水,生成白色沉淀,Al3++3NH3·H2O=Al(OH)3↓+3 ,氢氧化铝不溶于氨水。实验得到的沉淀分装两支试管中,一支试管中加入盐酸,白色沉淀逐渐溶解,生成盐和水,离子方程式为Al(OH)3+3H+=Al3++3H2O;另一支试管中加入NaOH溶液,白色沉淀逐渐溶解,生成偏铝酸盐和水,离子方程式为Al(OH)3+OH-=AlO+2H2O。向MgCl2溶液加入过量NaOH溶液,产生白色沉淀,离子方程式为Mg2++2OH-=Mg(OH)2↓。答案:产生白色沉淀;Al3++3NH3·H2O=Al(OH)3↓+3NH;白色沉淀逐渐溶解;Al(OH)3+3H+=Al3++3H2O;白色沉淀逐渐溶解;Al(OH)3+OH-=AlO+2H2O;产生白色沉淀;Mg2++2OH-=Mg(OH)2↓;
(3)第三周期的Na、Mg、Al的金属性逐渐减弱,最高价氧化物的水化物NaOH、Mg(OH)2、Al(OH)3的碱性逐渐减弱,NaOH为强碱,Mg(OH)2为中强碱,Al(OH)3为两性氢氧化物。第三周期的Si、P、S、Cl的非金属性逐渐增强,最高价氧化物的水化物H2SiO3、H3PO4、H2SO4、HClO4的酸性逐渐增强。HClO4是最强的含氧酸,H2SiO3为难溶的弱酸,H3PO4为中强酸,H2SO4为强酸。同一周期从左到右,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。答案:减弱;减弱;增强;增强;减小;减弱;增强;减弱; 增强。
16. 四 ⅢA +4 HClO4 Bi2O5 F < < Al2O3+3H2SO4 =Al2(SO4)3+3H2O
【详解】(1)Ga和Al同主族,在Al的下一个周期,即第四周期,低ⅢA族,故答案为:四;ⅢA;
(2)Sn和碳同主族,最高价是+4价,Cl的最高价是+7价,最高价氧化物对应水化物的化学式为HClO4;Bi和N元素同主族,所以最高正价是+5价,最高价氧化物为Bi2O5,故答案为:+4;HClO4;Bi2O5;
(3)①同主族元素从上到下,氢化物稳定性减弱,同周期元素从右到左,氢化物稳定性减弱,所以阴影部分元素氢化物热稳定性最高的是F,故答案为:F;
②As和Se同一周期,同周期元素从右到左,最高价含氧酸的酸性减弱,所以H3AsO4、H2SeO4的酸性强弱:H3AsO4<H2SeO4,故答案为:<;
③氢化物的还原性:H2O<H2S,故答案为:<;
(4)Al的最高价氧化物Al2O3可以和S的最高价氧化物的水化物H2SO4反应,其反应方程式为:Al2O3+3H2SO4 =Al2(SO4)3+3H2O。
17.(1) 三 ⅠA 2Na+2H2O=2NaOH+H2↑
(2)
(3) > 两种元素位于同一主族,最外层电子数相同,电子层数F<Cl,原子半径F<Cl,得电子能力F>Cl,非金属性F>Cl
(4)
(5)ab
【分析】根据短周期元素①~⑤在元素周期表中的位置可判断分别是Li、Na、O、F、Cl,据此解答。
【详解】(1)②是Na,在周期表中的位置是第三周期第ⅠA族,钠与反应的化学方程式是2Na+2H2O=2NaOH+H2↑。
(2)氧元素的一种核素的中子数是10,质量数是8+10=18,则表示该核素的符号是。
(3)同主族从上到下非金属性逐渐减弱,则非金属性:F>Cl,这是由于F、Cl为同主族元素,随原子序数的递增,原子半径增大,得电子能力减弱,非金属性减弱。
(4)②、⑤两种元素形成的化合物是氯化钠,属于离子化合物,则用电子式表示它的形成过程为。
(5)a、Li的原子序数是3,其原子结构示意图为,a正确;
b、在同周期中Li是最活泼的金属,所以Li的最高价氧化物的水化物的碱性最强,b正确;
c、同主族从上到下金属性逐渐增强,则在同主族的元素中,Li的金属性最弱,c错误;
答案选ab。
18. C < H2SO4
【分析】从元素周期表中可知,①为C;②为O;③为Si;④为P;⑤为S。
【详解】(1)①位于第二周期第ⅣA族,为碳元素,其符号为C;故答案为:C;
(2)②位于第二周期第ⅥA族,为氧元素,其原子结构示意图为:,故答案为:;
(3)①为碳元素,③为硅元素,位于同一主族,根据同一主族元素,从上到下,原子半径增大,其原子半径大小关系是:r(C)(4)③为Si、④为P、⑤为S,其最高价氧化物对应的水化物分别为:H2SiO3、H3PO4、H2SO4,同一周期,从左到右,最高价氧化物对应的水化物酸性增强,所以最强的酸为:H2SO4,故答案为:H2SO4。
【点睛】
19.错误 20.正确 21.正确 22.错误
【解析】19.1个-OH中含有9个电子,1 mol羟基中电子数为9 NA,故错误。
20.1个H2O2分子中含有18个电子,1.7 g H2O2是0.05mol,则含有电子数为0.9 NA,故正确。
21.3He的中子数为3-2=1,则3g3He的中子数为=1NA,故正确。
22.24 g镁是1mol,其原子最外层电子数为2NA,故错误。
23.(1) ce bdf a B
(2) 180g/mol 0.3mol/L 250ml容量瓶
【详解】(1)①硅为良好的半导体材料,可用于制太阳能电池、计算机芯片;所用材料为SiO2或要用到SiO2的是:门窗玻璃(原料有二氧化硅、成分含有二氧化硅)、水晶镜片、石英光导纤维;所用材料为硅酸盐的是陶瓷餐具。
因此用到硅单质的是ce;
所用材料为SiO2或要用到SiO2的是bdf;
所用材料为硅酸盐的是a;
②氢氟酸与玻璃中的SiO2会发生反应:SiO2+4HF=SiF4↑+2H2O,因此可用于雕刻赏心悦目的雕花玻璃的是氢氟酸,故合理选项是B。
(2)①当摩尔质量以g/mol为单位时,数值上等于该物质的相对分子质量,葡萄糖相对分子质量是180,所以葡萄糖的摩尔质量是180g/mol;
②根据n=可计算葡萄糖的物质的量n==0.15mol,再由c==0.3mol/L;
③根据准确配制一定物质的量浓度的溶液需要使用的仪器,可知如果要配制一定物质的量浓度的葡萄糖溶液250mL,所需仪器除了托盘天平、药匙、烧杯、玻璃棒、胶头滴管外,还缺少的仪器是250mL的容量瓶。
24.(1)
(2) +3价的铁 Cl2
(3) 四 VIII
(4)
(5)1.12
【分析】用化合价升降法配平。在该反应中Fe元素的化合价由Fe(NO3)3中的+3价升至Na2FeO4中的+6价,1molFe(NO3)3参与反应失去3mol电子生成1molNa2FeO4;Cl元素的化合价由0价降至NaCl中的-1价,1molCl2参与反应得到2mol电子生成2molNaCl;根据得失电子守恒、原子守恒配平方程式。对比氧化还原反应的概念作答。
【详解】(1)在该反应中Fe元素的化合价由Fe(NO3)3中的+3价升至Na2FeO4中的+6价,1molFe(NO3)3参与反应失去3mol电子生成1molNa2FeO4;Cl元素的化合价由0价降至NaCl中的-1价,1molCl2参与反应得到2mol电子生成2molNaCl;根据得失电子守恒、原子守恒,配平后的方程式为2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+8H2O。电子转移方向和数目为:;
(2)上述反应中Fe元素化合价升高,+3价的Fe元素被氧化。Cl元素的化合价降低,发生还原反应的物质是Cl2;
(3)Fe的原子结构示意图为,铁元素在元素周期表中的位置是第4周期第VIII族;
(4)上述反应中还原产物为NaCl,NaCl的电子式为;
(5)根据上述分析每消耗1molCl2转移2mol电子,若反应中转移了0.1mol电子,消耗Cl2物质的量为0.05mol,消耗Cl2在标准状况下的体积为0.05mol22.4L/mol=1.12L。
25. 2Fe3++Cu=2Fe2++Cu2+ ② KSCN 紫(或紫红) 分液漏斗
【分析】(1)已知反应物和生成物,根据得失电子守恒、电荷守恒、元素守恒配平;
(3)先确定变价元素、根据化合价变化和物质的量计算转移电子数目,再根据化合价升高失电子,化合价降低得电子,确定电子转移的方向。
【详解】(1)FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,该离子反应为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体,从而制得氢氧化铁胶体,则应选②,利用KSCN检验铁离子,溶液为血红色,故答案为②;KSCN;
(3)2FeCl3+2KI=2FeCl2+I2+2KCl中,Fe元素的化合价降低,I元素的化合价升高,则电子转移的方向和数目为;向反应后的溶液中加入CCl4,碘单质更易溶于CCl4,且CCl4密度比水的密度大,则振荡、静置后,碘的CCl4溶液在下层,颜色为紫色(或紫红色),然后用分液漏斗分离,故答案为:;分液漏斗。
26.(1)A
(2)5CoSO4+5Na2CO3+3H2O=5Na2SO4+(CoCO3)2·3Co(OH)2↓+3CO2↑或5CoSO4+8Na2CO3+6H2O=5Na2SO4+(CoCO3)2·3Co(OH)2↓+6NaHCO3
【分析】“碱浸”过程中,Co3O4和LiCoO2不与碱反应存在于滤渣中,Al在碱性溶液中发生反应生成NaAlO2,滤液①主要成分为NaAlO2,滤渣中加入硫酸和过氧化氢发生反应使滤渣溶解,过滤后加入有机磷萃取,得到有机相和无机相,有机相反萃取后加入Na2CO3沉钴,得到CoCO3,以此解答。
(1)
反萃取即使萃取平衡向逆向移动,根据平衡移动原理,在不引入新杂质的情况下可加入H2SO4,使平衡逆向移动,从而达到反萃取目的,故A正确;
(2)
“反萃取”后的“滤液3”中含有CoSO4,继续加入Na2CO3可生成碱式碳酸钴(CoCO3)2 3Co(OH)2沉淀,为复分解反应,化学方程式为5CoSO4+5Na2CO3+3H2O=(CoCO3)2 3Co(OH)2↓+5Na2SO4+3CO2↑或5CoSO4+8Na2CO3+6H2O=(CoCO3)2 3Co(OH)2↓+5Na2SO4+6NaHCO3。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列说法中正确的是( )
A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B.同一周期中(除第一周期外),从左到右,各元素原子核的电子数都是从1个逐渐增加到8个
C.第二、三周期上下相邻元素的原子核外电子数相差8个
D.第七周期只有23种元素
2.化学与生活密切有关,下列说法不正确的是
A.高纯硅用于生产光导纤维 B.氢氧化铝可作胃酸的中和剂
C.Fe2O3常用作红色油漆和涂料 D.NaHCO3在食品工业中可作为焙制糕点的膨松剂
3.下列递变规律正确的是
A.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
B.Na、Mg、Al、Si的金属性逐渐增强
C.O、S、Na、K的原子半径依次增大
D.HF、HCl、H2S、PH3的稳定性依次增强
4.下列元素的原子半径最小的是
A.F B.Al C.S D.Cl
5.下列说法不正确的是
A.传统的无机非金属材料主要是指玻璃、水泥、陶瓷等硅酸盐材料
B.碳纳米材料属于新型无机非金属材料,主要包括富勒烯、碳纳米管、石墨烯等
C.硅酸钠溶液可以保存在具有磨口玻璃塞的试剂瓶中
D.大多数硅酸盐结构复杂,具有硬度高、难溶于水、耐高温、耐腐蚀等特点
6.我国拥有自主知识产权的硅衬底高光效氮化镓发光二极管(简称LED)技术,已广泛用于照明、显像等多个领域。氮元素、镓元素的原子结构示意图及镓在元素周期表中的信息如图所示,下列说法不正确的是
A.氮元素位于元素周期表的第二周期
B.镓原子与镓离子质量几乎相等
C.镓的相对原子质量为69.72
D.一个Ga3+有34个电子
7.下列有关化学试剂在实验室中的保存方法 正确的是
A.少量钠用石蜡封存 B.用塑料瓶保存氢氟酸
C.用无色透明试剂瓶保存氯水 D.用磨口玻璃塞的试剂瓶保存氢氧化钠溶液
8.锗元素在元素周期表中的信息如图所示。下列有关锗元素的说法错误的是
A.属于金属元素 B.位于第四周期IVA族
C.原子核外有32个电子 D.相对原子质量为72.63g/mol
9.现有核电荷数为a的微粒Xn-和核电荷数为b的微粒Ym+两种单原子的简单离子,它们的电子层结构相同。下列说法正确的是:
A.a-n=b+m
B.离子半径Xn-<Ym+
C.X的氢化物的化学式为HnX或XHn;
D.Y的氧化物的化学式为YOm
10.用下列实验装置进行相应实验,能达到实验目的且操作正确的是( )
A.用图a所示装置配制l00mL0.100molL-1稀盐酸
B.用图b所示装置蒸发NaCl溶液制备NaCl固体
C.用图c所示装置制取少量CO2气体
D.用图d所示装置分离用苯萃取碘水后已分层的有机层和水层
11.下列说法正确的是
A.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色,其原理相同
B.高纯度的硅应用于新能源技术领域是由于硅燃烧能放出大量的热
C.NH3溶于水形成的溶液呈碱性,故NH3属于一元碱
D.工业制硫酸中,利用98.3%的浓硫酸吸收SO3是为了避免酸雾的形成
12.化学与环境、生活密切相关,下列与化学有关的说法正确的是( )
A.用石材制作砚台的过程是化学变化
B.氯化铵溶液可清除铜制品表面的锈渍,是因为氨根离子水解使溶液显酸性
C.月饼因为富含油脂而易发生氧化,保存时常放入装有硅胶的透气袋
D.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
13.2022年12月7日国务院联防联控机制发布《新冠病毒感染者居家治疗指南》,为新冠病毒感染者居家治疗提供参照。下列相关说法错误的是
A.家庭使用的玻璃体温计中含有副族元素汞
B.连花清瘟胶囊成分中的石膏属于混合物
C.止咳祛痰药盐酸氨溴索中含有两种卤族元素
D.医用酒精凝胶中的乙醇属于有机化合物
14.著名科学家张青莲教授主持测定了铟、铱、锑、铕等几种元素的相对原子质量新值,其中他测定核电荷数为63的铕元素的相对原子质量的新值为152。则下列说法正确的是( )
A.铕元素的原子质子数为63 B.铕元素的原子中子数为63
C.铕元素的原子核外电子数为152 D.铕元素的原子的质量为152
二、填空题
15.同周期的元素性质递变规律
(1)钠、镁与水的反应
钠 镁
实验操作 实验① 实验②
实验现象 钠熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红 加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为粉红色
反应原理 ____________ ____________
结论 钠、镁均能与水反应,钠比镁活泼,金属性:_____________。
(2)Al(OH)3的制备与性质
实验探究:
①向AlCl3溶液中加入足量氨水,现象为__________,反应的离子方程式为__________;
②将①实验得到的沉淀分装两支试管中,一支试管中加入盐酸,现象为__________,离子方程式为_________;另一支试管中加入NaOH溶液,现象为________,离子方程式为______________。
③向MgCl2溶液加入过量NaOH溶液,现象_________,离子方程式为_____________。
两性氢氧化物:既能与酸反应又能与强碱反应,且均生成盐和水的氢氧化物。如 Al(OH)3。
(3)第三周期递变规律
①第三周期的Na、Mg、Al的金属性逐渐__________,NaOH、Mg(OH)2、Al(OH)3的碱性逐渐__________,NaOH为强碱,Mg(OH)2为中强碱,Al(OH)3为两性氢氧化物。
②第三周期的Si、P、S、Cl的非金属性逐渐__________,H3SiO3、H3PO4、H2SO4、HClO4的酸性逐渐__________。HClO4是最强的含氧酸,H2SiO3为难溶的弱酸,H3PO4为中强酸,H2SO4为强酸。
③同一周期从左到右,原子半径逐渐__________,失电子能力逐渐__________,得电子能力逐渐__________,金属性逐渐__________,非金属性逐渐__________。
16.元素周期表体现了元素“位—构—性”的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:
(1)元素Ga在元素周期表中的位置为:第_______周期第_______族;
(2)Sn的最高正价为_______,Cl的最高价氧化物对应的水化物的化学式为_______,Bi的最高价氧化物为_______;
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最强的是_______元素(填元素符号);
②H3AsO4、H2SeO4的酸性强弱:H3AsO4_______(填“>”“<”或“=”)H2SeO4;
③氢化物的还原性:H2O_______(填“>”“<”或“=”)H2S;
(4)Al的最高价氧化物可以和S的最高价氧化物的水化物反应,其反应方程式为_______。
17.下图是短周期元素①~⑤在元素周期表中的位置。
(1)②在周期表中的位置是第___________周期第___________族,其与反应的化学方程式是___________。
(2)③的一种核素的中子数是10,表示该核素的符号是___________。
(3)非金属性:④___________⑤(填“>”或“<”),从原子结构角度解释其原因:___________。
(4)②、⑤两种元素形成的化合物有重要的用途,用电子式表示它的形成过程___________。
(5)下列关于①的说法正确的是___________。
a、原子结构示意图为
b、在同周期中,①最高价氧化物的水化物的碱性最强
c、在同主族的元素中,①的金属性最强
18.下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
(1)①的元素符号是_________;
(2)②的原子结构示意图是_________;
(3)①和③的原子半径大小关系是:①____③(填“>”、“<”或“=”);
(4)③、④和⑤中,最高价氧化物对应的水化物酸性最强的酸的化学式是____________。
正误判断
19.1mol羟基中电子数为10NA。(_______)
20.1.7gH2O2中含有电子数为0.9NA。(_______)
21.3g3He含有的中子数为1NA。(_______)
22.24g镁的原子最外层电子数为NA。(_______)
23.新的课程理念要求普及科学知识,提高公民素养,让知识走进社会、走进生活,充分体现化学的社会价值,下面是两则生活中的化学知识,请按要求作答:
(1)硅及其化合物在无机非金属材料中一直扮演着主要的角色,则:
①有下列物品或设备:
a.陶瓷餐具 b.门窗玻璃 c.硅太阳能电池 d.水晶镜片
e.计算机芯片 f.石英光导纤维
用到硅单质的是__________(填字母标号,下同)。
所用材料为SiO2或要用到SiO2的是___________。
所用材料为硅酸盐的是___________。
②赏心悦目的雕花玻璃是用下列物质中的一种对玻璃进行刻蚀而制成的,这种物质是________。
A.盐酸 B.氢氟酸 C.烧碱 D.纯碱
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式C6H12O6)的水溶液,其标签上的部分内容如图所示,利用标签所提供的信息,回答下列问题:
①该注射液中葡萄糖的摩尔质量为:_______________
②该注射液中葡萄糖的物质的量浓度为:______________
③如果要配制一定物质的量浓度的葡萄糖溶液250mL,所需仪器除了托盘天平、药匙、烧杯、玻璃棒、胶头滴管外,还缺少的仪器是___________
24.配平化学反应方程式并标出电子转移的方向和总数:
____Fe(NO3)3 + ____NaOH + ___Cl2 → ___Na2FeO4 + ____NaNO3 + ___NaCl + ____H2O
(1)___________
(2)上述反应中______元素被氧化,发生还原反应的物质是_________
(3)写出铁元素在元素周期表中的位置是第______周期第____________族
(4)写出上述反应中还原产物的电子式___________________
(5)若反应中转移了0.1 mol电子,则消耗了_______L Cl2(标准状况)。
25.FeCl3是一种用途比较广泛的铁盐。
(1)印刷电路板是由高分子材料和铜箔复合而成的,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,请写出该反应的离子方程式:___________________。
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速率高于铝盐,是城市污水和工业废水处理的高效絮凝剂.实验中制取氢氧化铁胶体的方法是_______(填序号)。
①向FeCl3溶液中加入足量的NaOH溶液;
②将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体;
③将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色沉淀;
含有Fe3+的盐溶液遇到___________溶液时变成红色,我们可以利用这一反应检验Fe3+的存在。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式为2FeCl3+2KI=2FeCl2+I2+2KCl,用双线桥法标出该反应中电子转移的方向和数目__________________________
将一定量的CCl4加入上述反应后的溶液中,振荡、静置后会发现下层液体为__________色,再将混合液倒入_________(填仪器名称)中,可将两层液体分离。
26.钴具有广泛用途,其正三价化合物具有强氧化性。利用含钴废料(主要成分为Co3O4,还含有少量的铝箔、LiCoO2等杂质)制备碳酸钴的工艺流程如下图所示:
(1)Co2+萃取的反应原理如下:Co2++2HR(有机层)CoR2+2H+,则从有机相中分离出CoSO4需向有机溶剂中加入以下哪种试剂__________ (填选项字母)。
A.H2SO4 B.NaOH C.Co(OH)2 D.HR
(2)“沉钴”时,Na2CO3的滴速过快或浓度太大,可生成碱式碳酸钴(CoCO3)2·3Co(OH)2沉淀,会导致产品不纯。生成(CoCO3)2·3Co(OH)2沉淀的化学方程式为__________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.某微粒核外电子排布为2、8、8结构,则该微粒可能为氩原子、氯离子、钾离子等,故A错误;
B.最外层电子数不能超过8个,但长周期中最外层电子数没有明显的递增规律,如第四周期钙、钪、钛等最外层电子数均为2,故B错误;
C.第二、三周期各有8种元素,上下相邻的元素为同主族元素,则上下相邻的元素的原子核外电子数相差8个,故C正确;
D.第七周期包括锕系元素,若排满为32种元素,故D错误;
答案为C。
2.A
【详解】A. 二氧化硅有良好的光学性能,用于制作光导纤维,单晶硅用于制作芯片,故A错误;
B. 氢氧化铝能与HCl反应,而且没有腐蚀性,所以氢氧化铝可作胃酸的中和剂,故B正确;
C. 氧化铁为红棕色,氧化铁可以作红色油漆和涂料,故C正确;
D. 碳酸氢钠不稳定受热分解生成气体,在制作食品时加碳酸氢钠会使食品疏松多孔,故D正确;
答案选A。
3.C
【详解】A、同周期元素从左到右金属性逐渐减弱,同主族元素从上到下金属性逐渐增强,金属性越强,对应的最高价氧化物的水化物的碱性越强,故碱性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3,故A错误;
B、Si是非金属元素,无金属性,故B错误;
C、同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,原子半径:O
答案选C。
4.A
【详解】Al、S、Cl为同周期元素,同周期元素的原子半径从左到右逐渐减小,F、Cl为同主族元素,同主族元素的原子半径从上到下逐渐增大,则原子半径最小的是F;
答案选A。
5.C
【详解】A.传统的无机非金属材料多为硅酸盐材料,主要是指陶瓷、玻璃、水泥,故A正确;
B.碳纳米材料为新型无机非金属材料,包含富勒烯、碳纳米管、石墨烯等,故B正确;
C.硅酸钠溶液是一种无机粘合剂,能将玻璃塞和瓶体粘在一起,不便于打开,所以硅酸钠不可以保存在磨口玻璃塞试剂瓶中,故C错误;
D.硅酸盐属于离子晶体,因此具有熔点高、硬度大的特点;大多数硅酸盐难溶于水;大多数硅酸盐化学性质稳定,因此其耐高温、耐腐蚀,故D正确;
故选:C。
6.D
【详解】A.氮元素原子核外电子层数是2,位于元素周期表的第二周期,A项正确;
B.镓原子与镓离子质量几乎相等,这是因为电子相对于质子、中子来说,质量很小,B项正确;
C.镓的相对原子质量是69.72,C项正确;
D.阳离子由原子失电子形成,所以一个Ga3+有31-3=28个电子,D项错误;
故选D。
7.B
【分析】钠能够与空气中氧气和水反应;氢氟酸能够与玻璃中二氧化硅反应;依据氯水中次氯酸见光分解的性质判断;氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住。
【详解】A、钠能够与空气中氧气和水反应,少量钠通常保存在煤油中,故A不选;
B、氢氟酸能够与玻璃中二氧化硅反应,所以不能用玻璃瓶盛放,应用塑料瓶盛放,故B选;
C、氯水中次氯酸见光分解,所以氯水用棕色瓶保存,故C不选;
D、氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住,所以不能用磨口玻璃塞的试剂瓶保存氢氧化钠溶液,故D不选。
答案选B。
【点睛】本题考查化学试剂的保存,注意化学试剂的保存与物质的性质有关,学习中注意相关知识的积累。
8.D
【详解】A. 锗元素带“钅”字旁,属于金属元素,故A不选;
B. 锗原子有4个电子层,最外层有4个电子,位于第四周期IVA族,故B不选;
C. 原子序数是32号,原子核外有32个电子,故C不选
D. 相对原子质量的单位不是“g/mol”而是“1”,通常省略不写,故D选;
故选D。
9.C
【详解】核电荷数为a的微粒Xn-和核电荷数为b的微粒Ym+两种单原子的简单离子,它们的电子层结构相同;Xn-是原子得到n个电子得到的,其核外电子数为a+n;Ym+是Y原子失去m个电子得到的,其核外电子数为b-m;则a+n=b-m。
A、它们的关系式为a+n=b-m,选项A错误;
B、具有相同电子层结构的离子,核电荷数越大半径越小,故离子半径Xn- >Ym+,选项B错误;
C、Xn-带n个单位的负电荷,其元素化合价为-n价,氢元素显+1价,其氢化物化学式为HnX或XHn,选项C正确;
D、Ym+带m个单位的正电荷,其元素化合价为+m价,氧元素显-2价,其氧化物化学式为Y2Om,选项D错误。
答案选C。
【点睛】掌握元素在周期表中的相对位置关系、原子和离子之间的相互转化、原子的最外层电子数与主要化合价之间的关系等是正确解答本题的关键。
10.B
【详解】A. 浓盐酸应稀释后转移到容量瓶中,不能直接转移到容量瓶中,容量瓶不能直接溶解或稀释溶液,故A错误;
B. 图b所示为蒸发装置,NaCl为强酸强碱盐,不水解,通过蒸干NaCl溶液可制备NaCl固体,故B正确;
C. 纯碱为粉末固体且易溶于水,关闭止水夹不能使固、液分离,且盐酸易挥发,则不能利用图中装置制取少量纯净的CO2气体,故C错误;
D. 苯和水互不相溶,可用分液分离,但苯的密度比水小,有机层在上,水层在下,故D错误;
答案选B。
11.D
【详解】A.漂白粉、过氧化钠具有强氧化性,活性炭具有吸附性,二氧化硫与有色物质化合体现其漂白性,漂白原理不完全相同,A错误;
B.高纯度的硅应用于新能源技术领域是由于硅具有良好的半导体性能,B错误;
C.氨气不是一元碱,氨气与水反应生成一水合氨,一水合氨为一元碱,C错误;
D.在吸收塔中三氧化硫和水反应生成硫酸,但水直接吸收三氧化硫会形成酸雾,使三氧化硫的吸收率降低,故可利用98.3%的浓硫酸吸收SO3是为了避免酸雾的形成,D正确;
故选D。
12.B
【详解】A.用石材制作砚台的过程没有新物质生成,属于物理变化,故A错误;
B.氨根离子水解使溶液显酸性,酸性溶液可以用来除锈,故B正确;
C.硅胶具有吸水性,可作食品包装中的硅胶为干燥剂,但硅胶没有还原性、不能除去月饼包装袋中的氧气,可放入装有铁粉的透气袋,故C错误;
D.石英坩埚中含有二氧化硅,二氧化硅能和氢氧化钠发生反应,故D错误;
故答案选B。
13.B
【详解】A.汞为第ⅡB族元素,A正确;
B.为结晶水合物,为纯净物,B错误;
C.盐酸氨溴索中含有氯()和溴()两种卤族元素,C正确;
D.乙醇()属于有机化合物,D正确;
故选B。
14.A
【详解】A.原子的质子数=核电荷数=63,故A正确;
B.中子数=质量数-质子数=152-63=89,故B错误;
C.原子核外电子数=核电荷数=63,故C错误;
D.铕元素原子的质量是指实际质量,单位为g,该题中无法判断,故D错误;
故答案为A。
【点睛】原子符号的左上角数字表示质量数,左下角数字为质子数,质量数=质子数+中子数; 质子数=原子序数=核电荷数=原子核外电子数。
15.(1) 2Na+2H2O=2NaOH+H2↑ Mg+2H2OMg(OH)2↓+H2↑ 金属性:Na>Mg
(2) 产生白色沉淀 Al3++3NH3·H2O=Al(OH)3↓+3NH 白色沉淀逐渐溶解 Al(OH)3+3H+=Al3++3H2O 白色沉淀逐渐溶解 Al(OH)3+OH-=AlO+2H2O 产生白色沉淀 Mg2++2OH-=Mg(OH)2↓
(3) 减弱 减弱 增强 增强 减小 减弱 增强 减弱 增强
【详解】(1)钠和水常温下剧烈反应生成碱和气体,化学方程式2Na+2H2O=2NaOH+H2↑,镁常温下和水不反应,加热时剧烈反应,生成碱和气体,化学方程式Mg+2H2OMg(OH)2↓+H2↑,金属单质和水或酸反应越剧烈,金属的金属性越强,所以金属性:Na>Mg,答案:2Na+2H2O=2NaOH+H2↑;Mg+2H2OMg(OH)2↓+H2↑;金属性:Na>Mg;
(2)向AlCl3溶液中加入足量氨水,生成白色沉淀,Al3++3NH3·H2O=Al(OH)3↓+3 ,氢氧化铝不溶于氨水。实验得到的沉淀分装两支试管中,一支试管中加入盐酸,白色沉淀逐渐溶解,生成盐和水,离子方程式为Al(OH)3+3H+=Al3++3H2O;另一支试管中加入NaOH溶液,白色沉淀逐渐溶解,生成偏铝酸盐和水,离子方程式为Al(OH)3+OH-=AlO+2H2O。向MgCl2溶液加入过量NaOH溶液,产生白色沉淀,离子方程式为Mg2++2OH-=Mg(OH)2↓。答案:产生白色沉淀;Al3++3NH3·H2O=Al(OH)3↓+3NH;白色沉淀逐渐溶解;Al(OH)3+3H+=Al3++3H2O;白色沉淀逐渐溶解;Al(OH)3+OH-=AlO+2H2O;产生白色沉淀;Mg2++2OH-=Mg(OH)2↓;
(3)第三周期的Na、Mg、Al的金属性逐渐减弱,最高价氧化物的水化物NaOH、Mg(OH)2、Al(OH)3的碱性逐渐减弱,NaOH为强碱,Mg(OH)2为中强碱,Al(OH)3为两性氢氧化物。第三周期的Si、P、S、Cl的非金属性逐渐增强,最高价氧化物的水化物H2SiO3、H3PO4、H2SO4、HClO4的酸性逐渐增强。HClO4是最强的含氧酸,H2SiO3为难溶的弱酸,H3PO4为中强酸,H2SO4为强酸。同一周期从左到右,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。答案:减弱;减弱;增强;增强;减小;减弱;增强;减弱; 增强。
16. 四 ⅢA +4 HClO4 Bi2O5 F < < Al2O3+3H2SO4 =Al2(SO4)3+3H2O
【详解】(1)Ga和Al同主族,在Al的下一个周期,即第四周期,低ⅢA族,故答案为:四;ⅢA;
(2)Sn和碳同主族,最高价是+4价,Cl的最高价是+7价,最高价氧化物对应水化物的化学式为HClO4;Bi和N元素同主族,所以最高正价是+5价,最高价氧化物为Bi2O5,故答案为:+4;HClO4;Bi2O5;
(3)①同主族元素从上到下,氢化物稳定性减弱,同周期元素从右到左,氢化物稳定性减弱,所以阴影部分元素氢化物热稳定性最高的是F,故答案为:F;
②As和Se同一周期,同周期元素从右到左,最高价含氧酸的酸性减弱,所以H3AsO4、H2SeO4的酸性强弱:H3AsO4<H2SeO4,故答案为:<;
③氢化物的还原性:H2O<H2S,故答案为:<;
(4)Al的最高价氧化物Al2O3可以和S的最高价氧化物的水化物H2SO4反应,其反应方程式为:Al2O3+3H2SO4 =Al2(SO4)3+3H2O。
17.(1) 三 ⅠA 2Na+2H2O=2NaOH+H2↑
(2)
(3) > 两种元素位于同一主族,最外层电子数相同,电子层数F<Cl,原子半径F<Cl,得电子能力F>Cl,非金属性F>Cl
(4)
(5)ab
【分析】根据短周期元素①~⑤在元素周期表中的位置可判断分别是Li、Na、O、F、Cl,据此解答。
【详解】(1)②是Na,在周期表中的位置是第三周期第ⅠA族,钠与反应的化学方程式是2Na+2H2O=2NaOH+H2↑。
(2)氧元素的一种核素的中子数是10,质量数是8+10=18,则表示该核素的符号是。
(3)同主族从上到下非金属性逐渐减弱,则非金属性:F>Cl,这是由于F、Cl为同主族元素,随原子序数的递增,原子半径增大,得电子能力减弱,非金属性减弱。
(4)②、⑤两种元素形成的化合物是氯化钠,属于离子化合物,则用电子式表示它的形成过程为。
(5)a、Li的原子序数是3,其原子结构示意图为,a正确;
b、在同周期中Li是最活泼的金属,所以Li的最高价氧化物的水化物的碱性最强,b正确;
c、同主族从上到下金属性逐渐增强,则在同主族的元素中,Li的金属性最弱,c错误;
答案选ab。
18. C < H2SO4
【分析】从元素周期表中可知,①为C;②为O;③为Si;④为P;⑤为S。
【详解】(1)①位于第二周期第ⅣA族,为碳元素,其符号为C;故答案为:C;
(2)②位于第二周期第ⅥA族,为氧元素,其原子结构示意图为:,故答案为:;
(3)①为碳元素,③为硅元素,位于同一主族,根据同一主族元素,从上到下,原子半径增大,其原子半径大小关系是:r(C)
【点睛】
19.错误 20.正确 21.正确 22.错误
【解析】19.1个-OH中含有9个电子,1 mol羟基中电子数为9 NA,故错误。
20.1个H2O2分子中含有18个电子,1.7 g H2O2是0.05mol,则含有电子数为0.9 NA,故正确。
21.3He的中子数为3-2=1,则3g3He的中子数为=1NA,故正确。
22.24 g镁是1mol,其原子最外层电子数为2NA,故错误。
23.(1) ce bdf a B
(2) 180g/mol 0.3mol/L 250ml容量瓶
【详解】(1)①硅为良好的半导体材料,可用于制太阳能电池、计算机芯片;所用材料为SiO2或要用到SiO2的是:门窗玻璃(原料有二氧化硅、成分含有二氧化硅)、水晶镜片、石英光导纤维;所用材料为硅酸盐的是陶瓷餐具。
因此用到硅单质的是ce;
所用材料为SiO2或要用到SiO2的是bdf;
所用材料为硅酸盐的是a;
②氢氟酸与玻璃中的SiO2会发生反应:SiO2+4HF=SiF4↑+2H2O,因此可用于雕刻赏心悦目的雕花玻璃的是氢氟酸,故合理选项是B。
(2)①当摩尔质量以g/mol为单位时,数值上等于该物质的相对分子质量,葡萄糖相对分子质量是180,所以葡萄糖的摩尔质量是180g/mol;
②根据n=可计算葡萄糖的物质的量n==0.15mol,再由c==0.3mol/L;
③根据准确配制一定物质的量浓度的溶液需要使用的仪器,可知如果要配制一定物质的量浓度的葡萄糖溶液250mL,所需仪器除了托盘天平、药匙、烧杯、玻璃棒、胶头滴管外,还缺少的仪器是250mL的容量瓶。
24.(1)
(2) +3价的铁 Cl2
(3) 四 VIII
(4)
(5)1.12
【分析】用化合价升降法配平。在该反应中Fe元素的化合价由Fe(NO3)3中的+3价升至Na2FeO4中的+6价,1molFe(NO3)3参与反应失去3mol电子生成1molNa2FeO4;Cl元素的化合价由0价降至NaCl中的-1价,1molCl2参与反应得到2mol电子生成2molNaCl;根据得失电子守恒、原子守恒配平方程式。对比氧化还原反应的概念作答。
【详解】(1)在该反应中Fe元素的化合价由Fe(NO3)3中的+3价升至Na2FeO4中的+6价,1molFe(NO3)3参与反应失去3mol电子生成1molNa2FeO4;Cl元素的化合价由0价降至NaCl中的-1价,1molCl2参与反应得到2mol电子生成2molNaCl;根据得失电子守恒、原子守恒,配平后的方程式为2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+8H2O。电子转移方向和数目为:;
(2)上述反应中Fe元素化合价升高,+3价的Fe元素被氧化。Cl元素的化合价降低,发生还原反应的物质是Cl2;
(3)Fe的原子结构示意图为,铁元素在元素周期表中的位置是第4周期第VIII族;
(4)上述反应中还原产物为NaCl,NaCl的电子式为;
(5)根据上述分析每消耗1molCl2转移2mol电子,若反应中转移了0.1mol电子,消耗Cl2物质的量为0.05mol,消耗Cl2在标准状况下的体积为0.05mol22.4L/mol=1.12L。
25. 2Fe3++Cu=2Fe2++Cu2+ ② KSCN 紫(或紫红) 分液漏斗
【分析】(1)已知反应物和生成物,根据得失电子守恒、电荷守恒、元素守恒配平;
(3)先确定变价元素、根据化合价变化和物质的量计算转移电子数目,再根据化合价升高失电子,化合价降低得电子,确定电子转移的方向。
【详解】(1)FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,该离子反应为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)将饱和的FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体,从而制得氢氧化铁胶体,则应选②,利用KSCN检验铁离子,溶液为血红色,故答案为②;KSCN;
(3)2FeCl3+2KI=2FeCl2+I2+2KCl中,Fe元素的化合价降低,I元素的化合价升高,则电子转移的方向和数目为;向反应后的溶液中加入CCl4,碘单质更易溶于CCl4,且CCl4密度比水的密度大,则振荡、静置后,碘的CCl4溶液在下层,颜色为紫色(或紫红色),然后用分液漏斗分离,故答案为:;分液漏斗。
26.(1)A
(2)5CoSO4+5Na2CO3+3H2O=5Na2SO4+(CoCO3)2·3Co(OH)2↓+3CO2↑或5CoSO4+8Na2CO3+6H2O=5Na2SO4+(CoCO3)2·3Co(OH)2↓+6NaHCO3
【分析】“碱浸”过程中,Co3O4和LiCoO2不与碱反应存在于滤渣中,Al在碱性溶液中发生反应生成NaAlO2,滤液①主要成分为NaAlO2,滤渣中加入硫酸和过氧化氢发生反应使滤渣溶解,过滤后加入有机磷萃取,得到有机相和无机相,有机相反萃取后加入Na2CO3沉钴,得到CoCO3,以此解答。
(1)
反萃取即使萃取平衡向逆向移动,根据平衡移动原理,在不引入新杂质的情况下可加入H2SO4,使平衡逆向移动,从而达到反萃取目的,故A正确;
(2)
“反萃取”后的“滤液3”中含有CoSO4,继续加入Na2CO3可生成碱式碳酸钴(CoCO3)2 3Co(OH)2沉淀,为复分解反应,化学方程式为5CoSO4+5Na2CO3+3H2O=(CoCO3)2 3Co(OH)2↓+5Na2SO4+3CO2↑或5CoSO4+8Na2CO3+6H2O=(CoCO3)2 3Co(OH)2↓+5Na2SO4+6NaHCO3。
答案第1页,共2页
答案第1页,共2页
