9.1金属的冶炼方法 同步练习(含答案) 2022-2023学年高一下学期化学苏教版(2019)必修第二册
文档属性
| 名称 | 9.1金属的冶炼方法 同步练习(含答案) 2022-2023学年高一下学期化学苏教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 264.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-03 09:42:09 | ||
图片预览


文档简介
9.1金属的冶炼方法
(同步练习)
一、单选题
1.下列关铝热反应的叙述,不正确的是
A.铝热反应可以用来焊接钢轨
B.铝热反应很剧烈可以释放出大量的热,用来冶炼难熔的金属
C.铝热反应中铝做还原剂
D.铝热反应很刺激,闲着没事可以在被窝里偷偷做着玩
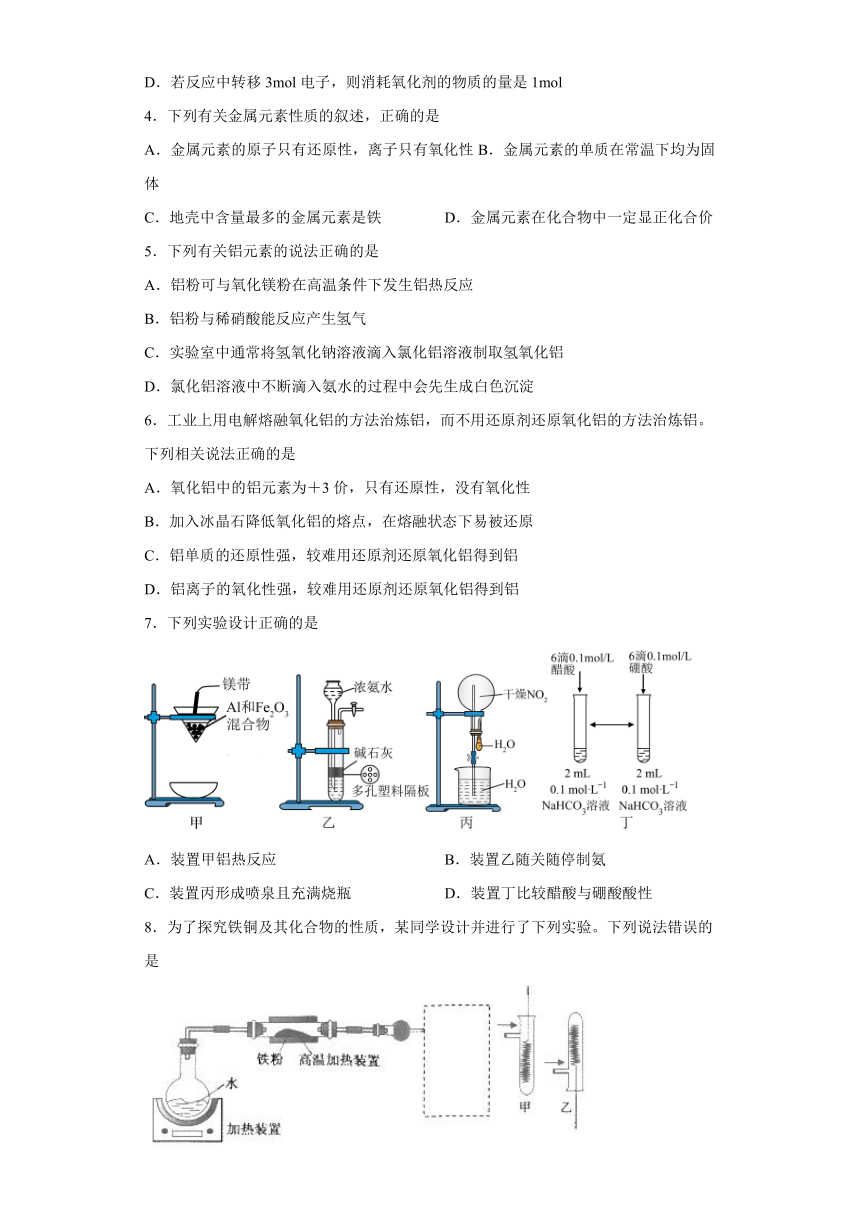
2.如图是铝热反应()的实验装置,有关该反应的下列说法中正确的是 ( )
A.若氧化铁换成二氧化锰,也能发生类似的反应
B.b为氧化铁与铝粉的混合物
C.2mol氧化剂参与反应则电子转移6NA个
D.还原剂与氧化产物的物质的量之比为1∶2
3.利用如图装置做铝热反应实验,下列说法不正确的是
A.该反应的化学方程式是
B.该反应会产生高温、发出强光
C.根据铝热反应的原理,可以冶炼某些高熔点的金属
D.若反应中转移3mol电子,则消耗氧化剂的物质的量是1mol
4.下列有关金属元素性质的叙述,正确的是
A.金属元素的原子只有还原性,离子只有氧化性 B.金属元素的单质在常温下均为固体
C.地壳中含量最多的金属元素是铁 D.金属元素在化合物中一定显正化合价
5.下列有关铝元素的说法正确的是
A.铝粉可与氧化镁粉在高温条件下发生铝热反应
B.铝粉与稀硝酸能反应产生氢气
C.实验室中通常将氢氧化钠溶液滴入氯化铝溶液制取氢氧化铝
D.氯化铝溶液中不断滴入氨水的过程中会先生成白色沉淀
6.工业上用电解熔融氧化铝的方法治炼铝,而不用还原剂还原氧化铝的方法治炼铝。下列相关说法正确的是
A.氧化铝中的铝元素为+3价,只有还原性,没有氧化性
B.加入冰晶石降低氧化铝的熔点,在熔融状态下易被还原
C.铝单质的还原性强,较难用还原剂还原氧化铝得到铝
D.铝离子的氧化性强,较难用还原剂还原氧化铝得到铝
7.下列实验设计正确的是
A.装置甲铝热反应 B.装置乙随关随停制氨
C.装置丙形成喷泉且充满烧瓶 D.装置丁比较醋酸与硼酸酸性
8.为了探究铁铜及其化合物的性质,某同学设计并进行了下列实验。下列说法错误的是
A.高温加热装置中发生的反应为3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)
B.虚线框处宜选择的装置是甲
C.实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑色变为红色
D.实验后,可用铝粉在高温下还原玻璃管中的固体获得铁单质
9.下列关于金属冶炼的说法中正确的是
A.加热辰砂,使它分解可以冶炼得到汞
B.热还原法常用的还原剂有等
C.金属均能通过电解熔融氯化物的方法获得
D.人类历史上金属被发现的顺序与金属的活泼性无关
10.国际纯粹与应用化学联合会(IUPAC)自2018年7月开始,通过每月评选,向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。其中,华东师范大学姜雪峰教授被IUPAC遴选为硫元素代言人,苏州大学刘庄教授被遴选为汞元素代言人,为中国青年化学家赢得了世界荣耀。下列有关硫、汞及其化合物的说法正确的是
A.S2与S8互为同位素
B.汞是常温、常压下唯一以液态存在的金属,俗称水银
C.硫在自然界中只有化合态形式
D.加热条件下,硫粉与铜反应直接化合生成CuS
11.下列各组物质均属于硅酸盐制品的是( )
A.陶瓷、水泥 B.单晶硅、玻璃
C.石膏、漂白粉 D.水玻璃、铝热剂
12.科学家制备的聚合金属簇杂化材料——聚,能高效电催化转化成。下列说法正确的是
A.和N均属于主族元素
B.用灼烧法可以区别黄铜(铜锌合金)和黄金
C.转化成需要加入强氧化剂
D.工业上常用液氨作制冷剂的原因是液氨分解需要吸热
13.下列关于铁的叙述中错误的是
A.纯净的铁是光亮的银白色金属
B.铁能被磁体吸引
C.铁是地壳中含量最多的金属元素
D.铁具有延展性和导热性,可制作炊具
14.化学与人类历史、生产生活密切相关,下列有关说法不正确的是
A.“新冠抗疫”中,用于消毒的84消毒液的有效成分为氯的含氧酸盐
B.指南针是我国的四大发明之一,制造指南针的磁性物质是
C.我国科学家首次在实验室利用合成出淀粉[],该过程涉及氧化还原反应
D.人类利用金属的历史顺序(铜→铁→铝)跟地壳中金属元素的含量有关
15.工业上由黄铜矿(主要成分为CuFeS2)冶炼铜的主要流程如下。下列说法不正确的是
A.气体A中的大气污染物可用氨水吸收并回收利用
B.由泡铜冶炼粗铜的化学方程式为3Cu2O+2AlAl2O3+6Cu
C.加入石英砂作为添加剂熔剂,生成更稳定、更容易分离的硅酸盐
D.用过量稀H2SO4可全部溶解熔渣B
二、填空题
16.“化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”道理。请填空:
(1)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂,请写出其中一个反应的化学方程式___。
(2)氯水和漂白粉都有漂白作用,也可用于水体的杀菌消毒。工业上利用氯气和氢氧化钙反应可制得漂白粉,其化学方程式为___。
(3)高温下铝粉与氧化铁的反应可用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流人钢轨的裂缝里,冷却后就将钢轨牢牢地焊接在一起。该反应的化学方程式为___,其中还原剂是___(填化学式,下同),被还原的物质是___。
17.已知氯气的氧化性很强,与金属发生反应一般生成高价态的金属氯化物。现有铜、铝、镁、铁、锌五种金属中的两种组成的混合物,取该混合物4g与足量的氯气反应后,固体质量增加7.1 g;等质量的该金属混合物投入足量的盐酸中,产生氢气0.2 g。金属混合物的组成情况可能有__种,分别为_____________ 。
18.如图是某同学在实验室中进行铝热反应的实验装置,实验中他观察到的现象之一为:“纸漏斗的下部被烧穿,有熔融物落入沙中”
该反应的化学方程式是 ___________________,在反应中用到了镁条和氯酸钾,氯酸钾的作用是 __________,铝热反应的用途是_________________。
19.回答下列问题:
(1)①写出的电子式___________;②分子比分子稳定的理由___________。
(2)和铁红发生铝热反应的化学方程式___________,该反应的用途是___________(任写一条)。
20.根据信息填空
(1)用如图所示的装置进行铝热法炼铁实验,写出铝热法炼铁反应的化学方程式:_______。
(2)已知:Fe+2FeCl3=3FeCl2,利用这一反应,设计一个原电池,画出示意图,标明电极材料名称,电解质溶液______。该原电池中,三价铁离子向_______(填“正极”或“负极”)移动。负极的电极反应式为_______
(3)古代《药性论》中有关铅丹(Pb3O4)的描述是治惊悸狂走,呕逆,消渴,铅丹(Pb3O4)也可作为防锈用涂料,呈红褐色,又名红丹。
①铅丹可用PbO在空气中加热制备,请写出有关反应的化学方程式_______。
②铅丹曾用于铁制品防锈,请举例说明铁制品防锈的其它方法_______(只填一种方法)。
三、实验题
21.I.天宫二号空间实验室已于2016年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是___________(填化学式),该物质的类别属于_______(填“碱性氧化物”或“酸性氧化物”),实验室中不能用玻璃塞的试剂瓶盛放KOH溶液,原因是___________________(用离子方程式表示)。
(2)太阳能电池帆板是“天宫二号”空间运行的动力。其性能直接影响到“天宫二号”的运行寿命和可靠性。天宫二号使用的光太阳能电池,该电池的核心材料是_______,其能量转化方式为____________________。
II.铝和氢氧化钾都是重要的工业产品。
请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是____________________。
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____________(填序号)。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,若能,则不用填写理由,若不能,理由是(用离子方程式说明)___________________。
参考答案:
1.D2.A3.D4.D5.D6.C7.D8.B9.B10.B11.A12.B13.C14.D15.D
16. 2Na2O2+2H2O=4NaOH+O2或2Na2O2+2CO2=Na2CO3+O2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2Al+Fe2O32Fe+Al2O3 Al Fe2O3
17. 2 铝和锌 镁和锌
18. Fe2O3+2AlAl2O3+2Fe 分解产生氧气,使镁条充分燃烧放出大量热 焊接钢轨和冶炼高熔点金属
19.(1) 氧原子半径小于硫原子,中共价键比中强,所以比稳定
(2) 焊接铁轨
20.(1)
(2) 正极
(3) 涂油层、制成合金(其它答案合理均可)
21. SiO2 酸性氧化物 SiO2+2OH- =SiO32-+H2O Si(或晶体硅) 太阳能转化为电能 2Al+2OH-+2H2O=2AlO+3H2↑ bd 不能 Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+
(同步练习)
一、单选题
1.下列关铝热反应的叙述,不正确的是
A.铝热反应可以用来焊接钢轨
B.铝热反应很剧烈可以释放出大量的热,用来冶炼难熔的金属
C.铝热反应中铝做还原剂
D.铝热反应很刺激,闲着没事可以在被窝里偷偷做着玩
2.如图是铝热反应()的实验装置,有关该反应的下列说法中正确的是 ( )
A.若氧化铁换成二氧化锰,也能发生类似的反应
B.b为氧化铁与铝粉的混合物
C.2mol氧化剂参与反应则电子转移6NA个
D.还原剂与氧化产物的物质的量之比为1∶2
3.利用如图装置做铝热反应实验,下列说法不正确的是
A.该反应的化学方程式是
B.该反应会产生高温、发出强光
C.根据铝热反应的原理,可以冶炼某些高熔点的金属
D.若反应中转移3mol电子,则消耗氧化剂的物质的量是1mol
4.下列有关金属元素性质的叙述,正确的是
A.金属元素的原子只有还原性,离子只有氧化性 B.金属元素的单质在常温下均为固体
C.地壳中含量最多的金属元素是铁 D.金属元素在化合物中一定显正化合价
5.下列有关铝元素的说法正确的是
A.铝粉可与氧化镁粉在高温条件下发生铝热反应
B.铝粉与稀硝酸能反应产生氢气
C.实验室中通常将氢氧化钠溶液滴入氯化铝溶液制取氢氧化铝
D.氯化铝溶液中不断滴入氨水的过程中会先生成白色沉淀
6.工业上用电解熔融氧化铝的方法治炼铝,而不用还原剂还原氧化铝的方法治炼铝。下列相关说法正确的是
A.氧化铝中的铝元素为+3价,只有还原性,没有氧化性
B.加入冰晶石降低氧化铝的熔点,在熔融状态下易被还原
C.铝单质的还原性强,较难用还原剂还原氧化铝得到铝
D.铝离子的氧化性强,较难用还原剂还原氧化铝得到铝
7.下列实验设计正确的是
A.装置甲铝热反应 B.装置乙随关随停制氨
C.装置丙形成喷泉且充满烧瓶 D.装置丁比较醋酸与硼酸酸性
8.为了探究铁铜及其化合物的性质,某同学设计并进行了下列实验。下列说法错误的是
A.高温加热装置中发生的反应为3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)
B.虚线框处宜选择的装置是甲
C.实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑色变为红色
D.实验后,可用铝粉在高温下还原玻璃管中的固体获得铁单质
9.下列关于金属冶炼的说法中正确的是
A.加热辰砂,使它分解可以冶炼得到汞
B.热还原法常用的还原剂有等
C.金属均能通过电解熔融氯化物的方法获得
D.人类历史上金属被发现的顺序与金属的活泼性无关
10.国际纯粹与应用化学联合会(IUPAC)自2018年7月开始,通过每月评选,向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。其中,华东师范大学姜雪峰教授被IUPAC遴选为硫元素代言人,苏州大学刘庄教授被遴选为汞元素代言人,为中国青年化学家赢得了世界荣耀。下列有关硫、汞及其化合物的说法正确的是
A.S2与S8互为同位素
B.汞是常温、常压下唯一以液态存在的金属,俗称水银
C.硫在自然界中只有化合态形式
D.加热条件下,硫粉与铜反应直接化合生成CuS
11.下列各组物质均属于硅酸盐制品的是( )
A.陶瓷、水泥 B.单晶硅、玻璃
C.石膏、漂白粉 D.水玻璃、铝热剂
12.科学家制备的聚合金属簇杂化材料——聚,能高效电催化转化成。下列说法正确的是
A.和N均属于主族元素
B.用灼烧法可以区别黄铜(铜锌合金)和黄金
C.转化成需要加入强氧化剂
D.工业上常用液氨作制冷剂的原因是液氨分解需要吸热
13.下列关于铁的叙述中错误的是
A.纯净的铁是光亮的银白色金属
B.铁能被磁体吸引
C.铁是地壳中含量最多的金属元素
D.铁具有延展性和导热性,可制作炊具
14.化学与人类历史、生产生活密切相关,下列有关说法不正确的是
A.“新冠抗疫”中,用于消毒的84消毒液的有效成分为氯的含氧酸盐
B.指南针是我国的四大发明之一,制造指南针的磁性物质是
C.我国科学家首次在实验室利用合成出淀粉[],该过程涉及氧化还原反应
D.人类利用金属的历史顺序(铜→铁→铝)跟地壳中金属元素的含量有关
15.工业上由黄铜矿(主要成分为CuFeS2)冶炼铜的主要流程如下。下列说法不正确的是
A.气体A中的大气污染物可用氨水吸收并回收利用
B.由泡铜冶炼粗铜的化学方程式为3Cu2O+2AlAl2O3+6Cu
C.加入石英砂作为添加剂熔剂,生成更稳定、更容易分离的硅酸盐
D.用过量稀H2SO4可全部溶解熔渣B
二、填空题
16.“化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”道理。请填空:
(1)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂,请写出其中一个反应的化学方程式___。
(2)氯水和漂白粉都有漂白作用,也可用于水体的杀菌消毒。工业上利用氯气和氢氧化钙反应可制得漂白粉,其化学方程式为___。
(3)高温下铝粉与氧化铁的反应可用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流人钢轨的裂缝里,冷却后就将钢轨牢牢地焊接在一起。该反应的化学方程式为___,其中还原剂是___(填化学式,下同),被还原的物质是___。
17.已知氯气的氧化性很强,与金属发生反应一般生成高价态的金属氯化物。现有铜、铝、镁、铁、锌五种金属中的两种组成的混合物,取该混合物4g与足量的氯气反应后,固体质量增加7.1 g;等质量的该金属混合物投入足量的盐酸中,产生氢气0.2 g。金属混合物的组成情况可能有__种,分别为_____________ 。
18.如图是某同学在实验室中进行铝热反应的实验装置,实验中他观察到的现象之一为:“纸漏斗的下部被烧穿,有熔融物落入沙中”
该反应的化学方程式是 ___________________,在反应中用到了镁条和氯酸钾,氯酸钾的作用是 __________,铝热反应的用途是_________________。
19.回答下列问题:
(1)①写出的电子式___________;②分子比分子稳定的理由___________。
(2)和铁红发生铝热反应的化学方程式___________,该反应的用途是___________(任写一条)。
20.根据信息填空
(1)用如图所示的装置进行铝热法炼铁实验,写出铝热法炼铁反应的化学方程式:_______。
(2)已知:Fe+2FeCl3=3FeCl2,利用这一反应,设计一个原电池,画出示意图,标明电极材料名称,电解质溶液______。该原电池中,三价铁离子向_______(填“正极”或“负极”)移动。负极的电极反应式为_______
(3)古代《药性论》中有关铅丹(Pb3O4)的描述是治惊悸狂走,呕逆,消渴,铅丹(Pb3O4)也可作为防锈用涂料,呈红褐色,又名红丹。
①铅丹可用PbO在空气中加热制备,请写出有关反应的化学方程式_______。
②铅丹曾用于铁制品防锈,请举例说明铁制品防锈的其它方法_______(只填一种方法)。
三、实验题
21.I.天宫二号空间实验室已于2016年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是___________(填化学式),该物质的类别属于_______(填“碱性氧化物”或“酸性氧化物”),实验室中不能用玻璃塞的试剂瓶盛放KOH溶液,原因是___________________(用离子方程式表示)。
(2)太阳能电池帆板是“天宫二号”空间运行的动力。其性能直接影响到“天宫二号”的运行寿命和可靠性。天宫二号使用的光太阳能电池,该电池的核心材料是_______,其能量转化方式为____________________。
II.铝和氢氧化钾都是重要的工业产品。
请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是____________________。
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____________(填序号)。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,若能,则不用填写理由,若不能,理由是(用离子方程式说明)___________________。
参考答案:
1.D2.A3.D4.D5.D6.C7.D8.B9.B10.B11.A12.B13.C14.D15.D
16. 2Na2O2+2H2O=4NaOH+O2或2Na2O2+2CO2=Na2CO3+O2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2Al+Fe2O32Fe+Al2O3 Al Fe2O3
17. 2 铝和锌 镁和锌
18. Fe2O3+2AlAl2O3+2Fe 分解产生氧气,使镁条充分燃烧放出大量热 焊接钢轨和冶炼高熔点金属
19.(1) 氧原子半径小于硫原子,中共价键比中强,所以比稳定
(2) 焊接铁轨
20.(1)
(2) 正极
(3) 涂油层、制成合金(其它答案合理均可)
21. SiO2 酸性氧化物 SiO2+2OH- =SiO32-+H2O Si(或晶体硅) 太阳能转化为电能 2Al+2OH-+2H2O=2AlO+3H2↑ bd 不能 Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+
