2.2.3氯水和次氯酸盐 学案(含解析) 高中化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.3氯水和次氯酸盐 学案(含解析) 高中化学人教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 368.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-03 09:37:16 | ||
图片预览




文档简介
2.2.3氯水和次氯酸盐
1. 熟悉氯水的制备方法,掌握氯水的成分和性质。
2. 掌握次氯酸的性质。
3. 掌握漂白粉和漂白液的制备、成分和生效原理。
一、氯水
1.氯水的制备
Cl2+H2O HCl+ HClO
2.氯水的成分
(1) 新制氯水成分:三分子:Cl2、HClO、H2O;四离子:H+、Cl-、ClO- 以及微量的 OH (水的电离)
(2) 久置氯水由于 HClO 的不稳定性,逐渐会变成稀盐酸。所以久置氯水的氧化性变弱,但酸性增强。
3.氯水的性质
氯水的多种成分决定了它具有多重性质:
① Cl2 的强氧化性;②HCl 的强酸性;③HClO 的性质;④Cl- 的性质。
4.次氯酸的性质
(1) 弱酸性:酸性比碳酸还要弱。HClO H + +HClO-
(2) 不稳定性:久置会发生分解。2HClO==光照==2HCl+O2 ↑
(3) 氧化性:通过氧化还原反应使有色布条褪色。
题型演练
1.(2019·高一课时练习)下列关于氯水的叙述正确的是
A.新制氯水中的微粒只含Cl2和H2O
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照新制氯水有气泡逸出,该气体是Cl2
D.新制氯水在密闭无色玻璃瓶中放置数天后酸性减弱
2.(2022秋·高一课时练习)下列物质的保存方法,与其化学性质无关的是
A.金属钠保存在煤油中 B.过氧化钠需保持干燥密闭保存
C.浓盐酸需密闭保存 D.新制氯水密闭存放于棕色瓶中
3.(2021·高一课时练习)将①中溶液滴入②中,预测的现象与实际相符的是
选项 ① ② 预测的现象
A 浓硝酸 铁片 产生大量红棕色气体
B 二氧化硫水溶液 酸性KMnO4溶液 溶液褪色
C 氯水 FeSO4溶液 溶液褪色
D 二氧化硫水溶液 BaCl2溶液 产生白色沉淀
A.A B.B C.C D.D
4.(2021秋·高一课时练习)下列物质中,既含有氯分子,又含有氯离子的是
A.氯化钠溶液 B.新制氯水 C.漂白液 D.液氯
5.(2022秋·高一课时练习)在氯水中存在许多分子和离子,它们在不同的反应中表现各自的性质,下列的实验和结论一致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明溶液中有的存在
B.溶液呈浅黄绿色,且有刺激性气味,说明溶液中有的存在
C.先加入盐酸酸化,再加入溶液产生白色沉淀,说明氯水中有的存在
D.加入溶液,氯水浅黄绿色消失,说明溶液中有分子的存在
6.(2022秋·高一课时练习)氯气通入紫色石蕊试液中,溶液由紫色→红色→无色,导致变色的微粒依次是
A.H+、Cl- B.H+、HClO C.H+、Cl2 D.Cl2、Cl-
7.(2022·高一课时练习)向新制氯水中加入下列物质,产生的现象、解释或离子方程式均正确的是
选项 加入物质 现象 解释或离子方程式
A 溶液 有白色沉淀生成
B 石蕊试液 显红色 氯水中有、
C 有气体放出
D 有色布条 有色布条褪色 有漂白性
A.A B.B C.C D.D
8.(2019·高一课时练习)化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质 实际应用
A. Al2(SO4)3和小苏打反应 泡沫灭火器灭火
B. 铁比铜金属性强 FeCl3腐蚀Cu刻制印刷电路板
C. 次氯酸盐具有氧化性 漂白粉漂白织物
D. HF与SiO2反应 氢氟酸在玻璃器皿上刻蚀标记
A.A B.B C.C D.D
二、次氯酸钠和次氯酸钙
1.漂白液与漂白粉的制备方法
漂白液 (“84”消毒液) 的主要成分为 NaCl 和 NaClO,有效成分为 NaClO;漂白粉的主要成分为 CaCl2 和 Ca(ClO)2,有效成分为 Ca(ClO)2。
2.生效原理
NaClO+CO2+H2O=HClO+NaHCO3
3.失效原理
Ca(ClO)2+CO2+H2O=CaCO3+2HCIO
2HCIO=2HCI+O2
题型演练
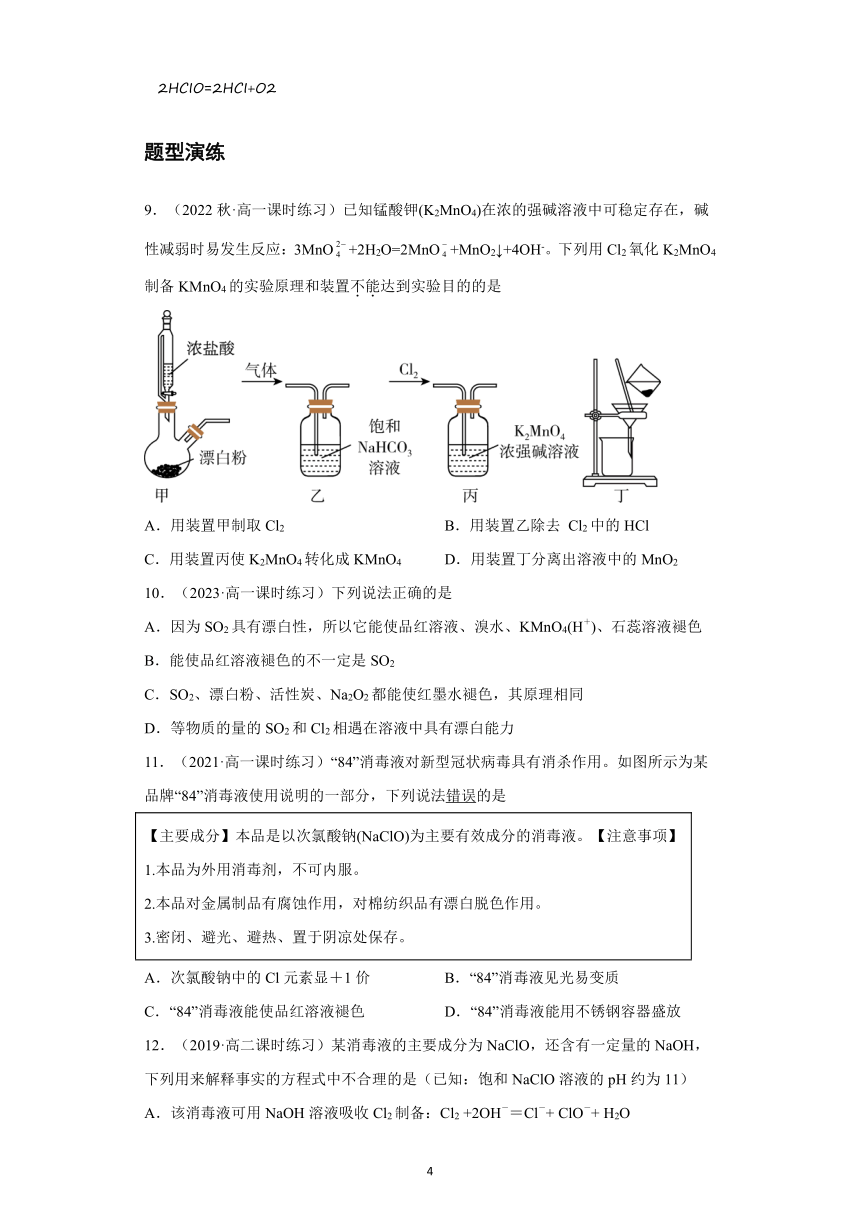
9.(2022秋·高一课时练习)已知锰酸钾(K2MnO4)在浓的强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO+2H2O=2MnO+MnO2↓+4OH-。下列用Cl2氧化K2MnO4制备KMnO4的实验原理和装置不能达到实验目的的是
A.用装置甲制取Cl2 B.用装置乙除去 Cl2中的HCl
C.用装置丙使K2MnO4转化成KMnO4 D.用装置丁分离出溶液中的MnO2
10.(2023·高一课时练习)下列说法正确的是
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色
B.能使品红溶液褪色的不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
D.等物质的量的SO2和Cl2相遇在溶液中具有漂白能力
11.(2021·高一课时练习)“84”消毒液对新型冠状病毒具有消杀作用。如图所示为某品牌“84”消毒液使用说明的一部分,下列说法错误的是
【主要成分】本品是以次氯酸钠(NaClO)为主要有效成分的消毒液。【注意事项】 1.本品为外用消毒剂,不可内服。 2.本品对金属制品有腐蚀作用,对棉纺织品有漂白脱色作用。 3.密闭、避光、避热、置于阴凉处保存。
A.次氯酸钠中的Cl元素显+1价 B.“84”消毒液见光易变质
C.“84”消毒液能使品红溶液褪色 D.“84”消毒液能用不锈钢容器盛放
12.(2019·高二课时练习)某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-=Cl-+ ClO-+ H2O
B.该消毒液的pH约为12:ClO-+ H2OHClO+ OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
13.(2022·高一课时练习)化学来源于生活,也服务于生活,下列有关生活中的化学知识叙述正确的是
A.氯气和活性炭均可作为漂白剂,若同时使用,漂白效果会明显加强
B.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
C.测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH对测定结果无影响
D.洁厕灵不能与“84”消毒液混用,原因是两种溶液混合产生的HClO易分解
第II卷(非选择题)
每空2分,共36分。
二、填空题
14.(2022秋·高一课时练习)某同学用下图所示装置制取氯水并进行相关实验。
(1)装置②中反应的化学方程式是_______。
(2)实验进行一段时间后,装置①中溶液呈黄绿色,说明该溶液中含有的一种物质是(填化学式)_______。
(3)下列物质能替代装置②中NaOH溶液的是_______
A.浓硫酸 B.浓FeCl2溶液 C.饱和食盐水
(4)氯水中含有多种成分,因而具有多重性质。将氯水分别加入盛有如图四种物质溶液的试管中,根据发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
①d过程中溶液先变红后褪色,说明氯水具有的性质是_______、_______。
②c过程中的现象是_______。
③a过程中的化学方程式为_______。
④b过程中的离子方程式为_______。
(5)欲验证Cl2的氧化性强于I2,取少量氯水加入盛有_______(填“KI”或“KIO3”)溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置,观察到的现象是_______。
15.(2022秋·高一课时练习)化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是一种___________色的气体;氯气与水反应的化学方程式为___________;氯水中滴加少量紫色石蕊试液的现象是___________。
(2)氯气和石灰乳反应可以制备漂白粉,漂白粉的有效成分是___________;次氯酸盐与空气中的二氧化碳和水蒸气反应可生成次氯酸,从而发挥漂白和消毒作用,用化学方程式表示漂白粉的漂白和消毒原理___________。
(3)二氧化氯(ClO2)是目前国际上公认的新一代的高效、广谱、安全的杀菌、保鲜剂。一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为___________;ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO),需将其转化为Cl-除去。下列试剂中,可将ClO转化为Cl-的是___________(填字母序号)。
a.FeSO4 b.O3 c.KMnO4 d.SO2
(4)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为___________;工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产100kg该溶液需消耗氯气的质量为___________kg(保留整数)。
16.(2021秋·高一课时练习)请填写下列空白。
(1)在常温下,将通入溶液中,可以得到一种漂白液。上述反应的离子方程式为___________,该漂白液的有效成分是___________(填名称)。
(2)检验某溶液中是否含有的方法是________,有关反应的离子方程式为_________。
试卷第1页,共3页
参考答案:
1.B
【详解】A.Cl2溶于水,并有少量Cl2与水反应产生HCl、HClO。HCl是强酸,完全电离,HClO是弱酸,部分电离,存在电离平衡,故新制氯水中的微粒含有Cl2、H2O、HClO、H+、Cl-、ClO-及少量OH-,A错误;
B.新制氯水中含有酸HCl、HClO,酸可使蓝色石蕊试纸变为红色,而HClO同时具有强氧化性,又将红色物质氧化变为无色,因此看到蓝色石蕊试纸先变红后褪色,B正确;
C.新制氯水中含有的HClO不稳定,光照分解产生HCl、O2,新制氯水有气泡逸出,该气体是O2,C错误;
D.新制氯水中含有的HClO不稳定,光照易分解,导致氯水颜色变浅,若新制氯水在密闭无色玻璃瓶中放置数天后,HClO分解产生HCl,使HCl的浓度增大,溶液的酸性会增强,D错误;
故合理选项是B。
2.C
【详解】A.金属钠的化学性质活泼,与空气中的氧气和水反应,需保存在煤油中,A不符合题意;
B.过氧化钠与水反应生成氢氧化钠和氧气,故过氧化钠需保持干燥密闭保存,B不符合题意;
C.浓盐酸易挥发需密闭保存,C符合题意;
D.氯气与水反应:且次氯酸易分解,故新制氯水密闭存放于棕色瓶中,D不符合题意;
故选C。
3.B
【详解】A.在室温下浓硝酸遇Fe时,浓硝酸会将Fe表面氧化,而在Fe表面产生一层致密的氧化物保护膜而阻止金属进一步发生反应,因此不能看到产生产生NO2红棕色气体,A不符合题意;
B.二氧化硫水溶液具有还原性,酸性KMnO4溶液具有强氧化性,酸性KMnO4溶液能够将SO2氧化而使溶液紫色褪色,因此会看到溶液紫色褪色,B符合题意;
C.FeSO4溶液具有还原性,氯水具有强氧化性,二者混合会发生氧化还原反应产生FeCl3、Fe2(SO4)3,使溶液变为黄色,而不是溶液褪色,C不符合题意;
D.由于酸性:HCl>H2SO3,所以将二氧化硫水溶液加入BaCl2溶液,不能发生反应,因此不能产生白色沉淀,D不符合题意;
故合理选项是B。
4.B
【详解】A.氯化钠为易溶于水的强电解质,在氯化钠溶液中只存在氯离子,不存在氯分子,A不符合题意;
B.新制氯水中,只有一部分氯分子与水反应生成盐酸和次氯酸,同时存在氯分子和氯离子,B符合题意;
C.漂白液的主要成分为氯化钠和次氯酸钠,只存在氯离子不存在氯分子,C不符合题意;
D.液氯为液态的氯分子,只存在氯分子不存在氯离子,D不符合题意;
故选B。
5.B
【详解】A.加入有色布条,一会儿有色布条褪色,说明溶液中有的存在,A错误;
B.溶液呈浅黄绿色,且有刺激性气味,说明溶液中有的存在,B正确;
C.应先加入硝酸酸化,再加入溶液产生白色沉淀,说明氯水中有的存在,加入盐酸会引入氯离子,C错误;
D.氯气为黄绿色,加入溶液,氯水浅黄绿色消失,只能说明溶液中有分子的存在,D错误;
故选B。
6.B
【详解】氯水通入水中,部分氯气与水发生:Cl2+H2O HClO+HCl,溶液中含有Cl2、HClO、H2O等分子,含有H+、ClO-、Cl-等离子,因为含有氢离子所以溶液显酸性,能够使紫色石蕊试液变红,又因为含有次氯酸,次氯酸具有漂白性,所以最后溶液褪色,故选:B。
7.A
【详解】A.氯水中存在Cl-,Cl-与Ag+反应生成白色沉淀,离子方程式为Ag+ + Cl- = AgCl,A正确;
B.氯水中有较多量的H+,能使石蕊试液显红色,存在HClO分子,HClO具有漂白性,所以溶液先变红后褪色,B错误;
C.氯水中有较多量的H+,能与CaCO3反应生成氯化钙、水和二氧化碳,离子方程式为CaCO3+2H+=Ca2++H2O+CO2,C错误;
D.氯水中存在HClO具有漂白性,能够使有色布条褪色,而Cl2不具有漂白性,D错误。
8.B
【详解】A、硫酸铝和碳酸氢钠发生反应生成氢氧化铝沉淀、硫酸钠和二氧化碳,能灭火,故说法正确;
B、氯化铁和铜反应生成氯化亚铁和氯化铜,说明铜的还原性强于亚铁离子,不能说明铁的金属性比铜强,故说法错误;
C、次氯酸具有强氧化性,能漂白,故说法正确;
D、氟化氢和二氧化硅反应生成四氟化硅和水,可以刻蚀玻璃,故说法正确。
故选B。
【点睛】盐类水解在生活中涉及方方面面,如泡沫灭火器、明矾净水等等,泡沫灭火剂原理就是盐类水解:Al3++3HCO3-=Al(OH)3↓+3CO2↑。比较金属性的强弱,可以通过置换反应,利用金属性强的制取置换性弱的,如Fe+Cu2+=Fe2++Cu,说明Fe比Cu金属性强。
9.B
【详解】A.漂白粉中的次氯酸钙具强氧化性,室温下能和浓盐酸发生氧化还原反应,生成氯化钙、氯气和水,故可用装置甲制取Cl2,A不符合题意;
B.氯化氢和饱和碳酸氢钠溶液反应生成二氧化碳,引入了新杂质,且Cl2溶于水后生成的HCl也会反应,从而增加了Cl2的损耗,故不能用装置乙除去 Cl2中的HCl,B符合题意;
C.已知锰酸钾(K2MnO4)在浓的强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO+2H2O=2MnO+MnO2↓+4OH-;氯气能和强碱溶液反应,消耗OH-而使溶液的碱性下降,故可用装置丙使K2MnO4转化成KMnO4,C不符合题意;
D.二氧化锰是不溶性固体,故可用装置丁分离出溶液中的MnO2,D不符合题意;
答案选B。
10.B
【分析】常见漂白剂的漂白原理:Cl2、Na2O2、H2O2、O3等是因强氧化性而具有漂白性;SO2是能和有机色质化合生成无色物质;活性炭是因吸附有机色质而漂白。
【详解】A.SO2使溴水、酸性KMnO4溶液褪色是因为SO2具有还原性,能使品红褪色是因其具有漂白性,SO2不能使指示剂褪色,A错误;
B.因为能使品红褪色的物质很多,不仅仅是SO2,B正确;
C.因为这些漂白剂的漂白原理不相同,SO2漂白属于化合型,活性炭属于吸附型,漂白粉、Na2O2属于氧化型,C错误;
D.等物质的量的SO2和Cl2相遇在溶液中反应生成H2SO4和HCl,从而失去漂白能力,D错误;
故选B。
11.D
【详解】A.次氯酸钠中Na为+1价、O为-1价,则Cl为+1价,A正确;
B.“84”消毒液会和空气中的CO2反应生成HClO,HClO见光易分解,从而导致变质,B正确;
C.“84”消毒液具有强氧化性,具有漂白性,可以漂白品红溶液,C正确;
D.“84”消毒液对金属制品有腐蚀作用,不能用不锈钢容器盛放,D错误;
综上所述答案为D。
12.B
【详解】A、用Cl2和NaOH溶液反应制取漂白液,故A正确;
B、根据提干信息知:饱和NaClO溶液的pH约为11,而该溶液pH=12>11,故主要是因为该消毒液中含有一定量的NaOH,故B不合理;
C、根据HCl和HClO中Cl的化合价分析,该氧化还原方程式的书写正确,故C正确;
D、根据漂白粉起漂白作用的原理,应用的是较强酸制取较弱酸,故D正确。
答案选B。
13.B
【详解】A.氯气和活性炭不反应,但活性炭吸附能力强、能吸附氯气,减弱漂白效果,故A错误;
B.氯气与烧碱溶液或石灰乳反应生成次氯酸钠或次氯酸钙,氯酸钠或次氯酸钙具有强氧化性,可作消毒剂,故B正确;
C.氯水具有漂白性,用pH计测定新制氯水的pH,故C错误;
D.洁厕灵主要成分是盐酸、“84”消毒液主要成分是次氯酸钠,二者混合会生成有毒的氯气,所以二者不能混用,故D错误;
综上所述,叙述正确的是B项,故答案为B。
14.(1)
(2)Cl2
(3)B
(4) 酸性 漂白性 有白色沉淀生成
(5) KI 液体分层、下层液体紫红色、上层液体无色
【解析】(1)
装置②中发生的反应为氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的化学方程式为,故答案为:;
(2)
实验进行一段时间后,装置①中溶液呈黄绿色,说明溶于水的氯气部分与水反应,所得溶液中含有氯气分子,故答案为:Cl2;
(3)
浓硫酸、饱和食盐水均不与氯气反应,氯化亚铁溶液与氯气反应生成氯化铁,则氯化亚铁溶液能替代装置②中氢氧化钠溶液,故选B;
(4)
①d过程中溶液先变红后褪色,说明氯水具有酸性和强氧化性,故答案为:酸性;强氧化性;
②c过程中发生的反应为氯水中盐酸和次氯酸,盐酸与硝酸银溶液反应生成氯化银白色沉淀和硝酸,则反应的现象为有白色沉淀生成,故答案为:有白色沉淀生成;
③a过程中发生的反应为氯化亚铁溶液与氯水中的氯气反应生成氯化铁,反应的化学方程式为,故答案为:;
④b过程中发生的反应为氯水中的盐酸与碳酸钠溶液反应生成氯化钠、二氧化碳和水,反应的离子方程式为,故答案为:;
(5)
取少量氯水加入盛有碘化钾溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置,观察到液体分层、下层液体紫红色、上层液体无色证明氯气的氧化性强于碘,故答案为:KI;液体分层、下层液体紫红色、上层液体无色。
15.(1) 黄绿 Cl2+H2O HCl+HClO 先变红会褪色
(2) Ca(ClO)2 Ca(ClO)2+CO2+H2O=2HClO+CaCO3↓
(3) SO2+2ClO =2ClO2+SO ad
(4) Cl2+2OH-=Cl-+ClO-+H2O 20
【解析】(1)
氯气是一种黄绿色的气体;氯气和水反应生成盐酸和次氯酸,化学方程式为Cl2+H2O HCl+HClO;氯水中有氢离子和次氯酸,故滴加少量紫色石蕊试液的现象是先变红会褪色;
(2)
氯气和石灰乳反应可以制备漂白粉,主要成分是氯化钙和次氯酸钙,漂白粉的有效成分是Ca(ClO)2;次氯酸钙和水、二氧化碳反应生成碳酸钙和次氯酸,化学方程式为Ca(ClO)2+CO2+H2O=2HClO+CaCO3 ;
(3)
根据题意可知SO2通入硫酸酸化的NaClO3溶液中生成ClO2,积极原子守恒产物还有硫酸根,故离子方程式为SO2+2ClO =2ClO2+SO ;ClO 转化为Cl-的过程中,化合价降低,所以需要还原剂,FeSO4 、SO2符合条件,故选ad;
(4)
氯气与烧碱溶液反应生成氯化钠、次氯酸钠和水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;工业上将氯气通入到30%的氢氧化钠溶液中来制备NaClO溶液,反应的方程式为Cl2+2NaOH=NaCl+NaClO+H2O,设氯气为xkg,则消耗的NaOH为,原氢氧化钠质量为kg ,由NaOH质量守恒:原溶液为(1000-x)kg,则 ,解得x=20,消耗氯气的质量为20kg。
16.(1) 次氯酸钠
(2) 取少量待检液于试管中,滴入稀硝酸酸化的硝酸银溶液,若出现白色沉淀则证明该液含有
【解析】(1)
在常温下,将通入溶液中,可以得到NaClO漂白液,离子方程式为;,该漂白液的有效成分是NaClO,名称是次氯酸钠。
(2)
检验某溶液中是否含有的方法:取少量待检液于试管中,滴入稀硝酸酸化的硝酸银溶液,若出现白色沉淀则证明该液含有,离子方程式为。
1. 熟悉氯水的制备方法,掌握氯水的成分和性质。
2. 掌握次氯酸的性质。
3. 掌握漂白粉和漂白液的制备、成分和生效原理。
一、氯水
1.氯水的制备
Cl2+H2O HCl+ HClO
2.氯水的成分
(1) 新制氯水成分:三分子:Cl2、HClO、H2O;四离子:H+、Cl-、ClO- 以及微量的 OH (水的电离)
(2) 久置氯水由于 HClO 的不稳定性,逐渐会变成稀盐酸。所以久置氯水的氧化性变弱,但酸性增强。
3.氯水的性质
氯水的多种成分决定了它具有多重性质:
① Cl2 的强氧化性;②HCl 的强酸性;③HClO 的性质;④Cl- 的性质。
4.次氯酸的性质
(1) 弱酸性:酸性比碳酸还要弱。HClO H + +HClO-
(2) 不稳定性:久置会发生分解。2HClO==光照==2HCl+O2 ↑
(3) 氧化性:通过氧化还原反应使有色布条褪色。
题型演练
1.(2019·高一课时练习)下列关于氯水的叙述正确的是
A.新制氯水中的微粒只含Cl2和H2O
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照新制氯水有气泡逸出,该气体是Cl2
D.新制氯水在密闭无色玻璃瓶中放置数天后酸性减弱
2.(2022秋·高一课时练习)下列物质的保存方法,与其化学性质无关的是
A.金属钠保存在煤油中 B.过氧化钠需保持干燥密闭保存
C.浓盐酸需密闭保存 D.新制氯水密闭存放于棕色瓶中
3.(2021·高一课时练习)将①中溶液滴入②中,预测的现象与实际相符的是
选项 ① ② 预测的现象
A 浓硝酸 铁片 产生大量红棕色气体
B 二氧化硫水溶液 酸性KMnO4溶液 溶液褪色
C 氯水 FeSO4溶液 溶液褪色
D 二氧化硫水溶液 BaCl2溶液 产生白色沉淀
A.A B.B C.C D.D
4.(2021秋·高一课时练习)下列物质中,既含有氯分子,又含有氯离子的是
A.氯化钠溶液 B.新制氯水 C.漂白液 D.液氯
5.(2022秋·高一课时练习)在氯水中存在许多分子和离子,它们在不同的反应中表现各自的性质,下列的实验和结论一致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明溶液中有的存在
B.溶液呈浅黄绿色,且有刺激性气味,说明溶液中有的存在
C.先加入盐酸酸化,再加入溶液产生白色沉淀,说明氯水中有的存在
D.加入溶液,氯水浅黄绿色消失,说明溶液中有分子的存在
6.(2022秋·高一课时练习)氯气通入紫色石蕊试液中,溶液由紫色→红色→无色,导致变色的微粒依次是
A.H+、Cl- B.H+、HClO C.H+、Cl2 D.Cl2、Cl-
7.(2022·高一课时练习)向新制氯水中加入下列物质,产生的现象、解释或离子方程式均正确的是
选项 加入物质 现象 解释或离子方程式
A 溶液 有白色沉淀生成
B 石蕊试液 显红色 氯水中有、
C 有气体放出
D 有色布条 有色布条褪色 有漂白性
A.A B.B C.C D.D
8.(2019·高一课时练习)化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质 实际应用
A. Al2(SO4)3和小苏打反应 泡沫灭火器灭火
B. 铁比铜金属性强 FeCl3腐蚀Cu刻制印刷电路板
C. 次氯酸盐具有氧化性 漂白粉漂白织物
D. HF与SiO2反应 氢氟酸在玻璃器皿上刻蚀标记
A.A B.B C.C D.D
二、次氯酸钠和次氯酸钙
1.漂白液与漂白粉的制备方法
漂白液 (“84”消毒液) 的主要成分为 NaCl 和 NaClO,有效成分为 NaClO;漂白粉的主要成分为 CaCl2 和 Ca(ClO)2,有效成分为 Ca(ClO)2。
2.生效原理
NaClO+CO2+H2O=HClO+NaHCO3
3.失效原理
Ca(ClO)2+CO2+H2O=CaCO3+2HCIO
2HCIO=2HCI+O2
题型演练
9.(2022秋·高一课时练习)已知锰酸钾(K2MnO4)在浓的强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO+2H2O=2MnO+MnO2↓+4OH-。下列用Cl2氧化K2MnO4制备KMnO4的实验原理和装置不能达到实验目的的是
A.用装置甲制取Cl2 B.用装置乙除去 Cl2中的HCl
C.用装置丙使K2MnO4转化成KMnO4 D.用装置丁分离出溶液中的MnO2
10.(2023·高一课时练习)下列说法正确的是
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色
B.能使品红溶液褪色的不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
D.等物质的量的SO2和Cl2相遇在溶液中具有漂白能力
11.(2021·高一课时练习)“84”消毒液对新型冠状病毒具有消杀作用。如图所示为某品牌“84”消毒液使用说明的一部分,下列说法错误的是
【主要成分】本品是以次氯酸钠(NaClO)为主要有效成分的消毒液。【注意事项】 1.本品为外用消毒剂,不可内服。 2.本品对金属制品有腐蚀作用,对棉纺织品有漂白脱色作用。 3.密闭、避光、避热、置于阴凉处保存。
A.次氯酸钠中的Cl元素显+1价 B.“84”消毒液见光易变质
C.“84”消毒液能使品红溶液褪色 D.“84”消毒液能用不锈钢容器盛放
12.(2019·高二课时练习)某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-=Cl-+ ClO-+ H2O
B.该消毒液的pH约为12:ClO-+ H2OHClO+ OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
13.(2022·高一课时练习)化学来源于生活,也服务于生活,下列有关生活中的化学知识叙述正确的是
A.氯气和活性炭均可作为漂白剂,若同时使用,漂白效果会明显加强
B.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
C.测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH对测定结果无影响
D.洁厕灵不能与“84”消毒液混用,原因是两种溶液混合产生的HClO易分解
第II卷(非选择题)
每空2分,共36分。
二、填空题
14.(2022秋·高一课时练习)某同学用下图所示装置制取氯水并进行相关实验。
(1)装置②中反应的化学方程式是_______。
(2)实验进行一段时间后,装置①中溶液呈黄绿色,说明该溶液中含有的一种物质是(填化学式)_______。
(3)下列物质能替代装置②中NaOH溶液的是_______
A.浓硫酸 B.浓FeCl2溶液 C.饱和食盐水
(4)氯水中含有多种成分,因而具有多重性质。将氯水分别加入盛有如图四种物质溶液的试管中,根据发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
①d过程中溶液先变红后褪色,说明氯水具有的性质是_______、_______。
②c过程中的现象是_______。
③a过程中的化学方程式为_______。
④b过程中的离子方程式为_______。
(5)欲验证Cl2的氧化性强于I2,取少量氯水加入盛有_______(填“KI”或“KIO3”)溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置,观察到的现象是_______。
15.(2022秋·高一课时练习)化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是一种___________色的气体;氯气与水反应的化学方程式为___________;氯水中滴加少量紫色石蕊试液的现象是___________。
(2)氯气和石灰乳反应可以制备漂白粉,漂白粉的有效成分是___________;次氯酸盐与空气中的二氧化碳和水蒸气反应可生成次氯酸,从而发挥漂白和消毒作用,用化学方程式表示漂白粉的漂白和消毒原理___________。
(3)二氧化氯(ClO2)是目前国际上公认的新一代的高效、广谱、安全的杀菌、保鲜剂。一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为___________;ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO),需将其转化为Cl-除去。下列试剂中,可将ClO转化为Cl-的是___________(填字母序号)。
a.FeSO4 b.O3 c.KMnO4 d.SO2
(4)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为___________;工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产100kg该溶液需消耗氯气的质量为___________kg(保留整数)。
16.(2021秋·高一课时练习)请填写下列空白。
(1)在常温下,将通入溶液中,可以得到一种漂白液。上述反应的离子方程式为___________,该漂白液的有效成分是___________(填名称)。
(2)检验某溶液中是否含有的方法是________,有关反应的离子方程式为_________。
试卷第1页,共3页
参考答案:
1.B
【详解】A.Cl2溶于水,并有少量Cl2与水反应产生HCl、HClO。HCl是强酸,完全电离,HClO是弱酸,部分电离,存在电离平衡,故新制氯水中的微粒含有Cl2、H2O、HClO、H+、Cl-、ClO-及少量OH-,A错误;
B.新制氯水中含有酸HCl、HClO,酸可使蓝色石蕊试纸变为红色,而HClO同时具有强氧化性,又将红色物质氧化变为无色,因此看到蓝色石蕊试纸先变红后褪色,B正确;
C.新制氯水中含有的HClO不稳定,光照分解产生HCl、O2,新制氯水有气泡逸出,该气体是O2,C错误;
D.新制氯水中含有的HClO不稳定,光照易分解,导致氯水颜色变浅,若新制氯水在密闭无色玻璃瓶中放置数天后,HClO分解产生HCl,使HCl的浓度增大,溶液的酸性会增强,D错误;
故合理选项是B。
2.C
【详解】A.金属钠的化学性质活泼,与空气中的氧气和水反应,需保存在煤油中,A不符合题意;
B.过氧化钠与水反应生成氢氧化钠和氧气,故过氧化钠需保持干燥密闭保存,B不符合题意;
C.浓盐酸易挥发需密闭保存,C符合题意;
D.氯气与水反应:且次氯酸易分解,故新制氯水密闭存放于棕色瓶中,D不符合题意;
故选C。
3.B
【详解】A.在室温下浓硝酸遇Fe时,浓硝酸会将Fe表面氧化,而在Fe表面产生一层致密的氧化物保护膜而阻止金属进一步发生反应,因此不能看到产生产生NO2红棕色气体,A不符合题意;
B.二氧化硫水溶液具有还原性,酸性KMnO4溶液具有强氧化性,酸性KMnO4溶液能够将SO2氧化而使溶液紫色褪色,因此会看到溶液紫色褪色,B符合题意;
C.FeSO4溶液具有还原性,氯水具有强氧化性,二者混合会发生氧化还原反应产生FeCl3、Fe2(SO4)3,使溶液变为黄色,而不是溶液褪色,C不符合题意;
D.由于酸性:HCl>H2SO3,所以将二氧化硫水溶液加入BaCl2溶液,不能发生反应,因此不能产生白色沉淀,D不符合题意;
故合理选项是B。
4.B
【详解】A.氯化钠为易溶于水的强电解质,在氯化钠溶液中只存在氯离子,不存在氯分子,A不符合题意;
B.新制氯水中,只有一部分氯分子与水反应生成盐酸和次氯酸,同时存在氯分子和氯离子,B符合题意;
C.漂白液的主要成分为氯化钠和次氯酸钠,只存在氯离子不存在氯分子,C不符合题意;
D.液氯为液态的氯分子,只存在氯分子不存在氯离子,D不符合题意;
故选B。
5.B
【详解】A.加入有色布条,一会儿有色布条褪色,说明溶液中有的存在,A错误;
B.溶液呈浅黄绿色,且有刺激性气味,说明溶液中有的存在,B正确;
C.应先加入硝酸酸化,再加入溶液产生白色沉淀,说明氯水中有的存在,加入盐酸会引入氯离子,C错误;
D.氯气为黄绿色,加入溶液,氯水浅黄绿色消失,只能说明溶液中有分子的存在,D错误;
故选B。
6.B
【详解】氯水通入水中,部分氯气与水发生:Cl2+H2O HClO+HCl,溶液中含有Cl2、HClO、H2O等分子,含有H+、ClO-、Cl-等离子,因为含有氢离子所以溶液显酸性,能够使紫色石蕊试液变红,又因为含有次氯酸,次氯酸具有漂白性,所以最后溶液褪色,故选:B。
7.A
【详解】A.氯水中存在Cl-,Cl-与Ag+反应生成白色沉淀,离子方程式为Ag+ + Cl- = AgCl,A正确;
B.氯水中有较多量的H+,能使石蕊试液显红色,存在HClO分子,HClO具有漂白性,所以溶液先变红后褪色,B错误;
C.氯水中有较多量的H+,能与CaCO3反应生成氯化钙、水和二氧化碳,离子方程式为CaCO3+2H+=Ca2++H2O+CO2,C错误;
D.氯水中存在HClO具有漂白性,能够使有色布条褪色,而Cl2不具有漂白性,D错误。
8.B
【详解】A、硫酸铝和碳酸氢钠发生反应生成氢氧化铝沉淀、硫酸钠和二氧化碳,能灭火,故说法正确;
B、氯化铁和铜反应生成氯化亚铁和氯化铜,说明铜的还原性强于亚铁离子,不能说明铁的金属性比铜强,故说法错误;
C、次氯酸具有强氧化性,能漂白,故说法正确;
D、氟化氢和二氧化硅反应生成四氟化硅和水,可以刻蚀玻璃,故说法正确。
故选B。
【点睛】盐类水解在生活中涉及方方面面,如泡沫灭火器、明矾净水等等,泡沫灭火剂原理就是盐类水解:Al3++3HCO3-=Al(OH)3↓+3CO2↑。比较金属性的强弱,可以通过置换反应,利用金属性强的制取置换性弱的,如Fe+Cu2+=Fe2++Cu,说明Fe比Cu金属性强。
9.B
【详解】A.漂白粉中的次氯酸钙具强氧化性,室温下能和浓盐酸发生氧化还原反应,生成氯化钙、氯气和水,故可用装置甲制取Cl2,A不符合题意;
B.氯化氢和饱和碳酸氢钠溶液反应生成二氧化碳,引入了新杂质,且Cl2溶于水后生成的HCl也会反应,从而增加了Cl2的损耗,故不能用装置乙除去 Cl2中的HCl,B符合题意;
C.已知锰酸钾(K2MnO4)在浓的强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO+2H2O=2MnO+MnO2↓+4OH-;氯气能和强碱溶液反应,消耗OH-而使溶液的碱性下降,故可用装置丙使K2MnO4转化成KMnO4,C不符合题意;
D.二氧化锰是不溶性固体,故可用装置丁分离出溶液中的MnO2,D不符合题意;
答案选B。
10.B
【分析】常见漂白剂的漂白原理:Cl2、Na2O2、H2O2、O3等是因强氧化性而具有漂白性;SO2是能和有机色质化合生成无色物质;活性炭是因吸附有机色质而漂白。
【详解】A.SO2使溴水、酸性KMnO4溶液褪色是因为SO2具有还原性,能使品红褪色是因其具有漂白性,SO2不能使指示剂褪色,A错误;
B.因为能使品红褪色的物质很多,不仅仅是SO2,B正确;
C.因为这些漂白剂的漂白原理不相同,SO2漂白属于化合型,活性炭属于吸附型,漂白粉、Na2O2属于氧化型,C错误;
D.等物质的量的SO2和Cl2相遇在溶液中反应生成H2SO4和HCl,从而失去漂白能力,D错误;
故选B。
11.D
【详解】A.次氯酸钠中Na为+1价、O为-1价,则Cl为+1价,A正确;
B.“84”消毒液会和空气中的CO2反应生成HClO,HClO见光易分解,从而导致变质,B正确;
C.“84”消毒液具有强氧化性,具有漂白性,可以漂白品红溶液,C正确;
D.“84”消毒液对金属制品有腐蚀作用,不能用不锈钢容器盛放,D错误;
综上所述答案为D。
12.B
【详解】A、用Cl2和NaOH溶液反应制取漂白液,故A正确;
B、根据提干信息知:饱和NaClO溶液的pH约为11,而该溶液pH=12>11,故主要是因为该消毒液中含有一定量的NaOH,故B不合理;
C、根据HCl和HClO中Cl的化合价分析,该氧化还原方程式的书写正确,故C正确;
D、根据漂白粉起漂白作用的原理,应用的是较强酸制取较弱酸,故D正确。
答案选B。
13.B
【详解】A.氯气和活性炭不反应,但活性炭吸附能力强、能吸附氯气,减弱漂白效果,故A错误;
B.氯气与烧碱溶液或石灰乳反应生成次氯酸钠或次氯酸钙,氯酸钠或次氯酸钙具有强氧化性,可作消毒剂,故B正确;
C.氯水具有漂白性,用pH计测定新制氯水的pH,故C错误;
D.洁厕灵主要成分是盐酸、“84”消毒液主要成分是次氯酸钠,二者混合会生成有毒的氯气,所以二者不能混用,故D错误;
综上所述,叙述正确的是B项,故答案为B。
14.(1)
(2)Cl2
(3)B
(4) 酸性 漂白性 有白色沉淀生成
(5) KI 液体分层、下层液体紫红色、上层液体无色
【解析】(1)
装置②中发生的反应为氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的化学方程式为,故答案为:;
(2)
实验进行一段时间后,装置①中溶液呈黄绿色,说明溶于水的氯气部分与水反应,所得溶液中含有氯气分子,故答案为:Cl2;
(3)
浓硫酸、饱和食盐水均不与氯气反应,氯化亚铁溶液与氯气反应生成氯化铁,则氯化亚铁溶液能替代装置②中氢氧化钠溶液,故选B;
(4)
①d过程中溶液先变红后褪色,说明氯水具有酸性和强氧化性,故答案为:酸性;强氧化性;
②c过程中发生的反应为氯水中盐酸和次氯酸,盐酸与硝酸银溶液反应生成氯化银白色沉淀和硝酸,则反应的现象为有白色沉淀生成,故答案为:有白色沉淀生成;
③a过程中发生的反应为氯化亚铁溶液与氯水中的氯气反应生成氯化铁,反应的化学方程式为,故答案为:;
④b过程中发生的反应为氯水中的盐酸与碳酸钠溶液反应生成氯化钠、二氧化碳和水,反应的离子方程式为,故答案为:;
(5)
取少量氯水加入盛有碘化钾溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置,观察到液体分层、下层液体紫红色、上层液体无色证明氯气的氧化性强于碘,故答案为:KI;液体分层、下层液体紫红色、上层液体无色。
15.(1) 黄绿 Cl2+H2O HCl+HClO 先变红会褪色
(2) Ca(ClO)2 Ca(ClO)2+CO2+H2O=2HClO+CaCO3↓
(3) SO2+2ClO =2ClO2+SO ad
(4) Cl2+2OH-=Cl-+ClO-+H2O 20
【解析】(1)
氯气是一种黄绿色的气体;氯气和水反应生成盐酸和次氯酸,化学方程式为Cl2+H2O HCl+HClO;氯水中有氢离子和次氯酸,故滴加少量紫色石蕊试液的现象是先变红会褪色;
(2)
氯气和石灰乳反应可以制备漂白粉,主要成分是氯化钙和次氯酸钙,漂白粉的有效成分是Ca(ClO)2;次氯酸钙和水、二氧化碳反应生成碳酸钙和次氯酸,化学方程式为Ca(ClO)2+CO2+H2O=2HClO+CaCO3 ;
(3)
根据题意可知SO2通入硫酸酸化的NaClO3溶液中生成ClO2,积极原子守恒产物还有硫酸根,故离子方程式为SO2+2ClO =2ClO2+SO ;ClO 转化为Cl-的过程中,化合价降低,所以需要还原剂,FeSO4 、SO2符合条件,故选ad;
(4)
氯气与烧碱溶液反应生成氯化钠、次氯酸钠和水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;工业上将氯气通入到30%的氢氧化钠溶液中来制备NaClO溶液,反应的方程式为Cl2+2NaOH=NaCl+NaClO+H2O,设氯气为xkg,则消耗的NaOH为,原氢氧化钠质量为kg ,由NaOH质量守恒:原溶液为(1000-x)kg,则 ,解得x=20,消耗氯气的质量为20kg。
16.(1) 次氯酸钠
(2) 取少量待检液于试管中,滴入稀硝酸酸化的硝酸银溶液,若出现白色沉淀则证明该液含有
【解析】(1)
在常温下,将通入溶液中,可以得到NaClO漂白液,离子方程式为;,该漂白液的有效成分是NaClO,名称是次氯酸钠。
(2)
检验某溶液中是否含有的方法:取少量待检液于试管中,滴入稀硝酸酸化的硝酸银溶液,若出现白色沉淀则证明该液含有,离子方程式为。
