2.3.4一定物质的量浓度溶液的配制(含解析)
文档属性
| 名称 | 2.3.4一定物质的量浓度溶液的配制(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-03 00:00:00 | ||
图片预览


文档简介
2.3.4一定物质的量浓度溶液的配制
1. 掌握一定物质的量浓度溶液的配制。
2.学会一定物质的量浓度溶液的配制及误差分析。
一、实验仪器
所需仪器:容量瓶、烧杯、玻璃棒、胶头滴管、天平 (量筒) 等。
二、容量瓶
(1)用途:准确配制一定物质的量浓度溶液的精密仪器。
(2)容量瓶的三个标识:温度、容量、刻度线。
(3)中学化学实验室中常见规格:25mL,50mL,100mL,250mL,500mL,1000mL 等。
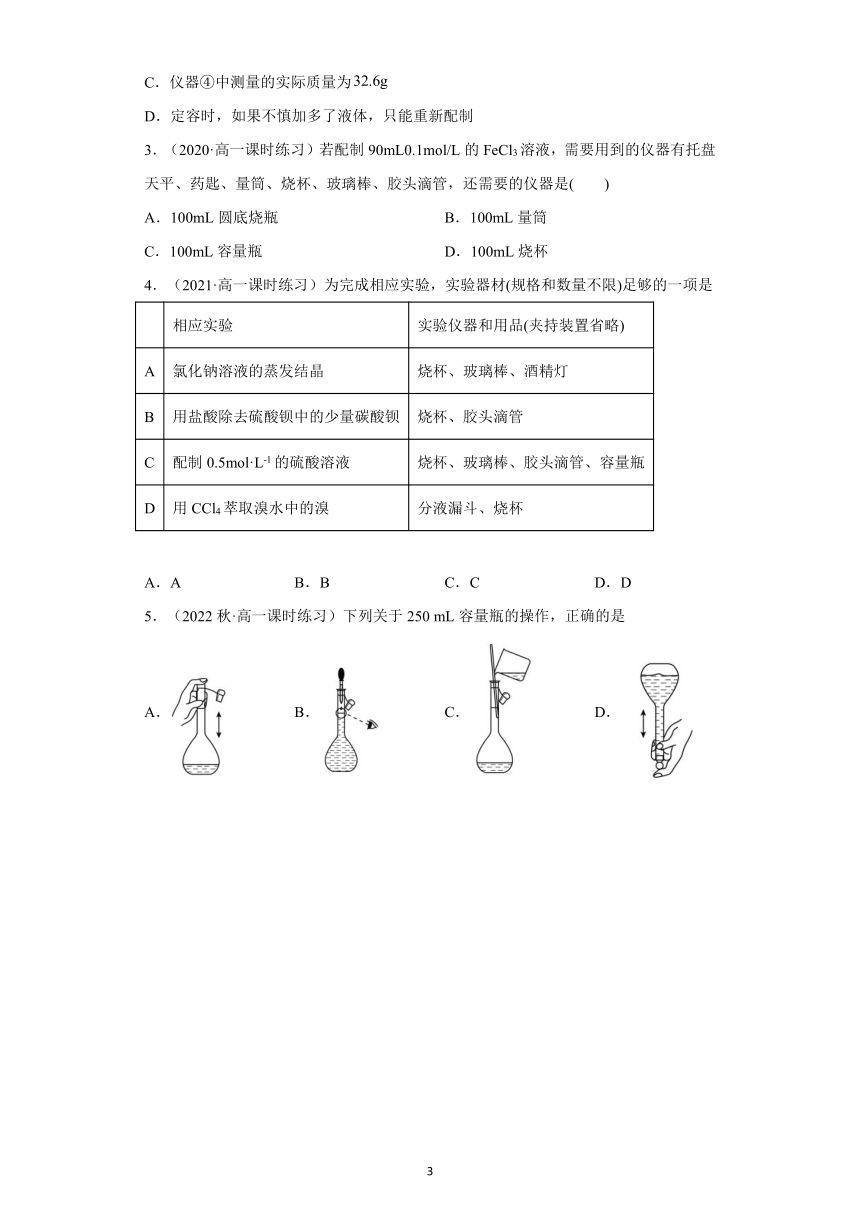
三、实验步骤
1.计算:求配制一定体积、一定物质的量浓度的溶液所需固态溶质的质量或液态溶质的体积。
2.称量:固态溶质用天平称量;液态溶质用量筒量取。
3.溶解:将溶质放入烧杯中用量筒取一定量的蒸馏水倒入烧杯溶解或稀释,同时用玻璃棒搅拌以加速溶解。
4.冷却后转移溶液:将溶液冷却至室温后,用玻璃棒引流,将溶液小心地转入一定体积的容量瓶中,且玻璃棒下端要在容量瓶刻度线以下。
5.洗涤:用少量蒸馏水洗涤烧杯内壁和玻璃棒 2 3 次,洗涤液一并转入容量瓶。
6.振荡:轻轻摇动容量瓶,使溶液混合均匀。
7.定容:向容量瓶中加水(用玻璃棒引流)至接近刻度线 1 2cm 处,再改用胶头滴管加水至液体凹面最低点与刻度线相切(或相平)。
8.摇匀:盖好瓶塞,上下颠倒,反复摇匀。摇匀后静置,即使液面低于刻度线,也不能再加水补齐,否则会引起实验误差。
9.装瓶保存:将配好的溶液转移到细口瓶中,贴好标签保存。
题型演练
1.(2021·高一课时练习)配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是
A.容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液
B.配制一定物质的量浓度的稀盐酸时,用量筒量取9.82mL浓盐酸
C.配制1L0.1mol·L—1的NaCl溶液时,用托盘天平称量5.85gNaCl固体
D.定容时,为防止液滴飞溅,胶头滴管紧贴容量瓶内壁
2.(2022秋·高一课时练习)疫情防控期间,家庭和各种公共场所需要大量使用“84清毒液”,某兴趣小组利用固体配制一定浓度的“84消毒液”,下列有关说法正确的是
A.上述仪器在配制过程中一定不需要的有两种
B.仪器①使用前必须检查是否漏液并保持干燥
C.仪器④中测量的实际质量为
D.定容时,如果不慎加多了液体,只能重新配制
3.(2020·高一课时练习)若配制90mL0.1mol/L的FeCl3溶液,需要用到的仪器有托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管,还需要的仪器是( )
A.100mL圆底烧瓶 B.100mL量筒
C.100mL容量瓶 D.100mL烧杯
4.(2021·高一课时练习)为完成相应实验,实验器材(规格和数量不限)足够的一项是
相应实验 实验仪器和用品(夹持装置省略)
A 氯化钠溶液的蒸发结晶 烧杯、玻璃棒、酒精灯
B 用盐酸除去硫酸钡中的少量碳酸钡 烧杯、胶头滴管
C 配制0.5mol·L-1的硫酸溶液 烧杯、玻璃棒、胶头滴管、容量瓶
D 用CCl4萃取溴水中的溴 分液漏斗、烧杯
A.A B.B C.C D.D
5.(2022秋·高一课时练习)下列关于250 mL容量瓶的操作,正确的是
A. B. C. D.
四、误差分析
题型演练
6.(2020·高一课时练习)实验室欲用晶体配制的溶液,下列说法正确的是
A.要完成实验需称取晶体
B.本实验需用到的仪器有天平、药匙、玻璃棒、烧杯、容量瓶
C.配制时若容量瓶不干燥,含有少量蒸馏水会导致溶液浓度偏低
D.定容时俯视刻度线会导致溶液浓度偏高
7.(2022秋·高一课时练习)配制一定物质的量浓度的溶液的操作过程示意图如下:
下列说法中错误的是
A.“操作1”需将溶解的溶液及烧杯洗涤液全部转移到容量瓶中
B.“操作2”中玻璃棒起引流作用
C.“操作4”定容时俯视刻度线会造成所配溶液浓度偏低
D.所配制的溶液中为
8.(2022秋·高一课时练习)下图是某同学用500mL容量瓶配制NaOH溶液的过程:
下列关于该实验的叙述正确的是
A.如图所示,用托盘直接称量2.0g烧碱
B.配制的正确顺序为①④③⑤②⑥
C.②中定容时仰视刻线会导致溶液浓度偏高
D.能用容量瓶贮存配制好的溶液
9.(2021·高一课时练习)配制450mL0.100mol L-1的NaCl溶液,部分实验操作示意图如图:
下列说法正确的是
A.容量瓶需用蒸馏水洗涤、干燥后才可使用
B.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
C.上述实验操作步骤的正确顺序为①②④①③
D.实验中需用到的仪器有:天平、450mL容量瓶、烧杯、玻璃棒、胶头滴管等
10.(2022秋·高一课时练习)配制500 mL 0.100 mol·L-1的NaCl溶液,部分实验操作示意图如下图:
下列说法正确的是
A.为了便于操作,固体溶解也可直接在容量瓶中进行
B.上述实验操作步骤的正确顺序为①②④③
C.容量瓶需用自来水、蒸馏水洗涤,干燥后才可用
D.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
11.(2021·高一课时练习)配制一定物质的量浓度的NaCl溶液时,下列操作不正确的是( )
A.接近称量质量时,轻振手腕,加够药品 B.溶解时,用量筒控制所加蒸馏水的量 C.移液时,玻璃棒插在刻度线以上,防止液体洒出 D.液面接近刻度线1~2cm时,用胶头滴管滴加蒸馏水至刻度线
A.A B.B C.C D. D
12.(2021·高一课时练习)欲配制100mL0.8mol·L-1的氯化钠溶液,下列说法错误的是
A.洗涤后,将洗涤液转移到100mL容量瓶中
B.在烧杯中用适量蒸馏水溶解NaCl固体
C.需称取4.68gNaCl固体
D.定容时,俯视容量瓶刻度线会导致所配溶液溶度偏大
13.(2021·高一课时练习)实验室工作人员现用Na2CO3·10H2O晶体配制0.2 mol·L-1的Na2CO3溶液480 mL。请回答下列问题:
(1)应称取Na2CO3·10H2O晶体的质量:_____________________。
(2)根据下列操作对所配溶液的浓度产生的影响,完成下列问题:
① Na2CO3·10H2O晶体失去了部分结晶水
② 用“左码右物”的称量方法称量晶体(使用游码)
③ 碳酸钠晶体不纯,其中混有氯化钠
④ 称量碳酸钠晶体时所用砝码生锈
⑤ 容量瓶未经干燥使用
其中引起所配溶液浓度偏高的有____(填序号,下同),无影响的有_________。
(3)下列操作中,容量瓶所不具备的功能有_____(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(4)某同学改用固体Na2CO3配制上述Na2CO3溶液的过程如图所示:
你认为该同学的错误步骤有______(填序号)。
A.1处 B.2处 C.3处 D.4处
14.(2020·高一课时练习)现用质量分数为98%的浓硫酸(密度为)配制的稀硫酸100 mL。
(1)经计算,需浓硫酸的体积为_______mL。
(2)实验中应选用的仪器是_____(填序号)。
①100mL量筒 ②托盘天平(带砝码) ③玻璃棒 ④50 mL容量瓶 ⑤10mL量筒 ⑥100mL烧杯 ⑦100mL容量瓶 ⑧胶头滴管
(3)此实验中玻璃棒的作用是___________。
(4)分析下列操作对所配溶液浓度的影响(填“偏高”“偏低”或“无影响”)。
①转移浓硫酸后,烧杯未洗涤:_______;
②量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中:_______;
③定容时俯视容量瓶刻度线:________;
④移液前容量瓶内留有少量蒸馏水:________;
15.(2021·高一课时练习)某兴趣小组帮助水质监测站配制480 mL 0.1mol·L-1的 KMnO4标准溶液的过程示意图如下:
(1)请你观察图示判断,其中错误的操作有___________(填序号)。
(2)该同学应称取KMnO4固体___________g,用质量为25.2 g的烧杯放在托盘天平上称取所需KMnO4固体时,请在下表中选取所需的砝码大小___________(填字母,下同),并在下图中选出能正确表示游码位置的选项___________。
砝码 a b c d
大小/g 50 20 10 5
(3)为增加氧化能力,通常在KMnO4溶液中加入稀硫酸,某小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制200.0 mL 2.3 mol·L-1的稀硫酸。
①在上述所配制的稀硫酸中,H+的物质的量浓度为___________mol·L-1。
②需量取浓硫酸的体积为___________mL。
16.(2022秋·高一课时练习)用NaCl固体配制100 mL 1.00 mol/L NaCl溶液。
(1)计算需要NaCl固体的质量为___________g。
(2)配制溶液时,正确的实验操作顺序是___________。
a.将称好的NaCl固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使NaCl固体全部溶解。
b.根据计算结果,称量NaCl固体。
c.计算需要NaCl固体的质量。
d.将烧杯中的溶液沿玻璃棒注入100 mL容量瓶,并用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
e.将配制好的溶液倒入试剂瓶中,并贴好标签。
f.将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
试卷第1页,共3页
参考答案:
1.A
【详解】A.容量瓶用蒸馏水洗净后,不需要干燥,因定容时还需要加水,故A正确;
B.量筒的感量为0.1mL,可量取9.8mL浓盐酸,无法量取9.82mL浓盐酸,故B错误;
C.托盘天平的感量为0.1g,可称量5.8g固体,无法称量5.85gNaCl固体,故C错误;
D.定容时,胶头滴管要悬空正放,不能紧贴容量瓶内壁,故D错误;
故选A。
2.D
【详解】A.利用次氯酸钠固体配制一定浓度的84消毒液时需要用到带砝码的托盘天平、烧杯、玻璃棒、胶头滴管、容量瓶,不需要用到分液漏斗,故A错误;
B.仪器①容量瓶使用前必须检查是否漏液,因定容时需要加入蒸馏水,所以不需要保持干燥,故B错误;
C.仪器④称量的质量32.6g是药品+小烧杯的质量,故C错误;
D.定容时,如果不慎加多了液体说明配制实验失败,只能重新配制,故D正确;
故选D。
3.C
【详解】实验室配制一定物质的量浓度的溶液时,需要准确控制溶液的最终体积,实验室使用容量瓶来配制一定体积、一定浓度的溶液,常见规格有50mL、100mL、250mL、500mL等,若配制90mL0.1mol/L的FeCl3溶液,则需100mL容量瓶,则A、B、D均错误,C正确;
答案选C。
4.D
【详解】A.蒸发操作实验仪器还缺少蒸发皿,A错误;
B.过滤装置中缺少漏斗、玻璃棒和滤纸,B错误;
C.配制0.5mol·L-1硫酸溶液,缺少量筒,C错误;
D.做萃取实验,只用分液漏斗和烧杯,D正确;
选D。
5.C
【详解】A.容量瓶使用过程中,不能用手等触碰瓶口,以免污染试剂,A错误;
B.定容时,视线应与溶液凹液面和刻度线“三线相切”,不能仰视或俯视,B错误;
C.向容量瓶中转移液体,需用玻璃棒引流,玻璃棒下端位于刻度线以下,同时玻璃棒不能接触容量瓶口,C正确;
D.定容完成后,盖上瓶塞,将容量瓶来回颠倒,将溶液摇匀,颠倒过程中,左手食指抵住瓶塞,防止瓶塞脱落,右手扶住容量瓶底部,防止容量瓶从左手掉落,D错误;
答案选C。
6.D
【详解】A. 配制的溶液,需要晶体的质量,A项错误;
B. 配制一定物质的量浓度溶液的步骤:计算、称量或量取、溶解、移液、洗涤、定容等,用到的仪器有天平、药匙、玻璃棒、烧杯、容量瓶、胶头滴管等,B项错误;
C. 定容时,需要向容量瓶中加入蒸馏水,所以配制时若容量瓶不干燥,含有少量蒸馏水对溶液浓度无影响,C项错误;
D. 定容时俯视刻度线,导致溶液体积偏小,依据可知溶液浓度偏高,D项正确;
故选D。
7.C
【详解】A.溶解得到的溶液及洗涤烧杯2~3次的洗涤液均需转移到容量瓶中,保证溶质完全转移,A项正确;
B.向容量瓶中转移溶液时用玻璃棒引流,B项正确;
C.定容时若俯视刻度线,水的量不足,溶液体积减小,造成所配溶液浓度偏大,C项错误;
D.碳酸钠的质量为10.6g,,容量瓶规格为100mL,溶液的物质的量浓度为,,D项正确;
答案选C。
8.B
【详解】A. 氢氧化钠易潮解,且有腐蚀性,故应在烧杯中称取氢氧化钠,而不能直接用托盘称量,故A错误;
B. 配制一定物质的量浓度的溶液的步骤为:计算、称量、溶解、冷却、移液洗涤、定容、摇匀、装瓶,故配制的正确顺序为①④③⑤②⑥,故B正确;
C.定容时仰视刻线会导致溶液的体积偏大,所溶液浓度偏低,故C错误;
D.容量瓶只能用于配溶液,不能用于贮存配制好的溶液,故D错误;
故选B。
9.B
【详解】A.容量瓶用蒸馏水洗净后,由于后面还需要加蒸馏水定容,无需干燥即可使用,A错误;
B.仰视容量瓶的刻度线,使得液面高于刻度线,溶液体积偏大,浓度偏低,B正确;
C.溶液配制的基本步骤为计算、称量、溶解、转移、洗涤、定容、装瓶特标签。①为溶液的转移;②为NaCl固体的溶解;③为定容;④为洗涤小烧杯和玻璃棒,所以顺序为②①④①③,C错误;
D.实验室没有450mL容量瓶,应使用500mL容量瓶,D错误;
综上所述答案为B。
10.D
【详解】A.容量瓶中不能进行固体的溶解,应该在烧杯中进行,A错误;
B.配置的步骤一般为计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,故上述实验操作步骤的正确顺序为②①④③,B错误;
C.容量瓶需要用蒸馏水洗涤,不干燥也可以使用,容量瓶中有水对配制过程中的浓度没有影响,C错误;
D.定容时仰视容量瓶的刻度线,则所加蒸馏水偏多,溶液的体积V偏大,溶液的浓度偏低,D正确;
故选D。
11.C
【详解】A.称量固体时,当接近称量质量时,应用左手拿药匙,右手轻轻振动左手手腕,加够药品,图示操作正确,故A不选;
B.为防止溶解和洗涤时所用蒸馏水的体积超过容量瓶容积,溶解时应用量筒控制所加蒸馏水的量,图示操作正确,故B不选;
C.图示移液操作中,玻璃棒插在刻度线以上,应插在刻度线以下,故C选;
D.定容时,当液面接近刻度线1~2 cm时,用胶头滴管滴加蒸馏水至刻度线,图示正确,故D不选;
故答案选C。
12.C
【详解】A.为避免溶质损失,洗涤后,将洗涤液转移到100mL容量瓶中,A正确;
B.溶解在烧杯中进行,B正确;
C.氯化钠的质量m=100mL×0.8mol·L-1×58.5g/mol=4.68g,用托盘天平称取4.7g,C错误;
D.定容时,俯视容量瓶刻度线会导致溶液体积偏小,所配溶液溶度偏大,D正确;
答案选C。
13. 28.6 g ① ④ ⑤ B、C、F B
【分析】配制0.2 mol·L-1的Na2CO3溶液480 mL时,由于实验室没有480mL规格的容量瓶,应选择500mL的容量瓶;分析误差时,用公式法进行分析。
【详解】(1)选择500mL的容量瓶,求所需溶质的质量时,使用500mL进行计算,所以应称取Na2CO3·10H2O晶体的质量:0.2 mol·L-1×0.5L×286g/mol=28.6 g。答案为:28.6 g;
(2)①Na2CO3·10H2O晶体失去部分结晶水,则溶质的物质的量偏大,所配溶液的浓度偏高;
②用“左码右物”的称量方法称量晶体(使用游码),则所称取溶质的质量偏小,所配溶液的浓度偏低;
③碳酸钠晶体不纯,其中混有氯化钠,则所称取溶质的质量偏小,所配溶液的浓度偏低;
④称量碳酸钠晶体时所用砝码生锈,则所称取溶质的质量偏大,所配溶液的浓度偏高;
⑤容量瓶未经干燥使用,对溶质的物质的量、溶液的体积都不产生影响,所配溶液的浓度不变;
综合以上分析,引起所配溶液浓度偏高的有①④,无影响的有⑤。答案为:①④;⑤;
(3)A.使用容量瓶,可以将一定物质的量的溶质溶解在一定量的溶剂中,配成一定体积准确浓度的标准溶液;
B.容量瓶不能用于贮存溶液,尤其是碱性溶液;
C.容量瓶只有一个刻度线,所以只能配制确定体积的液体;
D.利用容量瓶,可以将一定物质的量的溶液,加水稀释配成准确浓度的溶液;
E.容量瓶只能量取与容量瓶规格相同的液体;
F.容量瓶是不耐热的仪器,不能用来加热溶解固体溶质;
综合以上分析,容量瓶所不具备的功能有B、C、F。答案为:B、C、F;
(4)改用固体Na2CO3配制上述Na2CO3溶液,所需Na2CO3的质量为:0.2 mol·L-1×0.5L×106g/mol=10.6 g,①不正确;定容时,应平视刻度线,⑤不正确;
综合以上分析,该同学的错误步骤有2处,故选B。答案为:B。
【点睛】容量瓶是精确度高的仪器,不耐热,不能用于贮存溶液。
14. 5.4 ③⑤⑥⑦⑧ 搅拌和引流 偏低 偏高 偏高 无影响
【分析】先根据稀释前后溶质的物质的量不变,计算出浓溶液的体积,选取合适的量筒,再根据配制一定物质的量浓度的溶液需要量取、稀释、移液、洗涤、定容、摇匀等操作解答。
【详解】(1)由稀释定律可知,配制时所需98%浓硫酸的体积为≈5.4mL,故答案为:5.4;
(2)量取5.4mL浓硫酸应选用仪器⑤10mL量筒,由配制一定物质的量浓度的溶液需要量取、稀释、移液、洗涤、定容、摇匀等操作可知,还需要的仪器有③⑥⑦⑧,故答案为:③⑤⑥⑦⑧;
(3)在配制过程中,稀释浓硫酸和往容量瓶中转移溶液都用到玻璃棒,玻璃棒的作用分别是搅拌和引流,故答案为:搅拌和引流;
(4)①由于烧杯未洗涤,溶质未全部转入容量瓶中,导致溶液浓度偏低,故答案为:偏低;
②由于用蒸馏水洗涤了量筒,并将洗涤液移入容量瓶中,导致溶质增多,溶液浓度偏高,故答案为:偏高;
③俯视容量瓶刻度线会使溶液的体积减小,导致溶液浓度偏高,故答案为:偏高;
④配制溶液需要向容量瓶中加蒸馏水,所以移液前容量瓶中有少量的蒸馏水对溶液浓度无影响,故答案为:无影响。
15. ①②⑤ 7.9 bc C 4.6 25.0
【详解】(1)①托盘天平的称量原则应该是“左物右码”,故①错误;
②量筒不能用于固体的溶解,故②错误;
③溶解的固体转移至容量瓶,用玻璃棒引流,图中操作科学规范,故③正确;
④用蒸馏水洗涤烧杯内壁,将洗涤液一并转移到容量瓶,图中操作科学规范,故④正确;
⑤读数时,要平视刻度线,图中仰视刻度线会有误差,故⑤错误;
⑥定容后振荡摇匀,图中操作科学规范,故⑥正确;
综上所述,符合题意的为①②⑤;
(2)配制480 mL 0.1mol·L-1的 KMnO4标准溶液,则所用容量瓶的规格应为500 mL,根据公式m=nM=cVM可知,该同学应称取KMnO4固体的质量为0.1mol·L-1×0.5L×158g/mol=7.9g;用质量为25.2 g的烧杯放在托盘天平上称取所需KMnO4固体时总重量为:25.2g+7.9g=33.1g,所以应该选用20g与10g的砝码,再将游码推到3.1处,故应该选bc和C,故答案为:7.9;bc;C;
(3) ①上述所配制的稀硫酸的浓度为2.3 mol·L-1,则H+的物质的量浓度为2×2.3 mol·L-1=4.6 mol·L-1,故答案为:4.6;
②根据稀释定律可知,浓硫酸的浓度设为c,则根据公式可知,98%(密度为1.84 g·cm-3)的浓硫酸的物质的量浓度c==18.4mol/L,设需量取浓硫酸的体积为V,则18.4mol/L×V= 2.3 mol·L-1×0.2L,解得V=0.025L=25.0mL,量筒的精确度为0.1mL,故答案为:25.0。
16.(1)5.85
(2)c b a d f e
【详解】(1)根据公式m==0.1L×1.00 mol/L×58.5g/mol=5.85g;
故答案为5.85g。
(2)根据溶液的配制过程为:计算→称量→溶解→转移→洗涤→定容→摇匀、贴标签;据此分析正确的实验操作顺序是c b a d f e;
故答案为c b a d f e。
1. 掌握一定物质的量浓度溶液的配制。
2.学会一定物质的量浓度溶液的配制及误差分析。
一、实验仪器
所需仪器:容量瓶、烧杯、玻璃棒、胶头滴管、天平 (量筒) 等。
二、容量瓶
(1)用途:准确配制一定物质的量浓度溶液的精密仪器。
(2)容量瓶的三个标识:温度、容量、刻度线。
(3)中学化学实验室中常见规格:25mL,50mL,100mL,250mL,500mL,1000mL 等。
三、实验步骤
1.计算:求配制一定体积、一定物质的量浓度的溶液所需固态溶质的质量或液态溶质的体积。
2.称量:固态溶质用天平称量;液态溶质用量筒量取。
3.溶解:将溶质放入烧杯中用量筒取一定量的蒸馏水倒入烧杯溶解或稀释,同时用玻璃棒搅拌以加速溶解。
4.冷却后转移溶液:将溶液冷却至室温后,用玻璃棒引流,将溶液小心地转入一定体积的容量瓶中,且玻璃棒下端要在容量瓶刻度线以下。
5.洗涤:用少量蒸馏水洗涤烧杯内壁和玻璃棒 2 3 次,洗涤液一并转入容量瓶。
6.振荡:轻轻摇动容量瓶,使溶液混合均匀。
7.定容:向容量瓶中加水(用玻璃棒引流)至接近刻度线 1 2cm 处,再改用胶头滴管加水至液体凹面最低点与刻度线相切(或相平)。
8.摇匀:盖好瓶塞,上下颠倒,反复摇匀。摇匀后静置,即使液面低于刻度线,也不能再加水补齐,否则会引起实验误差。
9.装瓶保存:将配好的溶液转移到细口瓶中,贴好标签保存。
题型演练
1.(2021·高一课时练习)配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是
A.容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液
B.配制一定物质的量浓度的稀盐酸时,用量筒量取9.82mL浓盐酸
C.配制1L0.1mol·L—1的NaCl溶液时,用托盘天平称量5.85gNaCl固体
D.定容时,为防止液滴飞溅,胶头滴管紧贴容量瓶内壁
2.(2022秋·高一课时练习)疫情防控期间,家庭和各种公共场所需要大量使用“84清毒液”,某兴趣小组利用固体配制一定浓度的“84消毒液”,下列有关说法正确的是
A.上述仪器在配制过程中一定不需要的有两种
B.仪器①使用前必须检查是否漏液并保持干燥
C.仪器④中测量的实际质量为
D.定容时,如果不慎加多了液体,只能重新配制
3.(2020·高一课时练习)若配制90mL0.1mol/L的FeCl3溶液,需要用到的仪器有托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管,还需要的仪器是( )
A.100mL圆底烧瓶 B.100mL量筒
C.100mL容量瓶 D.100mL烧杯
4.(2021·高一课时练习)为完成相应实验,实验器材(规格和数量不限)足够的一项是
相应实验 实验仪器和用品(夹持装置省略)
A 氯化钠溶液的蒸发结晶 烧杯、玻璃棒、酒精灯
B 用盐酸除去硫酸钡中的少量碳酸钡 烧杯、胶头滴管
C 配制0.5mol·L-1的硫酸溶液 烧杯、玻璃棒、胶头滴管、容量瓶
D 用CCl4萃取溴水中的溴 分液漏斗、烧杯
A.A B.B C.C D.D
5.(2022秋·高一课时练习)下列关于250 mL容量瓶的操作,正确的是
A. B. C. D.
四、误差分析
题型演练
6.(2020·高一课时练习)实验室欲用晶体配制的溶液,下列说法正确的是
A.要完成实验需称取晶体
B.本实验需用到的仪器有天平、药匙、玻璃棒、烧杯、容量瓶
C.配制时若容量瓶不干燥,含有少量蒸馏水会导致溶液浓度偏低
D.定容时俯视刻度线会导致溶液浓度偏高
7.(2022秋·高一课时练习)配制一定物质的量浓度的溶液的操作过程示意图如下:
下列说法中错误的是
A.“操作1”需将溶解的溶液及烧杯洗涤液全部转移到容量瓶中
B.“操作2”中玻璃棒起引流作用
C.“操作4”定容时俯视刻度线会造成所配溶液浓度偏低
D.所配制的溶液中为
8.(2022秋·高一课时练习)下图是某同学用500mL容量瓶配制NaOH溶液的过程:
下列关于该实验的叙述正确的是
A.如图所示,用托盘直接称量2.0g烧碱
B.配制的正确顺序为①④③⑤②⑥
C.②中定容时仰视刻线会导致溶液浓度偏高
D.能用容量瓶贮存配制好的溶液
9.(2021·高一课时练习)配制450mL0.100mol L-1的NaCl溶液,部分实验操作示意图如图:
下列说法正确的是
A.容量瓶需用蒸馏水洗涤、干燥后才可使用
B.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
C.上述实验操作步骤的正确顺序为①②④①③
D.实验中需用到的仪器有:天平、450mL容量瓶、烧杯、玻璃棒、胶头滴管等
10.(2022秋·高一课时练习)配制500 mL 0.100 mol·L-1的NaCl溶液,部分实验操作示意图如下图:
下列说法正确的是
A.为了便于操作,固体溶解也可直接在容量瓶中进行
B.上述实验操作步骤的正确顺序为①②④③
C.容量瓶需用自来水、蒸馏水洗涤,干燥后才可用
D.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
11.(2021·高一课时练习)配制一定物质的量浓度的NaCl溶液时,下列操作不正确的是( )
A.接近称量质量时,轻振手腕,加够药品 B.溶解时,用量筒控制所加蒸馏水的量 C.移液时,玻璃棒插在刻度线以上,防止液体洒出 D.液面接近刻度线1~2cm时,用胶头滴管滴加蒸馏水至刻度线
A.A B.B C.C D. D
12.(2021·高一课时练习)欲配制100mL0.8mol·L-1的氯化钠溶液,下列说法错误的是
A.洗涤后,将洗涤液转移到100mL容量瓶中
B.在烧杯中用适量蒸馏水溶解NaCl固体
C.需称取4.68gNaCl固体
D.定容时,俯视容量瓶刻度线会导致所配溶液溶度偏大
13.(2021·高一课时练习)实验室工作人员现用Na2CO3·10H2O晶体配制0.2 mol·L-1的Na2CO3溶液480 mL。请回答下列问题:
(1)应称取Na2CO3·10H2O晶体的质量:_____________________。
(2)根据下列操作对所配溶液的浓度产生的影响,完成下列问题:
① Na2CO3·10H2O晶体失去了部分结晶水
② 用“左码右物”的称量方法称量晶体(使用游码)
③ 碳酸钠晶体不纯,其中混有氯化钠
④ 称量碳酸钠晶体时所用砝码生锈
⑤ 容量瓶未经干燥使用
其中引起所配溶液浓度偏高的有____(填序号,下同),无影响的有_________。
(3)下列操作中,容量瓶所不具备的功能有_____(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(4)某同学改用固体Na2CO3配制上述Na2CO3溶液的过程如图所示:
你认为该同学的错误步骤有______(填序号)。
A.1处 B.2处 C.3处 D.4处
14.(2020·高一课时练习)现用质量分数为98%的浓硫酸(密度为)配制的稀硫酸100 mL。
(1)经计算,需浓硫酸的体积为_______mL。
(2)实验中应选用的仪器是_____(填序号)。
①100mL量筒 ②托盘天平(带砝码) ③玻璃棒 ④50 mL容量瓶 ⑤10mL量筒 ⑥100mL烧杯 ⑦100mL容量瓶 ⑧胶头滴管
(3)此实验中玻璃棒的作用是___________。
(4)分析下列操作对所配溶液浓度的影响(填“偏高”“偏低”或“无影响”)。
①转移浓硫酸后,烧杯未洗涤:_______;
②量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中:_______;
③定容时俯视容量瓶刻度线:________;
④移液前容量瓶内留有少量蒸馏水:________;
15.(2021·高一课时练习)某兴趣小组帮助水质监测站配制480 mL 0.1mol·L-1的 KMnO4标准溶液的过程示意图如下:
(1)请你观察图示判断,其中错误的操作有___________(填序号)。
(2)该同学应称取KMnO4固体___________g,用质量为25.2 g的烧杯放在托盘天平上称取所需KMnO4固体时,请在下表中选取所需的砝码大小___________(填字母,下同),并在下图中选出能正确表示游码位置的选项___________。
砝码 a b c d
大小/g 50 20 10 5
(3)为增加氧化能力,通常在KMnO4溶液中加入稀硫酸,某小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制200.0 mL 2.3 mol·L-1的稀硫酸。
①在上述所配制的稀硫酸中,H+的物质的量浓度为___________mol·L-1。
②需量取浓硫酸的体积为___________mL。
16.(2022秋·高一课时练习)用NaCl固体配制100 mL 1.00 mol/L NaCl溶液。
(1)计算需要NaCl固体的质量为___________g。
(2)配制溶液时,正确的实验操作顺序是___________。
a.将称好的NaCl固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使NaCl固体全部溶解。
b.根据计算结果,称量NaCl固体。
c.计算需要NaCl固体的质量。
d.将烧杯中的溶液沿玻璃棒注入100 mL容量瓶,并用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
e.将配制好的溶液倒入试剂瓶中,并贴好标签。
f.将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
试卷第1页,共3页
参考答案:
1.A
【详解】A.容量瓶用蒸馏水洗净后,不需要干燥,因定容时还需要加水,故A正确;
B.量筒的感量为0.1mL,可量取9.8mL浓盐酸,无法量取9.82mL浓盐酸,故B错误;
C.托盘天平的感量为0.1g,可称量5.8g固体,无法称量5.85gNaCl固体,故C错误;
D.定容时,胶头滴管要悬空正放,不能紧贴容量瓶内壁,故D错误;
故选A。
2.D
【详解】A.利用次氯酸钠固体配制一定浓度的84消毒液时需要用到带砝码的托盘天平、烧杯、玻璃棒、胶头滴管、容量瓶,不需要用到分液漏斗,故A错误;
B.仪器①容量瓶使用前必须检查是否漏液,因定容时需要加入蒸馏水,所以不需要保持干燥,故B错误;
C.仪器④称量的质量32.6g是药品+小烧杯的质量,故C错误;
D.定容时,如果不慎加多了液体说明配制实验失败,只能重新配制,故D正确;
故选D。
3.C
【详解】实验室配制一定物质的量浓度的溶液时,需要准确控制溶液的最终体积,实验室使用容量瓶来配制一定体积、一定浓度的溶液,常见规格有50mL、100mL、250mL、500mL等,若配制90mL0.1mol/L的FeCl3溶液,则需100mL容量瓶,则A、B、D均错误,C正确;
答案选C。
4.D
【详解】A.蒸发操作实验仪器还缺少蒸发皿,A错误;
B.过滤装置中缺少漏斗、玻璃棒和滤纸,B错误;
C.配制0.5mol·L-1硫酸溶液,缺少量筒,C错误;
D.做萃取实验,只用分液漏斗和烧杯,D正确;
选D。
5.C
【详解】A.容量瓶使用过程中,不能用手等触碰瓶口,以免污染试剂,A错误;
B.定容时,视线应与溶液凹液面和刻度线“三线相切”,不能仰视或俯视,B错误;
C.向容量瓶中转移液体,需用玻璃棒引流,玻璃棒下端位于刻度线以下,同时玻璃棒不能接触容量瓶口,C正确;
D.定容完成后,盖上瓶塞,将容量瓶来回颠倒,将溶液摇匀,颠倒过程中,左手食指抵住瓶塞,防止瓶塞脱落,右手扶住容量瓶底部,防止容量瓶从左手掉落,D错误;
答案选C。
6.D
【详解】A. 配制的溶液,需要晶体的质量,A项错误;
B. 配制一定物质的量浓度溶液的步骤:计算、称量或量取、溶解、移液、洗涤、定容等,用到的仪器有天平、药匙、玻璃棒、烧杯、容量瓶、胶头滴管等,B项错误;
C. 定容时,需要向容量瓶中加入蒸馏水,所以配制时若容量瓶不干燥,含有少量蒸馏水对溶液浓度无影响,C项错误;
D. 定容时俯视刻度线,导致溶液体积偏小,依据可知溶液浓度偏高,D项正确;
故选D。
7.C
【详解】A.溶解得到的溶液及洗涤烧杯2~3次的洗涤液均需转移到容量瓶中,保证溶质完全转移,A项正确;
B.向容量瓶中转移溶液时用玻璃棒引流,B项正确;
C.定容时若俯视刻度线,水的量不足,溶液体积减小,造成所配溶液浓度偏大,C项错误;
D.碳酸钠的质量为10.6g,,容量瓶规格为100mL,溶液的物质的量浓度为,,D项正确;
答案选C。
8.B
【详解】A. 氢氧化钠易潮解,且有腐蚀性,故应在烧杯中称取氢氧化钠,而不能直接用托盘称量,故A错误;
B. 配制一定物质的量浓度的溶液的步骤为:计算、称量、溶解、冷却、移液洗涤、定容、摇匀、装瓶,故配制的正确顺序为①④③⑤②⑥,故B正确;
C.定容时仰视刻线会导致溶液的体积偏大,所溶液浓度偏低,故C错误;
D.容量瓶只能用于配溶液,不能用于贮存配制好的溶液,故D错误;
故选B。
9.B
【详解】A.容量瓶用蒸馏水洗净后,由于后面还需要加蒸馏水定容,无需干燥即可使用,A错误;
B.仰视容量瓶的刻度线,使得液面高于刻度线,溶液体积偏大,浓度偏低,B正确;
C.溶液配制的基本步骤为计算、称量、溶解、转移、洗涤、定容、装瓶特标签。①为溶液的转移;②为NaCl固体的溶解;③为定容;④为洗涤小烧杯和玻璃棒,所以顺序为②①④①③,C错误;
D.实验室没有450mL容量瓶,应使用500mL容量瓶,D错误;
综上所述答案为B。
10.D
【详解】A.容量瓶中不能进行固体的溶解,应该在烧杯中进行,A错误;
B.配置的步骤一般为计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,故上述实验操作步骤的正确顺序为②①④③,B错误;
C.容量瓶需要用蒸馏水洗涤,不干燥也可以使用,容量瓶中有水对配制过程中的浓度没有影响,C错误;
D.定容时仰视容量瓶的刻度线,则所加蒸馏水偏多,溶液的体积V偏大,溶液的浓度偏低,D正确;
故选D。
11.C
【详解】A.称量固体时,当接近称量质量时,应用左手拿药匙,右手轻轻振动左手手腕,加够药品,图示操作正确,故A不选;
B.为防止溶解和洗涤时所用蒸馏水的体积超过容量瓶容积,溶解时应用量筒控制所加蒸馏水的量,图示操作正确,故B不选;
C.图示移液操作中,玻璃棒插在刻度线以上,应插在刻度线以下,故C选;
D.定容时,当液面接近刻度线1~2 cm时,用胶头滴管滴加蒸馏水至刻度线,图示正确,故D不选;
故答案选C。
12.C
【详解】A.为避免溶质损失,洗涤后,将洗涤液转移到100mL容量瓶中,A正确;
B.溶解在烧杯中进行,B正确;
C.氯化钠的质量m=100mL×0.8mol·L-1×58.5g/mol=4.68g,用托盘天平称取4.7g,C错误;
D.定容时,俯视容量瓶刻度线会导致溶液体积偏小,所配溶液溶度偏大,D正确;
答案选C。
13. 28.6 g ① ④ ⑤ B、C、F B
【分析】配制0.2 mol·L-1的Na2CO3溶液480 mL时,由于实验室没有480mL规格的容量瓶,应选择500mL的容量瓶;分析误差时,用公式法进行分析。
【详解】(1)选择500mL的容量瓶,求所需溶质的质量时,使用500mL进行计算,所以应称取Na2CO3·10H2O晶体的质量:0.2 mol·L-1×0.5L×286g/mol=28.6 g。答案为:28.6 g;
(2)①Na2CO3·10H2O晶体失去部分结晶水,则溶质的物质的量偏大,所配溶液的浓度偏高;
②用“左码右物”的称量方法称量晶体(使用游码),则所称取溶质的质量偏小,所配溶液的浓度偏低;
③碳酸钠晶体不纯,其中混有氯化钠,则所称取溶质的质量偏小,所配溶液的浓度偏低;
④称量碳酸钠晶体时所用砝码生锈,则所称取溶质的质量偏大,所配溶液的浓度偏高;
⑤容量瓶未经干燥使用,对溶质的物质的量、溶液的体积都不产生影响,所配溶液的浓度不变;
综合以上分析,引起所配溶液浓度偏高的有①④,无影响的有⑤。答案为:①④;⑤;
(3)A.使用容量瓶,可以将一定物质的量的溶质溶解在一定量的溶剂中,配成一定体积准确浓度的标准溶液;
B.容量瓶不能用于贮存溶液,尤其是碱性溶液;
C.容量瓶只有一个刻度线,所以只能配制确定体积的液体;
D.利用容量瓶,可以将一定物质的量的溶液,加水稀释配成准确浓度的溶液;
E.容量瓶只能量取与容量瓶规格相同的液体;
F.容量瓶是不耐热的仪器,不能用来加热溶解固体溶质;
综合以上分析,容量瓶所不具备的功能有B、C、F。答案为:B、C、F;
(4)改用固体Na2CO3配制上述Na2CO3溶液,所需Na2CO3的质量为:0.2 mol·L-1×0.5L×106g/mol=10.6 g,①不正确;定容时,应平视刻度线,⑤不正确;
综合以上分析,该同学的错误步骤有2处,故选B。答案为:B。
【点睛】容量瓶是精确度高的仪器,不耐热,不能用于贮存溶液。
14. 5.4 ③⑤⑥⑦⑧ 搅拌和引流 偏低 偏高 偏高 无影响
【分析】先根据稀释前后溶质的物质的量不变,计算出浓溶液的体积,选取合适的量筒,再根据配制一定物质的量浓度的溶液需要量取、稀释、移液、洗涤、定容、摇匀等操作解答。
【详解】(1)由稀释定律可知,配制时所需98%浓硫酸的体积为≈5.4mL,故答案为:5.4;
(2)量取5.4mL浓硫酸应选用仪器⑤10mL量筒,由配制一定物质的量浓度的溶液需要量取、稀释、移液、洗涤、定容、摇匀等操作可知,还需要的仪器有③⑥⑦⑧,故答案为:③⑤⑥⑦⑧;
(3)在配制过程中,稀释浓硫酸和往容量瓶中转移溶液都用到玻璃棒,玻璃棒的作用分别是搅拌和引流,故答案为:搅拌和引流;
(4)①由于烧杯未洗涤,溶质未全部转入容量瓶中,导致溶液浓度偏低,故答案为:偏低;
②由于用蒸馏水洗涤了量筒,并将洗涤液移入容量瓶中,导致溶质增多,溶液浓度偏高,故答案为:偏高;
③俯视容量瓶刻度线会使溶液的体积减小,导致溶液浓度偏高,故答案为:偏高;
④配制溶液需要向容量瓶中加蒸馏水,所以移液前容量瓶中有少量的蒸馏水对溶液浓度无影响,故答案为:无影响。
15. ①②⑤ 7.9 bc C 4.6 25.0
【详解】(1)①托盘天平的称量原则应该是“左物右码”,故①错误;
②量筒不能用于固体的溶解,故②错误;
③溶解的固体转移至容量瓶,用玻璃棒引流,图中操作科学规范,故③正确;
④用蒸馏水洗涤烧杯内壁,将洗涤液一并转移到容量瓶,图中操作科学规范,故④正确;
⑤读数时,要平视刻度线,图中仰视刻度线会有误差,故⑤错误;
⑥定容后振荡摇匀,图中操作科学规范,故⑥正确;
综上所述,符合题意的为①②⑤;
(2)配制480 mL 0.1mol·L-1的 KMnO4标准溶液,则所用容量瓶的规格应为500 mL,根据公式m=nM=cVM可知,该同学应称取KMnO4固体的质量为0.1mol·L-1×0.5L×158g/mol=7.9g;用质量为25.2 g的烧杯放在托盘天平上称取所需KMnO4固体时总重量为:25.2g+7.9g=33.1g,所以应该选用20g与10g的砝码,再将游码推到3.1处,故应该选bc和C,故答案为:7.9;bc;C;
(3) ①上述所配制的稀硫酸的浓度为2.3 mol·L-1,则H+的物质的量浓度为2×2.3 mol·L-1=4.6 mol·L-1,故答案为:4.6;
②根据稀释定律可知,浓硫酸的浓度设为c,则根据公式可知,98%(密度为1.84 g·cm-3)的浓硫酸的物质的量浓度c==18.4mol/L,设需量取浓硫酸的体积为V,则18.4mol/L×V= 2.3 mol·L-1×0.2L,解得V=0.025L=25.0mL,量筒的精确度为0.1mL,故答案为:25.0。
16.(1)5.85
(2)c b a d f e
【详解】(1)根据公式m==0.1L×1.00 mol/L×58.5g/mol=5.85g;
故答案为5.85g。
(2)根据溶液的配制过程为:计算→称量→溶解→转移→洗涤→定容→摇匀、贴标签;据此分析正确的实验操作顺序是c b a d f e;
故答案为c b a d f e。
