3.1.2铁的氧化物和氢氧化物 学案(含解析) 高中化学人教版(2019)必修 第一册
文档属性
| 名称 | 3.1.2铁的氧化物和氢氧化物 学案(含解析) 高中化学人教版(2019)必修 第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-04 09:05:03 | ||
图片预览



文档简介
3.1.2铁的氧化物和氢氧化物
1. 掌握铁的几种常见氧化物的性质和两种氢氧化物的性质及制备。
2. 掌握铁的氧化物和氢氧化物的用途。
一、铁的氧化物
铁的氧化物主要有 3 种,分别是氧化亚铁 (FeO)、氧化铁 (Fe2O3)、四氧化三铁 (Fe3O4),它们都不溶于水且不与水反应。
题型演练
1.(2022·高一课时练习)某同学对铁的氧化物产生了浓厚兴趣,查阅资料后制成以下卡片:
在空气中把铁灼烧到500℃生成Fe3O4;温度再升高可生成Fe2O3;再更高的温度(约1400℃)下加热Fe2O3时,又可得到Fe3O4。即:FeFe3O4Fe2O3
下列说法正确的是
A.FeO、Fe2O3和Fe3O4均为黑色固体
B.反应②的温度比反应③的温度高
C.FeO的稳定性强于Fe2O3
D.四氧化三铁中铁元素的化合价较复杂,其组成可表示为FeO Fe2O3
2.(2022·高一课时练习)化学既是一门变幻无穷的神奇学科,也是一个色彩缤纷的美丽世界,对下列物质的颜色判断错误的是
A.Cl2:黄绿色气体 B.Fe2O3:红棕色固体
C.Fe3O4:红棕色固体 D.FeO:黑色固体
3.(2022秋·高一课时练习)能够在人体血管中通行的药物分子运输车——“纳米药物分子运输车”在中国科学院上海硅酸盐研究所研制成功,该“运输车”可提高肿瘤的治疗效果,其结构如图所示。下列有关说法错误的是
A.包装上印“OTC”标识的药物为非处方药
B.油脂、蔗糖等这类含碳化合物属于有机物
C.分散质粒子直径在1~100nm的分散系为胶体,该“运输车”分散于水中所得的分散系不属于胶体
D.该“运输车”中铁元素的价态为+3价
4.(2022秋·高一课时练习)《新修本草》中描述“青矾”为“本来绿色,新出窟未见风者,正如琉璃……烧之赤色……”。青矾加热时的反应为。下列说法正确的是
A.产物中含有3种酸性氧化物 B.所得赤色物质为
C.反应为分解反应 D.铁元素被还原
5.(2022秋·高一课时练习)有一块铁的“氧化物”样品,用140 mL5.0 mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025 mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
6.(2022秋·高一课时练习)某废旧金属材料中主要含Fe、Cu、Al、Fe2O3、FeO、A12O3、CuO等,现利用下列工艺流程回收部分金属及金属化合物:
已知:绿矾为FeSO4 7H2O。下列说法中错误的是
A.焙烧过程中金属单质转化成了对应的氧化物
B.操作I使用到的玻璃仪器有玻璃棒、小烧杯和漏斗
C.酸浸2发生的反应为Fe+Cu2+=Fe2++Cu
D.操作III的方法是蒸发浓缩、冷却结晶
二、铁的氢氧化物
铁有两种常见的氢氧化物,红褐色的氢氧化铁 Fe(OH)3 和白色的氢氧化亚铁 Fe(OH)2,它们都是不溶于水的弱碱。
1.与酸反应
都能与盐酸或者稀硫酸发生中和反应生成相应的盐和水。
Fe(OH)3 +3HCl=FeCl3 +3H2O
Fe(OH)2 +2HCl=FeCl2 +2H2O
2.不稳定性
① 将氢氧化铁加热可以得到对应的氧化物——氧化铁。
2Fe(OH)3 ==△ ==Fe2O3+3H2O
② 氢氧化亚铁有很强的还原性,在空气中极易被氧化变为氢氧化铁。
4Fe(OH)2 +O2+2H2O=4Fe(OH)3
10
3.Fe(OH)3 和 Fe(OH)2 的制备
铁的两种氢氧化物,他们都可由相对应的可溶性盐与碱溶液反应制得。例如,Fe(OH)3 可由 FeCl3 和 NaOH 反应生成,对应的离子方程式为:Fe3+ +3OH- = Fe(OH)3 ↓。
题型演练
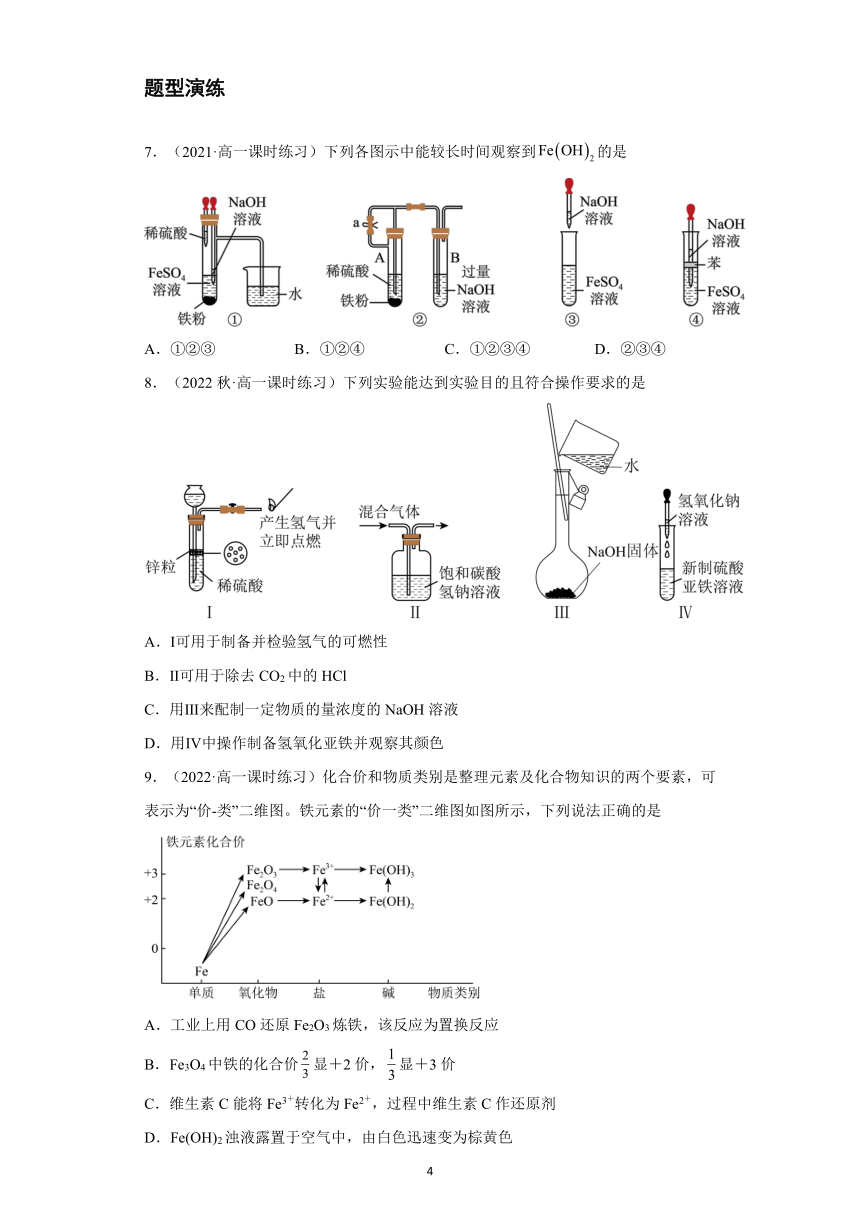
7.(2021·高一课时练习)下列各图示中能较长时间观察到的是
A.①②③ B.①②④ C.①②③④ D.②③④
8.(2022秋·高一课时练习)下列实验能达到实验目的且符合操作要求的是
A.Ⅰ可用于制备并检验氢气的可燃性
B.Ⅱ可用于除去CO2中的HCl
C.用Ⅲ来配制一定物质的量浓度的NaOH溶液
D.用Ⅳ中操作制备氢氧化亚铁并观察其颜色
9.(2022·高一课时练习)化合价和物质类别是整理元素及化合物知识的两个要素,可表示为“价-类”二维图。铁元素的“价一类”二维图如图所示,下列说法正确的是
A.工业上用CO还原Fe2O3炼铁,该反应为置换反应
B.Fe3O4中铁的化合价显+2价,显+3价
C.维生素C能将Fe3+转化为Fe2+,过程中维生素C作还原剂
D.Fe(OH)2浊液露置于空气中,由白色迅速变为棕黄色
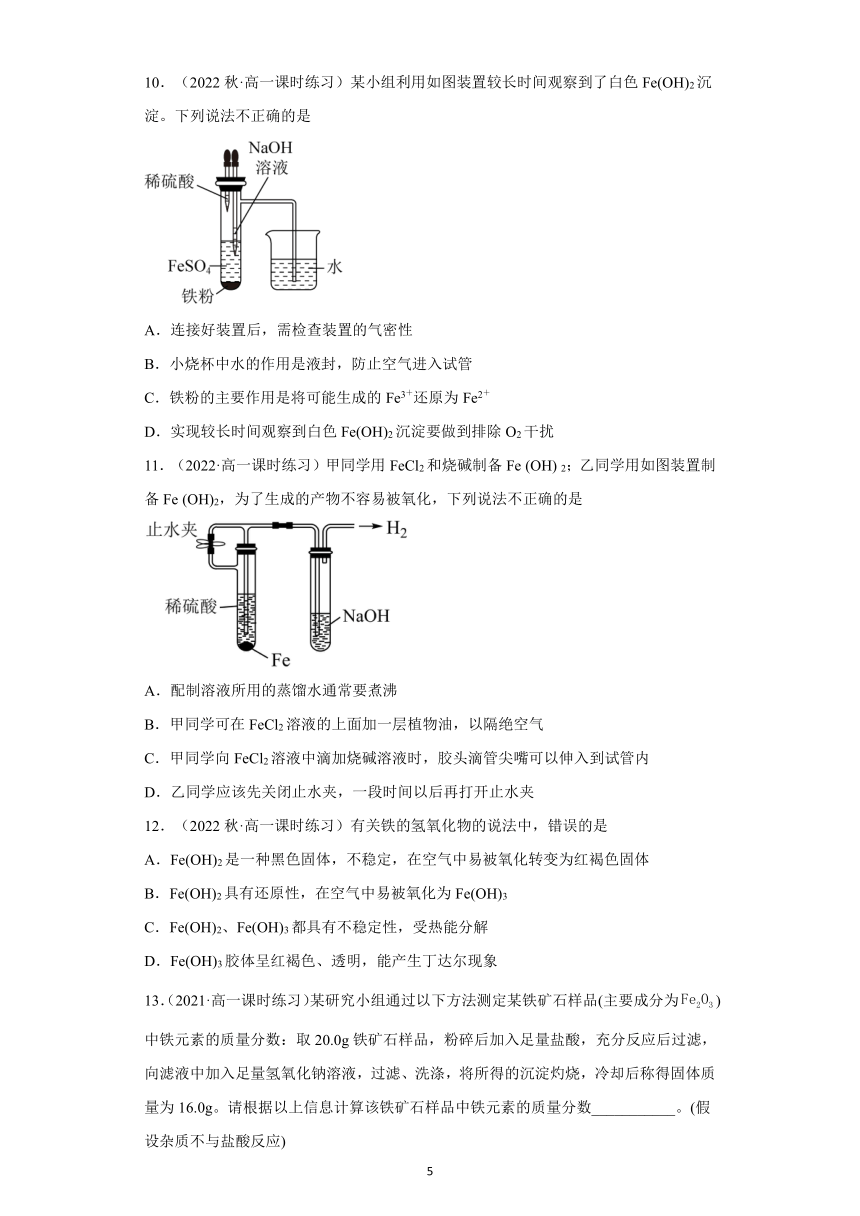
10.(2022秋·高一课时练习)某小组利用如图装置较长时间观察到了白色Fe(OH)2沉淀。下列说法不正确的是
A.连接好装置后,需检查装置的气密性
B.小烧杯中水的作用是液封,防止空气进入试管
C.铁粉的主要作用是将可能生成的Fe3+还原为Fe2+
D.实现较长时间观察到白色Fe(OH)2沉淀要做到排除O2干扰
11.(2022·高一课时练习)甲同学用FeCl2和烧碱制备Fe (OH) 2;乙同学用如图装置制备Fe (OH)2,为了生成的产物不容易被氧化,下列说法不正确的是
A.配制溶液所用的蒸馏水通常要煮沸
B.甲同学可在FeCl2溶液的上面加一层植物油,以隔绝空气
C.甲同学向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴可以伸入到试管内
D.乙同学应该先关闭止水夹,一段时间以后再打开止水夹
12.(2022秋·高一课时练习)有关铁的氢氧化物的说法中,错误的是
A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化转变为红褐色固体
B.Fe(OH)2具有还原性,在空气中易被氧化为Fe(OH)3
C.Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解
D.Fe(OH)3胶体呈红褐色、透明,能产生丁达尔现象
13.(2021·高一课时练习)某研究小组通过以下方法测定某铁矿石样品(主要成分为)中铁元素的质量分数:取20.0g铁矿石样品,粉碎后加入足量盐酸,充分反应后过滤,向滤液中加入足量氢氧化钠溶液,过滤、洗涤,将所得的沉淀灼烧,冷却后称得固体质量为16.0g。请根据以上信息计算该铁矿石样品中铁元素的质量分数___________。(假设杂质不与盐酸反应)
14.(2022秋·高一课时练习)铁的氧化物
(1)物理性质
FeO Fe2O3 Fe3O4
俗称 无 ①______ ②_____
颜色 黑 ③______ ④______
价态 +2 ⑤______ ⑥______
水溶解性 不溶 不溶 不溶
用途 —— ⑦______ ⑧______
(2)化学性质
①FeO不稳定,在空气中受热生成Fe3O4:_______。
②FeO和Fe2O3均为_______氧化物,盐酸反应的离子方程式分别为:_______;_______。
15.(2020·高一课时练习)《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用,某博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物
主要成分的化学式
铁器在具有、_____等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ.转化为。
Ⅱ.在自然环境中形成,该物质中铁元素的化合价为_______。
Ⅲ.和反应形成致密的保护层,的作用是_______。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ.保护层被氧化为,如此往复腐蚀,___+___+_______(将反应补充完整)
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成保护层,方法如下: 将铁器浸没在盛有溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用溶液洗涤至无Cl-。
①检测洗涤液中 Cl-的方法是_____。
②脱氯反应:。离子反应的本质是离子浓度的减小,比较与溶解度的大小:__________较大。[填与]
16.(2020·高一课时练习)用下面两种方法可以制得白色沉淀。
方法一:用溶液与不含的蒸馏水配制的溶液反应制备。
(1)除去蒸馏水中溶解的常采用_____________________的方法。
(2)生成白色沉淀的操作是用长滴管吸取不含的溶液,插入溶液液面以下,再挤出溶液。这样操作的理由是______________________。
方法二:在如图所示装置中,用不含的溶液、铁屑和稀硫酸制备。
(3)在试管Ⅰ中加入的试剂是________________________________________________。
(4)在试管Ⅱ中加入的试剂是________________________________________________。
(5)为了制得白色沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________________________________________________________________________。
(6)这样生成的沉淀能较长时间保持白色,其理由是_____________________________________________________________________。
试卷第1页,共3页
参考答案:
1.D
【详解】A.为红棕色固体,A错误;
B.根据信息可知,在时与氧气反应生成,继续升高温度生成,而在时转化为,则反应②的温度比反应③的温度低,B错误;
C.不稳定,在空气里受热能迅速被氧化为,其稳定性弱于,C错误;
D.中为价和价,化学式可写为,D正确;
答案选D。
2.C
【详解】A.氯气是黄绿色有毒气体,密度比空气大,A正确;
B.氧化铁为红棕色固体,俗称铁红,B正确;
C.四氧化三铁为黑色固体,有磁性,又称磁性氧化铁,C错误;
D.氧化亚铁为黑色固体,D正确;
答案选C。
3.D
【详解】A.“OTC”代表非处方药,R代表处方药,A正确;
B.油脂、蔗糖均含碳元素,不根据其组成和结构特点,属于有机物,B正确;
C.该"纳米药物分子车”的直径为20Onm,而胶体分散质粒子直径为1~100nm,所以该"纳米药物分子车"分散于水中所得的分散系不属于胶体,C正确;
D.由图可知,该有机物中含有四氧化三铁,其中有+2价和+3价铁,D错误;
故选D。
4.C
【详解】A.产物中的酸性氧化物只有SO2,故A错误;
B.Fe2O3是红色粉末,所得赤色物质为Fe2O3,故B错误;
C.反应,一种物质变为多种物质,属于分解反应,故C正确;
D.反应中铁元素化合价由+2升高为+3,铁元素被氧化,故D错误;
选C。
5.D
【详解】n(HCl)=0.14 L×5.0 mol/L=0.7 mol,由氧化物和盐酸反应生成水可知,氧化物中含有n(O)=n(HCl)=0.35 mol,所得溶液还能吸收0.025 mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,反应后所得溶液为FeCl3,因n(Cl-)=0.7 mol+0.025 mol×2=0.75 mol,则n(Fe3+) = n(Cl-)=0.25 mol,所以氧化物中n(Fe):n(O)=0.25:0.35=5:7,故该铁的氧化物化学式为Fe5O7,故合理选项是D。
6.C
【分析】废旧金属材料在焙烧过程中,金属被氧化为氧化物,再加入NaOH溶液,A12O3与NaOH溶液反应生成NaAlO2,过滤,得到滤渣Fe2O3、FeO、Fe3O4、CuO,向滤渣中加入硫酸,向溶液中加入过量铁粉,过滤,向滤渣中加入硫酸,铁溶解变为硫酸亚铁。
【详解】A.Fe、Cu、Al在焙烧过程中会生成对应的氧化物,故A正确;
B.操作I是过滤,则使用到的玻璃仪器有玻璃棒、小烧杯和漏斗,故B正确;
C.酸浸2是Fe、Cu混合物中Fe和硫酸反应,其发生的反应为Fe+2H+=Fe2++ H2↑,故C错误;
D.操作III是滤液II变为绿矾,其方法是蒸发浓缩、冷却结晶,故D正确。
7.B
【详解】①稀硫酸和铁粉生成H2,氢气排除了装置中的空气,在滴加氢氧化钠溶液,可以观察到白色沉淀;
②稀硫酸和铁粉生成H2,打开a止水夹,氢气排除了装置中的空气,过一段时间关闭a止水夹,A中生成硫酸亚铁的试管压强增大,将硫酸亚铁压如B试管,可以观察到白色沉淀;
③与空气直接接触,Fe(OH)2迅速被空气氧化成灰绿色最终变成红褐色的Fe(OH)3,不能较长时间观察到Fe(OH)2白色沉淀;
④在硫酸亚铁溶液上面加苯液封,隔绝空气,能较长时间观察到Fe(OH)2白色沉淀;
综上所述,①②④符合题意;
故选B。
8.B
【详解】A.氢气不纯加热易发生保证,应验纯后再点燃,A不符合操作要求;
B.HCl与碳酸氢钠溶液反应生成二氧化碳,图中洗气装置可分离,B能达到实验目的;
C.不能在容量瓶中溶解固体,应在烧杯中溶解冷却后转移到容量瓶中定容,C不符合实验操作要求;
D.生成氢氧化亚铁容易被氧化,应隔绝空气,D不能达到实验目的;
故答案选:B。
9.C
【详解】A.一氧化碳还原氧化铁时,反应物中没有单质参加反应,不属于置换反应,故A错误;
B.四氧化三铁中铁的化合价有+2、+3价,由化合物化合价代数和为0可知,四氧化三铁中铁元素的化合价显+3价,显+2价,故B错误;
C.维生素C将铁离子转化为亚铁离子时,铁元素的化合价降低被还原,维生素为反应的还原剂,表现还原性,故C正确;
D.氢氧化亚铁浊液露置于空气中,白色沉淀迅速变为灰绿色,最后变为红褐色,故D错误;
故选C。
10.C
【分析】根据装置图可知:连接好装置后,先检查装置的气密性。左侧试管内利用铁与稀硫酸反应生成氢气,用氢气作保护气,反应一段时间后检验导管口排出气体的纯度,氢气纯时,说明空气排尽,导管口用水液封,再滴加氢氧化钠溶液与生成的硫酸亚铁溶液反应,在氢气作保护气的条件下保证了新制的氢氧化亚铁不被氧化,据此答题。
【详解】A.有气体生成的实验,连接好装置后,首先要检查装置的气密性,A正确;
B.反应一段时间后检验导管口排出氢气为纯净时,说明空气排尽,导管口用水液封,防止空气进入试管,B正确;
C.铁粉的主要作用是与稀H2SO4反应生成硫酸亚铁溶液,C错误;
D.Fe(OH)2遇到氧气会被氧气氧化成Fe(OH)3,所以在制取氢氧化亚铁时,要做到排除O2干扰,D正确;
故答案选:C。
11.D
【详解】A.配制溶液时未防止水中溶解的氧气氧化亚铁离子,应先加热煮沸蒸馏水除去溶解氧,以防氧化亚铁离子,故A正确;
B.植物油的密度比水小,浮在水面上可以起到隔绝空气的作用,防止亚铁离子被氧化,故B正确;
C.向FeCl2溶液中滴加烧碱溶液,为防止空气的氧气被带入溶液中,将胶头滴管尖嘴直接伸入试管内在挤出氢氧化钠,故C正确;
D.实验过程中应先打开止水夹,让产生的氢气排尽装置内的空气,以防亚铁离子氧化,故D错误;
故选:D。
12.A
【详解】A.Fe(OH)2是一种白色固体,不稳定,在空气中易被氧化转变为红褐色固体Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故A错误;
B.Fe(OH)2具有还原性,在空气中易被氧化为Fe(OH)3,故B正确;
C.Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解为相应的氧化物和水,故C正确;
D.Fe(OH)3胶体呈红褐色、透明,能产生丁达尔现象,故D正确;
故选A。
13.56.0%
【详解】由题意可知,铁矿石样品中的氧化铁与足量盐酸充分反应得到氯化铁溶液,氯化铁溶液与足量氢氧化钠溶液反应得到氢氧化铁沉淀,氢氧化铁灼烧得到氧化铁,由铁原子个数守恒可知,铁矿石样品中铁元素的质量分数为×100%=56.0 %,故答案为:56.0%。
14.(1) 铁红 磁性氧化铁 红棕 黑 +3 +2,+3 油漆、涂料、油墨等 磁铁
(2) 6FeO+O22Fe3O4 碱性 FeO+2H+=Fe2++H2O Fe2O3+6H+=2Fe3++3H2O
【解析】略
15. H2O或潮湿 +3 c 4 1 6 12 取少量洗涤液于试管中,加入稀硝酸和硝酸银的混合液,若无白色沉淀产生说明无Cl- FeOCl
【详解】(1)铁器在潮湿的环境中和氧气发生电化腐蚀生成铁锈,铁器在具有O2、H2O 等环境中容易被腐蚀;答案为H2O(或潮湿)。
(2)II.根据化合物中元素化合价代数和为0,计算FeO(OH)中铁元素的化合价为+3;答案为+3。
III.FeO(OH)和Fe2+反应形成致密的Fe3O4保护层,四氧化三铁看作Fe2O3 FeO,所以Fe2+既不是氧化剂也不是还原剂,故选c;答案为c。
IV.反应中O2中O元素的化合价降低4,Fe3O4中3个Fe的化合价共升高1,根据化合价升降守恒可知,Fe3O4的计量数为4,O2的计量数为1,结合原子守恒配平得到反应的化学方程式为:4Fe3O4+O2+6H2O=12FeO(OH);答案为4,1,6,12。
(3)①检验Cl-常用硝酸酸化的硝酸银溶液,操作为:取少量洗涤液于试管中,加入稀硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明无Cl-;答案为取少量洗涤液于试管中,加入稀硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明无Cl-。
②化学反应有从溶解度小的物质转化为溶解度更小的趋势,由于不溶物FeOCl→FeO(OH),所以FeOCl的溶解度大于FeO(OH);答案为FeOCl。
16. 煮沸 避免生成的沉淀接触而被氧化 稀硫酸﹑铁屑 不含氧气的溶液 检验试管Ⅱ出口处的纯度,当排出的纯净时,再夹紧止水夹 试管Ⅰ中反应生成的充满了试管Ⅰ和试管Ⅱ,且外界空气不易进入装置中
【分析】方法一利用制备的NaOH溶液,用滴管吸入NaOH溶液,伸入到硫酸亚铁溶液液面以下,挤出滴管中液体发生反应生成氢氧化亚铁沉淀。
方法二中试管Ⅱ是开口式的,无法利用产生的气体将溶液压入试管Ⅰ中,所以制取应在试管Ⅰ中进行,而在试管Ⅱ中应加入不含的溶液。当把Fe与稀硫酸加入试管Ⅰ中后,打开止水夹,产生的可排尽装置内的空气。最后关闭止水夹,试管Ⅰ内产生的无法逸出,压强增大,将试管Ⅰ内的溶液通过长导管压入试管Ⅱ内,据此分析解答。
【详解】(1)常采用煮沸的方法除去蒸馏水中的;故答案为:煮沸。
(2)题述操作是为了防止滴加溶液时带入空气,避免生成的接触;故答案为:避免生成的沉淀接触而被氧化。
(3)根据分析试管Ⅰ反应生成氢气和硫酸亚铁,因此加入的试剂是稀硫酸﹑铁屑;故答案为:稀硫酸﹑铁屑。
(4)根据分析试管Ⅱ发生硫酸亚铁和氢氧化钠反应生成氢氧化亚铁沉淀,试管Ⅰ是制备硫酸亚铁,因此试管Ⅱ盛放的试剂是NaOH溶液;故答案为:不含氧气的溶液。
(5)当把Fe与稀硫酸加入试管Ⅰ中后,打开止水夹,产生的可排尽装置内的空气。最后关闭止水夹;故答案为:检验试管Ⅱ出口处的纯度,当排出的纯净时,再夹紧止水夹。
(6)试管Ⅰ内产生的无法逸出,压强增大将试管Ⅰ内的溶液通过长导管压入试管Ⅱ内,在此过程中,液体处于氛围中,不易被氧化,能较长时间保持白色;故答案为:试管Ⅰ中反应生成的充满了试管Ⅰ和试管Ⅱ,且外界空气不易进入装置中。
【点睛】制备氢氧化亚铁时,由于氢氧化亚铁、铁离子易被氧化,因此在制备过程中要防止氧气进入,要排除装置内的空气。
1. 掌握铁的几种常见氧化物的性质和两种氢氧化物的性质及制备。
2. 掌握铁的氧化物和氢氧化物的用途。
一、铁的氧化物
铁的氧化物主要有 3 种,分别是氧化亚铁 (FeO)、氧化铁 (Fe2O3)、四氧化三铁 (Fe3O4),它们都不溶于水且不与水反应。
题型演练
1.(2022·高一课时练习)某同学对铁的氧化物产生了浓厚兴趣,查阅资料后制成以下卡片:
在空气中把铁灼烧到500℃生成Fe3O4;温度再升高可生成Fe2O3;再更高的温度(约1400℃)下加热Fe2O3时,又可得到Fe3O4。即:FeFe3O4Fe2O3
下列说法正确的是
A.FeO、Fe2O3和Fe3O4均为黑色固体
B.反应②的温度比反应③的温度高
C.FeO的稳定性强于Fe2O3
D.四氧化三铁中铁元素的化合价较复杂,其组成可表示为FeO Fe2O3
2.(2022·高一课时练习)化学既是一门变幻无穷的神奇学科,也是一个色彩缤纷的美丽世界,对下列物质的颜色判断错误的是
A.Cl2:黄绿色气体 B.Fe2O3:红棕色固体
C.Fe3O4:红棕色固体 D.FeO:黑色固体
3.(2022秋·高一课时练习)能够在人体血管中通行的药物分子运输车——“纳米药物分子运输车”在中国科学院上海硅酸盐研究所研制成功,该“运输车”可提高肿瘤的治疗效果,其结构如图所示。下列有关说法错误的是
A.包装上印“OTC”标识的药物为非处方药
B.油脂、蔗糖等这类含碳化合物属于有机物
C.分散质粒子直径在1~100nm的分散系为胶体,该“运输车”分散于水中所得的分散系不属于胶体
D.该“运输车”中铁元素的价态为+3价
4.(2022秋·高一课时练习)《新修本草》中描述“青矾”为“本来绿色,新出窟未见风者,正如琉璃……烧之赤色……”。青矾加热时的反应为。下列说法正确的是
A.产物中含有3种酸性氧化物 B.所得赤色物质为
C.反应为分解反应 D.铁元素被还原
5.(2022秋·高一课时练习)有一块铁的“氧化物”样品,用140 mL5.0 mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025 mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
6.(2022秋·高一课时练习)某废旧金属材料中主要含Fe、Cu、Al、Fe2O3、FeO、A12O3、CuO等,现利用下列工艺流程回收部分金属及金属化合物:
已知:绿矾为FeSO4 7H2O。下列说法中错误的是
A.焙烧过程中金属单质转化成了对应的氧化物
B.操作I使用到的玻璃仪器有玻璃棒、小烧杯和漏斗
C.酸浸2发生的反应为Fe+Cu2+=Fe2++Cu
D.操作III的方法是蒸发浓缩、冷却结晶
二、铁的氢氧化物
铁有两种常见的氢氧化物,红褐色的氢氧化铁 Fe(OH)3 和白色的氢氧化亚铁 Fe(OH)2,它们都是不溶于水的弱碱。
1.与酸反应
都能与盐酸或者稀硫酸发生中和反应生成相应的盐和水。
Fe(OH)3 +3HCl=FeCl3 +3H2O
Fe(OH)2 +2HCl=FeCl2 +2H2O
2.不稳定性
① 将氢氧化铁加热可以得到对应的氧化物——氧化铁。
2Fe(OH)3 ==△ ==Fe2O3+3H2O
② 氢氧化亚铁有很强的还原性,在空气中极易被氧化变为氢氧化铁。
4Fe(OH)2 +O2+2H2O=4Fe(OH)3
10
3.Fe(OH)3 和 Fe(OH)2 的制备
铁的两种氢氧化物,他们都可由相对应的可溶性盐与碱溶液反应制得。例如,Fe(OH)3 可由 FeCl3 和 NaOH 反应生成,对应的离子方程式为:Fe3+ +3OH- = Fe(OH)3 ↓。
题型演练
7.(2021·高一课时练习)下列各图示中能较长时间观察到的是
A.①②③ B.①②④ C.①②③④ D.②③④
8.(2022秋·高一课时练习)下列实验能达到实验目的且符合操作要求的是
A.Ⅰ可用于制备并检验氢气的可燃性
B.Ⅱ可用于除去CO2中的HCl
C.用Ⅲ来配制一定物质的量浓度的NaOH溶液
D.用Ⅳ中操作制备氢氧化亚铁并观察其颜色
9.(2022·高一课时练习)化合价和物质类别是整理元素及化合物知识的两个要素,可表示为“价-类”二维图。铁元素的“价一类”二维图如图所示,下列说法正确的是
A.工业上用CO还原Fe2O3炼铁,该反应为置换反应
B.Fe3O4中铁的化合价显+2价,显+3价
C.维生素C能将Fe3+转化为Fe2+,过程中维生素C作还原剂
D.Fe(OH)2浊液露置于空气中,由白色迅速变为棕黄色
10.(2022秋·高一课时练习)某小组利用如图装置较长时间观察到了白色Fe(OH)2沉淀。下列说法不正确的是
A.连接好装置后,需检查装置的气密性
B.小烧杯中水的作用是液封,防止空气进入试管
C.铁粉的主要作用是将可能生成的Fe3+还原为Fe2+
D.实现较长时间观察到白色Fe(OH)2沉淀要做到排除O2干扰
11.(2022·高一课时练习)甲同学用FeCl2和烧碱制备Fe (OH) 2;乙同学用如图装置制备Fe (OH)2,为了生成的产物不容易被氧化,下列说法不正确的是
A.配制溶液所用的蒸馏水通常要煮沸
B.甲同学可在FeCl2溶液的上面加一层植物油,以隔绝空气
C.甲同学向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴可以伸入到试管内
D.乙同学应该先关闭止水夹,一段时间以后再打开止水夹
12.(2022秋·高一课时练习)有关铁的氢氧化物的说法中,错误的是
A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化转变为红褐色固体
B.Fe(OH)2具有还原性,在空气中易被氧化为Fe(OH)3
C.Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解
D.Fe(OH)3胶体呈红褐色、透明,能产生丁达尔现象
13.(2021·高一课时练习)某研究小组通过以下方法测定某铁矿石样品(主要成分为)中铁元素的质量分数:取20.0g铁矿石样品,粉碎后加入足量盐酸,充分反应后过滤,向滤液中加入足量氢氧化钠溶液,过滤、洗涤,将所得的沉淀灼烧,冷却后称得固体质量为16.0g。请根据以上信息计算该铁矿石样品中铁元素的质量分数___________。(假设杂质不与盐酸反应)
14.(2022秋·高一课时练习)铁的氧化物
(1)物理性质
FeO Fe2O3 Fe3O4
俗称 无 ①______ ②_____
颜色 黑 ③______ ④______
价态 +2 ⑤______ ⑥______
水溶解性 不溶 不溶 不溶
用途 —— ⑦______ ⑧______
(2)化学性质
①FeO不稳定,在空气中受热生成Fe3O4:_______。
②FeO和Fe2O3均为_______氧化物,盐酸反应的离子方程式分别为:_______;_______。
15.(2020·高一课时练习)《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用,某博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物
主要成分的化学式
铁器在具有、_____等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ.转化为。
Ⅱ.在自然环境中形成,该物质中铁元素的化合价为_______。
Ⅲ.和反应形成致密的保护层,的作用是_______。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ.保护层被氧化为,如此往复腐蚀,___+___+_______(将反应补充完整)
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成保护层,方法如下: 将铁器浸没在盛有溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用溶液洗涤至无Cl-。
①检测洗涤液中 Cl-的方法是_____。
②脱氯反应:。离子反应的本质是离子浓度的减小,比较与溶解度的大小:__________较大。[填与]
16.(2020·高一课时练习)用下面两种方法可以制得白色沉淀。
方法一:用溶液与不含的蒸馏水配制的溶液反应制备。
(1)除去蒸馏水中溶解的常采用_____________________的方法。
(2)生成白色沉淀的操作是用长滴管吸取不含的溶液,插入溶液液面以下,再挤出溶液。这样操作的理由是______________________。
方法二:在如图所示装置中,用不含的溶液、铁屑和稀硫酸制备。
(3)在试管Ⅰ中加入的试剂是________________________________________________。
(4)在试管Ⅱ中加入的试剂是________________________________________________。
(5)为了制得白色沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________________________________________________________________________。
(6)这样生成的沉淀能较长时间保持白色,其理由是_____________________________________________________________________。
试卷第1页,共3页
参考答案:
1.D
【详解】A.为红棕色固体,A错误;
B.根据信息可知,在时与氧气反应生成,继续升高温度生成,而在时转化为,则反应②的温度比反应③的温度低,B错误;
C.不稳定,在空气里受热能迅速被氧化为,其稳定性弱于,C错误;
D.中为价和价,化学式可写为,D正确;
答案选D。
2.C
【详解】A.氯气是黄绿色有毒气体,密度比空气大,A正确;
B.氧化铁为红棕色固体,俗称铁红,B正确;
C.四氧化三铁为黑色固体,有磁性,又称磁性氧化铁,C错误;
D.氧化亚铁为黑色固体,D正确;
答案选C。
3.D
【详解】A.“OTC”代表非处方药,R代表处方药,A正确;
B.油脂、蔗糖均含碳元素,不根据其组成和结构特点,属于有机物,B正确;
C.该"纳米药物分子车”的直径为20Onm,而胶体分散质粒子直径为1~100nm,所以该"纳米药物分子车"分散于水中所得的分散系不属于胶体,C正确;
D.由图可知,该有机物中含有四氧化三铁,其中有+2价和+3价铁,D错误;
故选D。
4.C
【详解】A.产物中的酸性氧化物只有SO2,故A错误;
B.Fe2O3是红色粉末,所得赤色物质为Fe2O3,故B错误;
C.反应,一种物质变为多种物质,属于分解反应,故C正确;
D.反应中铁元素化合价由+2升高为+3,铁元素被氧化,故D错误;
选C。
5.D
【详解】n(HCl)=0.14 L×5.0 mol/L=0.7 mol,由氧化物和盐酸反应生成水可知,氧化物中含有n(O)=n(HCl)=0.35 mol,所得溶液还能吸收0.025 mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,反应后所得溶液为FeCl3,因n(Cl-)=0.7 mol+0.025 mol×2=0.75 mol,则n(Fe3+) = n(Cl-)=0.25 mol,所以氧化物中n(Fe):n(O)=0.25:0.35=5:7,故该铁的氧化物化学式为Fe5O7,故合理选项是D。
6.C
【分析】废旧金属材料在焙烧过程中,金属被氧化为氧化物,再加入NaOH溶液,A12O3与NaOH溶液反应生成NaAlO2,过滤,得到滤渣Fe2O3、FeO、Fe3O4、CuO,向滤渣中加入硫酸,向溶液中加入过量铁粉,过滤,向滤渣中加入硫酸,铁溶解变为硫酸亚铁。
【详解】A.Fe、Cu、Al在焙烧过程中会生成对应的氧化物,故A正确;
B.操作I是过滤,则使用到的玻璃仪器有玻璃棒、小烧杯和漏斗,故B正确;
C.酸浸2是Fe、Cu混合物中Fe和硫酸反应,其发生的反应为Fe+2H+=Fe2++ H2↑,故C错误;
D.操作III是滤液II变为绿矾,其方法是蒸发浓缩、冷却结晶,故D正确。
7.B
【详解】①稀硫酸和铁粉生成H2,氢气排除了装置中的空气,在滴加氢氧化钠溶液,可以观察到白色沉淀;
②稀硫酸和铁粉生成H2,打开a止水夹,氢气排除了装置中的空气,过一段时间关闭a止水夹,A中生成硫酸亚铁的试管压强增大,将硫酸亚铁压如B试管,可以观察到白色沉淀;
③与空气直接接触,Fe(OH)2迅速被空气氧化成灰绿色最终变成红褐色的Fe(OH)3,不能较长时间观察到Fe(OH)2白色沉淀;
④在硫酸亚铁溶液上面加苯液封,隔绝空气,能较长时间观察到Fe(OH)2白色沉淀;
综上所述,①②④符合题意;
故选B。
8.B
【详解】A.氢气不纯加热易发生保证,应验纯后再点燃,A不符合操作要求;
B.HCl与碳酸氢钠溶液反应生成二氧化碳,图中洗气装置可分离,B能达到实验目的;
C.不能在容量瓶中溶解固体,应在烧杯中溶解冷却后转移到容量瓶中定容,C不符合实验操作要求;
D.生成氢氧化亚铁容易被氧化,应隔绝空气,D不能达到实验目的;
故答案选:B。
9.C
【详解】A.一氧化碳还原氧化铁时,反应物中没有单质参加反应,不属于置换反应,故A错误;
B.四氧化三铁中铁的化合价有+2、+3价,由化合物化合价代数和为0可知,四氧化三铁中铁元素的化合价显+3价,显+2价,故B错误;
C.维生素C将铁离子转化为亚铁离子时,铁元素的化合价降低被还原,维生素为反应的还原剂,表现还原性,故C正确;
D.氢氧化亚铁浊液露置于空气中,白色沉淀迅速变为灰绿色,最后变为红褐色,故D错误;
故选C。
10.C
【分析】根据装置图可知:连接好装置后,先检查装置的气密性。左侧试管内利用铁与稀硫酸反应生成氢气,用氢气作保护气,反应一段时间后检验导管口排出气体的纯度,氢气纯时,说明空气排尽,导管口用水液封,再滴加氢氧化钠溶液与生成的硫酸亚铁溶液反应,在氢气作保护气的条件下保证了新制的氢氧化亚铁不被氧化,据此答题。
【详解】A.有气体生成的实验,连接好装置后,首先要检查装置的气密性,A正确;
B.反应一段时间后检验导管口排出氢气为纯净时,说明空气排尽,导管口用水液封,防止空气进入试管,B正确;
C.铁粉的主要作用是与稀H2SO4反应生成硫酸亚铁溶液,C错误;
D.Fe(OH)2遇到氧气会被氧气氧化成Fe(OH)3,所以在制取氢氧化亚铁时,要做到排除O2干扰,D正确;
故答案选:C。
11.D
【详解】A.配制溶液时未防止水中溶解的氧气氧化亚铁离子,应先加热煮沸蒸馏水除去溶解氧,以防氧化亚铁离子,故A正确;
B.植物油的密度比水小,浮在水面上可以起到隔绝空气的作用,防止亚铁离子被氧化,故B正确;
C.向FeCl2溶液中滴加烧碱溶液,为防止空气的氧气被带入溶液中,将胶头滴管尖嘴直接伸入试管内在挤出氢氧化钠,故C正确;
D.实验过程中应先打开止水夹,让产生的氢气排尽装置内的空气,以防亚铁离子氧化,故D错误;
故选:D。
12.A
【详解】A.Fe(OH)2是一种白色固体,不稳定,在空气中易被氧化转变为红褐色固体Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故A错误;
B.Fe(OH)2具有还原性,在空气中易被氧化为Fe(OH)3,故B正确;
C.Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解为相应的氧化物和水,故C正确;
D.Fe(OH)3胶体呈红褐色、透明,能产生丁达尔现象,故D正确;
故选A。
13.56.0%
【详解】由题意可知,铁矿石样品中的氧化铁与足量盐酸充分反应得到氯化铁溶液,氯化铁溶液与足量氢氧化钠溶液反应得到氢氧化铁沉淀,氢氧化铁灼烧得到氧化铁,由铁原子个数守恒可知,铁矿石样品中铁元素的质量分数为×100%=56.0 %,故答案为:56.0%。
14.(1) 铁红 磁性氧化铁 红棕 黑 +3 +2,+3 油漆、涂料、油墨等 磁铁
(2) 6FeO+O22Fe3O4 碱性 FeO+2H+=Fe2++H2O Fe2O3+6H+=2Fe3++3H2O
【解析】略
15. H2O或潮湿 +3 c 4 1 6 12 取少量洗涤液于试管中,加入稀硝酸和硝酸银的混合液,若无白色沉淀产生说明无Cl- FeOCl
【详解】(1)铁器在潮湿的环境中和氧气发生电化腐蚀生成铁锈,铁器在具有O2、H2O 等环境中容易被腐蚀;答案为H2O(或潮湿)。
(2)II.根据化合物中元素化合价代数和为0,计算FeO(OH)中铁元素的化合价为+3;答案为+3。
III.FeO(OH)和Fe2+反应形成致密的Fe3O4保护层,四氧化三铁看作Fe2O3 FeO,所以Fe2+既不是氧化剂也不是还原剂,故选c;答案为c。
IV.反应中O2中O元素的化合价降低4,Fe3O4中3个Fe的化合价共升高1,根据化合价升降守恒可知,Fe3O4的计量数为4,O2的计量数为1,结合原子守恒配平得到反应的化学方程式为:4Fe3O4+O2+6H2O=12FeO(OH);答案为4,1,6,12。
(3)①检验Cl-常用硝酸酸化的硝酸银溶液,操作为:取少量洗涤液于试管中,加入稀硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明无Cl-;答案为取少量洗涤液于试管中,加入稀硝酸酸化的硝酸银溶液,若无白色沉淀产生,说明无Cl-。
②化学反应有从溶解度小的物质转化为溶解度更小的趋势,由于不溶物FeOCl→FeO(OH),所以FeOCl的溶解度大于FeO(OH);答案为FeOCl。
16. 煮沸 避免生成的沉淀接触而被氧化 稀硫酸﹑铁屑 不含氧气的溶液 检验试管Ⅱ出口处的纯度,当排出的纯净时,再夹紧止水夹 试管Ⅰ中反应生成的充满了试管Ⅰ和试管Ⅱ,且外界空气不易进入装置中
【分析】方法一利用制备的NaOH溶液,用滴管吸入NaOH溶液,伸入到硫酸亚铁溶液液面以下,挤出滴管中液体发生反应生成氢氧化亚铁沉淀。
方法二中试管Ⅱ是开口式的,无法利用产生的气体将溶液压入试管Ⅰ中,所以制取应在试管Ⅰ中进行,而在试管Ⅱ中应加入不含的溶液。当把Fe与稀硫酸加入试管Ⅰ中后,打开止水夹,产生的可排尽装置内的空气。最后关闭止水夹,试管Ⅰ内产生的无法逸出,压强增大,将试管Ⅰ内的溶液通过长导管压入试管Ⅱ内,据此分析解答。
【详解】(1)常采用煮沸的方法除去蒸馏水中的;故答案为:煮沸。
(2)题述操作是为了防止滴加溶液时带入空气,避免生成的接触;故答案为:避免生成的沉淀接触而被氧化。
(3)根据分析试管Ⅰ反应生成氢气和硫酸亚铁,因此加入的试剂是稀硫酸﹑铁屑;故答案为:稀硫酸﹑铁屑。
(4)根据分析试管Ⅱ发生硫酸亚铁和氢氧化钠反应生成氢氧化亚铁沉淀,试管Ⅰ是制备硫酸亚铁,因此试管Ⅱ盛放的试剂是NaOH溶液;故答案为:不含氧气的溶液。
(5)当把Fe与稀硫酸加入试管Ⅰ中后,打开止水夹,产生的可排尽装置内的空气。最后关闭止水夹;故答案为:检验试管Ⅱ出口处的纯度,当排出的纯净时,再夹紧止水夹。
(6)试管Ⅰ内产生的无法逸出,压强增大将试管Ⅰ内的溶液通过长导管压入试管Ⅱ内,在此过程中,液体处于氛围中,不易被氧化,能较长时间保持白色;故答案为:试管Ⅰ中反应生成的充满了试管Ⅰ和试管Ⅱ,且外界空气不易进入装置中。
【点睛】制备氢氧化亚铁时,由于氢氧化亚铁、铁离子易被氧化,因此在制备过程中要防止氧气进入,要排除装置内的空气。
