3.2.3元素及其化合物计算 学案(含解析)
文档属性
| 名称 | 3.2.3元素及其化合物计算 学案(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 567.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-04 10:24:32 | ||
图片预览



文档简介
3.2.3元素及其化合物计算
1. 掌握铁及其化合物之间的转化关系,能定性和定量分析图像和计算问题。
2. 掌握铝及其化合物之间的转化关系,能定性和定量分析图像和计算问题。
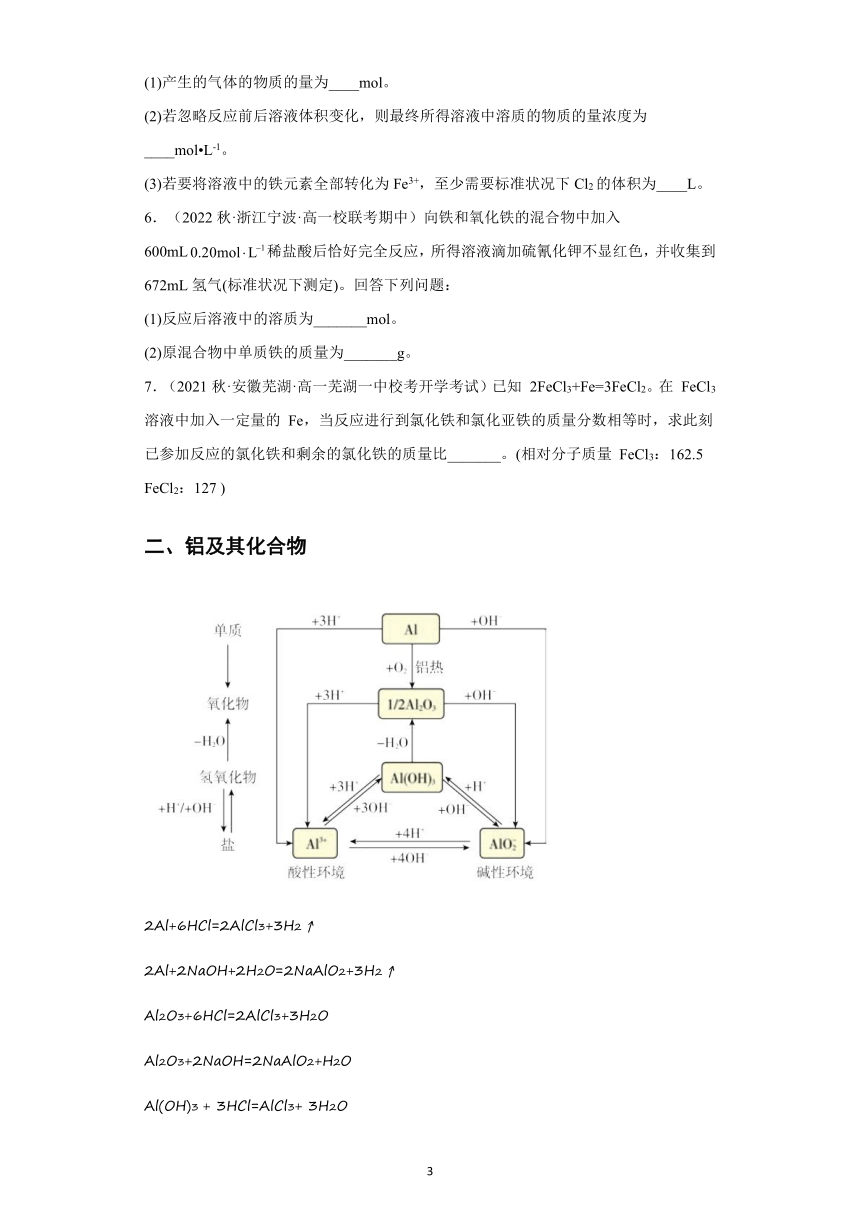
一、铁及其化合物
3Fe+4H2O(g) Fe3O4+4H2
Fe+2FeCl3=3FeCl2、Cu+2FeCl3=CuCl2+2FeCl2
2FeCl2+Cl2=2FeCl3
FeCl2+2NaOH=Fe(OH)2 ↓ +2NaCl
FeCl3+3NaOH=Fe(OH)3 ↓ +3NaCl
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe(OH)3 Fe2O3+3H2O
计算专题
1.(2020·高一课时练习)(1)将铁和氧化铁的混合物投入到某浓度的硫酸溶液中,恰好完全反应,并产生(标准状况),向反应后的溶液中滴入溶液,溶液不显红色。试计算所用硫酸溶液的物质的量浓度______________。
(2)将一定质量的铁、氧化铁、氧化铜的固体混合物加入盐酸中,充分反应后产生(标准状况),残留固体。过滤,滤液中无。将滤液加水稀释到,测得其中为。试计算原混合物中单质铁的质量______________。
2.(2020·高一单元测试)硫酸铁铵[]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(1)步骤③中选用足量的,理由是______。
(2)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______。
3.(2023春·浙江宁波·高一校联考期中)向铁和氧化铁的混合物中加入470mL0.20mol/L稀盐酸后恰好完全溶解,得到只含一种金属离子的浅绿色溶液,并收集到448mL氢气(标准状况下测定)。回答下列问题:
(1)收集气体的物质的量为_______。
(2)原混合物中单质铁的质量为_______g。
4.(2023秋·浙江杭州·高二期末)将2.88gCu与Fe2O3的混合物加入40.0 mL2.00 mol/L的稀硫酸中,充分反应后剩余固体的质量为0.640 g。继续往溶液中加入一定质量的铁粉,溶液质量增加了1.54 g,请计算:
(1)混合物中Cu与Fe2O3物质的量之比为_______。
(2)继续加入铁粉的质量为_______。
5.(2022秋·浙江·高一期中)向一定量的Fe和Fe2O3的混合物中加入480mL0.250mol L-1稀盐酸后恰好完全溶解,放出标准状况下的气体672mL,在溶液中加入KSCN溶液无血红色出现。回答下列问题:
(1)产生的气体的物质的量为____mol。
(2)若忽略反应前后溶液体积变化,则最终所得溶液中溶质的物质的量浓度为____mol L-1。
(3)若要将溶液中的铁元素全部转化为Fe3+,至少需要标准状况下Cl2的体积为____L。
6.(2022秋·浙江宁波·高一校联考期中)向铁和氧化铁的混合物中加入600mL稀盐酸后恰好完全反应,所得溶液滴加硫氰化钾不显红色,并收集到672mL氢气(标准状况下测定)。回答下列问题:
(1)反应后溶液中的溶质为_______mol。
(2)原混合物中单质铁的质量为_______g。
7.(2021秋·安徽芜湖·高一芜湖一中校考开学考试)已知 2FeCl3+Fe=3FeCl2。在 FeCl3 溶液中加入一定量的 Fe,当反应进行到氯化铁和氯化亚铁的质量分数相等时,求此刻已参加反应的氯化铁和剩余的氯化铁的质量比_______。(相对分子质量 FeCl3:162.5 FeCl2:127 )
二、铝及其化合物
2Al+6HCl=2AlCl3+3H2 ↑
2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
Al(OH)3 + 3HCl=AlCl3+ 3H2O
Al(OH)3 +NaOH=NaAlO2+ 2H2O
Al3++3OH-=Al(OH)3 ↓
Al3++4OH-=AlO2-+2H2O
Al3++ 3NH3 ·H2O = Al(OH)3 ↓ + 3NH4+
AlO2-+H++H2O=Al(OH)3 ↓
AlO2-+4H+=Al3++2H2O
计算专题
8.(2022春·云南昆明·高一校考阶段练习)已知铝是一种能够和强碱溶液反应生成氢气的一种特殊金属,其反应的化学方程式为,现向溶液中投入,二者恰好完全反应,计算:
(1)参加反应的的物质的量浓度________;
(2)生成的在标准状况下的体积________。
9.(2022秋·吉林松原·高一校考期末)把10.2g镁铝合金的粉末放入过量的盐酸中,得到11.2LH2(标准状况下)。试计算:
(1)该合金中镁的质量分数为_______。
(2)该合金中镁与铝的物质的量之比为_______。
(3)该合金溶于足量的烧碱溶液中,产生H2的体积(标准状况下)用是_______;
10.(2022秋·宁夏银川·高一校考期末)计算题
(1)含0.4 mol Al3+ 的Al2 (SO4 )3中所含的SO的物质的量是_______。
(2)_______ mol H2O2所含原子数与0.2mol H3PO4所含原子数相等。
(3)把10.2 g镁铝合金的粉末放入过量的烧碱中,得到6.72 L标准状况下的H2。
分别进行下列相关计算(要求写出必要的计算过程)。
① 该合金中铝的质量分数为_______ ;
② 该合金中镁与铝的物质的量之比为_______;
③ 该合金溶于足量的盐酸溶液中,产生H2的体积(标准状况下)为_______。
试卷第1页,共3页
参考答案:
1.
【详解】(l)向反应后的溶液中滴入溶液,溶液不显红色,说明溶液中不含铁离子,发生的反应有:,,;
设混合物中Fe、的物质的量分别为x、y,标准状况下产生的物质的量为,则有;
根据反应方程式有关系式:铁有两部分,一部分与铁离子反应,另一部分与酸反应,即,,可以得到:,即,结合,解得,;
因恰好完全反应,反应后溶液中的溶质为,根据硫元素守恒和铁元素守恒,则;
故所用硫酸溶液的物质的量浓度为;
(2)盐酸中,标准状况下产生的物质的量;①根据,消耗的铁的物质的量为0.04mol,消耗的盐酸的物质的量为0.08mol;
②滤液中剩余的的物质的量为,则Fe无剩余,固体全部是Cu,又滤液中无;故滤液中无,;由、可知,2HCl~CuCl2~Fe~Cu,这两个反应中消耗的为,消耗的Fe为;
③、,这两个反应中消耗的为,根据,消耗的Fe为,所以Fe的总物质的量为,。
2. 将全部氧化为;不引入杂质
【详解】(1)步骤③中选用足量的,是为了将全部氧化为,是绿色氧化剂,还原产物是水,在氧化的过程中,不引入杂质;
(2)失重5.6%是质量分数,设结晶水合物的化学式为,由题意可知,,解得x=12,因此硫酸铁铵晶体的化学式为。
3.(1)0.02 mol
(2)1.68g
【分析】氧化铁为碱性氧化物,先发生Fe2O3+6H+=2Fe3++3H2O,Fe3+氧化性强于H+,接着发生2Fe3++Fe=3Fe2+,有气体产生,然后在发生Fe+2H+=H2↑+Fe2+,据此分析。
【详解】(1)收集气体的物质的量为。
(2)根据上述分析,反应后溶液的溶质为FeCl2,因为得到只含一种金属离子的浅绿色溶液,即HCl完全反应,利用元素守恒,得出n(FeCl2)===0.05mol,根据铁元素守恒,得出n(Fe)+2n(Fe2O3)=0.05mol,根据得失电子数目守恒,2n(Fe)=2n(Fe2O3)+2n(H2) ,2n(Fe)=2n(Fe2O3)+2×0.02mol,联立解得n(Fe)=0.03mol,n(Fe2O3)=0.01mol,故原混合物中单质铁的质量为0.03mol×56g·mol-1=1.68g。
4.(1)2:1
(2)2.24g
【详解】(1)假设2.88g全是Fe2O3,即为0.018mol,Fe2O3和硫酸反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,消耗硫酸0.054mol,小于题给硫酸的0.04L×2.00mol/L=0.08mol,所以反应后硫酸有剩余,Fe2O3和硫酸完全反应,生成的硫酸铁和铜反应:Fe2(SO4)3+Cu=CuSO4+2FeSO4,反应后有固体剩余,则剩余的固体0.640g为铜,物质的量为0.01mol。根据反应方程式可知,反应中消耗的氧化铁和铜的物质的量相等,假设原有Fe2O3的物质的量为x,则消耗的铜的物质的量也为x,有160x+64x+0.640=2.88,解得x=0.01mol,则原有铜的物质的量为0.01mol+0.01mol=0.02mol,所以混合物中铜和Fe2O3的物质的量之比为2:1。
(2)原有Fe2O3的物质的量为0.01mol,则反应消耗的硫酸的物质的量为0.03mol,剩余硫酸为0.05mol。加入铁粉前,溶液中含0.01molCuSO4、0.02molFeSO4和0.05molH2SO4,加入铁粉,先发生反应:
后发生反应:
此时消耗n(H2SO4)==0.03mol<0.05mol,则硫酸有剩余。则n(Fe)= n(H2SO4)=0.03mol,因此继续加入铁粉的质量为(0.01mol+0.03mol)×56g/mol=2.24g。
5.(1)0.03
(2)0.125
(3)0.672
【详解】(1)标准状况下的气体672mL=0.672L,n==0.03mol;
(2)最终所得溶液中溶质为FeCl2,HCl的物质的量为0.480L×0.250mol L-1=0.12mol,HCl先与Fe2O3反应,Fe2O3-6HCl- 2FeCl3- 3FeCl2;Fe-Fe2+-H2,氯离子完全转化为FeCl2,由生成的FeCl2的物质的量为0.06mol,FeCl2浓度为0.06mol÷0.48L=0.125mol L-1;
(3)生成的FeCl2的物质的量为0.06mol,2FeCl2+ Cl2= 2FeCl3,若要将溶液中的铁元素全部转化为Fe3+,至少Cl2的物质的量为0.03mol,标准状况下的体积为:0.03mol×22.4L/mol=0.672L。
6.(1)0.06
(2)2.24
【分析】氧化铁为碱性氧化物,先发生Fe2O3+6H+=2Fe3++3H2O,Fe3+氧化性强于H+,接着发生2Fe3++Fe=3Fe2+,有气体产生,然后在发生Fe+2H+=H2↑+Fe2+,据此分析。
【详解】(1)根据上述分析,反应后溶液的溶质为FeCl2,因为溶液滴加硫氰化钾不显红色,没有Fe3+,即HCl完全反应,利用元素守恒,得出n(FeCl2)=;
(2)根据铁元素守恒,得出n(Fe)+2n(Fe2O3)=0.06mol,根据得失电子数目守恒,2n(Fe)=2n(Fe2O3)+2n(H2) ,n(H2)=,联立解得n(Fe)=0.045mol,n(Fe2O3)=0.015mol,m(Fe)=0.045mol×56g·mol-1=2.52g。
7.325:381
【详解】当反应进行到氯化铁和氯化亚铁的质量分数相同时,设氯化铁的质量为m,那么氯化亚铁的质量也为m,参加反应的氯化铁质量为m1。
所以已参加反应的氯化铁和剩余的氯化铁的质量比是325m/381:m=325:381。
8.(1)0.8mol/L
(2)13.44L
【详解】(1)根据方程式,,,。
(2),,。
9.(1)47.1%
(2)1:1
(3)6.72L
【分析】设合金中镁和铝的物质的量分别为xmol、ymol,则24x+27y=10.2g;
结合反应可知:、,则生成氢气的物质的量为:x+1.5y= ,解得:x=0.2、y=0.2;据此分析解答。
【详解】(1)该合金中镁的质量分数=,故答案为:47.1%;
(2)该合金中镁与铝的物质的量物质的量均为0.2mol,物质的量之比为1:1,故答案为:1:1;
(3)该合金溶于足量的烧碱溶液中,只有铝单质能与碱反应生成氢气,0.2molA了反应生成氢气的物质的量为0.3mol,体积为:0.3mol×=6.72L,故答案为:6.72L;
10.(1)0.6mol
(2)0.4
(3) 52.9% 1∶1 11.2L
【详解】(1)含0.4molAl3+的Al2(SO4)3中所含的SO的物质的量是:0.4mol=0.6mol,答案:0.6mol;
(2)过氧化氢与磷酸分子含有原子个数相等,则应满足:, = 0.4mol,答案为:0.4;
(3)①镁铝合金的粉末放入过量的烧碱中,镁不反应,只有Al能与NaOH反应,2Al+2NaOH+2H O=2NaAlO2+3H2↑,生成氢气,则消耗铝=0.2mol,m(Al)==5.4g,铝的质量分数为= 52.9%。答案:52.9%;
②铝质量为5.4g,则m(Mg)=10.2g-5.4g=4.8g,n(Mg)==0.2mol,该合金中镁与铝的物质的量之比为0.2mol∶0.2mol=1∶1,答案:1∶1;
③2Al+2NaOH+2H O=2NaAlO2+3H2↑,2Al+6HCl=2AlCl3+3H2↑,相同质量的铝和盐酸或氢氧化钠反应生成相同量的氢气,则铝和盐酸生成标准状况下的H26.72 L,Mg+2HCl= MgCl2 + H2↑,0.2mol镁生成氢气0.2mol,标准状况下体积,共产生氢气4.48L+6.72L=11.2L。答案:11.2L。
1. 掌握铁及其化合物之间的转化关系,能定性和定量分析图像和计算问题。
2. 掌握铝及其化合物之间的转化关系,能定性和定量分析图像和计算问题。
一、铁及其化合物
3Fe+4H2O(g) Fe3O4+4H2
Fe+2FeCl3=3FeCl2、Cu+2FeCl3=CuCl2+2FeCl2
2FeCl2+Cl2=2FeCl3
FeCl2+2NaOH=Fe(OH)2 ↓ +2NaCl
FeCl3+3NaOH=Fe(OH)3 ↓ +3NaCl
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe(OH)3 Fe2O3+3H2O
计算专题
1.(2020·高一课时练习)(1)将铁和氧化铁的混合物投入到某浓度的硫酸溶液中,恰好完全反应,并产生(标准状况),向反应后的溶液中滴入溶液,溶液不显红色。试计算所用硫酸溶液的物质的量浓度______________。
(2)将一定质量的铁、氧化铁、氧化铜的固体混合物加入盐酸中,充分反应后产生(标准状况),残留固体。过滤,滤液中无。将滤液加水稀释到,测得其中为。试计算原混合物中单质铁的质量______________。
2.(2020·高一单元测试)硫酸铁铵[]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(1)步骤③中选用足量的,理由是______。
(2)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______。
3.(2023春·浙江宁波·高一校联考期中)向铁和氧化铁的混合物中加入470mL0.20mol/L稀盐酸后恰好完全溶解,得到只含一种金属离子的浅绿色溶液,并收集到448mL氢气(标准状况下测定)。回答下列问题:
(1)收集气体的物质的量为_______。
(2)原混合物中单质铁的质量为_______g。
4.(2023秋·浙江杭州·高二期末)将2.88gCu与Fe2O3的混合物加入40.0 mL2.00 mol/L的稀硫酸中,充分反应后剩余固体的质量为0.640 g。继续往溶液中加入一定质量的铁粉,溶液质量增加了1.54 g,请计算:
(1)混合物中Cu与Fe2O3物质的量之比为_______。
(2)继续加入铁粉的质量为_______。
5.(2022秋·浙江·高一期中)向一定量的Fe和Fe2O3的混合物中加入480mL0.250mol L-1稀盐酸后恰好完全溶解,放出标准状况下的气体672mL,在溶液中加入KSCN溶液无血红色出现。回答下列问题:
(1)产生的气体的物质的量为____mol。
(2)若忽略反应前后溶液体积变化,则最终所得溶液中溶质的物质的量浓度为____mol L-1。
(3)若要将溶液中的铁元素全部转化为Fe3+,至少需要标准状况下Cl2的体积为____L。
6.(2022秋·浙江宁波·高一校联考期中)向铁和氧化铁的混合物中加入600mL稀盐酸后恰好完全反应,所得溶液滴加硫氰化钾不显红色,并收集到672mL氢气(标准状况下测定)。回答下列问题:
(1)反应后溶液中的溶质为_______mol。
(2)原混合物中单质铁的质量为_______g。
7.(2021秋·安徽芜湖·高一芜湖一中校考开学考试)已知 2FeCl3+Fe=3FeCl2。在 FeCl3 溶液中加入一定量的 Fe,当反应进行到氯化铁和氯化亚铁的质量分数相等时,求此刻已参加反应的氯化铁和剩余的氯化铁的质量比_______。(相对分子质量 FeCl3:162.5 FeCl2:127 )
二、铝及其化合物
2Al+6HCl=2AlCl3+3H2 ↑
2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
Al(OH)3 + 3HCl=AlCl3+ 3H2O
Al(OH)3 +NaOH=NaAlO2+ 2H2O
Al3++3OH-=Al(OH)3 ↓
Al3++4OH-=AlO2-+2H2O
Al3++ 3NH3 ·H2O = Al(OH)3 ↓ + 3NH4+
AlO2-+H++H2O=Al(OH)3 ↓
AlO2-+4H+=Al3++2H2O
计算专题
8.(2022春·云南昆明·高一校考阶段练习)已知铝是一种能够和强碱溶液反应生成氢气的一种特殊金属,其反应的化学方程式为,现向溶液中投入,二者恰好完全反应,计算:
(1)参加反应的的物质的量浓度________;
(2)生成的在标准状况下的体积________。
9.(2022秋·吉林松原·高一校考期末)把10.2g镁铝合金的粉末放入过量的盐酸中,得到11.2LH2(标准状况下)。试计算:
(1)该合金中镁的质量分数为_______。
(2)该合金中镁与铝的物质的量之比为_______。
(3)该合金溶于足量的烧碱溶液中,产生H2的体积(标准状况下)用是_______;
10.(2022秋·宁夏银川·高一校考期末)计算题
(1)含0.4 mol Al3+ 的Al2 (SO4 )3中所含的SO的物质的量是_______。
(2)_______ mol H2O2所含原子数与0.2mol H3PO4所含原子数相等。
(3)把10.2 g镁铝合金的粉末放入过量的烧碱中,得到6.72 L标准状况下的H2。
分别进行下列相关计算(要求写出必要的计算过程)。
① 该合金中铝的质量分数为_______ ;
② 该合金中镁与铝的物质的量之比为_______;
③ 该合金溶于足量的盐酸溶液中,产生H2的体积(标准状况下)为_______。
试卷第1页,共3页
参考答案:
1.
【详解】(l)向反应后的溶液中滴入溶液,溶液不显红色,说明溶液中不含铁离子,发生的反应有:,,;
设混合物中Fe、的物质的量分别为x、y,标准状况下产生的物质的量为,则有;
根据反应方程式有关系式:铁有两部分,一部分与铁离子反应,另一部分与酸反应,即,,可以得到:,即,结合,解得,;
因恰好完全反应,反应后溶液中的溶质为,根据硫元素守恒和铁元素守恒,则;
故所用硫酸溶液的物质的量浓度为;
(2)盐酸中,标准状况下产生的物质的量;①根据,消耗的铁的物质的量为0.04mol,消耗的盐酸的物质的量为0.08mol;
②滤液中剩余的的物质的量为,则Fe无剩余,固体全部是Cu,又滤液中无;故滤液中无,;由、可知,2HCl~CuCl2~Fe~Cu,这两个反应中消耗的为,消耗的Fe为;
③、,这两个反应中消耗的为,根据,消耗的Fe为,所以Fe的总物质的量为,。
2. 将全部氧化为;不引入杂质
【详解】(1)步骤③中选用足量的,是为了将全部氧化为,是绿色氧化剂,还原产物是水,在氧化的过程中,不引入杂质;
(2)失重5.6%是质量分数,设结晶水合物的化学式为,由题意可知,,解得x=12,因此硫酸铁铵晶体的化学式为。
3.(1)0.02 mol
(2)1.68g
【分析】氧化铁为碱性氧化物,先发生Fe2O3+6H+=2Fe3++3H2O,Fe3+氧化性强于H+,接着发生2Fe3++Fe=3Fe2+,有气体产生,然后在发生Fe+2H+=H2↑+Fe2+,据此分析。
【详解】(1)收集气体的物质的量为。
(2)根据上述分析,反应后溶液的溶质为FeCl2,因为得到只含一种金属离子的浅绿色溶液,即HCl完全反应,利用元素守恒,得出n(FeCl2)===0.05mol,根据铁元素守恒,得出n(Fe)+2n(Fe2O3)=0.05mol,根据得失电子数目守恒,2n(Fe)=2n(Fe2O3)+2n(H2) ,2n(Fe)=2n(Fe2O3)+2×0.02mol,联立解得n(Fe)=0.03mol,n(Fe2O3)=0.01mol,故原混合物中单质铁的质量为0.03mol×56g·mol-1=1.68g。
4.(1)2:1
(2)2.24g
【详解】(1)假设2.88g全是Fe2O3,即为0.018mol,Fe2O3和硫酸反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,消耗硫酸0.054mol,小于题给硫酸的0.04L×2.00mol/L=0.08mol,所以反应后硫酸有剩余,Fe2O3和硫酸完全反应,生成的硫酸铁和铜反应:Fe2(SO4)3+Cu=CuSO4+2FeSO4,反应后有固体剩余,则剩余的固体0.640g为铜,物质的量为0.01mol。根据反应方程式可知,反应中消耗的氧化铁和铜的物质的量相等,假设原有Fe2O3的物质的量为x,则消耗的铜的物质的量也为x,有160x+64x+0.640=2.88,解得x=0.01mol,则原有铜的物质的量为0.01mol+0.01mol=0.02mol,所以混合物中铜和Fe2O3的物质的量之比为2:1。
(2)原有Fe2O3的物质的量为0.01mol,则反应消耗的硫酸的物质的量为0.03mol,剩余硫酸为0.05mol。加入铁粉前,溶液中含0.01molCuSO4、0.02molFeSO4和0.05molH2SO4,加入铁粉,先发生反应:
后发生反应:
此时消耗n(H2SO4)==0.03mol<0.05mol,则硫酸有剩余。则n(Fe)= n(H2SO4)=0.03mol,因此继续加入铁粉的质量为(0.01mol+0.03mol)×56g/mol=2.24g。
5.(1)0.03
(2)0.125
(3)0.672
【详解】(1)标准状况下的气体672mL=0.672L,n==0.03mol;
(2)最终所得溶液中溶质为FeCl2,HCl的物质的量为0.480L×0.250mol L-1=0.12mol,HCl先与Fe2O3反应,Fe2O3-6HCl- 2FeCl3- 3FeCl2;Fe-Fe2+-H2,氯离子完全转化为FeCl2,由生成的FeCl2的物质的量为0.06mol,FeCl2浓度为0.06mol÷0.48L=0.125mol L-1;
(3)生成的FeCl2的物质的量为0.06mol,2FeCl2+ Cl2= 2FeCl3,若要将溶液中的铁元素全部转化为Fe3+,至少Cl2的物质的量为0.03mol,标准状况下的体积为:0.03mol×22.4L/mol=0.672L。
6.(1)0.06
(2)2.24
【分析】氧化铁为碱性氧化物,先发生Fe2O3+6H+=2Fe3++3H2O,Fe3+氧化性强于H+,接着发生2Fe3++Fe=3Fe2+,有气体产生,然后在发生Fe+2H+=H2↑+Fe2+,据此分析。
【详解】(1)根据上述分析,反应后溶液的溶质为FeCl2,因为溶液滴加硫氰化钾不显红色,没有Fe3+,即HCl完全反应,利用元素守恒,得出n(FeCl2)=;
(2)根据铁元素守恒,得出n(Fe)+2n(Fe2O3)=0.06mol,根据得失电子数目守恒,2n(Fe)=2n(Fe2O3)+2n(H2) ,n(H2)=,联立解得n(Fe)=0.045mol,n(Fe2O3)=0.015mol,m(Fe)=0.045mol×56g·mol-1=2.52g。
7.325:381
【详解】当反应进行到氯化铁和氯化亚铁的质量分数相同时,设氯化铁的质量为m,那么氯化亚铁的质量也为m,参加反应的氯化铁质量为m1。
所以已参加反应的氯化铁和剩余的氯化铁的质量比是325m/381:m=325:381。
8.(1)0.8mol/L
(2)13.44L
【详解】(1)根据方程式,,,。
(2),,。
9.(1)47.1%
(2)1:1
(3)6.72L
【分析】设合金中镁和铝的物质的量分别为xmol、ymol,则24x+27y=10.2g;
结合反应可知:、,则生成氢气的物质的量为:x+1.5y= ,解得:x=0.2、y=0.2;据此分析解答。
【详解】(1)该合金中镁的质量分数=,故答案为:47.1%;
(2)该合金中镁与铝的物质的量物质的量均为0.2mol,物质的量之比为1:1,故答案为:1:1;
(3)该合金溶于足量的烧碱溶液中,只有铝单质能与碱反应生成氢气,0.2molA了反应生成氢气的物质的量为0.3mol,体积为:0.3mol×=6.72L,故答案为:6.72L;
10.(1)0.6mol
(2)0.4
(3) 52.9% 1∶1 11.2L
【详解】(1)含0.4molAl3+的Al2(SO4)3中所含的SO的物质的量是:0.4mol=0.6mol,答案:0.6mol;
(2)过氧化氢与磷酸分子含有原子个数相等,则应满足:, = 0.4mol,答案为:0.4;
(3)①镁铝合金的粉末放入过量的烧碱中,镁不反应,只有Al能与NaOH反应,2Al+2NaOH+2H O=2NaAlO2+3H2↑,生成氢气,则消耗铝=0.2mol,m(Al)==5.4g,铝的质量分数为= 52.9%。答案:52.9%;
②铝质量为5.4g,则m(Mg)=10.2g-5.4g=4.8g,n(Mg)==0.2mol,该合金中镁与铝的物质的量之比为0.2mol∶0.2mol=1∶1,答案:1∶1;
③2Al+2NaOH+2H O=2NaAlO2+3H2↑,2Al+6HCl=2AlCl3+3H2↑,相同质量的铝和盐酸或氢氧化钠反应生成相同量的氢气,则铝和盐酸生成标准状况下的H26.72 L,Mg+2HCl= MgCl2 + H2↑,0.2mol镁生成氢气0.2mol,标准状况下体积,共产生氢气4.48L+6.72L=11.2L。答案:11.2L。
