4.1.1原子结构和核外电子排布 学案(含解析) 高中化学人教版(2019)必修 第一册
文档属性
| 名称 | 4.1.1原子结构和核外电子排布 学案(含解析) 高中化学人教版(2019)必修 第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 504.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-04 09:12:21 | ||
图片预览



文档简介
4.1.1原子结构和核外电子排布
1. 掌握原子结构、核外电子排布规律,能够辨析元素、核素、同位素的概念及应用。
2. 掌握元素、核素的(相对、近似、平均)原子质量的计算。
一、原子的构成
1.原子的构成
2
2.微粒间的数量关系
(1)核外电子数 = 质子数 = 核电荷数 = 原子序数
(2)质量数 (A) = 质子数 (Z) + 中子数 (N) = 该原子的近似相对原子质量
质量数:质子数和中子数之和叫质量数,用 A 来表示。
3.微粒符号
用 代表一个质量数为 A、质子数为 Z 的原子,例如 表示质量数为 12,质子数为 6,中子数为 6 的碳原子。
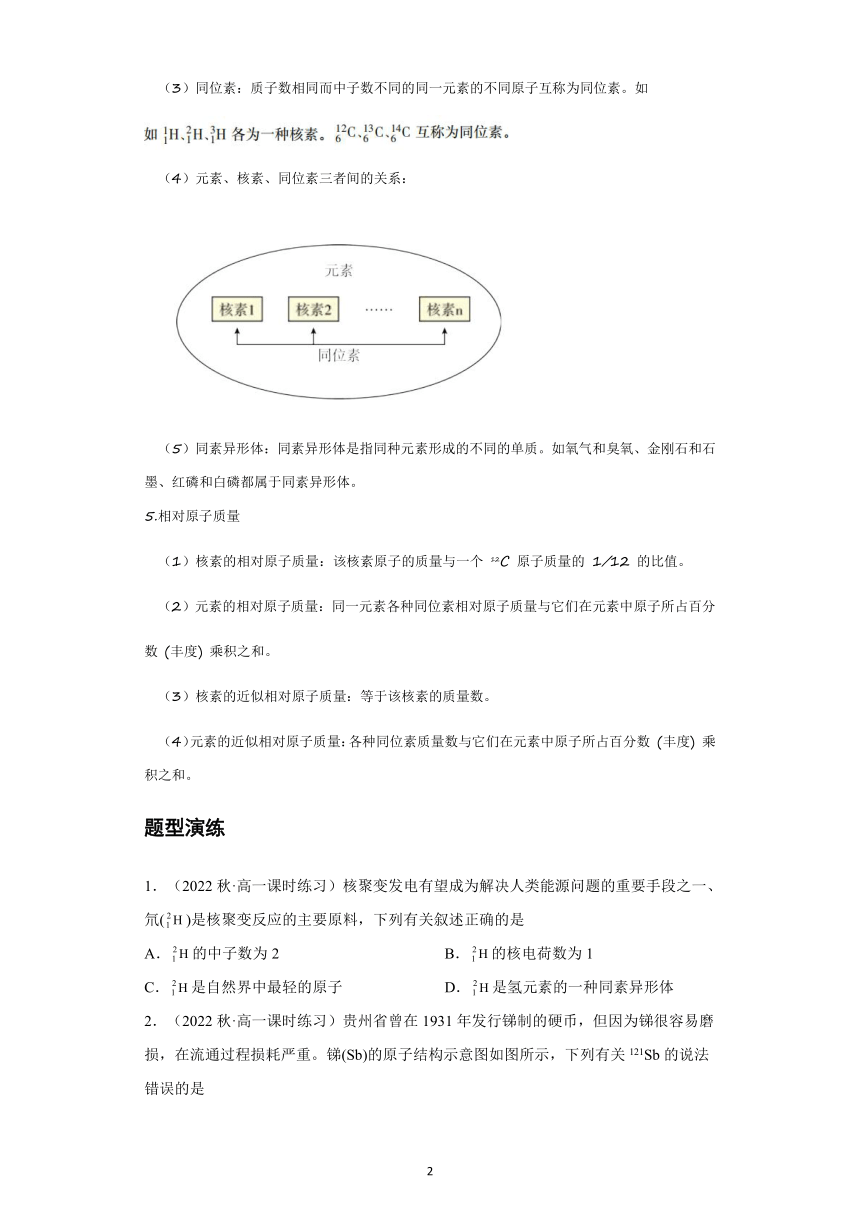
4.元素、核素、同位素
(1)元素:具有相同核电荷数的同一类原子的总称。
(2)核素:具有一定数目的质子和中子的一种原子,叫做核素。
(3)同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。如
(4)元素、核素、同位素三者间的关系:
练一练
(5)同素异形体:同素异形体是指同种元素形成的不同的单质。如氧气和臭氧、金刚石和石墨、红磷和白磷都属于同素异形体。
5.相对原子质量
(1)核素的相对原子质量:该核素原子的质量与一个 12C 原子质量的 1/12 的比值。
(2)元素的相对原子质量:同一元素各种同位素相对原子质量与它们在元素中原子所占百分数 (丰度) 乘积之和。
(3)核素的近似相对原子质量:等于该核素的质量数。
(4)元素的近似相对原子质量:各种同位素质量数与它们在元素中原子所占百分数 (丰度) 乘积之和。
题型演练
1.(2022秋·高一课时练习)核聚变发电有望成为解决人类能源问题的重要手段之一、氘()是核聚变反应的主要原料,下列有关叙述正确的是
A.的中子数为2 B.的核电荷数为1
C.是自然界中最轻的原子 D.是氢元素的一种同素异形体
2.(2022秋·高一课时练习)贵州省曾在1931年发行锑制的硬币,但因为锑很容易磨损,在流通过程损耗严重。锑(Sb)的原子结构示意图如图所示,下列有关121Sb的说法错误的是
A.与123Sb互为同位素 B.原子核内的中子数为70
C.相对原子质量约为51 D.位于元素周期表的第五周期
3.(2021秋·高一课时练习)在中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
A.A-x+n+48 B.A-x+n+24 C.A-x-n-24 D.A+x-n-24
4.(2021·高一课时练习)日本政府于2021年4月13日召开会议,决定在未来2年内将核电站产生的核废水分批排入大海,核废水中包含63种放射性物质,其中可导致白血病,下列有关说法不正确的是
A.的质子数为38
B.内中子数和核外电子数之差为11
C.和互为同位素
D.转变为属于物理变化
5.(2022秋·高一课时练习)下列有关物质分类或归类正确的是
A.混合物:盐酸、漂白粉、氯水、液氯
B.化合物:CaCl2、NaOH、HCl、O2
C.同素异形体:C60、干冰、金刚石、石墨
D.化学变化:硫燃烧、碳酸钙高温分解、氢气与氯气混合气光照下爆炸
6.(2022秋·高一课时练习)用中子撞击铀原子的裂变方程为。下列说法错误的是
A.和是铀元素的两种核素
B.裂变时净产生的中子数为
C.和的化学性质几乎没有差别
D.裂变产物的质量数A为92
二、核外电子排布
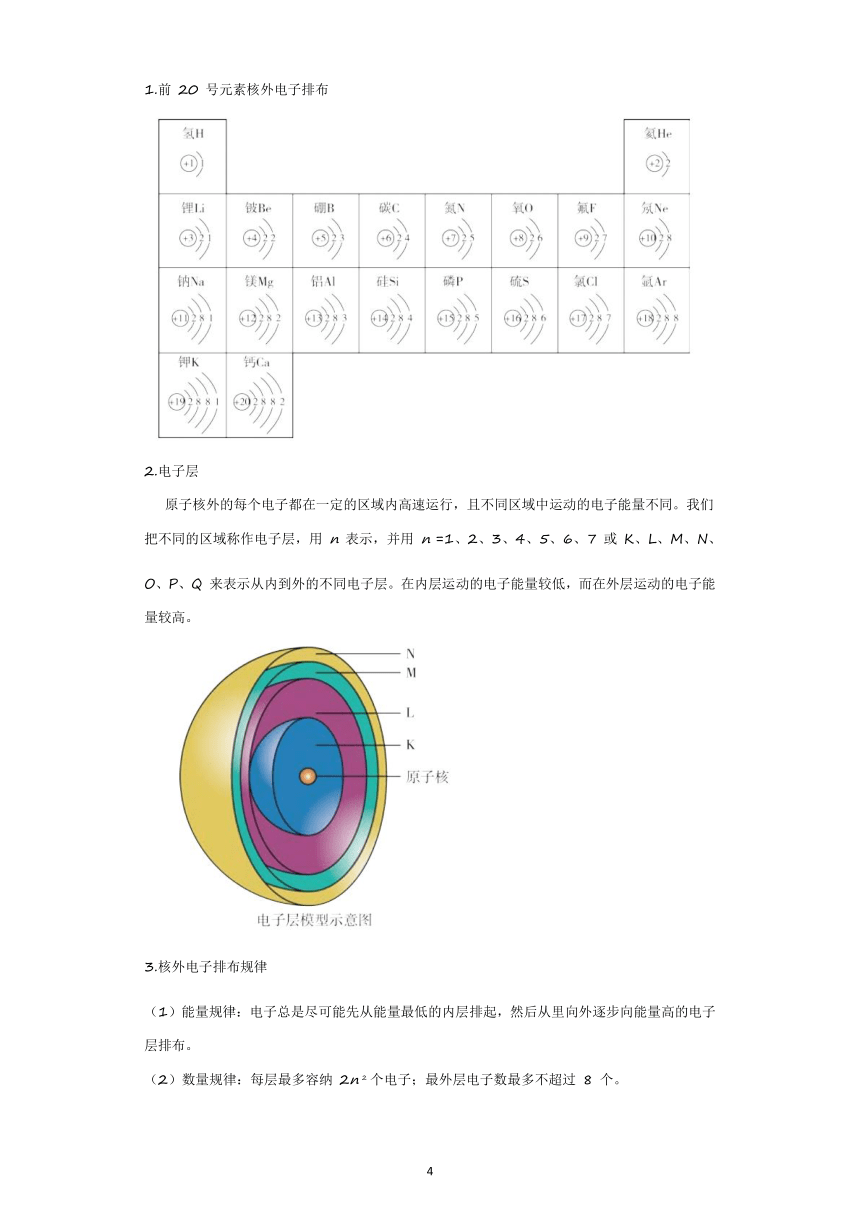
1.前 20 号元素核外电子排布13
2.电子层
原子核外的每个电子都在一定的区域内高速运行,且不同区域中运动的电子能量不同。我们把不同的区域称作电子层,用 n 表示,并用 n =1、2、3、4、5、6、7 或 K、L、M、N、O、P、Q 来表示从内到外的不同电子层。在内层运动的电子能量较低,而在外层运动的电子能量较高。
3.核外电子排布规律
(1)能量规律:电子总是尽可能先从能量最低的内层排起,然后从里向外逐步向能量高的电子层排布。
(2)数量规律:每层最多容纳 2n 2 个电子;最外层电子数最多不超过 8 个。
题型演练
7.(2022秋·高一课时练习)核外电子层结构相同的是
A.、、、Ar B.、、、
C.、、、Ar D.、、、
8.(2022秋·高一课时练习)根据核外电子排布规律,M层最多容纳的电子数是
A.8 B.10 C.18 D.32
9.(2022秋·高一课时练习)某粒子的结构示意图为,关于该粒子的说法不正确的是
A.核外电子数为18 B.核外有3个电子层
C.属于带负电荷的粒子 D.在化学反应中易得电子
10.(2022·高二课时练习)下列叙述中,不属于核外电子的特点的是
A.质量很小 B.运动范围很小 C.运动速度很快 D.有确定的运动轨迹
11.(2021·高一课时练习)下列说法中正确的是
A.某微粒核外电子排布为2、8、8结构,则该微粒一定氩原子
B.最外层电子达到稳定结构的微粒只能是稀有气体的原子
C.F-、Na+、A13+是与Ne原子具有相同电子层结构的离子
D.某元素原子的最外层只有2个电子,则该元素一定是金属元素
12.(2020·高一课时练习)具有下列结构的原子一定属于碱金属元素的是()
A.最外层只有1个电子
B.最外层电子数为次外层电子数的一半
C.M层电子数为K层电子数的
D.K、L层电子数之和等于M、N层电子数之和
13.(2020·高一课时练习)下列关于核外电子排布的说法中不正确的是( )
A.第二电子层最多可容纳的电子数为8
B.次外层最多可容纳的电子数为18
C.最多可容纳2个电子的电子层一定是第一电子层
D.最多可容纳8个电子的电子层一定是第二电子层
14.(2021·高一课时练习)下列说法中正确的是
A.除最外层外,原子中各电子层上的电子数均已达到2n2个
B.最外层只有1个电子的原子失去1个电子后都变成了稀有气体元素原子的电子层结构
C.某原子M层上的电子数为L层的3倍
D.某简单离子L层上的电子数为K层的4倍
15.(2021·高一课时练习)根据下列微粒回答问题:1H、2H、3H、14C、14N、16O、35Cl2、37Cl2
(1)以上8种微粒共有___________种核素,共___________种元素。
(2)互为同位素的是___________(填8种微粒中合理的微粒)。
(3)质量数相等的是___________,中子数相等的是___________。(填8种微粒中合理的微粒)。
(4)相同物质的量的14CO2与S18O2的质量之比为___________;质子数之比为___________。
16.(2021·高一课时练习)已知下列八种化学符号:
(1)其中,表示核素的符号共___________种。
(2)所表示的核素中,互为同位素的是________和___________。
(3)所表示的核素中,质量数相等但不能互称同位素的是________和________。
17.(2020·高一校考课时练习)在水溶液中:YO3n-+3S2-+6H+=Y-+3S +3H2O
(1)YO3n-中Y元素的化合价是:_______
(2)Y元素原子的最外层电子数是:_____
(3)比较S2-和Y-的还原性:____
试卷第1页,共3页
参考答案:
1.B
【详解】A.的中子数为2-1=1,故A错误;
B.的质子数为1,则核电荷数为1,故B正确;
C.自然界中最轻的原子是,不是,故C错误;
D.是氢元素的一种同位素,故D错误;
故选B。
2.C
【详解】A.121Sb与123Sb的质子数相同,中子数不同,两者互为同位素,A正确;
B.121Sb的质子数为51,质量数为121,所以其中子数=质量数-质子数=121-51=70,B正确;
C.根据图示原子结构示意图可知,121Sb的质子数为51,相对原子质量在数值上与质量数有关,不等于其质子数,C错误;
D.根据图示原子结构示意图可知,核外电子层数等于其周期数,所以该核素位于元素周期表的第五周期,D正确;
故选C。
3.B
【详解】在中,质子总数=核外电子总数x-n,质量数=A+3×16=A+48,则的中子总数=A+48-(x-n)=A+48-x+n,则R原子核内含有的中子数=A+48-x+n-3×8= A-x+n+24,B正确;
故答案为B。
4.B
【详解】A.左下角表示质子数,则的质子数为38,A正确;
B.内中子数和核外电子数之差为90-38-38=14,B错误;
C.和的质子数相同,质量数不同,二者互为同位素,C正确;
D.转变过程是没有产生新物质,为属于物理变化,D正确;
答案选B。
5.D
【详解】A.液氯属于纯净物,故A错误;
B.O2为单质,不是化合物,故B错误;
C.干冰是CO2, C60、金刚石、石墨均为碳元素形成的单质,C60、干冰、金刚石、石墨不属于同素异形体,故C错误;
D.有新物质生成的变化为化学变化,硫燃烧生成二氧化硫,碳酸钙高温分解生成氧化钙和二氧化碳,氢气与氯气混合气光照下爆炸,均有新物质生成,均属于化学变化,故D正确;
答案选D。
6.B
【详解】A.和质子数相同,中子数不同,是铀元素的两种核素,A项正确;
B.根据裂变的方程式,可知裂变时净产生的中子数为,B项错误;
C.和互为同位素,化学性质几乎相同,C项正确;
D.根据质量守恒定律,裂变产物的质量数A==92,D项正确;
答案选B。
7.C
【详解】A.镁离子、铝离子的电子层结构相同,比氯离子和氩原子少一个电子层,A错误;
B.钠离子、氟离子和氖原子电子层结构相同,比硫离子少一个电子层,B错误;
C.钾离子、钙离子、硫离子和氩核外都是18个电子,所以电子层结构相同,C正确;
D.钠离子和镁离子电子层结构相同,氯离子和钾离子电子层结构相同,但钠离子和镁离子比氯离子和钾离子少一个电子层,D错误;
故选C。
8.C
【详解】根据核外电子排布规则可知,M为3层,即第n层最多容纳2n2个电子,所以M层上最多容纳的电子数是2×32=9×2= 18;
故选C。
9.D
【分析】中核电荷数为16,核外电子层数为3,核外电子总数为18,说明该粒子为硫离子,然后根据硫的结构与性质进行判断。
【详解】A、核外电子数为18,故A正确;
B、核外有3个电子层,故B正确;
C、属于带2个单位负电荷的粒子,故C正确;
D、在化学反应中易失电子,故D错误;
故选D。
【点睛】本题考查了原子结构示意图的表示方法及意义,解题关键:掌握粒子结构示意图的正确表示方法,明确离子结构示意图与原子结构示意图的区别,能够根据粒子结构示意图判断粒子的性质。
10.D
【详解】A.核外电子的质量极小,约为,A正确;
B.电子在极小的空间内做高速运动,B正确;
C.电子在极小的空间内高速运动,运动速度非常快,C正确;
D.人们不能准确地测定电子在某一时刻所处的位置及运动速度,也不能描绘出它的运动轨迹,D错误;
故答案选D。
11.C
【详解】A.某微粒核外电子排布为2、8、8结构,不一定是氩原子,还可能是氯离子、钾离子等,故A错误;
B.最外层电子达稳定结构的微粒不一定是稀有气体的原子,也可能是阴离子或阳离子,故B错误;
C.F-、Na+、Al3+都有2个电子层,第1层上2个电子,第2层上8个电子,与Ne原子具有相同电子层结构,故C正确;
D.原子的最外层只有2个电子,该元素不一定是金属元素,也可能是He,故D错误。
答案选C。
12.C
【详解】A.氢原子的最外层只有1个电子,但氢元素不是碱金属元素,故A错误;
B.硅原子最外层电子数为次外层电子数的一半,但硅元素不是碱金属元素,故B错误;
C.由M层电子数为K层电子数的可知,该原子为钠原子,钠元素是碱金属元素,故C正确;
D.由K、L层电子数之和等于M、N层电子数之和可知,该原子的M层有8个电子、N层有2个电子,为钙原子,钙元素不属于碱金属元素,故D错误;
故选C。
13.D
【详解】A.根据2n2原则,第二电子层最多可容纳8个电子,A正确;
B.最外层最多可容纳8个电子,次外层最多可容纳18个电子,B正确;
C.根据2n2原则,最多可容纳2个电子的电子层一定是第一电子层,C正确;
D.最多可容纳8个电子的电子层不一定是第二电子层,当第三电子层为最外层时,最多只可容纳8个电子,D错误;
故选D。
【点睛】本题考查了核外电子的运动和电子排布规律,注意在原子核外区域能量不同,距核由近到远,能量由低到高。需要明确核外电子的排布规律是相对的不能孤立理解,例如第三层最多能够容纳18个电子,但是处于最外层时最多容纳8个电子。
14.D
【详解】A. 任一电子层最多能够容纳的电子数为2n2个,而不是必须容纳2n2个,如M层为次外层时,它所容纳的电子数≤18个,A项错误;
B. 一般简单离子均具有稀有气体元素原子的电子层结构,但对于氢而言,失去1个电子后形成的是H+,它是一个没有电子的裸露的质子,不符合稀有气体元素原子的电子层结构,B项错误;
C. 当M层上有电子时,L层已经排满了8个电子,而M层最多只能排18个电子,不可能为L层的3倍,C项错误;
D. 符合D项的实例有、等,D项正确。
故选D。
15. 6 5 1H、2H、3H 14C、14N 14C、16O 23∶34 11∶16
【分析】核素指的是原子;质子数和中子数只要其一不相同就属于不同核素;元素的种类由质子数决定,质子数不同,元素的种类就不同;质子数相同,而中子数不同的原子,互称为同位素;中子数=质量数-质子数。
【详解】(1)核素指的是原子,故共有6种核素;1H、2H、3H均属于氢元素,14C属于碳元素14N属于氮元素,16O属于氧元素,35Cl2、37Cl2都属于氯元素,一共有5种元素,故答案为:6;5;
(2)1H、2H、3H都属于氢元素,质子数相同,而中子数不同互为同位素,故答案为:1H、2H、3H;
(3)核素符号左上角的数字表示质量数,则质量数相等的是14C、14N;14C中中子数=14-6=8,16O 的中子数=16-8=8,所以二者中子数相同,故答案为:14C、14N ;14C、16O;
(4)相同物质的量的14CO2与S18O2的质量之比等于相对分子质量之比,相对原子质量近似等于质量数,则相同物质的量的14CO2与S18O2的质量之比为(14+16+16):(32+18+18)=23∶34;质子数之比为(6+8+8):(16+8+8)=11∶16;故答案为:23∶34;11∶16。
16.(1)6
(2)
(3)
【详解】(1)在、、、、、、、中,、表示分子,、、、、、都表示核素,则表示核素的符号共6种。答案为:6;
(2)同种元素的不同核素,互称同位素,则、、、、、所表示的核素中,互为同位素的是和。答案为:;;
(3)、、、、、所表示的核素中,只有和的质量数相同,则质量数相等但不能互称同位素的是和。答案为:;。
17. +5 7 S2->Y-
【分析】先根据离子方程式电荷守恒判断n值,从化合物中化合价代数和为0的角度判断Y元素的化合价,进而判断最外层电子数;利用还原剂的还原性大于还原产物的还原性解答。
【详解】(1)离子方程式遵循电荷守恒,则在YO3n-+3S2-+6H+=Y-+3S +3H2O中:n+3×2 6=1,n=1,设YO3n-中Y元素的化合价为x,则 2×3+x= 1,x=+5;
(2)由离子方程式可知,Y的最低负价为 1价,则说明最外层含有7个电子;
(3)S元素化合价升高,Y元素的化合价降低,则S2 为还原剂,Y 为还原产物,还原性为S2 >Y 。
【点睛】判断还原性时,可以根据还原剂的还原性大于还原产物判断。
1. 掌握原子结构、核外电子排布规律,能够辨析元素、核素、同位素的概念及应用。
2. 掌握元素、核素的(相对、近似、平均)原子质量的计算。
一、原子的构成
1.原子的构成
2
2.微粒间的数量关系
(1)核外电子数 = 质子数 = 核电荷数 = 原子序数
(2)质量数 (A) = 质子数 (Z) + 中子数 (N) = 该原子的近似相对原子质量
质量数:质子数和中子数之和叫质量数,用 A 来表示。
3.微粒符号
用 代表一个质量数为 A、质子数为 Z 的原子,例如 表示质量数为 12,质子数为 6,中子数为 6 的碳原子。
4.元素、核素、同位素
(1)元素:具有相同核电荷数的同一类原子的总称。
(2)核素:具有一定数目的质子和中子的一种原子,叫做核素。
(3)同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。如
(4)元素、核素、同位素三者间的关系:
练一练
(5)同素异形体:同素异形体是指同种元素形成的不同的单质。如氧气和臭氧、金刚石和石墨、红磷和白磷都属于同素异形体。
5.相对原子质量
(1)核素的相对原子质量:该核素原子的质量与一个 12C 原子质量的 1/12 的比值。
(2)元素的相对原子质量:同一元素各种同位素相对原子质量与它们在元素中原子所占百分数 (丰度) 乘积之和。
(3)核素的近似相对原子质量:等于该核素的质量数。
(4)元素的近似相对原子质量:各种同位素质量数与它们在元素中原子所占百分数 (丰度) 乘积之和。
题型演练
1.(2022秋·高一课时练习)核聚变发电有望成为解决人类能源问题的重要手段之一、氘()是核聚变反应的主要原料,下列有关叙述正确的是
A.的中子数为2 B.的核电荷数为1
C.是自然界中最轻的原子 D.是氢元素的一种同素异形体
2.(2022秋·高一课时练习)贵州省曾在1931年发行锑制的硬币,但因为锑很容易磨损,在流通过程损耗严重。锑(Sb)的原子结构示意图如图所示,下列有关121Sb的说法错误的是
A.与123Sb互为同位素 B.原子核内的中子数为70
C.相对原子质量约为51 D.位于元素周期表的第五周期
3.(2021秋·高一课时练习)在中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
A.A-x+n+48 B.A-x+n+24 C.A-x-n-24 D.A+x-n-24
4.(2021·高一课时练习)日本政府于2021年4月13日召开会议,决定在未来2年内将核电站产生的核废水分批排入大海,核废水中包含63种放射性物质,其中可导致白血病,下列有关说法不正确的是
A.的质子数为38
B.内中子数和核外电子数之差为11
C.和互为同位素
D.转变为属于物理变化
5.(2022秋·高一课时练习)下列有关物质分类或归类正确的是
A.混合物:盐酸、漂白粉、氯水、液氯
B.化合物:CaCl2、NaOH、HCl、O2
C.同素异形体:C60、干冰、金刚石、石墨
D.化学变化:硫燃烧、碳酸钙高温分解、氢气与氯气混合气光照下爆炸
6.(2022秋·高一课时练习)用中子撞击铀原子的裂变方程为。下列说法错误的是
A.和是铀元素的两种核素
B.裂变时净产生的中子数为
C.和的化学性质几乎没有差别
D.裂变产物的质量数A为92
二、核外电子排布
1.前 20 号元素核外电子排布13
2.电子层
原子核外的每个电子都在一定的区域内高速运行,且不同区域中运动的电子能量不同。我们把不同的区域称作电子层,用 n 表示,并用 n =1、2、3、4、5、6、7 或 K、L、M、N、O、P、Q 来表示从内到外的不同电子层。在内层运动的电子能量较低,而在外层运动的电子能量较高。
3.核外电子排布规律
(1)能量规律:电子总是尽可能先从能量最低的内层排起,然后从里向外逐步向能量高的电子层排布。
(2)数量规律:每层最多容纳 2n 2 个电子;最外层电子数最多不超过 8 个。
题型演练
7.(2022秋·高一课时练习)核外电子层结构相同的是
A.、、、Ar B.、、、
C.、、、Ar D.、、、
8.(2022秋·高一课时练习)根据核外电子排布规律,M层最多容纳的电子数是
A.8 B.10 C.18 D.32
9.(2022秋·高一课时练习)某粒子的结构示意图为,关于该粒子的说法不正确的是
A.核外电子数为18 B.核外有3个电子层
C.属于带负电荷的粒子 D.在化学反应中易得电子
10.(2022·高二课时练习)下列叙述中,不属于核外电子的特点的是
A.质量很小 B.运动范围很小 C.运动速度很快 D.有确定的运动轨迹
11.(2021·高一课时练习)下列说法中正确的是
A.某微粒核外电子排布为2、8、8结构,则该微粒一定氩原子
B.最外层电子达到稳定结构的微粒只能是稀有气体的原子
C.F-、Na+、A13+是与Ne原子具有相同电子层结构的离子
D.某元素原子的最外层只有2个电子,则该元素一定是金属元素
12.(2020·高一课时练习)具有下列结构的原子一定属于碱金属元素的是()
A.最外层只有1个电子
B.最外层电子数为次外层电子数的一半
C.M层电子数为K层电子数的
D.K、L层电子数之和等于M、N层电子数之和
13.(2020·高一课时练习)下列关于核外电子排布的说法中不正确的是( )
A.第二电子层最多可容纳的电子数为8
B.次外层最多可容纳的电子数为18
C.最多可容纳2个电子的电子层一定是第一电子层
D.最多可容纳8个电子的电子层一定是第二电子层
14.(2021·高一课时练习)下列说法中正确的是
A.除最外层外,原子中各电子层上的电子数均已达到2n2个
B.最外层只有1个电子的原子失去1个电子后都变成了稀有气体元素原子的电子层结构
C.某原子M层上的电子数为L层的3倍
D.某简单离子L层上的电子数为K层的4倍
15.(2021·高一课时练习)根据下列微粒回答问题:1H、2H、3H、14C、14N、16O、35Cl2、37Cl2
(1)以上8种微粒共有___________种核素,共___________种元素。
(2)互为同位素的是___________(填8种微粒中合理的微粒)。
(3)质量数相等的是___________,中子数相等的是___________。(填8种微粒中合理的微粒)。
(4)相同物质的量的14CO2与S18O2的质量之比为___________;质子数之比为___________。
16.(2021·高一课时练习)已知下列八种化学符号:
(1)其中,表示核素的符号共___________种。
(2)所表示的核素中,互为同位素的是________和___________。
(3)所表示的核素中,质量数相等但不能互称同位素的是________和________。
17.(2020·高一校考课时练习)在水溶液中:YO3n-+3S2-+6H+=Y-+3S +3H2O
(1)YO3n-中Y元素的化合价是:_______
(2)Y元素原子的最外层电子数是:_____
(3)比较S2-和Y-的还原性:____
试卷第1页,共3页
参考答案:
1.B
【详解】A.的中子数为2-1=1,故A错误;
B.的质子数为1,则核电荷数为1,故B正确;
C.自然界中最轻的原子是,不是,故C错误;
D.是氢元素的一种同位素,故D错误;
故选B。
2.C
【详解】A.121Sb与123Sb的质子数相同,中子数不同,两者互为同位素,A正确;
B.121Sb的质子数为51,质量数为121,所以其中子数=质量数-质子数=121-51=70,B正确;
C.根据图示原子结构示意图可知,121Sb的质子数为51,相对原子质量在数值上与质量数有关,不等于其质子数,C错误;
D.根据图示原子结构示意图可知,核外电子层数等于其周期数,所以该核素位于元素周期表的第五周期,D正确;
故选C。
3.B
【详解】在中,质子总数=核外电子总数x-n,质量数=A+3×16=A+48,则的中子总数=A+48-(x-n)=A+48-x+n,则R原子核内含有的中子数=A+48-x+n-3×8= A-x+n+24,B正确;
故答案为B。
4.B
【详解】A.左下角表示质子数,则的质子数为38,A正确;
B.内中子数和核外电子数之差为90-38-38=14,B错误;
C.和的质子数相同,质量数不同,二者互为同位素,C正确;
D.转变过程是没有产生新物质,为属于物理变化,D正确;
答案选B。
5.D
【详解】A.液氯属于纯净物,故A错误;
B.O2为单质,不是化合物,故B错误;
C.干冰是CO2, C60、金刚石、石墨均为碳元素形成的单质,C60、干冰、金刚石、石墨不属于同素异形体,故C错误;
D.有新物质生成的变化为化学变化,硫燃烧生成二氧化硫,碳酸钙高温分解生成氧化钙和二氧化碳,氢气与氯气混合气光照下爆炸,均有新物质生成,均属于化学变化,故D正确;
答案选D。
6.B
【详解】A.和质子数相同,中子数不同,是铀元素的两种核素,A项正确;
B.根据裂变的方程式,可知裂变时净产生的中子数为,B项错误;
C.和互为同位素,化学性质几乎相同,C项正确;
D.根据质量守恒定律,裂变产物的质量数A==92,D项正确;
答案选B。
7.C
【详解】A.镁离子、铝离子的电子层结构相同,比氯离子和氩原子少一个电子层,A错误;
B.钠离子、氟离子和氖原子电子层结构相同,比硫离子少一个电子层,B错误;
C.钾离子、钙离子、硫离子和氩核外都是18个电子,所以电子层结构相同,C正确;
D.钠离子和镁离子电子层结构相同,氯离子和钾离子电子层结构相同,但钠离子和镁离子比氯离子和钾离子少一个电子层,D错误;
故选C。
8.C
【详解】根据核外电子排布规则可知,M为3层,即第n层最多容纳2n2个电子,所以M层上最多容纳的电子数是2×32=9×2= 18;
故选C。
9.D
【分析】中核电荷数为16,核外电子层数为3,核外电子总数为18,说明该粒子为硫离子,然后根据硫的结构与性质进行判断。
【详解】A、核外电子数为18,故A正确;
B、核外有3个电子层,故B正确;
C、属于带2个单位负电荷的粒子,故C正确;
D、在化学反应中易失电子,故D错误;
故选D。
【点睛】本题考查了原子结构示意图的表示方法及意义,解题关键:掌握粒子结构示意图的正确表示方法,明确离子结构示意图与原子结构示意图的区别,能够根据粒子结构示意图判断粒子的性质。
10.D
【详解】A.核外电子的质量极小,约为,A正确;
B.电子在极小的空间内做高速运动,B正确;
C.电子在极小的空间内高速运动,运动速度非常快,C正确;
D.人们不能准确地测定电子在某一时刻所处的位置及运动速度,也不能描绘出它的运动轨迹,D错误;
故答案选D。
11.C
【详解】A.某微粒核外电子排布为2、8、8结构,不一定是氩原子,还可能是氯离子、钾离子等,故A错误;
B.最外层电子达稳定结构的微粒不一定是稀有气体的原子,也可能是阴离子或阳离子,故B错误;
C.F-、Na+、Al3+都有2个电子层,第1层上2个电子,第2层上8个电子,与Ne原子具有相同电子层结构,故C正确;
D.原子的最外层只有2个电子,该元素不一定是金属元素,也可能是He,故D错误。
答案选C。
12.C
【详解】A.氢原子的最外层只有1个电子,但氢元素不是碱金属元素,故A错误;
B.硅原子最外层电子数为次外层电子数的一半,但硅元素不是碱金属元素,故B错误;
C.由M层电子数为K层电子数的可知,该原子为钠原子,钠元素是碱金属元素,故C正确;
D.由K、L层电子数之和等于M、N层电子数之和可知,该原子的M层有8个电子、N层有2个电子,为钙原子,钙元素不属于碱金属元素,故D错误;
故选C。
13.D
【详解】A.根据2n2原则,第二电子层最多可容纳8个电子,A正确;
B.最外层最多可容纳8个电子,次外层最多可容纳18个电子,B正确;
C.根据2n2原则,最多可容纳2个电子的电子层一定是第一电子层,C正确;
D.最多可容纳8个电子的电子层不一定是第二电子层,当第三电子层为最外层时,最多只可容纳8个电子,D错误;
故选D。
【点睛】本题考查了核外电子的运动和电子排布规律,注意在原子核外区域能量不同,距核由近到远,能量由低到高。需要明确核外电子的排布规律是相对的不能孤立理解,例如第三层最多能够容纳18个电子,但是处于最外层时最多容纳8个电子。
14.D
【详解】A. 任一电子层最多能够容纳的电子数为2n2个,而不是必须容纳2n2个,如M层为次外层时,它所容纳的电子数≤18个,A项错误;
B. 一般简单离子均具有稀有气体元素原子的电子层结构,但对于氢而言,失去1个电子后形成的是H+,它是一个没有电子的裸露的质子,不符合稀有气体元素原子的电子层结构,B项错误;
C. 当M层上有电子时,L层已经排满了8个电子,而M层最多只能排18个电子,不可能为L层的3倍,C项错误;
D. 符合D项的实例有、等,D项正确。
故选D。
15. 6 5 1H、2H、3H 14C、14N 14C、16O 23∶34 11∶16
【分析】核素指的是原子;质子数和中子数只要其一不相同就属于不同核素;元素的种类由质子数决定,质子数不同,元素的种类就不同;质子数相同,而中子数不同的原子,互称为同位素;中子数=质量数-质子数。
【详解】(1)核素指的是原子,故共有6种核素;1H、2H、3H均属于氢元素,14C属于碳元素14N属于氮元素,16O属于氧元素,35Cl2、37Cl2都属于氯元素,一共有5种元素,故答案为:6;5;
(2)1H、2H、3H都属于氢元素,质子数相同,而中子数不同互为同位素,故答案为:1H、2H、3H;
(3)核素符号左上角的数字表示质量数,则质量数相等的是14C、14N;14C中中子数=14-6=8,16O 的中子数=16-8=8,所以二者中子数相同,故答案为:14C、14N ;14C、16O;
(4)相同物质的量的14CO2与S18O2的质量之比等于相对分子质量之比,相对原子质量近似等于质量数,则相同物质的量的14CO2与S18O2的质量之比为(14+16+16):(32+18+18)=23∶34;质子数之比为(6+8+8):(16+8+8)=11∶16;故答案为:23∶34;11∶16。
16.(1)6
(2)
(3)
【详解】(1)在、、、、、、、中,、表示分子,、、、、、都表示核素,则表示核素的符号共6种。答案为:6;
(2)同种元素的不同核素,互称同位素,则、、、、、所表示的核素中,互为同位素的是和。答案为:;;
(3)、、、、、所表示的核素中,只有和的质量数相同,则质量数相等但不能互称同位素的是和。答案为:;。
17. +5 7 S2->Y-
【分析】先根据离子方程式电荷守恒判断n值,从化合物中化合价代数和为0的角度判断Y元素的化合价,进而判断最外层电子数;利用还原剂的还原性大于还原产物的还原性解答。
【详解】(1)离子方程式遵循电荷守恒,则在YO3n-+3S2-+6H+=Y-+3S +3H2O中:n+3×2 6=1,n=1,设YO3n-中Y元素的化合价为x,则 2×3+x= 1,x=+5;
(2)由离子方程式可知,Y的最低负价为 1价,则说明最外层含有7个电子;
(3)S元素化合价升高,Y元素的化合价降低,则S2 为还原剂,Y 为还原产物,还原性为S2 >Y 。
【点睛】判断还原性时,可以根据还原剂的还原性大于还原产物判断。
