2.1.3碳酸钠和碳酸氢钠性质及计算 学案(含解析) 高中化学人教版(2019)必修 第一册
文档属性
| 名称 | 2.1.3碳酸钠和碳酸氢钠性质及计算 学案(含解析) 高中化学人教版(2019)必修 第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 906.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-04 09:18:52 | ||
图片预览



文档简介
2.1.3碳酸钠和碳酸氢钠
1. 掌握碳酸钠及碳酸氢钠的物理性质。
2. 掌握碳酸钠和碳酸氢钠的化学性质。
3. 掌握钠及其化合物的转化。
一、Na2CO3 与 NaHCO3的性质比较
二、盐酸与 Na2CO3 溶液反应的互滴
1.将稀盐酸滴加到 Na2CO3 溶液中
HCl+Na2CO3=NaCl+NaHCO3
HCl+NaHCO3=NaCl+H2O+CO2 ↑
开始滴加稀盐酸时无明显现象,一段时间后才会产生气泡。
2.将 Na2CO3 溶液滴入稀盐酸
2HCl+Na2CO3=2NaCl+H2O+CO2 ↑
在滴入后直接就会产生气泡。
题型演练
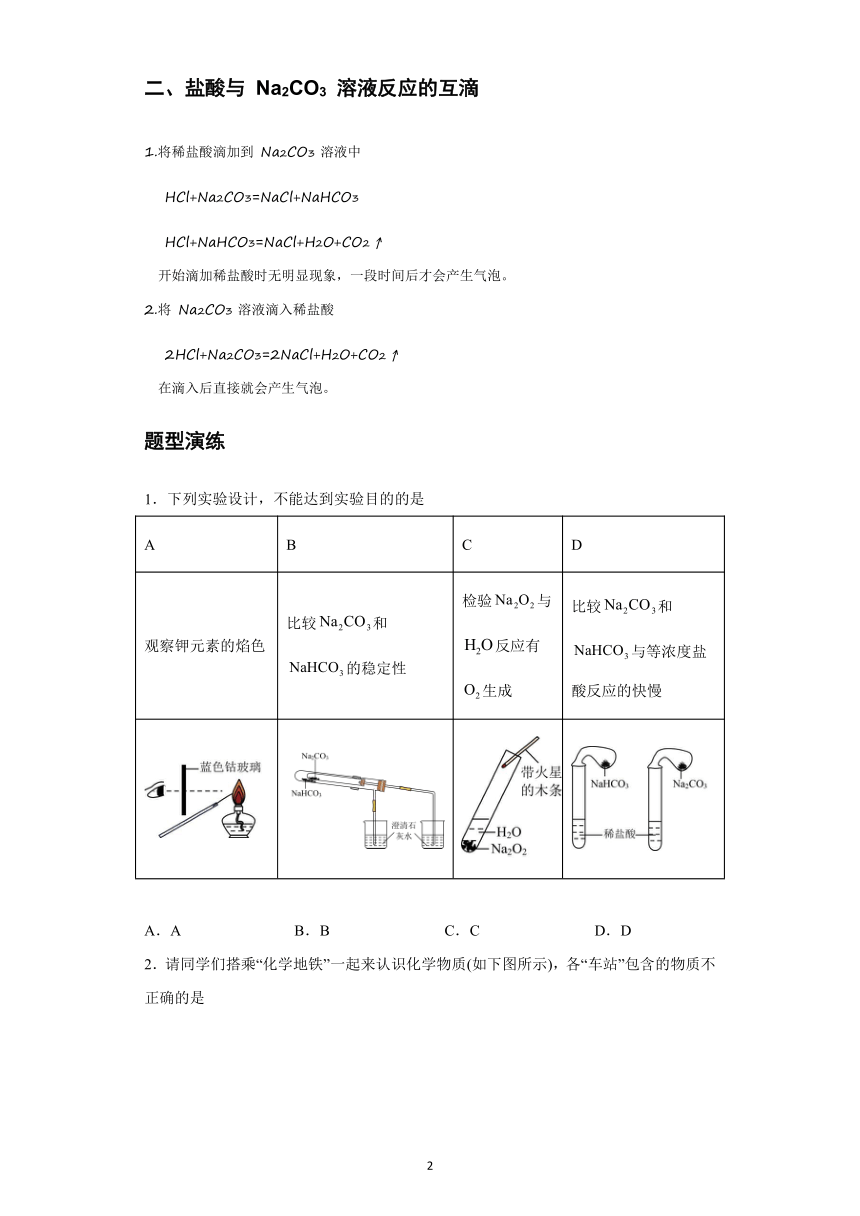
1.下列实验设计,不能达到实验目的的是
A B C D
观察钾元素的焰色 比较和的稳定性 检验与反应有生成 比较和与等浓度盐酸反应的快慢
A.A B.B C.C D.D
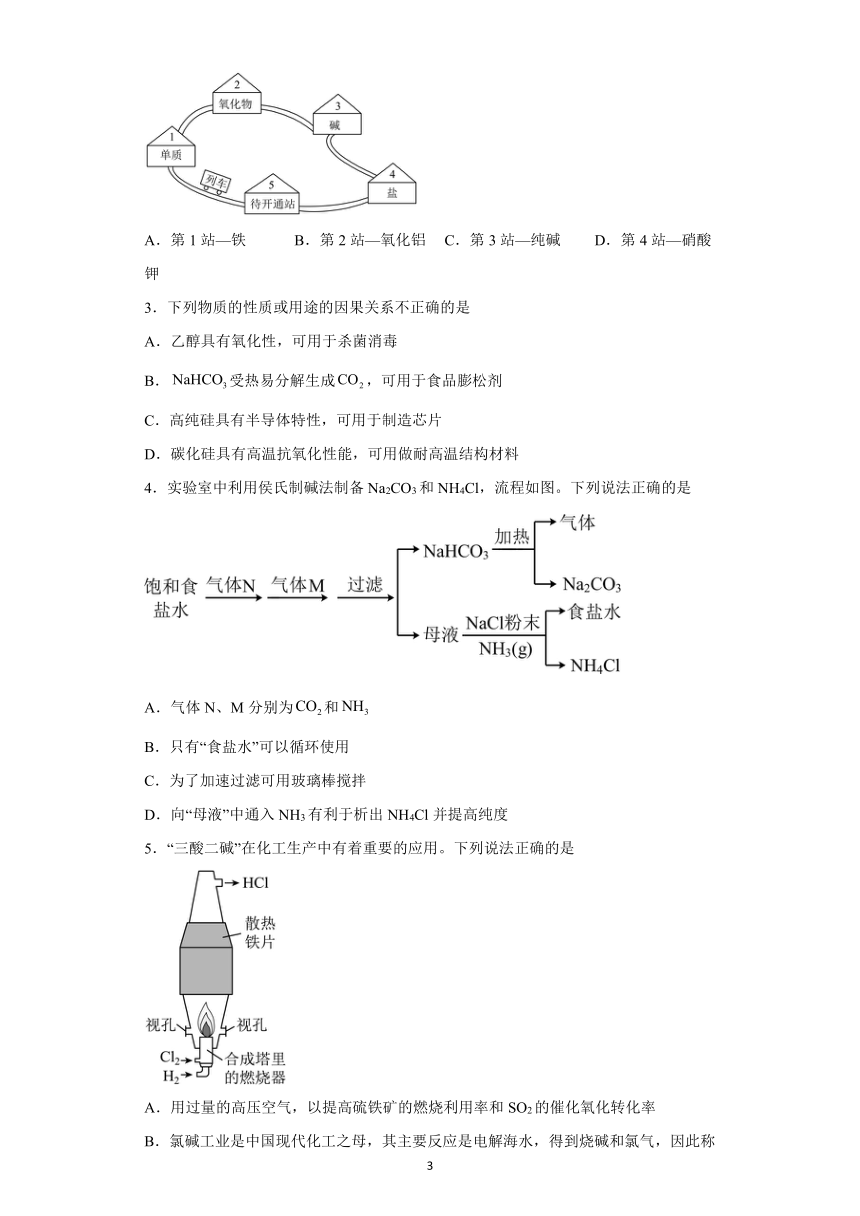
2.请同学们搭乘“化学地铁”一起来认识化学物质(如下图所示),各“车站”包含的物质不正确的是
A.第1站—铁 B.第2站—氧化铝 C.第3站—纯碱 D.第4站—硝酸钾
3.下列物质的性质或用途的因果关系不正确的是
A.乙醇具有氧化性,可用于杀菌消毒
B.受热易分解生成,可用于食品膨松剂
C.高纯硅具有半导体特性,可用于制造芯片
D.碳化硅具有高温抗氧化性能,可用做耐高温结构材料
4.实验室中利用侯氏制碱法制备Na2CO3和NH4Cl,流程如图。下列说法正确的是
A.气体N、M分别为和
B.只有“食盐水”可以循环使用
C.为了加速过滤可用玻璃棒搅拌
D.向“母液”中通入NH3有利于析出NH4Cl并提高纯度
5.“三酸二碱”在化工生产中有着重要的应用。下列说法正确的是
A.用过量的高压空气,以提高硫铁矿的燃烧利用率和SO2的催化氧化转化率
B.氯碱工业是中国现代化工之母,其主要反应是电解海水,得到烧碱和氯气,因此称为氯碱工业
C.合成氨工业为硝酸工业和纯碱工业提供了多种原料
D.如图是工业制盐酸的设备及其简易图
三、Na2CO3 与 NaHCO3 的鉴别与除杂
1.Na2CO3 与 NaHCO3 的鉴别
(1) Na2CO3 溶液与 NaHCO3 溶液的鉴别
① 分别取少量溶液于两只试管中,分别滴加少量 CaCl2 或 BaCl2 溶液,有白色沉淀产生的为 Na2CO3 溶液,无现象的为 NaHCO3 溶液。
② 分别取少量溶液于两只试管中,分别滴加少量稀盐酸,滴入后直接有气泡产生的是 NaHCO3 溶液,滴入后一段时间才产生气泡的是 Na2CO3 溶液。
2.Na2CO3 固体与 NaHCO3 固体的鉴别
分别取少量固体于两只试管中,加热一段时间后,质量减少的为 NaHCO3 固体,质量不变的为 Na2CO3 固体。(或加热能产生使澄清石灰水变浑浊的气体的是 NaHCO3)
3.Na2CO3 与 NaHCO3 的除杂
四、Na2CO3 与 NaHCO3 混合物组成的确定
1.固体加热法
将一定质量的混合固体加热至质量不再改变,测定释放出的 CO2 的体积 (质量) 或固体质量的减少量 (即生成的 CO2 的质量) 等进行计算。
2.加足量强酸
将一定质量的混合固体溶于水配成溶液,加足量强酸 (如稀盐酸),测定收集到的 CO2 的体积 (质量) 进行计算,注意此方法中必须保证测定的一定是纯净 CO2 的量,不能有杂质干扰
题型演练
6.为除去溶液中的下列杂质,所选用的试剂正确的是
选项 杂质 试剂
A 适量的NaOH溶液
B NaOH 适量的溶液
C NaCl 适量的盐酸
D 适量的溶液
A.A B.B C.C D.D
7.下列实验方案中,不能测定出和的混合物中质量分数的是
A.取ag混合物充分加热,质量减少bg
B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体
C.取ag混合物与足量溶液充分反应,过滤、洗涤、烘干、得到bg固体
D.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加bg
8.传统文化中蕴含着丰富的化学知识。下列说法错误的是
A.“忽闻海上有仙山,山在虚无缥缈间”中描述的海市蜃楼现象,与胶体知识有关
B.“以火烧之,紫青烟起,乃真硝石也”这是利用“焰色反应”来鉴别硝石(KNO3)
C.“大漠孤烟直,长河落日圆”中的“烟”与“发烟”硝酸中的“烟”成份相同
D.“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面”,这是《本草纲目》中有关“石碱”的记载,此处的“石碱”是指K2CO3
9.下列关于钠及其化合物的说法不正确的是
A.可用澄清的石灰水鉴别Na2CO3和NaHCO3两种溶液
B.Na在空气中加热会变成淡黄色的Na2O2
C.可采用加热的方法除去Na2CO3固体中混有的NaHCO3
D.将金属钠放入盛有MgSO4溶液的小烧杯中,既有气体,又有沉淀产生
10.碳酸钠与碳酸氢钠在外观上相似,均可做家用洗涤剂,如清洗厨房用具的油污等。为区别二者,下列试验方案不合理的是
选项 选用试剂或方法 判断依据
A 取少量固体放入两支试管中,各加几滴水 观察温度变化
B 配成溶液,向其中滴加酚酞溶液 观察溶液颜色变化
C 配成溶液,向其中滴加少量盐酸溶液 观察是否产生气泡
D 配成溶液,向其中滴加澄清石灰水 观察是否生成沉淀
A.A B.B C.C D.D
二、多选题
11.1943年我国化学工程专家侯德榜发明了侯氏制碱法,又称联合制碱法,为我国化工事业的发展做出了卓越贡献。其部分工艺流程如下,下列说法不正确的是
反应①的化学方程式为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
A.该工艺利用了不同物质溶解度的差异
B.反应①中先通CO2,再通NH3
C.若纯碱中混有NaHCO3,可用澄清石灰水除去
D.母液的主要成分是NH4Cl,可用于化肥工业
三、实验题
12.现有一份Na2CO3和NaHCO3固体混合物,某化学兴趣小组设计如图所示实验装置(夹持仪器省略),测定固体混合物中NaHCO3的质量分数。实验步骤如下:
①组装好实验装置,并___________;
②加药品,称取mg样品放入硬质玻璃管中;称量装有碱石灰的U形管D的质量为m1g;。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟;
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体;
⑤打开活塞K1,缓缓鼓入空气数分钟后拆下装置,称量U形管D的质量为m2g。
请回答下列问题:
(1)补充实验步骤①的操作为___________。
(2)装置E中实验仪器的名称为___________。
(3)装置B中发生反应的化学方程式为___________。
(4)实验步骤⑤中“缓缓鼓入空气数分钟”的目的是___________。
(5)若缺少实验步骤③会导致测定结果___________(填“偏大”“偏小”或“无影响”)。
(6)样品中NaHCO3的质量分数为___________×100%(用含m、m1、m2的式子表示)。
13.为测定出Na2CO3和NaHCO3的混合物中Na2CO3质量分数,请你完善下列方案。
方案一:称取一定质量样品,置于坩埚中高温加热至恒重后冷却,称量剩余固体质量,进行计算。
(1)发生反应的化学方程式为:_______
(2)实验中需加热至恒重的目的是:_______
方案二:按如图所示装置进行实验
(3)B装置的作用是_______
(4)反应完毕后还要通一段时间N2的目的是_______
(5)实验前称取混合物样品19.00 g,实验后测得C装置增重8.80 g,则样品中碳酸钠的质量分数为_______%(保留小数点后两位)。
四、元素或物质推断题
14.根据如图所示的转化关系及现象(图中部分产物未全部写出;除E为单质外,其他物质均为化合物),回答下列问题:
(1)固体X的名称为_____,Y的化学式为_____。
(2)反应①的化学方程式为_____;反应③的化学方程式为_____。
(3)X与C或D反应生成22.4L(标准状况)气体E时,消耗X的物质的量均为_____mol,消耗C、D的质量之比为_____。
(4)物质Y的溶液是化学分析中常用的试剂,实验室需要使用240mL0.1mol L-1溶液,配制该溶液时所需的玻璃仪器有量筒﹑烧杯、玻璃棒、胶头滴管和_____。
试卷第1页,共3页
参考答案:
1.B
【详解】A.K元素的焰色试验必须透过蓝色钴玻璃观察,滤去黄光的干扰,故A正确;
B.碳酸氢钠不稳定,受热分解生成Na2CO3、CO2、H2O,小试管中应该盛放碳酸氢钠,故B错误;
C.过氧化钠和水反应生成氧气,氧气是助燃性气体,能使带火星的木条复燃,故C正确;
D.Na2CO3、NaHCO3和稀盐酸反应生成气泡的快慢不同,从而比较NaHCO3和Na2CO3与盐酸反应快慢,故D正确;
故选B。
2.C
【详解】A. 第1站—铁属于单质,故A正确;
B. 第2站—氧化铝属于氧化物,故B正确;
C. 第3站—纯碱属于盐,不属于碱,故C错误;
D. 第4站—硝酸钾属于盐,故D正确;
故选C。
3.A
【详解】A.乙醇能使病毒或细菌的蛋白质变性,所以乙醇可用于消毒,不是因为乙醇具有氧化性,故A错误;
B.不稳定,受热易分解生成,可用于食品膨松剂,故B正确;
C.高纯硅具有半导体特性,可用于制造芯片,故C正确;
D.碳化硅具有高温抗氧化性能,可用做耐高温结构材料,故D正确;
故选A。
4.D
【分析】侯氏制碱法制备碳酸钠和氯化铵,饱和食盐水中先通入NH3、再通入CO2,此时生成碳酸氢钠沉淀和氯化铵,过滤得到碳酸氢钠,加热碳酸氢钠生成碳酸钠、二氧化碳和水,母液中加入NaCl和NH3,发生反应NaCl(s)+NH4Cl(aq)=NaCl(aq)+NH4Cl(s),过滤得到氯化铵。
【详解】A.气体N为NH3,气体M为CO2,A错误;
B.从流程图可知,最后碳酸氢钠分解生成的CO2、母液生成的食盐水都可以循环利用,B错误;
C.用玻璃棒搅动漏斗里的液体,容易把滤纸弄破,起不到加速过滤的作用,C错误;
D.向母液中通入NH3,增大溶液中的浓度,有利于NH4Cl析出并提高纯度,D正确;
故答案选D。
5.C
【详解】A.制备硫酸的过程中,接触室中常压下二氧化硫的转化率已很高,不需要高压空气,采用过量常压空气即可,故A错误;
B.海水含杂质,应首先净化,工业用电解饱和食盐水制备氯气和氢氧化钠,故B错误;
C.合成氨工业是工业制硝酸的基础,产生的氨气通入饱和NaCl溶液中,再向其中通入过量的CO2生成NaHCO3,合成氨工业为硝酸工业和纯碱工业提供了多种原料,故C正确;
D.上图是工业上氯气与氢气化合产生HCl的设备,HCl被水吸收才得到盐酸,故D错误;
故选C。
6.A
【详解】A.和NaOH溶液反应生成和水,可以用适量的NaOH溶液除溶液中的,故A正确;
B.NaOH和不能反应,不能用溶液除溶液中的NaOH,故B错误;
C.和盐酸反应生成NaCl、二氧化碳、水,不能用盐酸除溶液中的NaCl,故C错误;
D.、都能与反应,分别生成硫酸钡、碳酸钡沉淀,不能用溶液除溶液中的,故D错误;
选A。
7.D
【详解】A.只有碳酸氢钠加热分解,由差量法可计算碳酸氢钠的质量,然后再计算碳酸钠的质量分数,能够测出混合物中碳酸钠的质量分数,故A不选;
B.加热后bg固体为氯化钠的质量,设碳酸钠的物质的量为x、碳酸氢钠的物质的量为y,则106x+84y=a,2x+y=,解方程计算出a、b,然后可计算出混合物中碳酸钠的质量分数,故B不选;
C.碳酸钠和碳酸氢钠均能与反应生成碳酸钡沉淀,结合B项分析,也可以计算出混合物中碳酸钠的质量分数,故C不选;
D.ag混合物与足量稀硫酸充分反应,逸出气体主要是二氧化碳和水,所以质量增加bg两种气体的质量,故无法求出混合物中碳酸钠的质量分数,故D选;
故选:D。
8.C
【详解】A. 海上的空气中含有水分,属于胶体,故海市蜃楼与胶体知识有关,A正确;
B.硝石(KNO3)进行焰色试验时, 火焰呈紫色,故“以火烧之,紫青烟起,乃真硝石也”是利用了“焰色反应”,B正确;
C. “大漠孤烟直”中的“烟”是固体小颗粒引起的,“发烟”硝酸中的“烟”是硝酸小液滴引起的,二者成分不同,C不正确;
D.《本草纲目》中记载的 “石碱”,是从草木灰中提取所得,故此处的“石碱”是指K2CO3,D正确;
答案选C。
9.A
【详解】A.Na2CO3和NaHCO3均可与氢氧化钙反应生成碳酸钙,现象相同,A错误;
B.Na在空气中加热可与氧气反应生成淡黄色的Na2O2,B正确;
C.NaHCO3受热分解生成碳酸钠、水、二氧化碳,可采用加热的方法除去Na2CO3固体中混有的NaHCO3,C正确;
D.将金属钠放入盛有MgSO4溶液的小烧杯中,钠先与水反应生成氢氧化钠与氢气,氢氧化钠再与硫酸镁反应生成氢氧化镁沉淀,D正确;
故选A。
10.D
【详解】A.碳酸钠固体溶于是放热的,碳酸氢钠固体溶于水是吸热的,可以通过观察二者溶于水后温度变化来区别,故A正确;
B.碳酸钠溶液和碳酸氢钠溶液都是碱性的,但碳酸钠溶液碱性更强,滴加酚酞溶液后红色比碳酸氢钠溶液深,可以通过观察溶液颜色变化区别二者,故B正确;
C.碳酸钠与碳酸氢钠配成溶液,向其中滴加少量盐酸溶液,碳酸氢钠溶液马上有气泡产生,碳酸钠溶液刚开始没有气泡产生,则可以通过观察是否产生气泡区别二者,故C正确;
D.碳酸钠溶液和碳酸氢钠溶液和澄清石灰水反应都生成碳酸钙沉淀,不能通过观察是否生成沉淀区别二者,故D错误;
故选D。
11.BC
【分析】向饱和食盐水依次通入氨气、二氧化碳气体发生反应生成碳酸氢钠晶体和氯化铵,过滤得到含氯化铵的母液和碳酸氢钠固体,碳酸氢钠加热分解生成碳酸钠。
【详解】A.在饱和食盐水依次通入氨气、二氧化碳气体后,生成大量的,由于NaHCO3的溶解度较小,NaHCO3形成沉淀析出,因此该工艺利用了不同物质溶解度的差异,A正确;
B.氨气极易溶于水,使溶液显碱性,可吸收更多的二氧化碳,故先通NH3,再通CO2,B错误;
C.碳酸钠和碳酸氢钠和石灰水中的氢氧化钙都能发生反应,若纯碱中混有NaHCO3,不能用澄清石灰水除去,应用加热法除去碳酸氢钠,C错误;
D.根据分析,母液的主要成分是NH4Cl,是一种氮肥,可用于化肥工业,D正确;
故选BC。
12.(1)检查装置气密性
(2)球形干燥管
(3)
(4)使NaHCO3分解产生的水蒸气和二氧化碳完全被C、D吸收
(5)偏小
(6)或
【分析】将混合物加热会产生H2O (g) 、CO2等气体,应在C、D中分别吸收,由干燥剂的性质知应先吸收水,再吸收二氧化碳,即C中的干燥剂吸水后不能吸收CO2;由D的增重(NaHCO3分解产生的CO2的质量)可求出NaHCO3质量。由C的增重(NaHCO3分解产生的H2O的质量)可求出NaHCO3的质量,从而求出Na2CO3的质量;故应在实验前想法赶出装置中的空气,关键操作应是赶B中的空气,所以关闭b,打开a就成为操作的关键,缓缓通入则是为了赶出效果更好;E中碱石灰可防止外界空气中的H2O (g)、CO2进入装置D影响实验效果;
【详解】(1)①由实验原理可知,实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置装置,计算生成的水的质量,故应首先检验装置的气密性,故答案为:检查装置气密性;
(2)根据仪器的构造可知,装置E中实验仪器的名称为球形干燥管;
(3)装置B中NaHCO3受热分解生成碳酸钠、二氧化碳和水,发生反应的化学方程式为;
(4)缓缓鼓入空气数分钟的目的是使NaHCO3分解产生的水蒸气和二氧化碳完全被C、D吸收;
(5)若缺少实验步骤③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,会导致NaHCO3分解产生的水蒸气和二氧化碳不能完全被C、D吸收,则测定结果偏小;
(6)称量装有碱石灰的U形管D的质量为m1g,则样品中NaHCO3的质量为,质量分数为=;
称量U形管D的质量为m2g,则样品中NaHCO3的质量为,质量分数为=。
13.(1)2NaHCO3Na2CO3+CO2↑+H2O
(2)保证NaHCO3分解完全
(3)吸水干燥
(4)产生的CO2全部吹入C中吸收
(5)55.79
【分析】本实验的目的,测定样品中碳酸钠的质量分数。实验时,通过测定样品与足量硫酸反应生成CO2的质量,进而求出Na2CO3与NaHCO3的总物质的量,再利用样品的总质量,求出Na2CO3的质量。反应前通N2,排尽装置内的空气,防止干扰反应生成CO2质量的测定;反应后通N2,将装置内的CO2全部排出并被C中碱石灰吸收。装置A中样品与足量硫酸完全反应,生成CO2气体等,装置B干燥CO2,装置C吸收反应生成的CO2,装置D防止空气中的CO2和水蒸气进入C装置并被吸收。
【详解】(1)在坩埚中,NaHCO3受热分解,生成碳酸钠、二氧化碳等,发生反应的化学方程式为:2NaHCO3Na2CO3+CO2↑+H2O。答案为:2NaHCO3Na2CO3+CO2↑+H2O;
(2)实验中,要确保NaHCO3完全分解,则需加热至恒重的目的是:保证NaHCO3分解完全。答案为:保证NaHCO3分解完全;
(3)由分析可知,B装置的作用是吸水干燥。答案为:吸水干燥;
(4)反应完毕后,装置内还滞留一部分二氧化碳,为保证实验测定结果的准确性,还要通一段时间N2,目的是:产生的CO2全部吹入C中吸收。答案为:产生的CO2全部吹入C中吸收;
(5)实验前称取混合物样品19.00 g,实验后测得C装置增重8.80 g,则生成CO2的物质的量为=0.20mol。设Na2CO3的物质的量为x,NaHCO3物质的量为0.20-x,则存在下列等式:106x+84(0.20-x)=19.00,x=0.10mol,所以样品中碳酸钠的质量分数为≈55.79%。答案为:55.79。
【点睛】本实验成功的关键,是准确测定CO2的质量。
14.(1) 过氧化钠 NaOH
(2) 2NaHCO3Na2CO3+H2O+CO2↑ NaHCO3+NaOH=Na2CO3+H2O
(3) 2 22∶9
(4)250mL容量瓶
【分析】X为淡黄色固体,猜想X可能是硫单质或Na2O2,X与D或气体C均能反应生成气体E,澄清石灰水生成白色沉淀,猜想白色沉淀可能为CaCO3,CaCO3与盐酸反应则生成气体C为CO2,故X不可能是S,应为Na2O2,则E为O2;A加热得到CO2、物质B、物质D,则A为NaHCO3,C为CO2,B为Na2CO3,D为H2O,Y为NaOH,据此作答。
【详解】(1)根据分析,X为过氧化钠;Y的化学式为NaOH;
(2)根据分析,反应①是NaHCO3受热分解生成碳酸钠、二氧化碳和水,化学方程式为2NaHCO3Na2CO3+H2O+CO2↑;反应③是NaHCO3与NaOH反应生成碳酸钠和水,化学方程式为NaHCO3+NaOH=Na2CO3+H2O;
(3)X与C反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,22.4L(标准状况)气体O2,即1mol氧气,消耗X的物质的量均为2mol,消耗CO2、H2O的质量之比为(2mol×44g/mol):(2mol×18g/mol)=22:9。
(4)物质Y的溶液是化学分析中常用的试剂,实验室需要使用240mL0.1mol L-1溶液,但是实验室没有240mL的容量瓶,所以只能选择稍大的250mL的容量瓶。
1. 掌握碳酸钠及碳酸氢钠的物理性质。
2. 掌握碳酸钠和碳酸氢钠的化学性质。
3. 掌握钠及其化合物的转化。
一、Na2CO3 与 NaHCO3的性质比较
二、盐酸与 Na2CO3 溶液反应的互滴
1.将稀盐酸滴加到 Na2CO3 溶液中
HCl+Na2CO3=NaCl+NaHCO3
HCl+NaHCO3=NaCl+H2O+CO2 ↑
开始滴加稀盐酸时无明显现象,一段时间后才会产生气泡。
2.将 Na2CO3 溶液滴入稀盐酸
2HCl+Na2CO3=2NaCl+H2O+CO2 ↑
在滴入后直接就会产生气泡。
题型演练
1.下列实验设计,不能达到实验目的的是
A B C D
观察钾元素的焰色 比较和的稳定性 检验与反应有生成 比较和与等浓度盐酸反应的快慢
A.A B.B C.C D.D
2.请同学们搭乘“化学地铁”一起来认识化学物质(如下图所示),各“车站”包含的物质不正确的是
A.第1站—铁 B.第2站—氧化铝 C.第3站—纯碱 D.第4站—硝酸钾
3.下列物质的性质或用途的因果关系不正确的是
A.乙醇具有氧化性,可用于杀菌消毒
B.受热易分解生成,可用于食品膨松剂
C.高纯硅具有半导体特性,可用于制造芯片
D.碳化硅具有高温抗氧化性能,可用做耐高温结构材料
4.实验室中利用侯氏制碱法制备Na2CO3和NH4Cl,流程如图。下列说法正确的是
A.气体N、M分别为和
B.只有“食盐水”可以循环使用
C.为了加速过滤可用玻璃棒搅拌
D.向“母液”中通入NH3有利于析出NH4Cl并提高纯度
5.“三酸二碱”在化工生产中有着重要的应用。下列说法正确的是
A.用过量的高压空气,以提高硫铁矿的燃烧利用率和SO2的催化氧化转化率
B.氯碱工业是中国现代化工之母,其主要反应是电解海水,得到烧碱和氯气,因此称为氯碱工业
C.合成氨工业为硝酸工业和纯碱工业提供了多种原料
D.如图是工业制盐酸的设备及其简易图
三、Na2CO3 与 NaHCO3 的鉴别与除杂
1.Na2CO3 与 NaHCO3 的鉴别
(1) Na2CO3 溶液与 NaHCO3 溶液的鉴别
① 分别取少量溶液于两只试管中,分别滴加少量 CaCl2 或 BaCl2 溶液,有白色沉淀产生的为 Na2CO3 溶液,无现象的为 NaHCO3 溶液。
② 分别取少量溶液于两只试管中,分别滴加少量稀盐酸,滴入后直接有气泡产生的是 NaHCO3 溶液,滴入后一段时间才产生气泡的是 Na2CO3 溶液。
2.Na2CO3 固体与 NaHCO3 固体的鉴别
分别取少量固体于两只试管中,加热一段时间后,质量减少的为 NaHCO3 固体,质量不变的为 Na2CO3 固体。(或加热能产生使澄清石灰水变浑浊的气体的是 NaHCO3)
3.Na2CO3 与 NaHCO3 的除杂
四、Na2CO3 与 NaHCO3 混合物组成的确定
1.固体加热法
将一定质量的混合固体加热至质量不再改变,测定释放出的 CO2 的体积 (质量) 或固体质量的减少量 (即生成的 CO2 的质量) 等进行计算。
2.加足量强酸
将一定质量的混合固体溶于水配成溶液,加足量强酸 (如稀盐酸),测定收集到的 CO2 的体积 (质量) 进行计算,注意此方法中必须保证测定的一定是纯净 CO2 的量,不能有杂质干扰
题型演练
6.为除去溶液中的下列杂质,所选用的试剂正确的是
选项 杂质 试剂
A 适量的NaOH溶液
B NaOH 适量的溶液
C NaCl 适量的盐酸
D 适量的溶液
A.A B.B C.C D.D
7.下列实验方案中,不能测定出和的混合物中质量分数的是
A.取ag混合物充分加热,质量减少bg
B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体
C.取ag混合物与足量溶液充分反应,过滤、洗涤、烘干、得到bg固体
D.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加bg
8.传统文化中蕴含着丰富的化学知识。下列说法错误的是
A.“忽闻海上有仙山,山在虚无缥缈间”中描述的海市蜃楼现象,与胶体知识有关
B.“以火烧之,紫青烟起,乃真硝石也”这是利用“焰色反应”来鉴别硝石(KNO3)
C.“大漠孤烟直,长河落日圆”中的“烟”与“发烟”硝酸中的“烟”成份相同
D.“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面”,这是《本草纲目》中有关“石碱”的记载,此处的“石碱”是指K2CO3
9.下列关于钠及其化合物的说法不正确的是
A.可用澄清的石灰水鉴别Na2CO3和NaHCO3两种溶液
B.Na在空气中加热会变成淡黄色的Na2O2
C.可采用加热的方法除去Na2CO3固体中混有的NaHCO3
D.将金属钠放入盛有MgSO4溶液的小烧杯中,既有气体,又有沉淀产生
10.碳酸钠与碳酸氢钠在外观上相似,均可做家用洗涤剂,如清洗厨房用具的油污等。为区别二者,下列试验方案不合理的是
选项 选用试剂或方法 判断依据
A 取少量固体放入两支试管中,各加几滴水 观察温度变化
B 配成溶液,向其中滴加酚酞溶液 观察溶液颜色变化
C 配成溶液,向其中滴加少量盐酸溶液 观察是否产生气泡
D 配成溶液,向其中滴加澄清石灰水 观察是否生成沉淀
A.A B.B C.C D.D
二、多选题
11.1943年我国化学工程专家侯德榜发明了侯氏制碱法,又称联合制碱法,为我国化工事业的发展做出了卓越贡献。其部分工艺流程如下,下列说法不正确的是
反应①的化学方程式为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
A.该工艺利用了不同物质溶解度的差异
B.反应①中先通CO2,再通NH3
C.若纯碱中混有NaHCO3,可用澄清石灰水除去
D.母液的主要成分是NH4Cl,可用于化肥工业
三、实验题
12.现有一份Na2CO3和NaHCO3固体混合物,某化学兴趣小组设计如图所示实验装置(夹持仪器省略),测定固体混合物中NaHCO3的质量分数。实验步骤如下:
①组装好实验装置,并___________;
②加药品,称取mg样品放入硬质玻璃管中;称量装有碱石灰的U形管D的质量为m1g;。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟;
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体;
⑤打开活塞K1,缓缓鼓入空气数分钟后拆下装置,称量U形管D的质量为m2g。
请回答下列问题:
(1)补充实验步骤①的操作为___________。
(2)装置E中实验仪器的名称为___________。
(3)装置B中发生反应的化学方程式为___________。
(4)实验步骤⑤中“缓缓鼓入空气数分钟”的目的是___________。
(5)若缺少实验步骤③会导致测定结果___________(填“偏大”“偏小”或“无影响”)。
(6)样品中NaHCO3的质量分数为___________×100%(用含m、m1、m2的式子表示)。
13.为测定出Na2CO3和NaHCO3的混合物中Na2CO3质量分数,请你完善下列方案。
方案一:称取一定质量样品,置于坩埚中高温加热至恒重后冷却,称量剩余固体质量,进行计算。
(1)发生反应的化学方程式为:_______
(2)实验中需加热至恒重的目的是:_______
方案二:按如图所示装置进行实验
(3)B装置的作用是_______
(4)反应完毕后还要通一段时间N2的目的是_______
(5)实验前称取混合物样品19.00 g,实验后测得C装置增重8.80 g,则样品中碳酸钠的质量分数为_______%(保留小数点后两位)。
四、元素或物质推断题
14.根据如图所示的转化关系及现象(图中部分产物未全部写出;除E为单质外,其他物质均为化合物),回答下列问题:
(1)固体X的名称为_____,Y的化学式为_____。
(2)反应①的化学方程式为_____;反应③的化学方程式为_____。
(3)X与C或D反应生成22.4L(标准状况)气体E时,消耗X的物质的量均为_____mol,消耗C、D的质量之比为_____。
(4)物质Y的溶液是化学分析中常用的试剂,实验室需要使用240mL0.1mol L-1溶液,配制该溶液时所需的玻璃仪器有量筒﹑烧杯、玻璃棒、胶头滴管和_____。
试卷第1页,共3页
参考答案:
1.B
【详解】A.K元素的焰色试验必须透过蓝色钴玻璃观察,滤去黄光的干扰,故A正确;
B.碳酸氢钠不稳定,受热分解生成Na2CO3、CO2、H2O,小试管中应该盛放碳酸氢钠,故B错误;
C.过氧化钠和水反应生成氧气,氧气是助燃性气体,能使带火星的木条复燃,故C正确;
D.Na2CO3、NaHCO3和稀盐酸反应生成气泡的快慢不同,从而比较NaHCO3和Na2CO3与盐酸反应快慢,故D正确;
故选B。
2.C
【详解】A. 第1站—铁属于单质,故A正确;
B. 第2站—氧化铝属于氧化物,故B正确;
C. 第3站—纯碱属于盐,不属于碱,故C错误;
D. 第4站—硝酸钾属于盐,故D正确;
故选C。
3.A
【详解】A.乙醇能使病毒或细菌的蛋白质变性,所以乙醇可用于消毒,不是因为乙醇具有氧化性,故A错误;
B.不稳定,受热易分解生成,可用于食品膨松剂,故B正确;
C.高纯硅具有半导体特性,可用于制造芯片,故C正确;
D.碳化硅具有高温抗氧化性能,可用做耐高温结构材料,故D正确;
故选A。
4.D
【分析】侯氏制碱法制备碳酸钠和氯化铵,饱和食盐水中先通入NH3、再通入CO2,此时生成碳酸氢钠沉淀和氯化铵,过滤得到碳酸氢钠,加热碳酸氢钠生成碳酸钠、二氧化碳和水,母液中加入NaCl和NH3,发生反应NaCl(s)+NH4Cl(aq)=NaCl(aq)+NH4Cl(s),过滤得到氯化铵。
【详解】A.气体N为NH3,气体M为CO2,A错误;
B.从流程图可知,最后碳酸氢钠分解生成的CO2、母液生成的食盐水都可以循环利用,B错误;
C.用玻璃棒搅动漏斗里的液体,容易把滤纸弄破,起不到加速过滤的作用,C错误;
D.向母液中通入NH3,增大溶液中的浓度,有利于NH4Cl析出并提高纯度,D正确;
故答案选D。
5.C
【详解】A.制备硫酸的过程中,接触室中常压下二氧化硫的转化率已很高,不需要高压空气,采用过量常压空气即可,故A错误;
B.海水含杂质,应首先净化,工业用电解饱和食盐水制备氯气和氢氧化钠,故B错误;
C.合成氨工业是工业制硝酸的基础,产生的氨气通入饱和NaCl溶液中,再向其中通入过量的CO2生成NaHCO3,合成氨工业为硝酸工业和纯碱工业提供了多种原料,故C正确;
D.上图是工业上氯气与氢气化合产生HCl的设备,HCl被水吸收才得到盐酸,故D错误;
故选C。
6.A
【详解】A.和NaOH溶液反应生成和水,可以用适量的NaOH溶液除溶液中的,故A正确;
B.NaOH和不能反应,不能用溶液除溶液中的NaOH,故B错误;
C.和盐酸反应生成NaCl、二氧化碳、水,不能用盐酸除溶液中的NaCl,故C错误;
D.、都能与反应,分别生成硫酸钡、碳酸钡沉淀,不能用溶液除溶液中的,故D错误;
选A。
7.D
【详解】A.只有碳酸氢钠加热分解,由差量法可计算碳酸氢钠的质量,然后再计算碳酸钠的质量分数,能够测出混合物中碳酸钠的质量分数,故A不选;
B.加热后bg固体为氯化钠的质量,设碳酸钠的物质的量为x、碳酸氢钠的物质的量为y,则106x+84y=a,2x+y=,解方程计算出a、b,然后可计算出混合物中碳酸钠的质量分数,故B不选;
C.碳酸钠和碳酸氢钠均能与反应生成碳酸钡沉淀,结合B项分析,也可以计算出混合物中碳酸钠的质量分数,故C不选;
D.ag混合物与足量稀硫酸充分反应,逸出气体主要是二氧化碳和水,所以质量增加bg两种气体的质量,故无法求出混合物中碳酸钠的质量分数,故D选;
故选:D。
8.C
【详解】A. 海上的空气中含有水分,属于胶体,故海市蜃楼与胶体知识有关,A正确;
B.硝石(KNO3)进行焰色试验时, 火焰呈紫色,故“以火烧之,紫青烟起,乃真硝石也”是利用了“焰色反应”,B正确;
C. “大漠孤烟直”中的“烟”是固体小颗粒引起的,“发烟”硝酸中的“烟”是硝酸小液滴引起的,二者成分不同,C不正确;
D.《本草纲目》中记载的 “石碱”,是从草木灰中提取所得,故此处的“石碱”是指K2CO3,D正确;
答案选C。
9.A
【详解】A.Na2CO3和NaHCO3均可与氢氧化钙反应生成碳酸钙,现象相同,A错误;
B.Na在空气中加热可与氧气反应生成淡黄色的Na2O2,B正确;
C.NaHCO3受热分解生成碳酸钠、水、二氧化碳,可采用加热的方法除去Na2CO3固体中混有的NaHCO3,C正确;
D.将金属钠放入盛有MgSO4溶液的小烧杯中,钠先与水反应生成氢氧化钠与氢气,氢氧化钠再与硫酸镁反应生成氢氧化镁沉淀,D正确;
故选A。
10.D
【详解】A.碳酸钠固体溶于是放热的,碳酸氢钠固体溶于水是吸热的,可以通过观察二者溶于水后温度变化来区别,故A正确;
B.碳酸钠溶液和碳酸氢钠溶液都是碱性的,但碳酸钠溶液碱性更强,滴加酚酞溶液后红色比碳酸氢钠溶液深,可以通过观察溶液颜色变化区别二者,故B正确;
C.碳酸钠与碳酸氢钠配成溶液,向其中滴加少量盐酸溶液,碳酸氢钠溶液马上有气泡产生,碳酸钠溶液刚开始没有气泡产生,则可以通过观察是否产生气泡区别二者,故C正确;
D.碳酸钠溶液和碳酸氢钠溶液和澄清石灰水反应都生成碳酸钙沉淀,不能通过观察是否生成沉淀区别二者,故D错误;
故选D。
11.BC
【分析】向饱和食盐水依次通入氨气、二氧化碳气体发生反应生成碳酸氢钠晶体和氯化铵,过滤得到含氯化铵的母液和碳酸氢钠固体,碳酸氢钠加热分解生成碳酸钠。
【详解】A.在饱和食盐水依次通入氨气、二氧化碳气体后,生成大量的,由于NaHCO3的溶解度较小,NaHCO3形成沉淀析出,因此该工艺利用了不同物质溶解度的差异,A正确;
B.氨气极易溶于水,使溶液显碱性,可吸收更多的二氧化碳,故先通NH3,再通CO2,B错误;
C.碳酸钠和碳酸氢钠和石灰水中的氢氧化钙都能发生反应,若纯碱中混有NaHCO3,不能用澄清石灰水除去,应用加热法除去碳酸氢钠,C错误;
D.根据分析,母液的主要成分是NH4Cl,是一种氮肥,可用于化肥工业,D正确;
故选BC。
12.(1)检查装置气密性
(2)球形干燥管
(3)
(4)使NaHCO3分解产生的水蒸气和二氧化碳完全被C、D吸收
(5)偏小
(6)或
【分析】将混合物加热会产生H2O (g) 、CO2等气体,应在C、D中分别吸收,由干燥剂的性质知应先吸收水,再吸收二氧化碳,即C中的干燥剂吸水后不能吸收CO2;由D的增重(NaHCO3分解产生的CO2的质量)可求出NaHCO3质量。由C的增重(NaHCO3分解产生的H2O的质量)可求出NaHCO3的质量,从而求出Na2CO3的质量;故应在实验前想法赶出装置中的空气,关键操作应是赶B中的空气,所以关闭b,打开a就成为操作的关键,缓缓通入则是为了赶出效果更好;E中碱石灰可防止外界空气中的H2O (g)、CO2进入装置D影响实验效果;
【详解】(1)①由实验原理可知,实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置装置,计算生成的水的质量,故应首先检验装置的气密性,故答案为:检查装置气密性;
(2)根据仪器的构造可知,装置E中实验仪器的名称为球形干燥管;
(3)装置B中NaHCO3受热分解生成碳酸钠、二氧化碳和水,发生反应的化学方程式为;
(4)缓缓鼓入空气数分钟的目的是使NaHCO3分解产生的水蒸气和二氧化碳完全被C、D吸收;
(5)若缺少实验步骤③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,会导致NaHCO3分解产生的水蒸气和二氧化碳不能完全被C、D吸收,则测定结果偏小;
(6)称量装有碱石灰的U形管D的质量为m1g,则样品中NaHCO3的质量为,质量分数为=;
称量U形管D的质量为m2g,则样品中NaHCO3的质量为,质量分数为=。
13.(1)2NaHCO3Na2CO3+CO2↑+H2O
(2)保证NaHCO3分解完全
(3)吸水干燥
(4)产生的CO2全部吹入C中吸收
(5)55.79
【分析】本实验的目的,测定样品中碳酸钠的质量分数。实验时,通过测定样品与足量硫酸反应生成CO2的质量,进而求出Na2CO3与NaHCO3的总物质的量,再利用样品的总质量,求出Na2CO3的质量。反应前通N2,排尽装置内的空气,防止干扰反应生成CO2质量的测定;反应后通N2,将装置内的CO2全部排出并被C中碱石灰吸收。装置A中样品与足量硫酸完全反应,生成CO2气体等,装置B干燥CO2,装置C吸收反应生成的CO2,装置D防止空气中的CO2和水蒸气进入C装置并被吸收。
【详解】(1)在坩埚中,NaHCO3受热分解,生成碳酸钠、二氧化碳等,发生反应的化学方程式为:2NaHCO3Na2CO3+CO2↑+H2O。答案为:2NaHCO3Na2CO3+CO2↑+H2O;
(2)实验中,要确保NaHCO3完全分解,则需加热至恒重的目的是:保证NaHCO3分解完全。答案为:保证NaHCO3分解完全;
(3)由分析可知,B装置的作用是吸水干燥。答案为:吸水干燥;
(4)反应完毕后,装置内还滞留一部分二氧化碳,为保证实验测定结果的准确性,还要通一段时间N2,目的是:产生的CO2全部吹入C中吸收。答案为:产生的CO2全部吹入C中吸收;
(5)实验前称取混合物样品19.00 g,实验后测得C装置增重8.80 g,则生成CO2的物质的量为=0.20mol。设Na2CO3的物质的量为x,NaHCO3物质的量为0.20-x,则存在下列等式:106x+84(0.20-x)=19.00,x=0.10mol,所以样品中碳酸钠的质量分数为≈55.79%。答案为:55.79。
【点睛】本实验成功的关键,是准确测定CO2的质量。
14.(1) 过氧化钠 NaOH
(2) 2NaHCO3Na2CO3+H2O+CO2↑ NaHCO3+NaOH=Na2CO3+H2O
(3) 2 22∶9
(4)250mL容量瓶
【分析】X为淡黄色固体,猜想X可能是硫单质或Na2O2,X与D或气体C均能反应生成气体E,澄清石灰水生成白色沉淀,猜想白色沉淀可能为CaCO3,CaCO3与盐酸反应则生成气体C为CO2,故X不可能是S,应为Na2O2,则E为O2;A加热得到CO2、物质B、物质D,则A为NaHCO3,C为CO2,B为Na2CO3,D为H2O,Y为NaOH,据此作答。
【详解】(1)根据分析,X为过氧化钠;Y的化学式为NaOH;
(2)根据分析,反应①是NaHCO3受热分解生成碳酸钠、二氧化碳和水,化学方程式为2NaHCO3Na2CO3+H2O+CO2↑;反应③是NaHCO3与NaOH反应生成碳酸钠和水,化学方程式为NaHCO3+NaOH=Na2CO3+H2O;
(3)X与C反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,22.4L(标准状况)气体O2,即1mol氧气,消耗X的物质的量均为2mol,消耗CO2、H2O的质量之比为(2mol×44g/mol):(2mol×18g/mol)=22:9。
(4)物质Y的溶液是化学分析中常用的试剂,实验室需要使用240mL0.1mol L-1溶液,但是实验室没有240mL的容量瓶,所以只能选择稍大的250mL的容量瓶。
