2022-2023学年鲁科版高中化学必修一 3.2 硫的转化(第2课时)(共19张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版高中化学必修一 3.2 硫的转化(第2课时)(共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-03 08:37:07 | ||
图片预览






文档简介
(共19张PPT)
第2节 硫的转化
第2课时 实验室里研究不同价态硫元素之间的转化
含有硫元素的物质在自然界中依靠大自然的作用进行相互转化,那么如何通过实验实现这些物质的转化呢?本节课我们一起走进实验室,研究不同价态硫元素之间的转化。
自然界中不同价态硫元素之间的转化
【学习目标】
1、通过预测性质、设计方案和实施实验,以价态变化为主线,运用氧化还原反应知识探究不同价态硫元素之间的转化,掌握实现不同价态元素之间转化的思路和方法。
2、能够使用“价—类”二维模型从元素找到物质,运用“价—类”两个角度设计含硫物质的相互转化并进行实验验证。
3、通过探究不同价态硫元素之间的转化,总结二氧化硫、浓硫酸的部分化学性质,并学会从价态的角度认识物质群的化学性质。
【素养提升】科学探究与创新意识、证据推理与模型认知、科学态度与社会责任
FeS/Na2S
【复习回顾】结合硫单质的化学性质,在价类二维图中用箭头表示硫单质的转化关系。
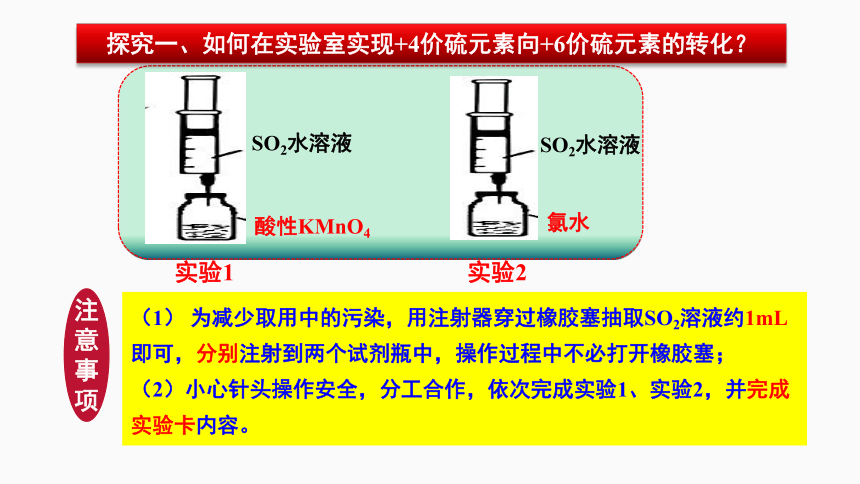
探究一、如何在实验室实现+4价硫元素向+6价硫元素的转化?
价升高,被氧化,加氧化剂
+4 +6
S 元素 S
SO2 ↓ SO3
H2SO3 物 H2SO4
SO32- 质 SO42-
【活动1】1、+4价硫元素存在于哪些物质中?
2、如何实现+4价到+6价的转化?
FeS/Na2S
展示汇报内容
探究一、如何在实验室实现+4价硫元素向+6价硫元素的转化?
实验用品:
SO2水溶液,Na2SO3溶液,Na2S溶液,氯水,酸性KMnO4溶液,稀硫酸
【活动2】根据提供的实验药品设计实验,验证转化,并描述实验设计思路。
SO2水溶液
酸性KMnO4
SO2水溶液
氯水
(1) 为减少取用中的污染,用注射器穿过橡胶塞抽取SO2溶液约1mL 即可,分别注射到两个试剂瓶中,操作过程中不必打开橡胶塞;
(2)小心针头操作安全,分工合作,依次完成实验1、实验2,并完成实验卡内容。
注意事项
探究一、如何在实验室实现+4价硫元素向+6价硫元素的转化?
实验1 实验2
预期转化 选取试剂 宏观实验现象 微观分析
实验方案设计及实施(实验1)
SO2水溶液,
KMnO4溶液
KMnO4溶液紫色
褪去
S
+4
S
+6
实验方案设计及实施(实验2)
预期转化 选取试剂 宏观实验现象 微观分析
S
+4
S
+6
SO2水溶液,氯水
氯水浅黄绿色褪去
BaCl2溶液
MnO4-→Mn2+,
SO2→SO42-
无明显现象
【深度思考1】若现象不明显,我们该如何证明反应发生?
Cl2→Cl-,SO2→SO42-
Ba2++SO42-= BaSO4
探究一、如何在实验室实现+4价硫元素向+6价硫元素的转化?
归纳总结1
含+4价硫元素的物质具有 还原 性;SO2体现较强的还原性,能与O2 、酸性KMnO4溶液、氯水、H2O2 、 Na2O2 、 Fe3+等氧化剂反应生成SO3/SO42-。
1、基于转化研究性质:
+6 SO3 H2SO4 Na2SO4
+4 SO2 H2SO3 Na2SO3
0 S
-2 H2S FeS
氢化物 单质 氧化物 含氧酸 盐
实现+4→+6价转化
设计实验并实施
含+4价硫元素物质
SO2、H2SO3、Na2SO3
S
S
+4
+6
价升高,失电子,被氧化
需要加氧化剂
还原性
提供证据
探究不同价态硫元素之间相互转化的思路
归纳总结2
基于价态
找物质
基于氧还
找原理
现象明显看现象
现象不明辨微粒
实验药品:
SO2水溶液,Na2SO3溶液,Na2S溶液,H2S溶液,酸性KMnO4溶液,
氯水,稀硫酸
探究二、如何在实验室实现+4价硫元素向0价硫元素的转化?
【活动3】根据提供的实验药品设计实验,验证转化,并描述实验设计思路。
展示汇报内容
基于价态找物质
基于氧还找原理
探究二、如何在实验室实现+4价硫元素向0价硫元素的转化?
H2S溶液
SO2水溶液
实验3
Na2SO3溶液
Na2S溶液
实验4
(1) 为减少取用中的污染,用注射器穿过橡胶塞抽取试剂约0.4mL (2个小格)即可,不必打开瓶塞;
(2)小心针头操作安全,分工合作,完成实验4,并完成实验卡4内容。
注意事项
预期转化 选取试剂 宏观实验现象 微观分析
实验方案设计及实施(实验3)
SO2水溶液,
H2S溶液
反应生成淡黄色沉淀
S
+4
S
0
实验方案设计及实施(实验4)
预期转化 选取试剂 宏观实验现象 微观分析
S
+4
S
0
Na2SO3溶液,
Na2S溶液
稀硫酸
H2S→S,
SO2→S
无明显现象
【深度思考2】从物质群的角度分析,实验4和实验3氧化还原反应原理相同,为什么实验4未出现预期的实验现象呢?
S2-→S
SO32-→S
探究二、如何在实验室实现+4价硫元素向0价硫元素的转化?
在H+条件下反应
实验4改进再探究:向Na2S和Na2SO3的混合溶液中用注射器加入0.2mL稀硫酸,并观察实验现象。
2S2- + SO32- + 6H+= 3S↓ + 3H2O
归纳总结3
含+4价硫元素的物质(SO2、SO32-)具有 氧化 性;能与H2S、Na2S反应生成硫单质。
基于转化研究性质:
+6 SO3 H2SO4 Na2SO4
+4 SO2 H2SO3 Na2SO3
0 S
-2 H2S FeS
氢化物 单质 氧化物 含氧酸 盐
探究三、如何在实验室实现+6价硫元素向+4价硫元素的转化?
实验药品:
氯水,KI溶液,
淀粉溶液,
浓硫酸,稀硫酸,
铜片
【活动4】根据提供的实验药品设计实验,验证转化,并描述实验设计思路。
基于价态找物质
基于氧还找原理
展示汇报内容
归纳总结4
含+6价硫元素的物质(浓硫酸) 具有 氧化 性;能与Cu、KI、C、H2S、Na2S等具有还原性的物质反应。
基于转化研究性质:
+6 SO3 H2SO4 Na2SO4
+4 SO2 H2SO3 Na2SO3
0 S
-2 H2S FeS
氢化物 单质 氧化物 含氧酸 盐
应用实践
1、根据现有知识,如何评价 SO2的“功”与“过”?
应用实践
SO2
NaHSO3
(NH4)2SO3
CaSO3
物质类别
氢化物
氧化物
酸
盐
单质
CaSO4
-2
0
+4
+6
SO42-
物理吸附
S
亚硫酸钠
氨水
石灰石
元素价态
氧化法
还原法
复
分
解
法
循环利用
2、依据SO2的性质,可有哪些方式实现SO2的改“过”自新?
污染防治长路漫漫,
吾辈努力上下求索!
同学们,看你的!
第2节 硫的转化
第2课时 实验室里研究不同价态硫元素之间的转化
含有硫元素的物质在自然界中依靠大自然的作用进行相互转化,那么如何通过实验实现这些物质的转化呢?本节课我们一起走进实验室,研究不同价态硫元素之间的转化。
自然界中不同价态硫元素之间的转化
【学习目标】
1、通过预测性质、设计方案和实施实验,以价态变化为主线,运用氧化还原反应知识探究不同价态硫元素之间的转化,掌握实现不同价态元素之间转化的思路和方法。
2、能够使用“价—类”二维模型从元素找到物质,运用“价—类”两个角度设计含硫物质的相互转化并进行实验验证。
3、通过探究不同价态硫元素之间的转化,总结二氧化硫、浓硫酸的部分化学性质,并学会从价态的角度认识物质群的化学性质。
【素养提升】科学探究与创新意识、证据推理与模型认知、科学态度与社会责任
FeS/Na2S
【复习回顾】结合硫单质的化学性质,在价类二维图中用箭头表示硫单质的转化关系。
探究一、如何在实验室实现+4价硫元素向+6价硫元素的转化?
价升高,被氧化,加氧化剂
+4 +6
S 元素 S
SO2 ↓ SO3
H2SO3 物 H2SO4
SO32- 质 SO42-
【活动1】1、+4价硫元素存在于哪些物质中?
2、如何实现+4价到+6价的转化?
FeS/Na2S
展示汇报内容
探究一、如何在实验室实现+4价硫元素向+6价硫元素的转化?
实验用品:
SO2水溶液,Na2SO3溶液,Na2S溶液,氯水,酸性KMnO4溶液,稀硫酸
【活动2】根据提供的实验药品设计实验,验证转化,并描述实验设计思路。
SO2水溶液
酸性KMnO4
SO2水溶液
氯水
(1) 为减少取用中的污染,用注射器穿过橡胶塞抽取SO2溶液约1mL 即可,分别注射到两个试剂瓶中,操作过程中不必打开橡胶塞;
(2)小心针头操作安全,分工合作,依次完成实验1、实验2,并完成实验卡内容。
注意事项
探究一、如何在实验室实现+4价硫元素向+6价硫元素的转化?
实验1 实验2
预期转化 选取试剂 宏观实验现象 微观分析
实验方案设计及实施(实验1)
SO2水溶液,
KMnO4溶液
KMnO4溶液紫色
褪去
S
+4
S
+6
实验方案设计及实施(实验2)
预期转化 选取试剂 宏观实验现象 微观分析
S
+4
S
+6
SO2水溶液,氯水
氯水浅黄绿色褪去
BaCl2溶液
MnO4-→Mn2+,
SO2→SO42-
无明显现象
【深度思考1】若现象不明显,我们该如何证明反应发生?
Cl2→Cl-,SO2→SO42-
Ba2++SO42-= BaSO4
探究一、如何在实验室实现+4价硫元素向+6价硫元素的转化?
归纳总结1
含+4价硫元素的物质具有 还原 性;SO2体现较强的还原性,能与O2 、酸性KMnO4溶液、氯水、H2O2 、 Na2O2 、 Fe3+等氧化剂反应生成SO3/SO42-。
1、基于转化研究性质:
+6 SO3 H2SO4 Na2SO4
+4 SO2 H2SO3 Na2SO3
0 S
-2 H2S FeS
氢化物 单质 氧化物 含氧酸 盐
实现+4→+6价转化
设计实验并实施
含+4价硫元素物质
SO2、H2SO3、Na2SO3
S
S
+4
+6
价升高,失电子,被氧化
需要加氧化剂
还原性
提供证据
探究不同价态硫元素之间相互转化的思路
归纳总结2
基于价态
找物质
基于氧还
找原理
现象明显看现象
现象不明辨微粒
实验药品:
SO2水溶液,Na2SO3溶液,Na2S溶液,H2S溶液,酸性KMnO4溶液,
氯水,稀硫酸
探究二、如何在实验室实现+4价硫元素向0价硫元素的转化?
【活动3】根据提供的实验药品设计实验,验证转化,并描述实验设计思路。
展示汇报内容
基于价态找物质
基于氧还找原理
探究二、如何在实验室实现+4价硫元素向0价硫元素的转化?
H2S溶液
SO2水溶液
实验3
Na2SO3溶液
Na2S溶液
实验4
(1) 为减少取用中的污染,用注射器穿过橡胶塞抽取试剂约0.4mL (2个小格)即可,不必打开瓶塞;
(2)小心针头操作安全,分工合作,完成实验4,并完成实验卡4内容。
注意事项
预期转化 选取试剂 宏观实验现象 微观分析
实验方案设计及实施(实验3)
SO2水溶液,
H2S溶液
反应生成淡黄色沉淀
S
+4
S
0
实验方案设计及实施(实验4)
预期转化 选取试剂 宏观实验现象 微观分析
S
+4
S
0
Na2SO3溶液,
Na2S溶液
稀硫酸
H2S→S,
SO2→S
无明显现象
【深度思考2】从物质群的角度分析,实验4和实验3氧化还原反应原理相同,为什么实验4未出现预期的实验现象呢?
S2-→S
SO32-→S
探究二、如何在实验室实现+4价硫元素向0价硫元素的转化?
在H+条件下反应
实验4改进再探究:向Na2S和Na2SO3的混合溶液中用注射器加入0.2mL稀硫酸,并观察实验现象。
2S2- + SO32- + 6H+= 3S↓ + 3H2O
归纳总结3
含+4价硫元素的物质(SO2、SO32-)具有 氧化 性;能与H2S、Na2S反应生成硫单质。
基于转化研究性质:
+6 SO3 H2SO4 Na2SO4
+4 SO2 H2SO3 Na2SO3
0 S
-2 H2S FeS
氢化物 单质 氧化物 含氧酸 盐
探究三、如何在实验室实现+6价硫元素向+4价硫元素的转化?
实验药品:
氯水,KI溶液,
淀粉溶液,
浓硫酸,稀硫酸,
铜片
【活动4】根据提供的实验药品设计实验,验证转化,并描述实验设计思路。
基于价态找物质
基于氧还找原理
展示汇报内容
归纳总结4
含+6价硫元素的物质(浓硫酸) 具有 氧化 性;能与Cu、KI、C、H2S、Na2S等具有还原性的物质反应。
基于转化研究性质:
+6 SO3 H2SO4 Na2SO4
+4 SO2 H2SO3 Na2SO3
0 S
-2 H2S FeS
氢化物 单质 氧化物 含氧酸 盐
应用实践
1、根据现有知识,如何评价 SO2的“功”与“过”?
应用实践
SO2
NaHSO3
(NH4)2SO3
CaSO3
物质类别
氢化物
氧化物
酸
盐
单质
CaSO4
-2
0
+4
+6
SO42-
物理吸附
S
亚硫酸钠
氨水
石灰石
元素价态
氧化法
还原法
复
分
解
法
循环利用
2、依据SO2的性质,可有哪些方式实现SO2的改“过”自新?
污染防治长路漫漫,
吾辈努力上下求索!
同学们,看你的!
